利用重组大肠杆菌SOS法评价污水厂出水的遗传毒性以及工艺去除效果
2017-03-14许燕王明泉逯南南孙韶华贾瑞宝
许燕,王明泉,逯南南,孙韶华,贾瑞宝
山东省城市供排水水质监测中心, 济南 250021
1997年,国际标准化组织(International Organization for Standardization,ISO)将SOS/umu 试验确立为该标准体系中唯一用于监测水环境遗传毒性的标准方法,德国等发达国家也已将该试验作为水环境遗传毒性检测的方法[1]。目前国际上最常用的SOS/umu测试系统是在鼠伤寒沙门氏菌(Salmonella typhimurium TA1535)中导入携带umuC'-LacZ嵌合体的质粒pSK1002,构建的细菌S.typhimurium TA1535/pSK1002。这个系统在实际应用时存在以下问题:1)对氯代有机物不敏感,特别是不适用于饮用水中消毒副产物的检测[2];2)鼠伤寒沙门菌为致病菌,易传播,每年全世界有近亿人感染,部分致死,对构建的鼠伤寒沙门氏菌系统的操作存在微生物风险;3)对该系统的应用步骤相对繁琐,对β-半乳糖苷酶活性的检测需要加入底物,如β-ONPG(邻硝基苯β-D-半乳糖苷),价格相对较贵。
本文采用基于重组大肠杆菌SOS效应的水质遗传毒性检测方法[2],使用重组大肠杆菌代替常用的鼠伤寒沙门氏菌,将大肠杆菌umuDC启动基因序列与绿色荧光蛋白基因序列连接,与质粒载体连接后导入大肠杆菌,重组的大肠杆菌遇到致DNA损伤物,启动绿色荧光蛋白基因表达进而产生绿色荧光蛋白,通过检测产生的荧光获得污染物信息。应用该技术对某市4座主要污水处理厂出水进行直接遗传毒性效应测定,并以污水一厂为例对遗传毒性的季节变化规律以及不同的工艺对水中直接遗传毒性效应物质的去除情况进行了SOS效应-遗传毒性测定。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:荧光光谱仪(HITACHI F-2700);超声波细胞粉碎仪(SCIENTZ-IID);恒温振荡培养箱(上海志成 ZHWY-200B);台式离心机(Thermo);固相萃取仪(Reeko SPE-06C);高压蒸汽灭菌锅(上海博迅)。
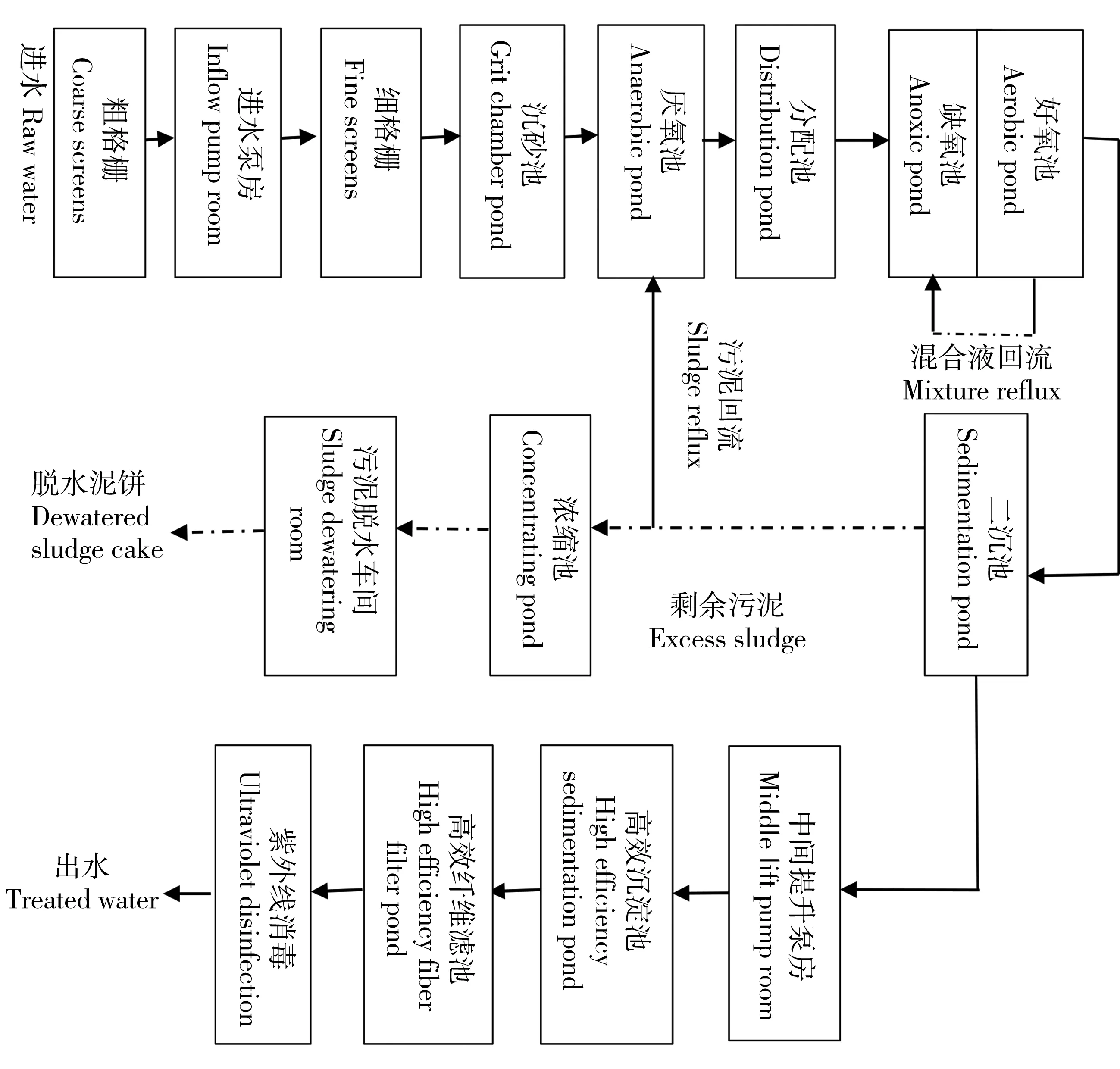
图1 污水处理一厂工艺流程图Fig. 1 Process flow diagram of the No.1 sewage plant
试剂:4-硝基喹啉-1-氧化物(4-nitroquinoline-1-oxide,4-NQO,美国Sigma公司);二氧化氯、正己烷、甲醇均为色谱纯。
1.2 污水处理工艺流程及工艺参数
目前,4座污水处理厂均采用改良后的A/A/O(厌氧-缺氧-好氧法)处理工艺,选择污水处理一厂进行工艺段出水遗传毒性检测。污水处理一厂的主要处理工艺见图1。
1.3 样品采集和处理
采集5 L水样经0.45 μm玻璃纤维素膜过滤后再用HLB柱(500 mg,OASIS,USA)富集,富集前HLB柱使用5 mL二氯甲烷、5 mL甲醇、5 mL纯水进行活化,然后分别以5 mL正己烷/二氯甲烷(1:1,体积比)和10 mL甲醇/二氯甲烷(1:9,体积比)为淋洗剂洗脱。洗脱液吹干置换溶剂为DMSO,定容至0.5 mL,-20 ℃下保存,富集倍数为1万倍。
1.4 重组大肠杆菌SOS效应-荧光法试验方法
1.4.1 重组大肠杆菌贮藏物复苏活化
将重组大肠杆菌贮藏物接入改良的LB培养液,加入氨苄霉素、葡萄糖,30 ℃、180 r·min-1的转速下振荡培养16~18 h。
1.4.2 大肠杆菌检测液制备
将复苏活化液按照1/100的比例接入新鲜的LB培养液,在37 ℃、200 r·min-1的转速下振荡培养2 h。
1.4.3 与受试样品接触
将受试样品/大肠杆菌检测液按照1/9的比例混匀(100 μL受试样品:900 μL大肠杆菌检测液),在37 ℃、200 r·min-1的转速下振荡接触1.5 h,设置3个平行组。设置不加检测样品,仅添加受试样品溶剂的对照组;设置经固相萃取前处理的纯水样品为程序空白组。
1.4.4 检测液后处理
将与受试物接触后的菌液及对照组的菌液通过离心收集菌体,以PBS缓冲液洗涤1次,利用超声波破碎仪破碎菌体。
1.4.5 荧光检测
将菌体破碎物高速离心,收集上清液,利用荧光光谱仪检测发射荧光强度。采用激发波长395 nm,检测波长为507 nm。
1.4.6 数据处理与分析
R值=各浓度下的受试物荧光强度/相应空白,若与空白比值大于1.5,则认为该物质具有致突变性(呈阳性)。
对应标准毒性物质4-NQO剂量效应标准曲线,得出受试物的4-NQO毒性当量(TEQ4-NQOmg·L-1)。
2 结果与分析(Results and analysis)
2.1 标准曲线及污水处理厂出水直接遗传毒性测定
考虑到4-硝基喹啉-1-氧化物(4-nitroquinoline-1-oxide, 4-NQO)是一种已由动物暴露试验数据证明了的致癌物,也是一种不需要代谢活化直接引起遗传物质损伤的直接遗传毒性物,在umu 测试中也已经被广泛用作阳性对照物进行质控[3],因此在本研究中选择4-NQO作为标准毒性物质,对直接遗传毒性进行定量,程序空白组的R值为0.57。
使用4-硝基喹啉-1-氧化物(4-NQO)为标准毒性物质制作剂量-效应标准曲线,见图2。对该市4座污水处理厂夏季出水重组大肠杆菌SOS效应测试(结果见表1),4座污水厂出水的R值均>1.5,表现出一定的直接遗传毒性效应,对应的4-NQO当量浓度0.018~0.514 mg·L-1。由于各污水处理厂收集的生活废水、工业废水来源复杂多样,经过常规污水处理工艺处理后,直接遗传毒性效应对应4-NQO的当量浓度也有所差异。目前,该市4座污水处理厂出水水质达到《城镇污水处理厂污染物排放标准》(GB18918—2002)的一级A标准,但是经本实验检测仍然有较强的致突变性,这些经过常规工艺处理过的污水直接排入城市河流,进而污染自然水体。

图2 4-NQO剂量-效应标准曲线Fig. 2 Dose-effect curve for 4-NQO

污水一厂TheNo.1sewageplant污水二厂TheNo.2sewageplant污水三厂TheNo.3sewageplant污水四厂TheNo.4sewageplantR值Ratiooffluorescence3.032.811.562.21TEQ4-NQO/(mg·L-1)0.5140.3110.0180.079
2.2 污水处理一厂不同季节进出水直接遗传毒性测定及去除率
取污水处理一厂不同季节(春、夏、秋、冬)进出水样品进行重组大肠杆菌SOS效应测试(结果见表2),进厂水的直接遗传毒性当量(TEQ4-NQO)为0.021~0.617 mg·L-1,出厂水的直接遗传毒性当量(TEQ4-NQO)为0.016~0.514 mg·L-1;夏季进厂水直接遗传毒性当量明显高于其他3季,可能原因是该市夏季降水量较大,地表径流中面源污染物随着降水进入城市排水管道。夏季该污水厂直接遗传毒性物质去除率最低为16.69%,在春季最高达到53.97%。由此可见,目前的污水厂处理工艺对直接遗传毒性物质有一定的去除效果,但去除能力变化较大。
2.3 污水处理一厂工艺段出水直接遗传毒性去除特征
取污水处理一厂主要工艺段出水样品进行重组大肠杆菌SOS效应测试(结果见图3),污水处理一厂进厂水为阳性,改良A/A/O工艺出水是阴性,二沉池出水及出厂水为阳性,直接遗传毒性比进厂水降低,出厂水较进厂水直接遗传毒性去除率为23.8%。其中,改良A/A/O工艺段对直接遗传毒性去除效果最佳(达到33.33%),整体工艺对直接遗传毒性物质有一定的去除效果。目前,国内外已有许多报道应用SOS/umu方法评价饮用水各个工艺段出水的遗传毒性[4-6],对于污水厂处理后的出水遗传毒性效应的监测还未引起足够的重视,遗传毒性物质的去除也应纳入污水厂工艺改进的考虑因素之一。

图3 污水处理一厂工艺出水TEQ4-NQO及去除率Fig. 3 TEQ4-NQO and removal rate of direct genetic toxicity of water from the No.1 sewage plant
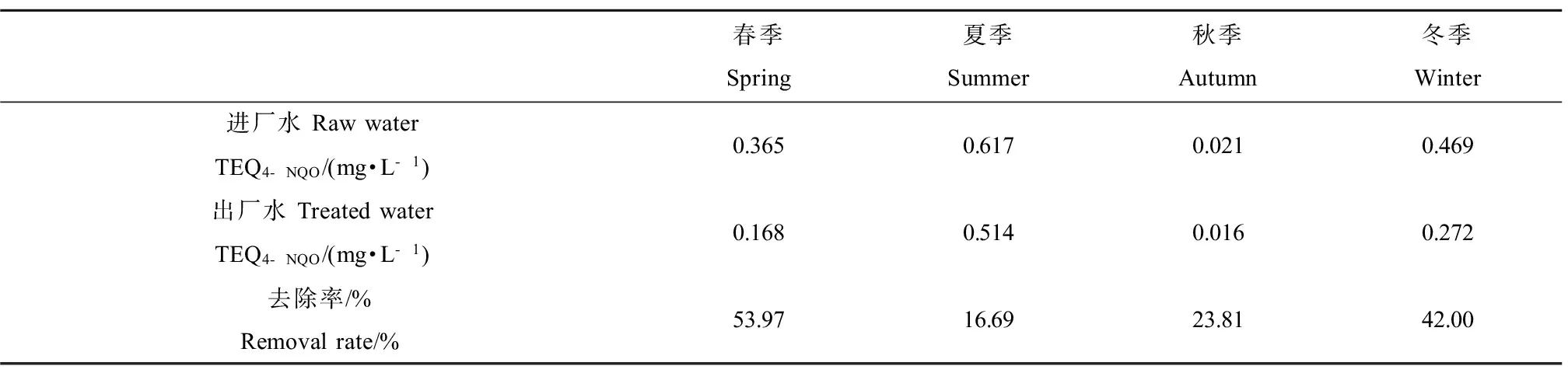
春季Spring夏季Summer秋季Autumn冬季Winter进厂水RawwaterTEQ4-NQO/(mg·L-1)0.3650.6170.0210.469出厂水TreatedwaterTEQ4-NQO/(mg·L-1)0.1680.5140.0160.272去除率/%Removalrate/%53.9716.6923.8142.00
3 讨论(Discussion)
3.1 传统SOS/umu测试方法和重组大肠杆菌SOS效应-荧光法应用于水质遗传毒性评价的相关研究
目前,国内外学者大多采用Oda等[7]于1985年建立起来的SOS/umu测试方法,或者根据该方法改进优化的SOS/umu测试方法。该方法被广泛应用于化合物和复杂样品检测的遗传毒性检测,国内学者将其应用于饮用水处理遗传毒性评价也较多,见表3。
本研究应用重组大肠杆菌SOS效应-荧光法测试了某市4座污水处理厂排水的直接遗传毒性,由于4座污水处理厂均采用改良后的A/A/O(厌氧-缺氧-好氧法)处理工艺,直接遗传毒性效应对应的4-NQO浓度有所差异,这可能与4座处理厂的污水来源以及处理规模有关。传统SOS/umu测试方法在污水或污泥样本遗传毒性测试的应用则相对较少,倪潇潇等[12]对造纸厂污水进行遗传毒性评价,得出目前该厂现行活性污泥废水处理工艺,对遗传毒性物质(包括直接的和间接的)的去除作用不明显,本研究测定的城市典型污水处理厂现行工艺对遗传毒性物质去除率为16.69%~53.97%,总体去除效果也不甚理想。倪潇潇[13]等某城市4个典型污水处理工艺进行遗传毒性评价,4个典型的城市污水处理工艺总体上对遗传毒性物质都有一定的去除效果;其中A2/O处理工艺的去除效果最明显;空气曝气活性污泥工艺对直接遗传毒性物质的去除效果较好,与本研究中污水处理厂改进的A/A/O工艺对直接遗传毒性物质去除效果较明显一致。李莉[14]等应用该方法评价了北京市污水处理厂的生污泥样品以及经过不同处理工艺处理后的污泥样品的遗传毒性效应,结果表明污水处理厂的污泥样品的遗传毒性都在控制范围内,在本文尚未涉及到污泥样品遗传毒性效应的评价,这也将是以后研究的方向。

表3 SOS/umu 测试法应用于饮用水处理的相关研究Table 3 Some research about the application of SOS/umu testing in water treatment
3.2 重组大肠杆菌SOS效应-荧光法与传统SOS/umu测试体系比较
本研究中实验样品经固相萃取前处理后,应用重组大肠杆菌SOS效应-荧光法测定水质直接遗传毒性,每组测试设置了3个平行组,荧光强度标准偏差在7%~26%,精密度良好;测定4-NQO的检测限为15.76 μg·L-1,对比Oda 等[15]使用传统的SOS/umu测试体系测定4-NQO检测限为28.5 μg·L-1,检测限更低;菌液培养时间比传统测试体系缩短了1 h,操作步骤更简便且易于操作。
综上所述,本研究使用固相萃取前处理和重组大肠杆菌SOS效应-荧光法测定水质直接遗传毒性,操作便利、检测敏感性较高、操作危险性较低,且使用4-硝基喹啉氧化物作为标准毒性当量物质,可以进行定量评价,行业推广前景可期。
[1] International Organization for Standardization (ISO). Water quality-determination of genotoxicity of water and wastewater using the umu-test. ISO/CD 13829, DIN [S]. Berlin: ISO, 1998
[2] 济南市供排水监测中心. 基于重组大肠杆菌SOS效应的水质遗传毒性检测方法: 中国, ZL201110022476.1[P]. 2011-09-07
[3] 朱舟, 顾炜旻, 安伟, 等. 基于umu遗传毒性效应的饮用水致癌风险评价的尝试[J]. 生态毒理学报, 2008, 3(4): 363-369
Zhu Z, Gu W M, An W, et al. Carcinogen risk assessment of drinking water based on genotoxic activities using SOS/umu test [J]. Asian Journal of Ecotoxicology, 2008, 3(4): 363-369 (in Chinese)
[4] 李娜, 骆坚平, 饶凯锋, 等. 用SOS/umu生物测试评价北方某自来水厂对遗传毒性物质的去除效果[J]. 环境工程学报, 2007, 1(11): 10-16
Li N, Luo J P, Rao K F, et al. Assessment of the effects of removal genotoxicity for a waterworks located in the north of China by using SOS/umu test [J]. Chinese Journal of Environmental Engineering, 2007, 1(11): 10-16 (in Chinese)
[5] 骆坚平, 李娜, 马梅, 等. 用成组生物效应标记方法定量评价饮用水健康风险[J]. 环境科学学报, 2007, 27(11): 1778-1782
Luo J P, Li N, Ma M, et al. Quantitatively assessing the health risks of drinking water based on a battery of in vitro bioassays [J]. Acta Scientiae Circumstantiae, 2007, 27(11): 1778-1782 (in Chinese)

[7] Oda Y, Nakamura S, Oki I, et al. Evaluation of the new system (umu-test) for the detection of environmental mutagens and carcinogens [J]. Mutation Research/Environmental Mutagenesis and Related Subjects, 1985, 147(5): 219-229
[8] 骆坚平, 马梅, 王子健, 等. 用成组生物毒性测试方法评价北方某市饮用水安全性[J]. 给水排水, 2006, 32(8): 17-21
Luo J P, Ma M, Wang Z J, et al. Assessment on the ecological risks of drink water in a city in North China by way of bioassay battery [J]. Water & Wastewater Engineering, 2006, 32(8): 17-21 (in Chinese)
[9] 乔敏, 王春霞, 黄圣彪, 等. 太湖梅梁湾水体和沉积物中有机污染物的遗传毒性[J]. 中国环境科学, 2006, 26(2): 224-227
Qiao M, Wang C X, Huang S B, et al. Genotoxicity of organic pollutant water and sediment in Meiliang Bay, Taihu Lake [J]. China Environmental Science, 2006, 26(2): 224-227 (in Chinese)
[10] 言野, 李娜, 刘楠楠, 等. 利用改进的 SOS/umu 方法检测水处理过程中污染物的遗传毒性效应[J]. 生态毒理学报, 2013, 8(6): 909-916
Yan Y, Li N, Liu N N, et al. Application of modified SOS/umu test to determine genotoxicity of genotoxic chemicals and effluents from drinking water treatment process [J]. Asian Journal of Ecotoxicology, 2013, 8(6): 909-916 (in Chinese)
[11] 柳清, 张丽萍, 刘文君, 等. umu 试验研究饮用水氯和氯胺消毒过程中遗传毒性的变化以及消毒条件的影响[J]. 环境科学, 2010, 31(1): 93-98
Liu Q, Zhang L P, Liu W J, et al. Genotoxicity of drinking water during chlorine and chloramine disinfection and the influence of disinfection conditions using the umu-test [J]. Environmental Science, 2010, 31(1): 93-98 (in Chinese)
[12] 倪潇潇, 王子健. 造纸厂废水的生物毒性测试[J]. 中国造纸, 2006, 25(12): 27-29
Ni X X, Wang Z J. Biotoxicity test of wastewater from paper mill [J]. China Pulp & Paper, 2006, 25(12): 27-29 (in Chinese)
[13] 倪潇潇, 周军, 蒲俊文. 利用成组生物测试评估某城市典型污水处理工艺[J]. 环境污染与防治, 2008, 30(4): 52-55
Ni X X, Zhou J, Pu J W. Assessing four wastewater treatment plants in a city by bioassay [J]. Environmental Pollution and Control, 2008, 30(4): 52-55 (in Chinese)
[14] 李莉, 周建国, 李娜. 利用SOS/umu 测试评价污泥样品的遗传毒性效应以及污泥处理工艺效果[J]. 河南师范大学学报: 自然科学版, 2013, 41(2): 112-114,118 (in Chinese)
Li L, Zhou J G, Li N. Evaluating the genotoxicity effect of sludge samples and the effect of sludge treatment process by SOS/umu test [J]. Journal of Henan Normal University: Natural Science, 2013, 41(2): 112-114, 118 (in Chinese)
[15] Oda Y, Funasaka K, Kitano M, et al. Use of a high-throughput umu-microplate test system for rapid detection of genotoxicity produced by mutagenic carcinogens and airborne particulate matter [J]. Environmental and Molecular Mutagenesis, 2004, 43(1): 10-19
