口服纳米银对大鼠的生物有效性及其体内分布的研究
2017-03-14江媛媛党菲李敏周东美吴笛施维林朱雪峰
江媛媛,党菲,李敏,周东美,吴笛,施维林,朱雪峰
1. 苏州科技大学环境科学与工程学院,苏州 215009 2. 中国科学院南京土壤研究所土壤环境与污染修复重点实验室,南京 210008 3. 南京医科大学公共卫生学院毒理系,南京 210029 4. 南京医科大学公共卫生学院江苏省医药兽药安全性评价与研究中心,南京 210029
纳米银(AgNP)由于其独特的抗菌性能,被广泛应用于各类商业产品[1],尤其是抗菌商品,如床上用品、洗衣机、水净化器、牙膏、洗发水、纺织物、医药喷雾、医疗设备、过滤器、加湿器、厨房用具和玩具等[2]。AgNP的大量使用将不可避免地造成AgNP或其他形态银在环境中的释放、累积,对各类生物(如双壳贝类、鱼类、真菌和其他物种)产生潜在风险[3-6]。此外,AgNP可用于口服产品,如膳食补充剂,说明AgNP同样对人体健康造成潜在风险[7-8]。相关研究表明,含AgNP涂层的医疗设备释放出的AgNP或银离子会通过呼吸、皮肤接触以及口部无意摄入等途径进入人体,在组织中富集并且致毒[9-13]。
AgNP的人体/动物毒性研究主要包括皮肤、粘膜细胞的体外毒性和肝、肺、生殖系统细胞、血管系统细胞及神经细胞的体内毒性[14]。Kulthong等[15]通过将含AgNP的抗菌敷料染毒于人造皮肤的研究发现,抗菌敷料中的银可以释放到汗液中,并且敷料中银的含量、汗液的组成成分以及pH影响了敷料中银的释放。Park等[16]发现含AgNP抗菌敷料对体外培养的小鼠纤维细胞能产生毒性,并引起炎症反应、遗传和发育毒性等。Ahamed等[17]研究了AgNP对人工模拟大鼠肝细胞的影响,发现AgNP会导致肝细胞谷胱甘肽衰竭,线粒体膜电位下降,活性氧升高,证实AgNP可通过氧化应激效应诱导肝细胞中毒。Jun等[18]研究发现AgNP会引起人体血小板聚集,磷脂酰丝氨酸外翻,促凝血活化,最终导致血栓。对于体内研究,主要将AgNP通过呼吸、皮肤接触和摄入等途径染毒于大鼠,研究大鼠相关组织中银的富集以及对组织的损伤程度。Hyun等[19]采用呼吸途径将AgNP染毒于大鼠28 d后,发现大鼠的脏器系数与对照组并无显著性差异。Sung等[20]同样采用呼吸途径将AgNP染毒于大鼠,发现肝和肺是AgNP富集的主要靶器官。Tiwari等[21]通过皮下注射高剂量的AgNP给大鼠,发现大鼠的血浆生化指标出现异常,血浆活性氧含量上升。Kim等[11]通过灌胃途径将AgNP染毒于大鼠,发现灌胃28 d后,大鼠血液中的碱性磷酸酶和胆固醇明显增加,说明大鼠的肝功能或脂质代谢出现了异常。Cha等[22]采用同样途径将AgNP染毒于大鼠,3 d后发现AgNP对肝产生毒性,肝组织淋巴细胞浸润,并出现凋亡现象,此外与炎症相关基因的表达也发生了改变。在哺乳动物体内,AgNP还会通过氧化应激效应导致细胞中DNA受损,改变基因表达,甚至引起细胞的凋亡[23-31]。这些研究都说明AgNP具有毒性效应,且毒性效应受染毒剂量、AgNP的染毒途径、AgNP基本性质的影响。
尽管上述研究促进了人们对AgNP毒性效应及健康危害的理解,然而大多数研究并未考虑AgNP的生物有效性,主要停留在AgNP在大鼠体内的分布以及毒性方面的研究[19-22, 32-35]。相关信息的缺失会导致我们无法全面认识AgNP毒性作用机理,尤其是不同剂量条件下生物反映出的不同的毒性效应。因此,了解AgNP对动物的生物有效性和生物累积过程,可能为AgNP的毒性研究提供有用的信息,以更准确评估AgNP的生态风险及人体健康风险。本文以SD大鼠为研究对象,采用灌胃途径将大鼠进行AgNP染毒,研究AgNP对大鼠的生物有效性、体内分布及累积动力学。
1 材料与方法(Materials and methods)
1.1 材料
本研究所用的聚乙烯吡咯烷酮包被的AgNP粉末购自Sigma公司,产品号为576832,厂家标注的纳米颗粒粒径< 100 nm,Ag的纯度> 99.5%。该产品在25 ℃厌氧下避光保存,以防止AgNP被氧化。银离子标准溶液(Sigma,1 000 mg·L-1)用于制备标准曲线以测定银浓度;实验用水为超纯水(18.2 MΩ,Millipore,美国);67%~69%的浓硝酸(优级纯)用于消解待测样品。实验所用玻璃容器均经10%(V/V)硝酸浸泡24 h后,用超纯水清洗干净。
1.2 实验动物
雌性Sprague - Dawley(SD)大鼠36只,体重160~180 g,由南京医科大学实验动物中心提供。由于雌性大鼠肾组织器官中银的累积是雄性大鼠的2倍[11],因此,本文以雌性大鼠为研究对象。
实验中,动物生存的环境为清洁级,人工光照时间为12 h:12 h(昼:夜),温度为(23 ± 1) ℃,相对湿度为55% ± 5%[36]。代谢笼为无毒钢丝笼(ZH-B6,中国),容积为250 mm×200 mm×200 mm,每笼3只大鼠,大鼠饮用水为净化水,食物为无菌块饲料。
1.3 AgNP的表征
采用超声破碎仪(X0-650D,南京先欧仪器制造有限公司)将AgNP分散在超纯水中,且超声破碎功率为390 w,时间间隙3.0 s,以此获得均匀悬浮液,用滴管吸少量均匀悬浮液至碳网包被的铜网上,用JEM-2100透射电子显微镜(TEM)检测AgNP颗粒尺寸及形状,同时采用BI-200SM光散射仪(DLS,Brookhaven Instruments, 美国)测定AgNP悬浮液中AgNP颗粒尺寸。采用火焰原子吸收光谱法(AAS)测得AgNP悬浮液中银浓度为(3 132.6 ± 2.6) mg·L-1。
1.4 AgNP生物有效性实验
将36只SD大鼠随机分为对照组和灌胃组,每组各18只。实验前12 h禁食(不禁水),第2日对2组大鼠给予单次灌胃。灌胃组每只大鼠灌胃0.6 mL AgNP悬浮液,对照组每只大鼠灌胃0.6 mL超纯水。灌胃结束时的时间点记为0 h,分别在1 h、8 h、24 h、96 h、168 h时,每组随机选3只大鼠麻醉,立即从心脏取血,置于涂有肝素的Corning管中;采集肝、肾、肺、小肠、脾和脑,用超纯水清洗表面残留的血液后,用滤纸吸干,记录组织鲜重,并于-80 ℃保存。检测结果显示,大鼠食物中银的浓度低于仪器检测浓度(0.003 mg·kg-1),小肠内容物并不影响实验结果。因此,采集小肠时并未将小肠内容物清洗掉。在24 h、48 h、72 h、96 h、120 h、144 h和168 h收集大鼠的尿液和粪便,尿液加浓硝酸保存(1:1,V/V),粪便在-80 ℃冰箱中保存。实验期间,大鼠自由饮水并饲喂无菌块饲料,且大鼠活动正常,未观察到不良反应。
1.5 总银含量分析
大鼠血液和尿液用7 mL浓硝酸和3 mL 30%的过氧化氢在25 ℃下温和消解3~4 h后进行350 ℃消解[36-37],直至溶液澄清,采用电感耦合等离子体质谱(ICP-MS,Thermo-iCAP Q,美国)分析其中总银含量。
大鼠组织和粪便首先进行冷冻干燥(ALPHA 1-2LD PLUS,德国),并记录组织和粪便干重。采用上述方法用浓硝酸和过氧化氢进行消解。消解完全后,以超纯水定容,ICP-MS测定总银含量。本研究采用非脱脂龙虾肝胰腺中微量元素和甲基汞标准物质(LUTS-1)进行实验质量控制,总银的回收率为92%~105%。
1.6 统计分析
采用SPSS 16.0软件的Tukey法检验对照组和灌胃组大鼠组织、尿液和粪便中银浓度的显著性差异,以及灌胃组不同时间点之间的显著性差异。显著性标准为P < 0.05,当P > 0.05时表明数据间不存在显著性差异。
人的全面发展离不开人的个性的发展。人的个性发展是人的全面发展的重要组成部分。两者的关系是辩证统一的。首先,人的全面发展是个性发展的基础,没有在一定限度内的人的全面发展,个性发展就像无源之水、无本之木,它的发展是片面的,是畸形的。其次,人的个性发展是人的全面发展的前提,人要实现自身的全面发展必将受到个性发展的制约,只有具备个性的个体,才有全面的整体,只有尊重个体的发展,才能发挥个性,并利用个性的独特性,使人走向全面的发展。所以说,工程师的个性具有全面性,他们的个性主要表现为行为特点、爱好、兴趣、心理、气质等特点。

图1 AgNP悬浮液的TEM图及粒径分布图Fig. 1 TEM image and size distribution of AgNP in suspension
2 结果与讨论 (Results and discussion)
2.1 AgNP的粒径分布
图1所示为AgNP的TEM图片。由图可见,AgNP大部分为球形颗粒,颗粒粒径均匀分布在10~30 nm范围内。统计数据表明,AgNP的平均粒径为(18.5 ± 5.1) nm。DLS分析得到AgNP的水合粒径为(35.1 ± 3.5) nm。
2.2 AgNP在大鼠体内的分布
对照组大鼠各器官、组织中的银浓度分别为:小肠(0.06 ± 0.02) mg·kg-1、血液(0.01 ± 0.01) mg·L-1、肝(0.01 ± 0.01) mg·kg-1、肾(0.04 ± 0.02) mg·kg-1、肺(0.02 ± 0.01) mg·kg-1、脾(0.05 ± 0.02) mg·kg-1、脑(0.02 ± 0.01) mg·kg-1,并且在整个实验过程中银浓度保持相对稳定。AgNP单次染毒于大鼠后,在大鼠的血液及主要组织(小肠、肝、肾、肺、脾和脑)中均能检测到银(图2)。其中,小肠中银的浓度最高(最高为132.80 ± 50.55 mg·kg-1),其次是肝(最高为0.29 ± 0.13 mg·kg-1)、肾(最高为0.23 ± 0.04 mg·kg-1)、脾(最高为0.17 ± 0.05 mg·kg-1)、肺(最高为0.11 ± 0.01 mg·kg-1)、脑(最高为0.06 ± 0.02 mg·kg-1)。
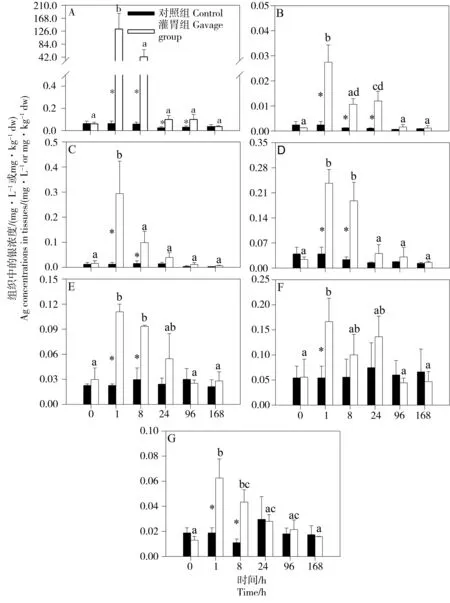
图2 大鼠组织中银浓度(A:小肠, B:血液, C:肝, D:肾, E:肺, F:脾, G:脑, n=3)注:*表示对照组与灌胃组之间存在显著性差异;不同字母表示灌胃组不同时间点之间显著性差异(P < 0.05)。Fig. 2 Ag concentrations in tissues of rats (A: intestine, B: blood, C: liver, D: kidney, E: lung, F: spleen, G: brain, n=3)Note: *indicated the significant difference between the control group and the gavage group, and the different letter indicated the significant difference of the gavage group in different time points (P < 0.05).
小肠中银浓度在灌胃后1 h时达到最高值(132.80 ± 50.55 mg·kg-1,图2A),之后下降,然而8 h、24 h和96 h暴露后的银浓度仍然是对照组浓度的3~707倍;168 h后小肠银浓度和对照组没有显著性差异。小肠中银累积呈现先增加后降低的趋势,可能与小肠的生理功能相关。小肠是大鼠消化、吸收营养物质的主要场所,通过消化管上皮细胞吸收的银通过血液循环(图2B)进入大鼠其他组织[36];同时,由于肠液pH一般呈碱性,部分AgNP可能发生团聚,形成微米级的聚合物[35],因此不易被吸收,将会以粪便的形式排出体外(图3B)。上述因素均导致了小肠中银浓度的降低。值得注意的是,除团聚外,AgNP在小肠中可能发生其他化学转化,例如:胃液中高浓度电解质以及低pH条件下,AgNP可能释放银离子,进入pH较高的肠液后,离子态的银可能生成AgCl或Ag2S,这值得进一步研究[38-39]。此外,采用口服途径将AgNP染毒大鼠,已报道的文献中表明,AgNP经胃肠消化后,大鼠血液中的银浓度都比较低[36]。而对于小肠消化上皮细胞吸收的银离子还是银颗粒,目前并无相关类似报道,这也是今后值得进一步研究的内容。
对于血液而言,染毒1 h后银浓度最高(0.03 ± 0.01 mg·L-1,图2B),在8 h和24 h时银浓度仍然是对照组浓度的11~12倍;96 h后银浓度下降至正常水平。本研究中血液最高浓度为(0.03 ± 0.01) mg·L-1,远低于Park报道的值(0.60 mg·L-1)[36]。后者采用了柠檬酸包被的平均粒径为7.9 nm的AgNP溶液进行染毒,与本研究采用的AgNP的表面特性、粒径大小均不同。
大鼠的肝、肾、肺、脑和脾中均能检测到银,说明银可以通过血液循环系统迁移并在体内累积,其中肝、肾、肺、脾和脑是AgNP作用的靶器官。肝、肾、肺和脑的银浓度呈现相似的规律,即染毒1 h和8 h后组织银浓度最高,之后恢复到对照组水平。这可能是这些组织重新释放银到了血液。在1 h时灌胃大鼠脾中银浓度与对照组有显著性差异,其他采样点并未发现显著性差异。值得注意的是,尽管是灌胃的途径,但是在肺和脑中依然检测到了银。肺中检测到银可能是肺泡巨噬细胞能够吞噬银,脑中检测到银可能是银穿透血脑屏障通过静脉系统进入大脑导致,这与前人报道一致[34]。但是目前尚不清楚银是以何种形式(纳米颗粒或者银离子)进行体内运输并且分布于这些组织,这值得进一步研究。
2.3 AgNP对大鼠的有效性
如图2B所示,灌胃后1 h血液和其他组织中银浓度达到最高值,且与对照组存在显著性差异(P < 0.05),说明AgNP已快速地被生物体吸收。因此,本研究通过大鼠体内银含量和染毒剂量的比值计算AgNP对大鼠的有效性。将灌胃后1 h时各组织中银的含量来计算AgNP的生物有效性。每只大鼠摄入总银量为1 879.56 μg,如表1所示,器官、组织中银总量为159.22 μg。器官、组织中银总量与摄入总量的比值为8.5%,说明本研究中AgNP对SD大鼠的有效性为8.5%。本研究计算出的生物有效性略高于文献报道值(4.2%)[36],除了采用的AgNP溶液的表面载体、粒径大小及分布等方面的差异外,还可能与计算方法有关。文献中采用口部摄入和尾静脉注射2种途径将AgNP染毒大鼠,并通过药物动力学软件计算大鼠血液的动力学参数(AUC),2种途径下AUC的比值为AgNP对大鼠的有效性。
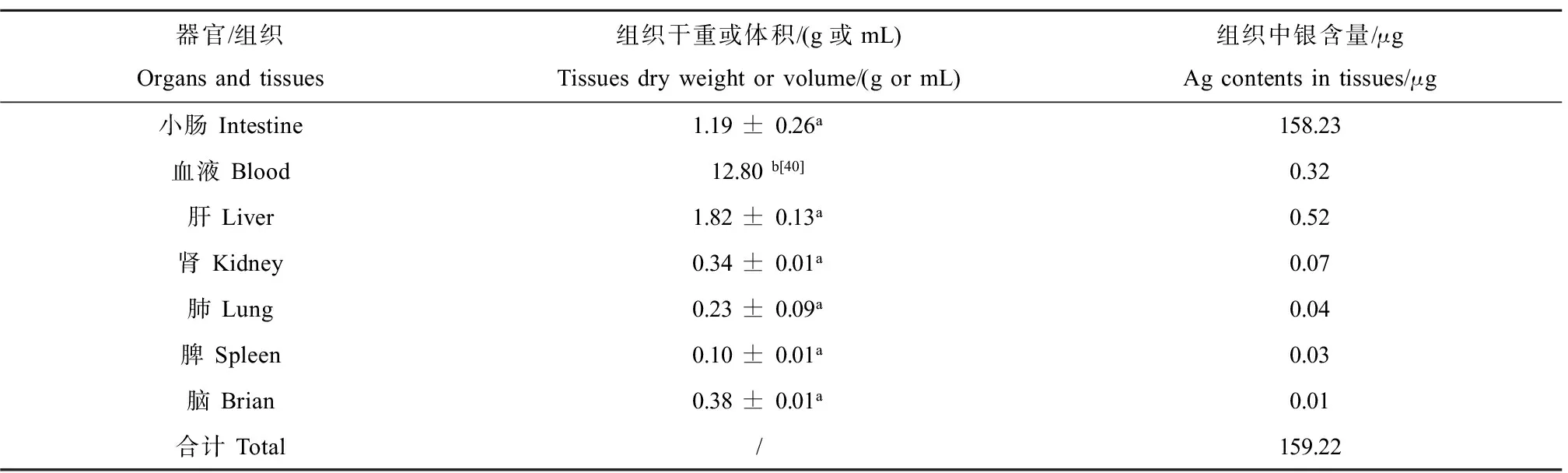
表1 大鼠体内AgNP生物有效性Table 1 The bioavailability of AgNP in rats
注:a表示平均值±标准偏差,b依据文献的估算值。
Note:ashowed average value ± standard deviation, andbshowed the estimated value of the literature.
2.4 AgNP的排出
AgNP可以通过粪便或者尿液排出体外(图3)。灌胃24 h后,尿液和粪便中银浓度最高,分别为(0.12 ± 0.08) mg·L-1和(419.21 ± 102.03) mg·kg-1。本研究中大鼠粪便中银浓度与已有报道相近,而尿液结果则高于已有报道[36]。168 h内大鼠排泄物中银总量为1 378.20 μg(其中,尿液和粪便中银含量分别为0.25 μg和1 377.95 μg),占染毒剂量的73%,说明了采用灌胃途径,绝大部分AgNP将排出体外,且粪便是最主要的排出途径。
本研究结果表明,通过灌胃途径染毒的AgNP中约8.5%可以被SD大鼠吸收,并且通过血液循环迅速分配到各个组织;1 h时各组织的银浓度达到最高值,之后会随时间下降,其中,肝、肾、肺、脾和脑是AgNP的靶器官,其银浓度的高低顺序依次为肝 > 肾 > 脾 > 肺 > 脑。相对而言,大部分灌胃的AgNP并未被吸收,是通过尿液或者粪便排出体外,其中粪便可排出约73%的银。因此,我们认为,当以灌胃的途径单次给药时,聚乙烯吡咯烷酮包被的AgNP经SD大鼠的肠胃吸收后,一小部分进入血液并分配到各个组织,而大部分银则通过粪便排出体外。由此可推测,该染毒剂量下AgNP的毒性可能不高,这将需要进一步的研究。
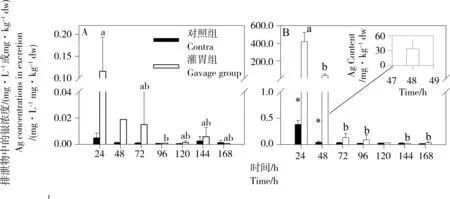
图3 大鼠排泄物中银浓度(A:尿液, B: 粪便, n=2~3, 48 h的尿液只采集到1个样品)注:*表示对照组与灌胃组之间存在显著性差异;不同字母表示灌胃组不同时间点之间显著性差异(P < 0.05)。Fig. 3 Ag concentrations in excretion of rats (A: urine, B: feces, n=2-3, only one sample of urine at 48 h)Note: *indicated the significant difference between the control group and the gavage group, and the different letter indicated the significant difference of the gavage group in different time points (P < 0.05).
[1] Wijnhoven S W P, Peijnenburg W J G M, Herberts C A, et al. Nano-silver: A review of available data and knowledge gaps in human and environmental risk assessment [J]. Nanotoxicology, 2009, 3(2): 109-138
[2] Glover R D, Miller J M, Hutchison J E. Generation of metal nanoparticles from silver and copper objects: Nanoparticle dynamics on surfaces and potential sources of nanoparticles in the environment [J]. ACS Nano, 2011, 5(11): 8950-8957
[3] 周东美. 纳米 Ag 粒子在我国主要类型土壤中的迁移转化过程与环境效应[J]. 环境化学, 2015, 34(4): 605-613
Zhou D M. Transport and transformation of nano Ag particle in soils and its environmental effects [J]. Environmental Chemistry, 2015, 34(4): 605-613 (in Chinese)
[4] Wang X, Ji Z X, Chang C H, et al. Use of coated silver nanoparticles to understand the relationship of particle dissolution and bioavailability to cell and lung toxicological potential [J]. Small, 2014, 10(2): 385-398
[5] 辛琦, 章强, 程金平. 纳米银对鱼类的毒性效应研究进展[J]. 生态毒理学报, 2014, 9(6): 1014-1026
Xin Q, Zhang Q, Cheng J P. Review on the toxicology study of silver nanoparticles on fish species [J]. Asian Journal of Ecotoxicology, 2014, 9(6): 1014-1026 (in Chinese)
[6] 辛琦, 章强. 程金平. 纳米银和银离子对斑马鱼胚胎早期生长发育的影响及作用机制[J]. 生态毒理学报, 2015, 10(4): 55-64
Xin Q, Zhang Q, Cheng J P. Effects of silver nanoparticles and silver ions on the early development of zebrafish embryos and toxicity mechanisms [J]. Asian Journal of Ecotoxicology, 2015, 10(4): 55-64 (in Chinese)
[7] Woodrow Wilson International Center for Scholar. Woodrow Wilson International Center for Scholars: Project on emerging nanotechnologies, an inventory of nanotechnology -based consumer products introduced on the market [EB/OL]. (2016-08-30) [2016-09-02]. http://www. nanotechproject.org/cpi/
[8] Chaloupka K, Malam Y, Seifalian A M. Nanosilver as a new generation of nanoproduct in biomedical applications [J]. Trends in Biotechnology, 2010, 28(11): 580-588
[9] Limbach L K, Wich P, Manser P, et al. Exposure of engineered nanoparticles to human lung epithelial cells: Influence of chemical composition and catalytic activity on oxidative stress [J]. Environmental Science and Technology, 2007, 41(11): 158-163
[10] Thrall L. A nano Trojan horse [J]. Environmental Science and Technology, 2007, 41: 3791-3792
[11] Kim Y S, Kim J S, Cho H S, et al. Twentyeight-day oral toxicity, genotoicity, and gender-related tissue distribution of silver nanoparticles in Sprague-Dawley rats [J]. Inhalation Toxicology, 2008, 20(6): 575-583
[12] Lubick N. Nanosilver toxicity: Ions, nanoparticles - or both? [J]. Environmental Science and Technology, 2008, 42(23): 8617
[13] Tang J, Xi T. Status of biological evaluation on silver nanoparticles [J]. Journal of Biomedical Engineering, 2008, 25(4): 958-961
[14] 施畅, 徐丽明, 邵安良. 纳米银的毒理学研究现状[J]. 药物分析杂志, 2013, 33(12): 2025-2033
Shi C, Xu L M, Shao A L. A brief review on toxicity of silver nanoparticles [J]. Chinese Journal of Pharmaceutical Analysis, 2013, 33(12): 2025-2033 (in Chinese)
[15] Kulthong K, Srisung S, Boonpavanitchakul K, et al. Determination of silver nanoparticle release from antibacterial fabrics into artificial sweat [J]. Particle Fibre Toxicology, 2010, 7(1): 1-9
[16] Park M V, Neigh A M, Vermeulen J P, et al. The effect of particle size on the cytotoxicity, inflammation, developmental toxicity and genotoxicity of silver nanoparticles [J]. Biomaterials, 2011, 32(36): 9810-9817
[17] Ahamed M, AlSalhi M S, Siddiqui M K J. Silver nanoparticle applications and human health [J]. Clinica Chimica Acta, 2010, 411(23-24): 1841-1848
[18] Jun E A, Lim K M, Kim K, et al. Silver nanoparticles enhance thrombus formation through increased platelet aggregation and procoagulant activity [J] Nanotoxicology, 2011, 5(2): 157-167
[19] Hyun J S, Lee B S, Ryu H Y, et al. Effects of repeated silver nanoparticles exposure on the histological structure and mucins of nasal respiratory mucosa in rats [J]. Toxicology Letters, 2008, 182(1-3): 24-28
[20] Sung J H, Ji J H, Park J D, et al. Subchronic inhalation toxicity of silver nanoparticles [J]. Toxicological Sciences, 2009, 108(2): 452-461
[21] Tiwari D K, Jin T, Behari J. Dose - dependent in-vivo toxicity assessment of silver nanoparticles in Wistar rats [J]. Toxicology Mechanisms and Methods, 2011, 21(1): 13-24
[22] Cha K, Hong H W, Choi Y G, et al. Comparison of acute responses of mice livers to short - term exposure to nano - sized or micro - sized silver particles [J]. Biotechnology Letters, 2008, 30(11): 1893-1899
[23] Sung J H, Ji J H, Yoon J U, et al. Lung function changes in Sprague-Dawley rats after prolonged inhalation exposure to silver nanoparticles [J]. Inhalation Toxicology, 2008, 20(6): 567-574
[24] Song K S, Sung J H, Ji J H, et al. Recovery from silver-nanoparticle-exposure-induced lung inflammation and lung function changes in Sprague Dawley rats [J]. Nanotoxicology, 2013, 7(2): 169-180
[25] Braydich-Stolle L, Hussain S, Schlager J J, et al. In vitro cytotoxicity of nanoparticles in mammalian germline stem cells [J]. Toxicological Sciences, 2005, 88(2): 412-419
[26] Ahamed M, Karns M, Goodson M, et al. DNA damage response to different surface chemistry of silver nanoparticles in mammalian cell [J]. Toxicology and Applied Pharmacology, 2008, 233(3): 404-410
[27] Carlson C, Hussain S M, Schrand A M, et al. Unique cellular interaction of silver nanoparticles: Size-dependent generation of reactive oxygen species [J]. Journal of Physical Chemistry B, 2008, 112(43): 13608-13619
[28] Hsin Y H, Chen C F, Huang S, et al. The apoptotic effect of nanosilver is mediated by a ROS- and JNK- dependent mechanism involving the mitochondrial pathway in NIH3T3 cells [J]. Toxicology Letters, 2008, 179(3): 130-139
[29] Arora S, Jain J, Rajwade J M, et al. Interactions of silver nanoparticles with primary mouse fibroblasts and liver cells [J]. Toxicology and Applied Pharmacology, 2009, 236(3): 310-318
[30] AshaRani P V, Low Kah Mun G, Hande M P, et al. Cytotoxicity and genotoxicity of silver nanoparticles in human cells [J]. ACS Nano, 2009, 3(2): 279-290
[31] Park E J, Yi J, Kim Y, et al. Silver nanoparticles induce cytotoxicity by a Trojan-horse type mechanism [J]. Toxicology in Vitro An International Journal Published in Association with Bibra, 2010, 24(3): 872-878
[32] 韩春茂, 陈炯, 余朝恒, 等. 纳米银用于烧伤患者创面后银代谢的变化[J]. 中华烧伤杂志, 2004, 20(3): 161-163
Han C M, Chen J, Yu C H, et al. Change in sliver metabolism after the application of nanometer silver on burn wound [J]. Chinese Journal of Burns, 2004, 20(3): 161-163 (in Chinese)
[33] 钟飞, 孙明波, 戴政宁, 等. 纳米银在大鼠体内的药代动力学及分布特性的研究[J]. 世界最新医学信息文摘, 2015, 15(4): 61-62
Zhong F, Sun M B, Dai Z N, et al. Study on pharmacokinetics and distribution of silver nanoparticles in rats [J]. World Latest Medicine Information, 2015, 15(4): 61-62 (in Chinese)
[34] 汤京龙, 王硕, 刘丽, 等. 纳米银颗粒在大鼠体内分布特性的研究[C]. 北京: 中国生物医药工程学会学术大会, 2010
Tang J L, Wang S, Liu L, et al. Distribution, translocation and accumulation of silver nanoparticles in rats [C]. Beijing: Academic Conference of the Chinese Society of Biomedical Engineering, 2010 (in Chinese)
[35] 陈丹丹, 奚廷斐, 白净, 等. 纳米银和微米银在大鼠组织器官中的分布[J]. 北京生物医学工程, 2007, 26(6):608-611
Chen D D, Xi T P, Bai J, et al. Nanosilver subchronic toxicity and silver distribution in different rat tissues [J]. Beijing Biomedical Engineering, 2007, 26(6): 608-611 (in Chinese)
[36] Park K, Park E J, Chun I K, et al. Bioavailability and toxicokinetics of citrate-coated silver nanoparticles in rats [J]. Archives of Pharmacal Research, 2011, 34(1): 153-158
[37] Li K, Li K, Ma L Q, et al. In vitro bioaccessibility and in vivo relative bioavailability in 12 contaminated soils: Method comparison and method development [J]. Science of the Total Environment, 2015, 532: 812-820
[38] Walczak A P, Fokkink R, Peters R, et al. Behaviour of silver nanoparticles and silver ions in an in vitro human gastrointestinal digestion model [J]. Nanotoxicology, 2012, 7(7): 1198-1210
[39] Peters R, Kramer E, Oomen A G, et al. Presence of nano-sized silica during in vitro digestion of foods containing silica as a food additive [J]. ACS Nano, 2012, 6(3): 2441-2451
[40] Diehl K H, Hull R, Morton D, et al. A good practice guide to the administration of substances and removal of blood, including routes and volumes [J]. Journal of Applied Toxicology, 2001, 21(1): 15-23
