3种酰胺类除草剂对斑马鱼不同生长阶段的急性毒性效应
2017-03-14程艳红葛婧胡高洁蔡磊明陈列忠蒋金花
程艳红,葛婧,胡高洁,蔡磊明,陈列忠,蒋金花
浙江省农业科学院农产品质量标准研究所 省部共建国家重点实验室培育基地—浙江省植物有害生物防控重点实验室,农业部农药残留检测重点实验室,杭州 310021
酰胺类除草剂是一类高效、高选择性的除草剂。自美国Monsanto公司于1956年成功开发此类除草剂以来,酰胺类除草剂发展迅速,产量逐年增长,在各类除草剂中列第4位,仅排在氨基酸类、磺酰脲类和其他结构类之后[1-2]。酰胺类除草剂包括甲草胺、乙草胺、丙草胺、丁草胺、异丙甲草胺等,其中乙草胺和丁草胺已逐步成为我国用量最大的三大除草剂中的2种,年产量都为万吨以上,且呈继续增长的趋势[3]。在保障农业安全和提高品质产量的同时,酰胺类除草剂在环境中的残留量也逐年增加,是农田和水源中的污染物,通过雨水淋溶、地表径流、食物链富集等作用,对生态系统和人类健康产生潜在风险。早在1994年U.S. EPA (Environmental Protection Agency)将乙草胺定为B-2类致癌物。针对目前国内酰胺类除草剂的生产和使用现状,国家环保部颁布了《酰胺类农药工业水污染物排放标准》的征求意见稿[4]。诸多研究表明,酰胺类除草剂具有内分泌干扰效应和“三致”效应,如可以干扰蝌蚪、非洲爪蟾和稀有鮈鲫体内甲状腺激素的表达和合成[5-8],可使斑马鱼胚胎发育迟缓和畸变,并且干扰早期生活阶段斑马鱼的内分泌系统和生长发育,具有一定的生殖毒性[9-12]。
目前,国内对这类农药的环境安全性评价主要集中在农药的浓度检测以及农药对生物个体某个生长阶段水平的急性毒性、对酶(靶标酶、代谢酶)活性的改变及对遗传物质损伤的研究,缺少对生物体整个生长阶段的毒性影响以及环境安全评价方法。
斑马鱼在毒理学研究中应用广泛,对水质污染与毒性物质反应灵敏,其基因与人类基因同源性在87%以上,且具有繁殖周期短,胚胎透明,个体小,易于养殖,易于观察药物对活体胚胎内各个组织和器官等特点,已成为各种研究的最佳模式生物。本研究以斑马鱼为受试对象,研究乙草胺、丙草胺和丁草胺3种酰胺类除草剂对斑马鱼不同生长阶段的毒性差异以更好地评价该类除草剂的毒性效应,阐明致毒机理,最终为酰胺类除草剂的毒性预测和生态风险评价提供科学依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:24孔细胞培养板和6孔细胞培养板均购自浙江拱东医疗科技有限公司,分别作为胚胎和仔鱼染毒器具。
试剂:乙草胺原药(93.0%),山东侨昌化学有限公司,丙草胺原药(96.8%)、丁草胺(92.5%),杭州庆丰化工有限公司;分析纯吐温-80(国药集团化学试剂有限公司);N,N-二甲基甲酰胺(DMF)为天津市福晨化学试剂厂。
1.2 实验材料
斑马鱼(Danio rerio)种鱼购自武汉中国科学院水生生物研究所的国家斑马鱼资源中心,AB型品系,本试验所用斑马鱼胚胎、仔鱼、幼鱼和成鱼均为种鱼繁殖所得。斑马鱼胚胎分别为同一天收集的健康胚胎;仔鱼为孵化后8日龄;幼鱼为孵化后55日龄;成鱼为3月龄。仔鱼、幼鱼和成鱼均于正式试验前24 h停止喂食。
试验用水为曝气除氯并经活性炭过滤的自来水,水温为(25±1) ℃,pH控制在6.5~7.5,光/暗比为14 h/10 h,溶解氧≥5.8 mg·L-1。
1.3 试验方法
1.3.1 试验药液配制
乙草胺、丙草胺、丁草胺原药用吐温-80和DMF溶解,经超声混匀定容后配制成一定浓度的标准储备液,冷藏备用。试验时,用移液器吸取适量储备液加入一定量的标准稀释水,超声混匀,按相应倍数逐级稀释至设计浓度。试验期间,各试验容器内的助溶剂DMF在水中的最终浓度均低于0.1 mg·L-1。标准稀释水按照《化学品鱼类急性毒性试验》[13]方法配制。
1.3.2 胚胎染毒试验
参考世界经济合作与发展组织(OECD)方法[14],通过立体显微镜观察,挑选发育正常的健康受精卵供试。采用24孔细胞培养板,每孔加入2 mL供试药液并放入1枚受精卵。根据预备试验结果,设定乙草胺、丙草胺、丁草胺对斑马鱼胚胎毒性试验浓度(表1),按最高浓度组的助剂浓度设置助剂对照组,以稀释水为空白对照组。每浓度设3次重复,每重复为1个24孔板。
染毒期间环境温度为(25±1) ℃,光/暗比为14 h/10 h。每24 h更换1次溶液。试验期间分别于染毒6、24、48、72、96 h观察并记录死亡数、孵化数及相关中毒症状,并及时取出死亡个体。
1.3.3 仔鱼、幼鱼和成鱼试验
参考OECD TG 203[15]方法,设计乙草胺、丙草胺、丁草胺对不同生长阶段斑马鱼的急性毒性试验。试验用水为曝气除氯并经活性炭过滤的自来水。根据预备试验结果,设定斑马鱼仔鱼、幼鱼和成鱼的试验浓度(表1),按最高浓度组的助剂浓度设助剂对照组,以曝气自来水为空白对照组。
仔鱼急性毒性试验采用6孔板,每孔放入3条仔鱼,设2次重复,每重复为1个6孔板;幼鱼和成鱼采用6 L鱼缸,每缸15条鱼,均设2次重复。仔鱼、幼鱼和成鱼的试验过程均采用“半静态法”,每24 h更换1次药液。
试验期间分别于6、24、48、72和96 h时间点观察并记录各组斑马鱼中毒症状及死亡情况,每隔24 h检查各组的pH值及溶解氧含量,并及时清除死鱼。
1.4 数据处理
用DPS数据处理系统9.50标准版计算斑马鱼
胚胎、仔鱼、幼鱼和成鱼的LC50值及其95%置信区间,分析乙草胺、丙草胺和丁草胺对斑马鱼各生长阶段的毒性差异。
2 结果(Results)
2.1 乙草胺对斑马鱼不同生长阶段的毒性效应
图1为斑马鱼胚胎经不同浓度乙草胺处理不同时间后的死亡率。不同处理组在24 h和48 h都未出现死亡,72 h时,12.0、8.00、5.33、3.56 mg·L-1乙草胺处理组的胚胎死亡率急速上升,96 h时死亡率分别为100%、62.5%、15.0%、5.00%。相对于药剂处理组,空白对照组和助剂对照组对斑马鱼胚胎的死亡率没有影响。

图1 乙草胺对斑马鱼胚胎暴露24 h、48 h、72 h和96 h的死亡率的影响Fig. 1 Effect of acetochlor on mortality rate of zebrafish embryo for 24 h, 48 h, 72 h and 96 h

农药Pesticide生长阶段Lifestages试验浓度/(mg·L-1)Concentrations/(mg·L-1)乙草胺Acetochlor胚胎Embryo12.08.005.333.562.37仔鱼Larvae3.112.071.380.9220.614幼鱼Juvenile3.603.002.502.081.74成鱼Adult2.001.541.180.9100.700丙草胺Pretilachlor胚胎Embryo4.623.552.732.101.62仔鱼Larvae3.002.502.081.741.451.21幼鱼Juvenile3.002.502.081.741.45成鱼Adult3.002.502.081.741.45丁草胺Butachlor胚胎Embryo3.912.441.530.9540.596仔鱼Larvae3.131.951.220.7630.477幼鱼Juvenile4.003.332.782.311.93成鱼Adult1.671.391.160.9650.804

图2 乙草胺对斑马鱼胚胎暴露24 h、48 h、72 h和96 h孵化率的影响Fig. 2 Effect of acetochlor on the hatching rate of zebrafish embryo for 24 h, 48 h, 72 h and 96 h
图2为不同浓度乙草胺处理后对斑马鱼胚胎孵化的影响。研究发现,低浓度的乙草胺对斑马鱼的胚胎孵化没有影响,高浓度的乙草胺对胚胎的孵化有一定的抑制作用。染毒72 h和96 h后,助剂对照、空白对照组以及试验组2.37、3.56、5.33、8.00、12.0 mg·L-1乙草胺对斑马鱼胚胎的孵化率分别为93.8%、93.8%、93.8%、51.3%、22.5%、18.8%、0%和
98.8%、97.5%、96.3%、96.3%、86.3%、66.3%、0%。
表2为96 h 时乙草胺对斑马鱼胚胎、仔鱼、幼鱼和成鱼的半致死浓度(LC50)及95%置信区间。从中可看出,乙草胺对斑马鱼胚胎、仔鱼、幼鱼和成鱼的96 h-LC50值分别为5.82、1.34、3.00、1.44 mg·L-1,因此,乙草胺对斑马鱼不同生长阶段的毒性从高到低顺序依次为:仔鱼>成鱼>幼鱼>胚胎。

图3 丙草胺对斑马鱼胚胎暴露24 h、48 h、72 h和96 h死亡率的影响Fig. 3 Effect of pretilachlor on mortality rate of zebrafish embryo for 24 h, 48 h, 72 h and 96 h

生长阶段Lifestages暴露时间/hExposureduration/h毒力回归方程Toxicregressionequation相关系数Relativecoefficient半致死浓度(95%置信限)/(mg·L-1)LC50(95%CI)/(mg·L-1)胚胎Embryo24---48---72Y=0.624+5.00x0.81513.3(5.58~31.6)96Y=4.54+12.5x0.9565.82(4.76~7.11)仔鱼Larvae24Y=1.45+9.78x0.9712.31(1.86~2.87)48Y=2.80+9.09x0.9641.75(1.44~2.12)72Y=3.19+12.8x0.9761.39(1.20~1.60)96Y=3.34+12.9x0.9781.34(1.17~1.54)幼鱼Juvenile24Y=4.42+15.0x0.8864.26(3.00~6.05)48Y=4.10+16.3x0.9203.60(2.91~4.47)72Y=5.36+20.9x0.9423.13(2.73~3.60)96Y=6.12+23.3x0.9623.00(2.71~3.32)成鱼Adult24Y=0.804+11.1x0.8932.39(1.52~3.76)48Y=2.52+9.25x0.8791.85(1.29~2.66)72Y=2.87+10.9x0.8841.57(1.19~2.07)96Y=3.02+12.4x0.9211.44(1.19~1.75)
2.2 丙草胺对斑马鱼不同生长阶段的毒性效应
图3为斑马鱼胚胎经不同浓度丙草胺处理不同时间后的死亡率。不同处理组在24 h和48 h内都未出现死亡,在72~96 h内,随着暴露时间的延长,丙草胺各浓度处理组的胚胎死亡率逐渐增加,在96 h时,1.62、2.10、2.73、3.55和4.62 mg·L-1试验组的死亡率分别为0%、20.0%、25.0%、72.5%和100%。相对于药剂处理组,空白对照组和助剂对照组对斑马鱼胚胎的死亡率没有影响。
图4为不同浓度丙草胺处理后对斑马鱼胚胎孵化的影响。研究发现,随着暴露浓度的增加,丙草胺各浓度处理组对斑马鱼胚胎孵化的抑制作用逐渐增加。染毒96 h后,助剂对照、空白对照组以及试验组1.62、2.10、2.73、3.55和4.62 mg·L-1丙草胺对斑马鱼胚胎的孵化率分别为100%、100%、97.5%、66.3%、37.5%、0%、0%。
表3为96 h 时丙草胺对斑马鱼胚胎、仔鱼、幼鱼和成鱼的半致死浓度(LC50)及95%置信区间。从中可看出,丙草胺对斑马鱼胚胎、仔鱼、幼鱼和成鱼的96 h-LC50值分别为2.79、2.02、2.26、2.01 mg·L-1,丙草胺对斑马鱼胚胎、仔鱼、幼鱼和成鱼的急性毒性顺序为:仔鱼、成鱼>幼鱼>胚胎。
2.3 丁草胺对斑马鱼不同生长阶段的毒性效应
图5为斑马鱼胚胎经不同浓度丁草胺处理不同时间后的死亡率。在24~96 h内,随着暴露时间的延长,丁草胺各浓度处理组的胚胎死亡率逐渐增加,在96 h时,0.596、0.954、1.53、2.44和3.91 mg·L-1试验组的死亡率分别为0%、12.5%、15.0%、30.0%和100%。相对于药剂处理组,空白对照组和助剂对照组对斑马鱼胚胎的死亡率没有影响。
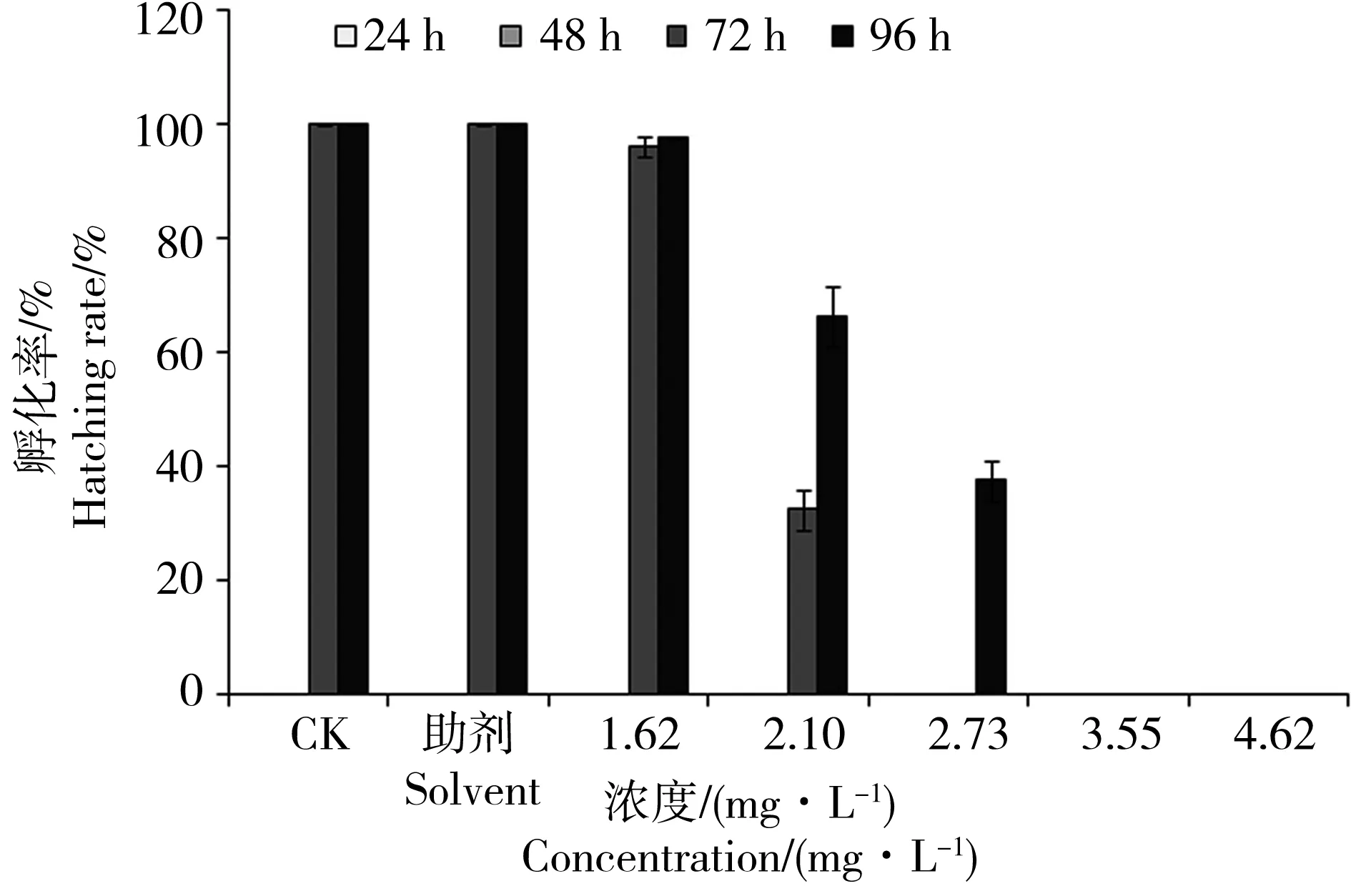
图4 丙草胺对斑马鱼胚胎暴露24 h、48 h、72 h和96 h孵化率的影响Fig. 4 Effect of pretilachlor on the hatching rate of zebrafish embryo for 24 h, 48 h, 72 h and 96 h

生长阶段Lifestages暴露时间/hExposuretime/h毒力回归方程Toxicregressionequation相关系数Relativecoefficient半致死浓度(95%置信限)/(mg·L-1)LC50(95%CI)/(mg·L-1)胚胎Embryo24---48---72Y=0.000800+18.8x0.7255.17(2.34~11.4)96Y=3.41+18.8x0.9462.79(2.42~3.23)仔鱼Larvae24---48Y=2.35+14.1x0.8413.32(2.22~4.96)72Y=1.29+20.5x0.9272.03(1.79~2.30)96Y=1.28+20.5x0.9292.02(1.79~2.29)幼鱼Juvenile24---48Y=2.79+11.6x0.7094.69(1.80~12.2)72Y=7.30+32.8x0.8942.37(2.01~2.79)96Y=6.58+32.8x0.9662.26(2.08~2.45)成鱼Adult24---48Y=2.79+11.6x0.7094.69(1.80~12.2)72Y=7.18+32.1x0.8892.40(2.02~2.84)96Y=5.19+33.6x0.9582.01(1.84~2.19)
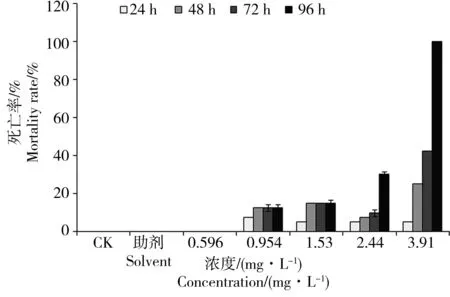
图5 丁草胺对斑马鱼胚胎暴露24 h、48 h、72 h和96 h死亡率的影响Fig. 5 Effect of butachlor on mortality rate of zebrafish embryo for 24 h, 48 h, 72 h and 96 h
图6为不同浓度丁草胺处理后对斑马鱼胚胎孵化的影响。研究表明,染毒48 h后,助剂对照、空白对照组的胚胎都未孵化,不同浓度的丁草胺对斑马鱼胚胎孵化有一定程度的促进作用,0.596、0.954、1.53、2.44 mg·L-1丁草胺对斑马鱼胚胎的孵化率分别为5.00%、11.3%、7.50%、5.00%。随着暴露时间的增加,丁草胺各浓度处理组对斑马鱼胚胎的孵化具有不同程度的抑制作用。染毒72 h和96 h后,助剂对照、空白对照组以及试验组0.596、0.954、1.53、
2.44和3.91 mg·L-1丁草胺对斑马鱼胚胎的孵化率分别为88.8%、91.3%、90.0%、73.8%、63.8%、42.5%、0%和98.8%、100%、97.5%、86.3%、83.8%、86.3%、0%。
表4为96 h 时丁草胺对斑马鱼胚胎、仔鱼、幼鱼和成鱼的半致死浓度(LC50)及95%置信区间。从中可看出,丁草胺对斑马鱼胚胎、仔鱼、幼鱼和成鱼的96 h-LC50值分别为1.73、0.919、3.37、1.19 mg·L-1,因此,丁草胺对斑马鱼不同生长阶段的毒性从高到低顺序依次为:仔鱼>成鱼>胚胎>幼鱼。

图6 丁草胺对斑马鱼胚胎暴露24 h、48 h、72 h和96 h孵化率的影响Fig. 6 Effect of butachlor on hatching rate of zebrafish embryo for 24 h, 48 h, 72 h and 96 h
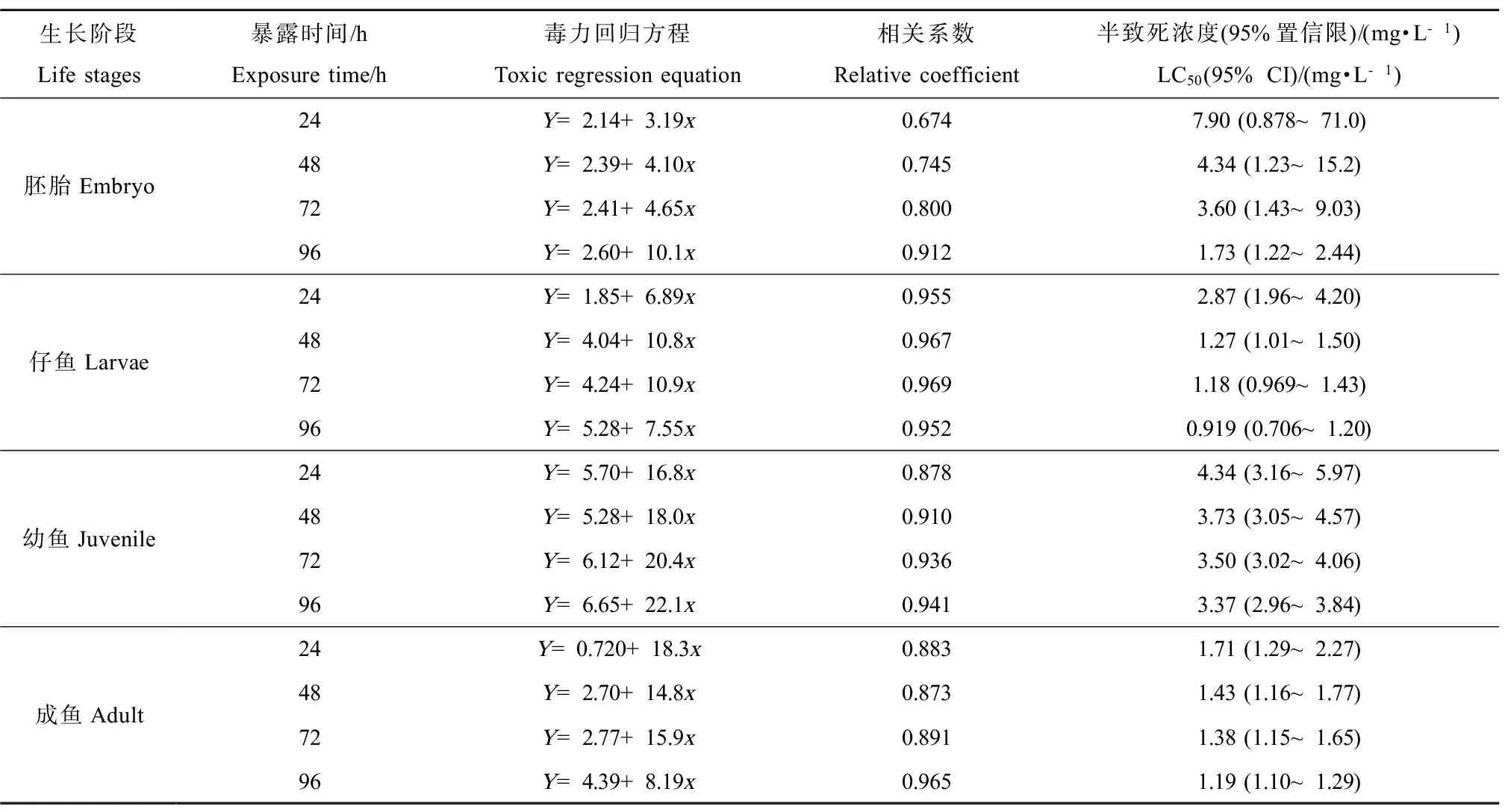
生长阶段Lifestages暴露时间/hExposuretime/h毒力回归方程Toxicregressionequation相关系数Relativecoefficient半致死浓度(95%置信限)/(mg·L-1)LC50(95%CI)/(mg·L-1)胚胎Embryo24Y=2.14+3.19x0.6747.90(0.878~71.0)48Y=2.39+4.10x0.7454.34(1.23~15.2)72Y=2.41+4.65x0.8003.60(1.43~9.03)96Y=2.60+10.1x0.9121.73(1.22~2.44)仔鱼Larvae24Y=1.85+6.89x0.9552.87(1.96~4.20)48Y=4.04+10.8x0.9671.27(1.01~1.50)72Y=4.24+10.9x0.9691.18(0.969~1.43)96Y=5.28+7.55x0.9520.919(0.706~1.20)幼鱼Juvenile24Y=5.70+16.8x0.8784.34(3.16~5.97)48Y=5.28+18.0x0.9103.73(3.05~4.57)72Y=6.12+20.4x0.9363.50(3.02~4.06)96Y=6.65+22.1x0.9413.37(2.96~3.84)成鱼Adult24Y=0.720+18.3x0.8831.71(1.29~2.27)48Y=2.70+14.8x0.8731.43(1.16~1.77)72Y=2.77+15.9x0.8911.38(1.15~1.65)96Y=4.39+8.19x0.9651.19(1.10~1.29)
3 讨论(Discussion)
随着人们对环境安全意识的提高,农药对环境和非靶标生物的安全性也得到了广泛关注。鱼类为重要的、典型的非靶标生物,是水生生态系统中非常重要组成部分,是自然生态系统中重要的生物类群和宝贵的自然资源,对周围环境变化的响应也比较敏感。斑马鱼已成为包括OECD、ISO、U.S. EPA等国际组织机构推荐使用的标准模式鱼种之一,其整个生命周期的各个阶段均可以用来开展相关研究。本试验分别以斑马鱼胚胎、8日龄仔鱼、55日龄幼鱼和3月龄成鱼为研究对象,研究了乙草胺、丙草胺和丁草胺对斑马鱼不同生长阶段的急性毒性试验。急性毒性试验试验时间短、测定方法简单和试验结果可以提供农药的毒性级别等信息,为农药登记和管理提供参考。
斑马鱼胚胎毒性试验具有许多优势,如胚胎试验只需要极少量受试药品;胚胎试验能够更好地反映化合物的致畸效应;更能顺应发展的动物福利要求。斑马鱼的胚胎是评价环境污染物发育毒性和致畸效应的模式生物,可以在卵受精后开始实验。研究表明,甲草胺、乙草胺、丙草胺、丁草胺、异丙甲草胺5种酰胺类除草剂均能抑制斑马鱼胚胎的孵化并诱导斑马鱼胚胎出现心包囊水肿、游囊关闭、躯干弯曲等症状[16],而且,乙草胺能干扰斑马鱼甲状腺相关基因的表达,具有一定的甲状腺内分泌干扰作用[17]。
本研究中,斑马鱼胚胎染毒72 h和96 h后,助剂对照、空白对照组以及试验组2.37、3.56、5.33、8.00、12.0 mg·L-1乙草胺对斑马鱼胚胎的孵化率分别为93.8%、93.8%、93.8%、51.3%、22.5%、18.8%、0%和98.8%、97.5%、96.3%、96.3%、86.3%、66.3%、0%。染毒96 h后,助剂对照、空白对照组以及试验组1.62、2.10、2.73、3.55和4.62 mg·L-1丙草胺对斑马鱼胚胎的孵化率分别为100%、100%、97.5%、66.3%、37.5%、0%、0%。染毒72 h和96 h后,助剂对照、空白对照组以及试验组0.596、0.954、1.53、2.44和3.91 mg·L-1丁草胺对斑马鱼胚胎的孵化率分别为88.8%、91.3%、90.0%、73.8%、63.8%、42.5%、0%和98.8%、100%、97.5%、86.3%、83.8%、86.3%、0%。乙草胺、丙草胺和丁草胺高浓度处理组均抑制斑马鱼胚胎的孵化。有研究认为造成胚胎发育迟缓的原因可能与超氧化物歧化酶SOD 和腺苷三磷酸ATPase的活性抑制有关,在受精卵通过分裂分化产生机体全部细胞表型的过程中,氧作为关键的环境因子起着重要作用,没有氧的参与胚胎不能正常地生长发育。当SOD活性受到抑制时,正常的活性氧平衡被打破,从而影响胚胎的正常发育。而ATPase的作用是水解高能化合物ATP而释放供生命活动所需的能量,它对胚胎发育的影响是显而易见的[18]。
死亡率通常可以作为一个重要的生态毒理学指标,用以评价污染物的毒性大小。斑马鱼96 h急性毒性试验一般被用作评价农药对鱼类等水生脊椎动物可能存在风险的常规方法。本研究发现,酰胺类除草剂对斑马鱼不同生长阶段的毒性随处理浓度的增大而增加,同时随暴露时间的延长而增加,显示一定的剂量-效应和时间-效应关系。乙草胺对斑马鱼不同生长阶段的毒性从高到低顺序依次为:仔鱼>成鱼>幼鱼>胚胎,丙草胺对斑马鱼胚胎、仔鱼、幼鱼和成鱼的急性毒性顺序为:仔鱼、成鱼>幼鱼>胚胎,丁草胺对斑马鱼不同生长阶段的毒性从高到低顺序依次为:仔鱼>成鱼>胚胎>幼鱼。可见,仔鱼阶段对酰胺类除草剂最敏感,成鱼其次,幼鱼和胚胎阶段的毒性效应最小,酰胺类除草剂对斑马鱼4个典型生长阶段的毒性差异较大,这可能与斑马鱼不同生长阶段的个体的生长发育密切相关。鱼类的早期生命阶段如胚胎和仔鱼阶段对化学物质的敏感性要高于成年及幼鱼阶段,因为斑马鱼在胚胎和仔鱼阶段不具备像成年及幼鱼个体那样的代谢解毒能力。另外胚胎的外膜能够起到阻碍有毒化合物与生命体接触的作用,具有一定的保护作用,使得斑马鱼胚胎对化学物质具有一定的耐受能力。从本研究的结果来看,仔鱼阶段是斑马鱼对酰胺类除草剂最敏感的生长阶段这可能是因为处于该阶段的斑马鱼既不具备代谢解毒能力,又没有胚胎膜的保护。斑马鱼胚胎阶段对于酰胺类除草剂的毒性为丁草胺>丙草胺>乙草胺,仔鱼阶段的毒性为丁草胺>乙草胺>丙草胺,幼鱼阶段的毒性为丙草胺>乙草胺>丁草胺,成鱼阶段的毒性为丁草胺>乙草胺>丙草胺。目前关于污染物对生物体某一生长阶段的急性毒性或者慢性毒性效应研究较多,农药对鱼类的毒性等级划分也仅局限于成鱼阶段[19],单一生命阶段的毒性试验数据较为片面,不能客观全面地反映污染物对生物的毒性。全周期试验能够模仿环境中生物的污染暴露情况,并且数据全面系统,也为进一步制定相应的毒性判断标准提供参考数据, 且对农药的生态风险评估以及水体污染的生物监测具有一定的指导意义。
[1] 丁丽, 付颖, 叶非. 酰胺类除草剂的研究和应用进展[J]. 农药科学与管理, 2011, 32(9): 22-26
Ding L, Fu Y, Ye F. Progress in research and application of amide herbicides [J]. Pesticide Science and Administratio, 2011, 32(9): 22-26 (in Chinese)
[2] 张一宾. 酰胺类除草剂的全球市场、品种及发展趋向[J]. 现代农药, 2011, 10(1): 41-43
Zhang Y B. Market and products and development trend of amide herbicides[J]. Modern Agrochemicals, 2011, 10(1): 41-43 (in Chinese)
[3] 姚斌, 徐建民, 张超兰. 除草剂丁草胺的环境行为综述[J]. 生态环境, 2003, 12(1): 66-70
Yao B, Xu J M, Zhang C L. Behavior of herbicide butachlor in environment [J]. Ecology and Environment, 2003, 12(1): 66-70 ( in Chinese)
[4] 环境保护部. 酰胺类农药工业水污染物排放标准(征求意见稿)[S]. 北京: 中国标准出版社, 2008
[5] Helbing C C, Ovaska K, Ji L. Evaluation of the effect of acetochlor on thyroid hormone receptor gene expression in the brain and behavior of Rana catesbeiana tadpoles [J]. Aquatic Toxicology, 2006, 80: 42-51
[6] Bicho R C, Amaral M J, Faustino A M, et al. Thyroid disruption in the lizard Podarcis bocagei exposed to a mixture of herbicides: A field study [J]. Ecotoxicology, 2013, 22: 156-165
[7] Crump D, Werry K, Veldhoen N, et al. Exposure to the herbicide acetochlor alters thyroid hormone-dependent gene expression and metamorphosis in Xenopus Laevis [J]. Environment Health Perspectives, 2002, 110: 1199-1205
[8] Li W, Zha J, Li Z, et al. Effects of exposure to acetochlor on the expression of thyroid hormone related genes in larval and adult rare minnow (Gobiocypris rarus) [J]. Aquatic Toxicology, 2009, 94: 87-93
[9] Chang J, Gui W, Wang M, et al. Effects of butachlor on estrogen receptor, vitellogenin and P450 aromatase gene expression in the early life stage of zebrafish [J]. Journal of Environmental Science and Health. Part A, Toxic/Hazardous Substances and Environmental Engineering, 2012, 47: 1672-1677
[10] Chang J, Liu S, Zhou S, et al. Effects of butachlor on reproduction and hormone levels in adult zebrafish (Danio rerio) [J]. Experimental and Toxicologic Pathology, 2013, 65: 205-209
[11] Tu W, Niu L, Liu W, et al. Embryonic exposure to butachlor in zebrafish (Danio rerio): Endocrine disruption, developmental toxicity and immunotoxicity [J]. Ecotoxicology and Environmental Safety, 2013, 89: 189-195
[12] Zhu L, Li W, Zha J, et al. Butachlor causes disruption of HPG and HPT axes in adult female rare minnow (Gobiocypris rarus) [J]. Chemico-Biological Interactions, 2014, 221: 119-126
[13] 国家质量监督检验检疫总局, 国家标准化管理委员会. GB/T27861—2011 化学品鱼类急性毒性试验[S]. 北京: 中国标准出版社, 2011
[14] OECD. Guideline for Testing of Chemicals 236: Fish Embryo Acute Toxicity (FET) Test [S]. Paris: Organization for Economic Co-operation and Development, 2013
[15] OECD. Guideline for Testing of Chemicals 203: Fish, Acute Toxicity Test [S]. Paris: Organization for Economic Co-operation and Development, 1992
[16] 刘迎, 胡燕, 姜蕾, 等. 5种酰胺类除草剂对斑马鱼胚胎发育的毒性效应[J]. 农药, 2014, 53(11): 806-808
Liu Y, Hu Y, Jiang L, et al. The toxicity effects of five amide herbicides on embryo development of zebrafish [J]. Agrochemicals, 2014, 53(11): 806-808 (in Chinese)
[17] 胡竞进, 曹楚彦, 杨梅, 等. 乙草胺对斑马鱼幼鱼早期发育阶段甲状腺相关基因的影响[J]. 农药学学报, 2015,17(4): 409-416
Hu J J, Cao C Y, Yang M, et al. Effects of acetochlor on the expression of thyroid related genes in early development stage of zebrafish (Danio rerio) larvae [J]. Chinese Journal of Pesticide Science, 2015,17(4): 409-416 (in Chinese)
[18] 夏勇, 傅剑云, 郑云燕, 等. 丁草胺对斑马鱼及其胚胎发育毒性影响的研究[J]. 浙江预防医学, 2011, 23(1): 11-16
Xia Y, Fu J Y, Zheng Y Y, et al. Study on toxicity of butaehlor on zebrafish and its embryo development [J]. Zhejiang Preventive Medicine, 2011, 23(1): 11-16 (in Chinese)
[19] 国家质量监督检验检疫总局, 国家标准化管理委员会. GB/T 31270.12—2014化学农药环境安全评价试验准则, 第12部分: 鱼类急性毒性试验[S]. 北京: 中国标准出版社, 2014
