六价铬诱导的肝细胞线粒体依赖性凋亡中VDAC1的作用
2017-03-14周晓昕张玉静肖芳钟才高
周晓昕,张玉静,肖芳,钟才高
中南大学湘雅公共卫生学院,长沙 410000
在生态系统中,铬存在多种价态,其中Cr(Ⅵ)具有生物氧化毒性,在自然界中主要以铬酸盐或重铬酸盐的形式存在,毒性最强[1]。肝脏是人体内最大的实质性器官,物质代谢是其主要功能。外源化学物经胃肠道吸收,由门静脉系统进入肝脏,经肝脏代谢后进入体循环,此过程称为首过消除;同时肝脏内血管网密布,外源化学物无论以何种方式进入人体,都可以通过血液循环进入肝脏。因此肝脏既是重要的解毒器官,也是主要的靶器官。线粒体是几乎所有哺乳动物细胞浆中都存在的一种半自主细胞器,通过三羧酸循环和氧化磷酸化作用产生ATP为细胞提供能量,同时参与多种物质的代谢与合成,还与细胞凋亡、固有免疫和维持细胞内稳态有关[2]。线粒体通透性转换孔(mitochondrial permeability transition pore, MPTP)是由位于线粒体内膜和外膜上多个分子组成的蛋白复合体,主要通过调节氧化磷酸化过程来控制细胞能量代谢,以及通过改变线粒体膜通透性引起细胞死亡[3]。电压依赖性阴离子通道(voltage-dependent anion channel, VDAC),是真核细胞线粒体外膜上的孔道蛋白,是线粒体外膜物质转运的通道,也是调控细胞生存与死亡途径的重要节点[4-5]。VDAC1是VDAC的3种亚型之一,可与细胞内多种蛋白(如BCL-2家族蛋白)相互作用,影响线粒体外膜通透性,释放线粒体膜间隙中的凋亡相关因子进入胞浆,从而引起细胞凋亡[6]。本研究以肝细胞作为研究对象,初步揭示了VDAC1在Cr(Ⅵ)诱导的线粒体依赖性细胞凋亡中的作用,为进一步的机制探讨提供了实验数据;同时也为防治Cr(Ⅵ)引起的职业损害,促进人群健康提供理论依据。
1 材料与方法(Materials and methods)
1.1 细胞、仪器和试剂
L02细胞(中南大学湘雅医学院实验中心);293T细胞(军事医学科学院);DH5α感受态细胞(北京鼎国昌盛生物公司);9700 型 PCR 扩增仪(美国 ABI 公司); Q5000 型微量紫外分光光度计(美国 Quawell 公司);Power Wave XS2 微孔板分光光度计(美国 BioTek 公司);流式细胞仪(美国 BD 公司);Mini-ProteanTetra 小型垂直电泳槽及PowerPac HC 型高电流电泳仪(美国 Bio-Rad 公司);重铬酸钾(美国Sigma-Aldrich公司);Hyclone RPMI Medium Modified 培养基、Hyclone DMEM/HIGH GLUCOSE培养基(北京赛默飞世尔生物公司);胎牛血清(杭州四季青生物有限公司);青-链霉素(北京LEAGENE公司);0.25%胰蛋白酶、Annexin V-FITC Apoptosis Detection Kit细胞凋亡检测试剂盒(美国Genview公司);嘌呤霉素(美国Invitrogen公司);二甲基亚砜(美国 Sigma-Aldrich 公司);Ampicillin sodium salt (BIOSHARP公司);无内毒素质粒小提试剂盒(北京康为世纪公司);细胞核蛋白与细胞浆蛋白抽提试剂盒、RIPA裂解液、活性氧(ROS)检测试剂盒(上海Beyotime生物技术公司);BCA蛋白定量检测试剂盒(北京鼎国昌盛生物公司);Cell Counting Kit细胞增殖与毒性检测试剂盒(七海生物公司);细胞总RNA提取试剂(美国Invitrogen公司);PrimeScriptTMRT Reagent kit、SYBR®Premix Ex TaqTMⅡ(日本Takara公司);活体细胞线粒体膜通道孔(MPTP)荧光检测试剂盒(美国GENMED公司)。
1.2 方法
1.2.1 VDAC1稳定低表达细胞系的建立
构建能够稳定敲低VDAC1基因的shRNA慢病毒载体,在293T细胞中转染shRNA慢病毒包装体系,并感染L02细胞获得VDAC1低表达的L02细胞系,同时转染空载质粒作为阴性对照(NC)。为避免脱靶效应影响实验结果,设计2种引物进行细胞转染,VDAC1低表达shRNA载体引物设计如表1。
1.2.2 L02细胞与VDAC1稳定低表达L02细胞系的培养
L02细胞使用含有10%胎牛血清和1%青-链霉素的RPMI Medium Modified 培养基;VDAC1稳定低表达的L02细胞系及NC细胞使用含有15%胎牛血清、1%青-链霉素和0.5%嘌呤霉素的RPMI Medium Modified 培养基。所有细胞在37 ℃、体积分数为5%的CO2培养箱中培养,2~3 d传代一次,取生长状态良好的对数期细胞用胰酶消化后按适当的密度接种至新培养皿中,并设置分组,以便用于后续实验。
1.2.3 预实验
取处于对数期生长状态良好的L02细胞、shVDAC1-1、shVDAC1-2及NC细胞,通过胰酶消化后用培养基重悬制成单个细胞悬液,使用细胞计数板计数并调整细胞浓度至1×105cells·mL-1,将细胞接种于96孔板中,每孔100 μL;培养24 h后每孔加入11 μL Cr(Ⅵ)染毒液,使其染毒终浓度分别为2 μmol·L-1、4 μmol·L-1、8 μmol·L-1、16 μmol·L-1、25 μmol·L-1、40 μmol·L-1、50 μmol·L-1、100 μmol·L-1、200 μmol·L-1,空白对照使用等体积的PBS,每组设3个复孔;染毒24 h后,每孔加入10 μL的CCK8溶液,继续在37 ℃、5%CO2的培养箱中培养40 min,使用酶标仪测定450 nm处的吸光值。
1.2.4 细胞的分组与处理
将处于对数生长期状态良好的L02细胞、shVDAC1-1、shVDAC-2及NC细胞用胰酶消化,按适当浓度接种至新的培养皿,待细胞生长密度达到70%左右时,根据预实验的结果对细胞进行染毒处理,染毒时间为24 h。
1.2.5 流式细胞仪检测细胞凋亡
原理:在正常细胞中,磷脂酰丝氨酸(PS)只分布在细胞膜脂质双分子层内侧,而在细胞凋亡早期,细胞膜中的PS由内侧翻向外侧。Annexin V与PS具有高度亲和力,故可通过细胞膜外侧暴露的PS与早期凋亡细胞结合,将Annexin V进行荧光素FITC标记,以标记了的Annexin V作为荧光探针,利用流式细胞仪检测细胞凋亡的发生。碘化丙啶(propidium iodide, PI)是一种核酸染料,它不能通过完整的细胞膜,但对凋亡中晚期的细胞和死细胞,PI能透过细胞膜将细胞核染红。因此将Annexin V与PI结合使用可以区分不同凋亡时期的细胞。
操作步骤:使用胰酶消化1.2.4中处理后的细胞,同时离心收集上清液中的死亡细胞,用PBS洗涤2次后加入300 μL的Binding Buffer悬浮细胞,加入5 μL Annexin V-FITC混匀后,加入5 μL PI混匀,室温避光反应5~10 min,1 h内进行流式细胞仪分析。
1.2.6 ROS活性检测
原理:DCFH-DA本身无荧光,可自由穿过细胞膜,进入细胞后可被细胞内的酯酶水解为不能通过细胞膜的DCFH。细胞内的活性氧可将无荧光的DCFH氧化为有荧光的DCF,检测荧光强度即可判断细胞内活性氧的含量。
操作步骤:将受试细胞按适当密度接种至6孔板,按1.2.4中步骤分组处理,24 h后除去细胞培养液,PBS清洗3~4次,用无血清培养基按1∶1 200稀释DCFH-DA,每孔加入300 μL,37 ℃细胞培养箱孵育20 min,每隔3~5 min混匀一次,无血清培养基清洗细胞3次,收集细胞,通过流式细胞仪检测ROS活性。
1.2.7 MPTP孔开放度测定
原理:钙黄绿素-AM极易进入细胞及线粒体,当它进入细胞后被酯酶切离,形成荧光性强的钙黄绿素,钙黄绿素进入线粒体后即被线粒体俘获,而未进入线粒体的钙黄绿素被胞浆中的淬灭剂钴离子淬灭,失去荧光。当MPTP孔开放,线粒体中的钙黄绿素进入胞浆,被钴离子淬灭。因此检测细胞荧光强度的变化可判断MPTP孔道的开放情况。

表1 VDAC1的引物Table 1 Primers for VDAC1
操作步骤:将受试细胞按适当密度接种至96孔板,按1.2.4中步骤进行处理,每种细胞每个处理组设3个复孔;24 h后小心吸尽培养液,沿孔壁在每一个孔中缓缓加入100 μL、37 ℃预热的清理液,覆盖细胞,再小心抽去清理液;沿孔壁在每孔中加入100 μL预先配好的含有染色液和中和液的染色工作液,覆盖细胞表面,置于37 ℃细胞培养箱中孵育20 min,避免光照;小心抽去染色工作液,沿孔壁加入100 μL清理液,清洗2次后再加入100 μL清理液到培养孔中,使用荧光分光光度计进行定量检测。
1.2.8 蛋白免疫印迹法检测相关蛋白的表达情况
将受试细胞按1.2.4处理后收集细胞,使用RIPA裂解液和胞浆蛋白抽提试剂分别提取总蛋白和胞浆蛋白,通过蛋白免疫印迹法获得VDAC1、细胞色素C和AIF的表达水平,以β-肌动蛋白(β-actin)作为内参,获得上述蛋白在不同细胞及不同处理组中的变化情况。
1.3 统计学分析
2 结果(Results)
2.1 L02-VDAC1低表达细胞系的鉴定
用Western blot法检验细胞系,如图1所示,转染细胞shVDAC1-1和shVDAC1-2中VDAC1的表达较L02明显减少;而NC细胞 VDAC1的表达与L02相比无明显差异。

图1 Western blot法检测4种细胞内VDAC1的表达Fig. 1 The Western blot bands of VDAC1 expression in 4 types of cells
2.2 VDAC1低表达对Cr(Ⅵ)处理的细胞生存率的影响
不同浓度Cr(Ⅵ)对4种细胞生存率的影响见图2,实验结果表明随着Cr(Ⅵ)染毒浓度的增加,4种细胞的生存率均有下降(P<0.05),并呈现明显的剂量-反应关系;但VDAC1低表达组较L02和NC细胞下降趋势较为平缓;根据CCK-8实验结果,确保Cr(Ⅵ)处理后细胞生存率在一个比较适合的范围(>70%),故选择8 μmol·L-1为后续试验的处理浓度;且在染毒浓度为8 μmol·L-1时,L02与NC细胞的生存率与非染毒组相比均下降(P<0.05),而VDAC1低表达细胞的生存率与非染毒组相比差异无统计学意义(P>0.05),见表2。
2.3 VDAC1对Cr(Ⅵ)诱导的细胞凋亡的影响
流式细胞仪检测细胞的凋亡率,如图3和图4所示,Q4为正常细胞,Q3为早期凋亡细胞,Q2为晚期凋亡细胞,Q1为坏死细胞,本实验主要研究晚期凋亡。VDAC1未敲低的L02细胞与NC细胞经Cr(Ⅵ)染毒处理后凋亡率升高(P<0.05),而VDAC1低表达组细胞染毒组与非染毒组的凋亡率无明显差异。

图2 不同浓度的Cr(Ⅵ)对受试细胞生存率的影响Fig. 2 Different doses of Cr(Ⅵ) exposure on hepatocytes viability

细胞类型Celltype对照组Controlgroup8μmol·L-1Cr(Ⅵ)处理组8μmol·L-1Cr(Ⅵ)groupL0210.79±0.04*NC10.80±0.08*shVDAC1-110.88±0.12shVDAC1-210.84±0.10
注:与同类型细胞对照组比较,*P<0.05。
Note: P<0.05 compared to the control group.

图3 Cr(Ⅵ)暴露对不同细胞凋亡率的影响Fig. 3 The effect of VDAC1 on Cr(Ⅵ) exposure-induced apoptosis in 4 types of cell

图4 Cr(Ⅵ)暴露对不同细胞凋亡率的影响注:与同类型细胞对照组相比* P<0.05。Fig. 4 The effect of VDAC1 on Cr(Ⅵ) exposure-induced apoptosis in 4 types of cellNotes: * P<0.05 compared with the control group.
2.4 VDAC1对Cr(Ⅵ)诱导的细胞内ROS的影响
本实验使用DCFH-DA探针通过流式细胞仪检测细胞内ROS的生成,如图5所示,经Cr(Ⅵ)染毒处理后,L02细胞与NC细胞内ROS含量明显增加,差异具有统计学意义(P<0.05);而VDAC1低表达组2种细胞ROS的生成量增加不明显,与非染毒组相比无统计学差异。
2.5 VDAC1对Cr(Ⅵ)诱导的线粒体功能的影响
2.5.1 VDAC1对Cr(Ⅵ)诱导的L02肝细胞MPTP活性的影响
使用钙黄素-AM荧光探针检测MPTP孔活性,经Cr(Ⅵ)处理后测得荧光强度减弱,说明MPTP孔活性增强。计算非染毒组与染毒组荧光强度的比值,得出相对荧光强度,相对荧光强度值大,说明染毒后细胞荧光强度减弱程度大,提示MPTP活性增强。比较4种细胞经Cr(Ⅵ)染毒后MPTP开放程度,如图6所示,经Cr(Ⅵ)染毒后,测得L02细胞和NC细胞的相对荧光强度高于VDAC1低表达组细胞,差异具有统计学意义(P<0.05),说明L02细胞与NC细胞染毒后荧光强度明显减弱,细胞内MPTP活性增强;而VDAC1低表达组的相对荧光强度约为1,表明染毒后VDAC1低表达组细胞的MPTP活性无明显变化。

图5 VDAC1对Cr(Ⅵ)引发产生细胞ROS的影响注:与同类型细胞对照组相比* P<0.05。Fig. 5 The effect of VDAC1 on Cr(Ⅵ) induced ROS accumulation in hepatocytesNote: * P<0.05 compared with the control group.
2.5.2 VDAC1对Cr(Ⅵ)诱导的肝细胞内细胞色素C表达的影响
用Western blot法检测4种细胞胞浆内细胞色素C的表达情况,Image J进行灰度值分析。结果如图7和表3所示。与非染毒组相比,L02细胞与NC细胞经8 μmol·L-1Cr(Ⅵ)染毒后胞浆内细胞素色C的含量显著上升,差异具有统计学意义(P<0.05);VDAC1低表达的2组细胞,经Cr(Ⅵ)处理后胞浆内细胞素色C的含量变化不明显。

图6 VDAC1对Cr(Ⅵ)诱导的肝细胞MPTP活性的影响注:与同类型细胞对照组相比* P<0.05。Fig. 6 The effect of VDAC1 on Cr(Ⅵ)-induced MPTP activity change in hepatocytesNote: *P<0.05 compared with the L02 group.
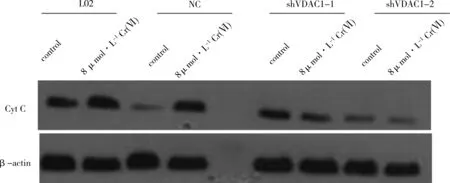
图7 VDAC1对Cr(Ⅵ)诱导的肝细胞胞浆中Cyt C表达的影响的蛋白免疫印迹图Fig. 7 The Western blot bands of the effect of VDAC1 on Cr(Ⅵ)-induced Cyt C expression in cytoplasm

图8 VDAC1对Cr(Ⅵ)诱导的肝细胞胞浆中AIF表达的影响Fig. 8 The effect of VDAC1 on Cr(Ⅵ)-induced AIF expression in cytoplasm
2.6 VDAC1对Cr(Ⅵ)染毒引起的AIF变化的影响
Western blot法检测胞浆内AIF的含量,结果如图8所示,经Cr(Ⅵ)染毒后,L02细胞与NC细胞胞浆内AIF含量明显升高,差异具有统计学意义(见表4)(P<0.05);VDAC1低表达组的细胞经Cr(Ⅵ)处理后胞浆内AIF的变化并不明显。
3 讨论(Discussion)
铬是一种具有多种价态的重金属,其中以六价铬的形式最为常见。Cr(Ⅵ)在工业上的应用极为广泛,涉及不锈钢制造、制革、电镀、焊接和木材加工等多个领域[7-8]。Cr(Ⅵ)暴露会使人体产生急慢性中毒,引起支气管炎症,造成肝肾损伤,胃肠道溃疡,同时Cr(Ⅵ)也具有遗传毒性及致癌性[9]。Bagchi等[10]认为Cr(Ⅵ)可使得细胞内ROS生成量和脂质过氧化增加,导致DNA碎片化以及细胞凋亡。本实验室前期研究结果表明,Cr(Ⅵ)可以影响L02细胞的生存率,引起细胞凋亡,并证实Cr(Ⅵ)引起的细胞毒性和凋亡与线粒体功能损伤有关[11]。MPTP是位于线粒体内膜上可以改变线粒体通透性的孔道[12],早在1990年Crompton和Costi[13]就发现线粒体通透性改变是细胞死亡的关键调控因素,随后的一些研究结果表明,ROS可以使线粒体通透性增加[14]。Le-Quoc K和Le-Quoc D[15]发现,要引起线粒体通透性变化需要线粒体外膜与内膜同时改变,而线粒体内膜外膜上有一些特定区域可作为它们相互作用的接触位点,VDAC就是位于线粒体外膜上的连接内膜与细胞质的位点[16]。VDAC1是VDAC 的3种亚型之一,它可调控线粒体外膜通透性,同时控制线粒体膜内外的物质运输[17]。本研究以L02细胞建立VDAC1低表达细胞系,通过将L02细胞、NC细胞与VDAC1低表达细胞作为研究对象,以预实验结果选定染毒浓度,建立铬肝细胞毒性损伤模型。结果显示,随着Cr(Ⅵ)染毒浓度的增加,4种细胞的生存率均存在不同程度的下降,且两者存在剂量-反应关系,但VDAC1低表达的2组细胞下降趋势较平缓;选定8 μmol·L-1为后续染毒剂量,在此剂量组中,L02与NC细胞的生存率与非染毒组相比均有下降且具有统计学差异(P<0.05),但VDAC1低表达组的生存率与非染毒组相比无明显差异;同时细胞凋亡情况的结果与生存率相符,Cr(Ⅵ)染毒组L02与NC细胞的凋亡率与非染毒组相比明显上升(P<0.05),而VDAC1低表达细胞染毒组与非染毒组的凋亡情况无明显差异。此外,本课题组前期实验数据显示Cr(Ⅵ)染毒24 h后,L02细胞内ROS的含量显著上升[18],与上文中L02与NC组的实验数据一致,但VDAC1低表达组染毒前后细胞内ROS生成量未见明显上升。因此,以上实验结果提示Cr(Ⅵ)染毒条件下,VDAC1敲低确实可以降低细胞内ROS生成量从而减少细胞凋亡,提高细胞生存率。

表3 VDAC1对Cr(Ⅵ)诱导的肝细胞胞浆中Cyt C表达的影响Table 3 The effect of VDAC1 on Cr(Ⅵ)-induced Cyt C expression in cytoplasm
注:与同类型细胞对照组比较,*P<0.05。
Note:*P<0.05 compared to the control group.

表4 VDAC1对Cr(Ⅵ)诱导的肝细胞胞浆中AIF表达的影响Table 4 The effect of VDAC1 on Cr(Ⅵ)-induced AIF expression in cytoplasm
注:与同类型细胞对照组比较,*P<0.05。
Note:*P<0.05 compared to the control group.
为进一步阐明VDAC1影响Cr(Ⅵ)诱导的肝细胞凋亡的原因,本研究检测了Cr(Ⅵ)处理后4种细胞线粒体功能及凋亡相关蛋白的变化情况。与非染毒组相比,L02和NC细胞染毒后MPTP活性增强(P<0.05),同时胞浆内细胞色素C的含量明显增加(P<0.05),表明在Cr(Ⅵ)的作用下,线粒体通透性转换孔的开放性增加,线粒体内的细胞色素C进入胞浆中,提示上述2种细胞发生了线粒体功能障碍;而VDAC1低表达组细胞的MPTP活性与胞浆内细胞色素C含量均无明显增加。同时L02细胞与NC细胞在染毒后,胞浆内AIF含量增加,与非染毒组相比有明显差异(P<0.05),VDAC1低表达组的2种细胞胞浆内AIF的含量无明显差异,说明VDAC1敲低可以拮抗由Cr(Ⅵ)诱导的肝细胞凋亡。
综上所述,Cr(Ⅵ)可使肝细胞中ROS生成量增加,造成线粒体功能障碍,线粒体外膜通透性增加,使得线粒体内的凋亡相关蛋白漏出,进入胞浆,引起细胞凋亡;而降低VDAC1的表达可抑制由Cr(Ⅵ)诱导的肝细胞凋亡。本研究可为Cr(Ⅵ)影响肝细胞线粒体依赖性凋亡的分子机制研究提供部分证据,从而为搞清楚铬暴露所致肝细胞毒性与肝损伤的预防和控制提供思路。但本研究还需在分子机制与信号通路方向进行进一步研究,并在后期通过动物实验验证。
[1] Bano F, Zutshi S, Fatma T. Chromium (VI) induced oxidative stress in hapalosiphon fontinalis [J]. World Journal of Microbiology and Biotechnology, 2012, 28(7): 2505-2511
[2] Shadel G S, Horvath T L. Mitochondrial ROS signaling in organismal homeostasis[J]. Cell, 2015, 163(3): 560-569
[3] Grimm S, Brdiczka D. The permeability transition pore in cell death [J]. Apoptosis, 2007, 12(5): 841-855
[4] Shoshan-Barmatz V, De Pinto V, Zweckstetter M, et al. VDAC, a multi-functional mitochondrial protein regulating cell life and death [J]. Molecular Aspects of Medicine, 2010, 31(3): 227-285
[5] Shoshan-Barmatz V, Ben-Hail D. VDAC, a multi-functional mitochondrial protein as a pharmacological target [J]. Mitochondrion, 2012, 12(1): 24-34
[6] Liu Z, Luo Q, Guo C. Bim and VDAC1 are hierarchically essential for mitochondrial ATF2 mediated cell death [J]. Cancer Cell International, 2015, 15(1): 34
[7] Pesch B, Kendzia B, Hauptmann K, et al. Airborne exposure to inhalable hexavalent chromium in welders and other occupations: Estimates from the German MEGA database [J]. International Journal Hygiene and Environmental Health, 2015, 218(5): 500-506
[8] Keane M, Siert A, Stone S, et al. Profiling stainless steel welding processes to reduce fume emissions, hexavalent chromium emissions and operating costs in the workplace[J]. Journal Occupational Environmental Hyginen, 2016, 13(1): 1-8
[9] Mignini F, Tomassoni D, Traini E, et al. Immunological pattern alteration in shoe, hide, and leather industry workers exposed to hexavalent chromium[J]. Environmental Toxicology, 2009, 24(6): 594-602
[10] Bagchi D, Stohs S J, Downs B W, et al. Cytotoxicity and oxidative mechanisms of different forms of chromium [J]. Toxicology, 2002, 180(1): 5-22
[11] 肖经纬, 钟才高, 李斌. 六价铬诱导L-02肝细胞凋亡与线粒体功能损伤的关系研究[J]. 卫生研究, 2006, 35 (4): 416-418
Xiao J, Zhong C, Li B. Study of L-02 hepatocyte apoptosis induced by hexavalent chromium associated with mitochondria function damage[J]. Journal of Hyguene Research, 2006, 35(4): 416-418 (in Chinese)
[12] Hunter D R, Haworth R A. The Ca2+-induced membrane transition in mitochondria. I. The protective mechanisms [J]. Archives Biochemistry Biophysics, 1979, 195(2): 453-459
[13] Crompton M, Costi A. A heart mitochondrial Ca2(+)-dependent pore of possible relevance to re-perfusion-induced injury. Evidence that ADP facilitates pore interconversion between the closed and open states [J]. Biochemical Journal, 1990, 266(1): 33-39
[14] Takeyama N, Matsuo N, Tanaka T. Oxidative damage to mitochondria is mediated by the Ca(2+)-dependent inner-membrane permeability transition[J]. Biochemical Journal, 1993, 294(3): 719-725
[15] Le-Quoc K, Le-Quoc D. Crucial role of sulfhydryl groups in the mitochondrial inner membrane structure [J]. Journal Biological Chemistry, 1985, 260(12): 7422-7428
[16] Beutner G, Ruck A, Riede B, et al. Complexes between kinases, mitochondrial porin and adenylate translocator in rat brain resemble the permeability transition pore[J]. FEBS Letters, 1996, 396(2-3): 189-195
[17] Li H, Zheng L, Mo Y, et al. Voltage-dependent anion channel 1(VDAC1) participates the apoptosis of the mitochondrial dysfunction in desminopathy[J]. PLOS One, 2016, 11(12): e0167908
[18] 杨渊, 刘新民, 肖芳, 等. 六价铬对肝细胞内活性氧和腺苷酸转运体1转录水平的影响[J]. 中国药理学与毒理学杂志, 2012, 26(5): 664-668
Yang Y, Liu X, Xiao F, et al. Effect of hexavalent chromium on reactive oxygen species level and adenine nucleotide translocator mRNA expression in L-02 hepatocytes[J]. Chinese Journal of Pharmacology and Toxicology, 2012, 26(5): 664-668 (in Chinese)
