海带夏季育苗系统褐藻酸降解菌数量组成分析
2017-03-14王伟伟王娜张壮志曹增梅曲艳艳王青岩李晓捷曲善村
王伟伟,王娜,张壮志,曹增梅,曲艳艳,王青岩,李晓捷,曲善村
(山东东方海洋科技股份有限公司,国家海藻与海参工程技术研究中心,山东省海藻遗传育种与栽培技术重点实验室,山东烟台264003)
海带夏季育苗系统褐藻酸降解菌数量组成分析
王伟伟,王娜,张壮志,曹增梅,曲艳艳,王青岩,李晓捷,曲善村
(山东东方海洋科技股份有限公司,国家海藻与海参工程技术研究中心,山东省海藻遗传育种与栽培技术重点实验室,山东烟台264003)
为研究褐藻酸降解菌对海带Saccharina japonica夏季育苗的影响及其与病害间的关系,全程跟踪监测育苗池水与苗帘上的可培养好氧异养细菌 (heterotrophic aerobic bacteria,H)和褐藻酸降解菌 (alginic acid decomposing bacteria,A)的数量变化,并对褐藻酸降解菌菌群组成进行初步分析。结果表明:孢子采苗使苗帘上好氧异养细菌量和褐藻酸降解菌量比附苗前明显增加,其中褐藻酸降解菌菌群的高活性+中活性菌的A/H值是附苗前的2.05倍;育苗池水与苗帘好氧异养细菌量在育苗期间相对稳定,分别为103~104cfu/mL和106~107cfu/g;苗帘A/H值在育苗前期呈下降趋势,在第21~28天出现峰值 (36.98% ~38.82%),高活性菌的比例增加1倍以上,这些变化与幼苗发生变形烂病较重的时间段一致;而育苗池水A/H峰值滞后,出现在第28天 (53.33%),育苗池水与苗帘在育苗中后期 A/H值均较高 (分别为27.63%~43.67%和31.38%~40.56%),褐藻酸降解菌菌群组成在育苗前期以低活性菌为主,中后期高、中活性菌增长为优势菌,这可能是后期出现幼苗柄部病烂或脱苗的重要影响因素;16S rDNA测序比对结果表明,部分高活性褐藻酸降解菌与交替单胞菌属和假交替单胞菌属同源性高,但其降解能力与感染性存在菌株间差异。研究表明,褐藻酸降解菌数量、群落组成变化应是育苗生产过程中的重要生物监测指标。
海带;夏季育苗;褐藻酸降解菌;好氧异养细菌
为减轻海藻养殖业中的病害损失,病原菌的鉴定、致病机制和大型海藻的免疫防御机制研究已成为海藻病害防治研究的重点与焦点[1-3]。目前,人工育苗作为中国海带Saccharina japonica养殖业发展的首要环节,病害防治问题日益突出,除不断优化管理技术措施外,病害发生时对养殖系统细菌及特殊条件下优势菌群的数量与分布跟踪研究,以及分析病原菌与病害间的关系[4-6],应成为海带苗期病害防治的重要手段。
褐藻酸降解菌是海水与藻体表面的主要组成菌群,它与其他异养细菌的主要区别是具有降解褐藻酸的能力,该菌种类繁多,包括交替单胞菌属Alteromonas、假交替单胞菌属Pseudoalteromonas、弧菌属Vibrio、糖噬胞菌属Saccharophagus、黄杆菌属Flavobacterium等[7-11]。已有研究表明,褐藻酸降解菌是海带育苗与养殖过程中脱苗与烂苗等病害发生的重要影响因素[4,12-13],但目前尚无对其致病条件、侵染机理和海藻防御机制的系统研究。尤其是对海带苗期病害发生的基本原因认识不足,而且育苗病害病情不断变化,普遍做法是从管理措施上严加控制,但实际效果不佳,特别在循环海水育苗系统中收效甚微。本研究中从种海带孢子采苗开始,对海带夏季循环海水育苗系统中好氧异养细菌与褐藻酸降解菌的数量及其分布特点进行了为期2个多月的跟踪监测,并对褐藻酸降解菌菌群组成进行初步分析,以探讨褐藻酸降解菌与病害发生的相互关系,建立育苗系统中微生物的监测指标,以期为海带夏季育苗管理与防病提供基础数据。
1 材料与方法
1.1 材料
本试验于2015年7月末—10月初在山东东方海洋科技股份有限公司牟平分公司海带育苗车间进行孢子采苗及育苗。采苗时选择生长状况良好的种海带,除掉叶边与病烂部分,然后用海水多次洗刷,移到放散池,其采苗方法与长海带[14]基本相同。主要试验材料为:采集于放散池中的种海带叶片、假根,附苗前处理好的海水与棕绳苗帘,附苗用的孢子水以及附苗后的棕绳苗帘。
1.2 方法
育苗期间进行育苗池水与棕绳苗帘跟踪监测, 每7 d采样1次,共采集3个车间。每次固定采集每个育苗车间 (阶梯式育苗池,共6排,每排22个育苗池)的第1、3、6排各3个育苗池的池水与苗帘样品,每排采集的3个样品合为1个样本,用于可培养细菌检测。取3个车间的平均值作为每次采样池水或苗帘的计数结果。
1.2.1 细菌计数 将种海带、苗帘等固体样本称重后,用无菌海水漂洗除去附着的其他污染物,然后加入适量无菌海水,用灭菌的研磨棒研磨。用无菌移液管取上清液0.1 mL及适度稀释液分别涂布于2216E培养基与褐藻酸钠固体培养基[(NH4)2SO45 g,K2HPO40.2 g,MgSO4·7H2O 1 g,FeSO4·7H2O 0.01 g,NaCl 30 g,褐藻酸钠5 g,琼脂20 g,蒸馏水1 L]上,在28℃下培养5~7 d。换算为每克样品的细菌数量。水样用无菌海水稀释适当倍数同样涂布于2216E培养基与褐藻酸钠固体培养基上,换算为每毫升水样细菌数量。2216E培养平板的菌落计数为好氧异养细菌量,褐藻酸钠固体培养平板的菌落计数为褐藻酸降解菌量。
1.2.2 褐藻酸降解菌与好氧异养细菌的测定及其比值 (A/H)的计算 根据改良后的A/H测定方法[13]进行。从2216E平板中选择菌落数目适中的平板,从中逐一挑取全部单菌落,分别接种到富营养褐藻酸钠培养基 (0.5%蛋白胨,0.1%酵母浸粉,0.5%褐藻酸钠,2%琼脂,其中褐藻酸钠用1/2体积的淡水溶解后加入NaCl调至3%浓度,其余成分用1/2体积海水溶解),15℃下培养7 d。用卢戈试剂法鉴定褐藻酸降解活性[15],即用稀释的卢戈试剂覆在培养基表面,菌落周围出现透明活性圈即表示该菌落为褐藻酸降解菌,计算褐藻酸降解菌株数 (alginic acid decomposing bacteria,A)与好氧异养细菌株数 (heterotrophic aerobic bacteria,H)的百分比值 (A/H)。
本试验中,人为划定活性圈直径≥15 mm的菌落为高活性褐藻酸降解菌 (HA);活性圈直径<15 mm,但活性圈边界清晰的菌落为中活性菌(MA);有活性,但活性圈模糊、无明确边界线的菌落为低活性菌 (LA)。统计3种活性褐藻酸降解菌在好氧异养细菌中的比例,并分析褐藻酸降解菌群落组成变化。
1.2.3 褐藻酸降解菌降解能力分析与感染试验将部分在培养基平板上降解活性高的菌株分离纯化,然后以1×106cfu/mL菌量接种到富营养褐藻酸钠液体培养基中,在28℃下培养2 d,每组设3个平行。培养液以12 000 r/min离心,取上清液, 用3,5-二硝基水杨酸 (DNS)法 (http:// www.docin.com/p-472416269.html)测定其还原糖浓度,以进一步确定褐藻酸降解菌活性。用筛选出的高活性菌进行海带组织块感染试验,具体操作方法如下:取健康海带孢子体 (长为50~60 cm),除梢部、假根和叶片边缘部分,用灭菌海水反复擦洗,于无菌培养皿中切成边长约1 cm的小块,然后在海带块表面做3~4处小切口处理,并接种活化好的由上述方法筛选出的5株褐藻酸降解菌,以未接种菌的海带组织块作为对照组。上述操作均按照无菌操作规则进行。每株菌设2个平行,每个平行接种10块。在水温为15℃、接种菌为20 μmol/(m2·s)的条件下培养8 d,定期观测。
1.2.4 褐藻酸降解菌的分子鉴定 将筛选出的菌株进行DNA提取 (SDS法),然后选用16S rDNA通用引物27F和1492R进行PCR扩增[16],其中退火温度为55℃。PCR产物由北京天一辉远生物科技有限公司测序,并将其测序结果在NCBI(National Center for Biotechnology Information)基因数据库中进行同源性比对。
1.3 数据处理
所有测定数据均以平均值±标准差 (mean± S.D.)表示,并利用SPSS 15.0软件和Excel 2007软件进行数据统计分析与作图。将测得的16S rDNA序列用BLAST程序在NCBI基因数据库进行相似性比较,采用MEGA 5.0软件中Neighbor-Joining法构建系统发育树[17]。
2 结果与分析
2.1 采苗系统中的菌量
采苗系统菌量分布与A/H值变化分别见表1和图1。结果表明,不易洗刷的海带假根比叶片的菌量高1个数量级以上,且A/H值高出16.47%,主要差异表现在其高活性褐藻酸降解菌 (相差13%)。孢子放散后形成的孢子水与附苗后苗帘的好氧异养细菌量和褐藻酸降解菌量分别比孢子放散前处理好的海水与附苗前苗帘明显增加;附苗前海水与苗帘主要以低活性褐藻酸降解菌为主,孢子水中褐藻酸降解菌总A/H值较附苗前海水增加了12.34%,主要增量为高活性菌 (增加了 5.91 倍);附苗后苗帘上总A/H值较附苗前仅增长了3.78%,但高活性菌+中活性菌的A/H值之和是附苗前的2.05倍。

表1 海带采苗系统中细菌数量的分布Tab.1 Quantity distribution of bacteria in seedling collection system of kelp Saccharina japonica
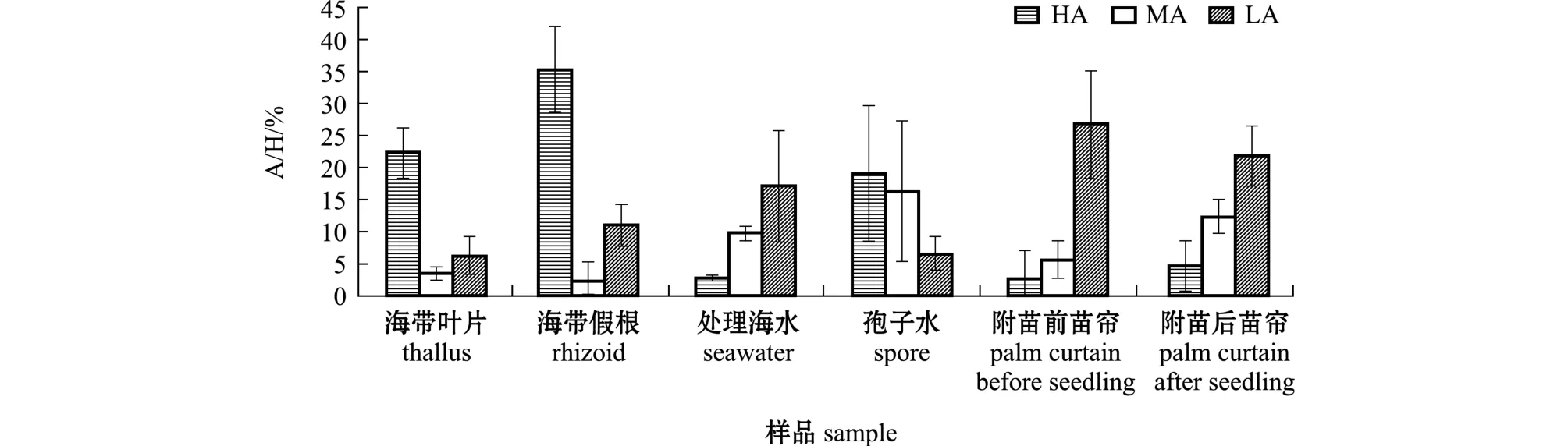
图1 海带采苗系统A/H值的变化Fig.1 Variations in number of heterotrophic aerobic bacterium/number of alginic acid decomposing bacterium(A/H) value in seedling collection system of kelp Saccharina japonica
2.2 育苗池水中的菌量
育苗期间,池水中好氧异养细菌与褐藻酸降解菌量变化如图2所示。好氧异养细菌除在育苗第7天、第28天和最后一次采样时达到104cfu/mL数量级外,整个育苗期间保持稳定 (103cfu/mL);褐藻酸降解菌量除在培养前期 (0~7 d)较高外,整个育苗期间菌量保持102cfu/mL(图2-A)。但A/H值从育苗的第21天左右开始上升,第28天达到峰值(3种活性菌之和为53.33%),此时期内主要是低活性菌和中活性菌的大幅增加;其后近1个月时间保持高A/H值(27.63%~43.69%),此时期显著特征是高活性菌的比例呈快速上升趋势, 第49天时其占菌量比例达到25.76%(图2-B)。
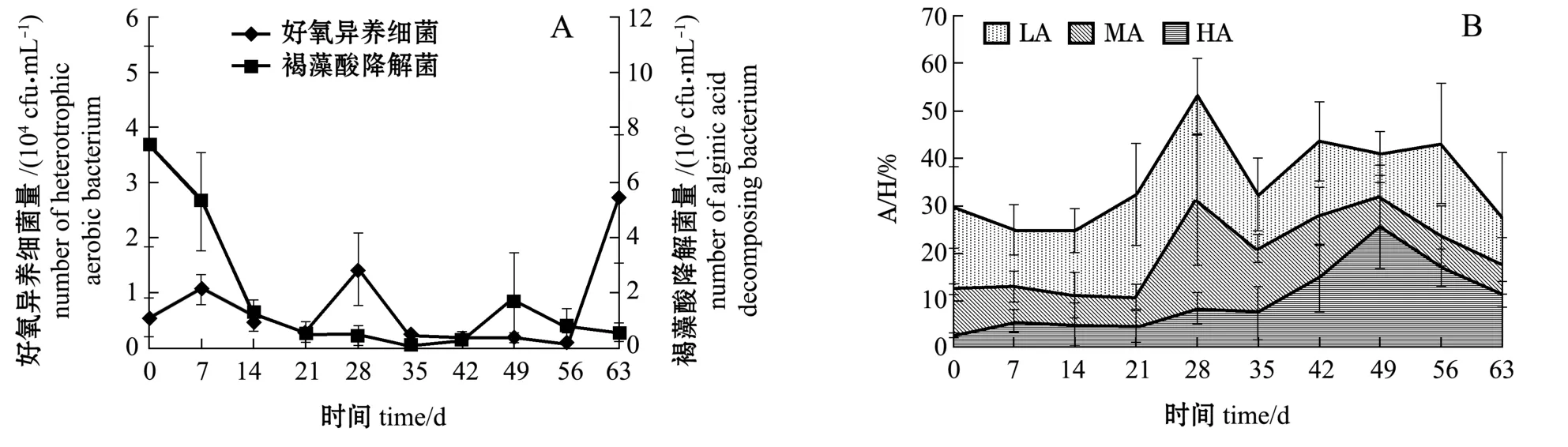
图2 育苗池水中菌量、A/H值随时间的变化Fig.2 Temporal variations in amount of bacteria and A/H in seedling seawater with time
2.3 育苗苗帘的菌量
育苗帘上的菌量比池水高2~3个数量级。好氧异养细菌除最后一次采样菌量增加明显外,育苗期间苗帘菌量在106~107cfu/g变化;育苗期间除第0天 (采苗)外,褐藻酸降解菌量在105~106cfu/g波动 (图3-A)。但A/H值结果表明,育苗期间苗帘褐藻酸降解菌量与菌群组成随时间变化明显 (图3-B)。采苗后苗帘的A/H值为38.81%,在前期14 d的育苗过程中A/H值呈下降趋势,降幅达到10.53%;第14~21天期间,苗帘A/H值快速上升,第21~28天期间,A/H值为36.98%~38.82%,高活性菌比例增加1倍以上,第21天是褐藻酸降解菌菌群组成的转折点,这之前菌群以低活性菌为主,之后高活性菌+中活性菌占优势;第35天时A/H出现最低值,同育苗池水中菌量下降的时间一致,这可能与臭氧处理水等操作有关。试验中观察发现,育苗第15~16天以后幼苗变形烂(又称畸形肿大病、畸形病烂)零星出现,第20~28天时幼苗变形烂发病较为严重,育苗第30~35天后变形烂减缓直至消失。可以看出,苗帘A/H变化与变形烂发病在时间上具一致性,而池水的A/H结果相对滞后 (图2-B)。育苗中后期苗帘上A/H值保持在31.38%~40.56%,但高活性菌+中活性菌 (二者之和为21.47%~30.83%)增长成为优势菌,这可能是育苗后期出现幼苗柄部病烂或脱苗的重要影响因素。
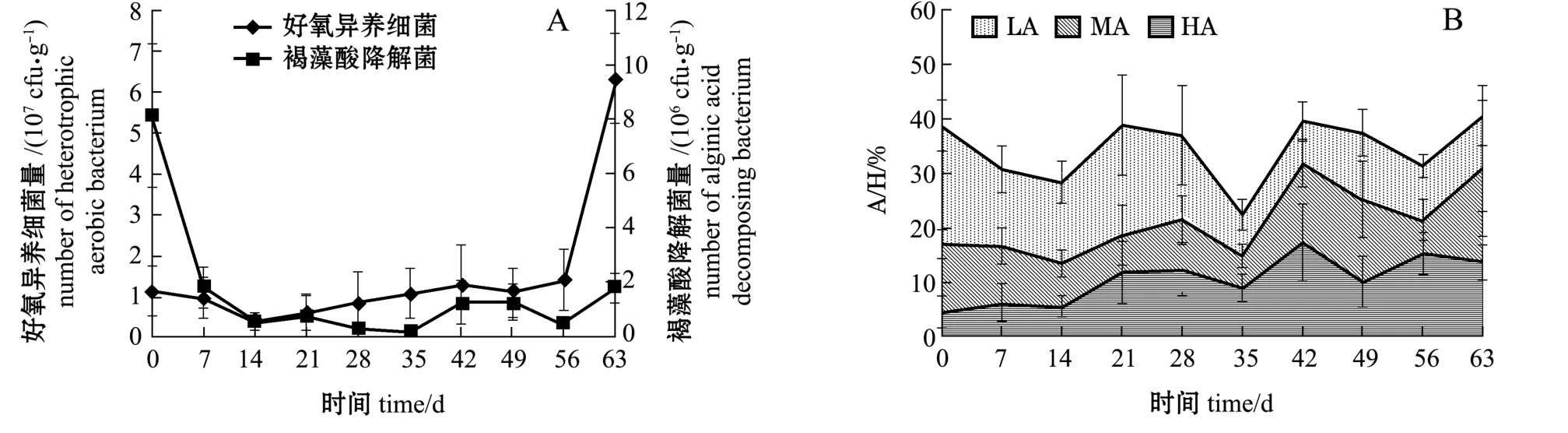
图3 育苗苗帘上菌量、A/H值随时间的变化Fig.3 Temporal variations in amount of bacteria and A/H on palm curtains with time
2.4 褐藻酸降解菌株的降解能力及其分子鉴定
对褐藻酸降解菌的分析表明,A5、A24、A33 3株菌的降解能力明显高于其他菌株,其次为A7 和A31菌株,其余菌株在液体培养基中的降解能力较小或不表现出降解活性 (图4)。对A5、A24、A33、A7、A31 5株菌的感染试验结果表明,感染第1天时组织块无明显症状,第2~3天时切口部位褐色开始褪去,第5~6天后感染组织块数均迅速增加且褪色区域增大,第7~8天时出现病烂,其中A5、A24、A33组病变过程较快,A7和A31组次之,对照组最慢,这与液体培养基中降解能力分析结果一致。
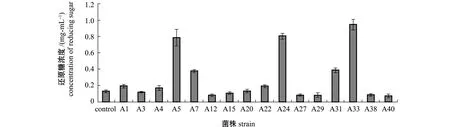
图4 褐藻酸降解菌的降解能力比较Fig.4 Comparison of decomposing activity in alginic acid decomposing bacteria
对5株褐藻酸降解菌的16S rDNA进行测序并构建系统发育树 (图5)。从图5可见,A31、A33首先聚为一支,然后再和A7聚为一支,A7、A31 和A33均属于交替单胞菌属Alteromonas,且A31、A33株菌落色素 (黄色)与A7(乳白色)明显不同,故A31、A33株与A7不属于一个种,A31、A33株一致性为97%;而A5和A24聚为另一支,均属于假交替单胞菌属Pseudoalteromonas(一致性为99%)。
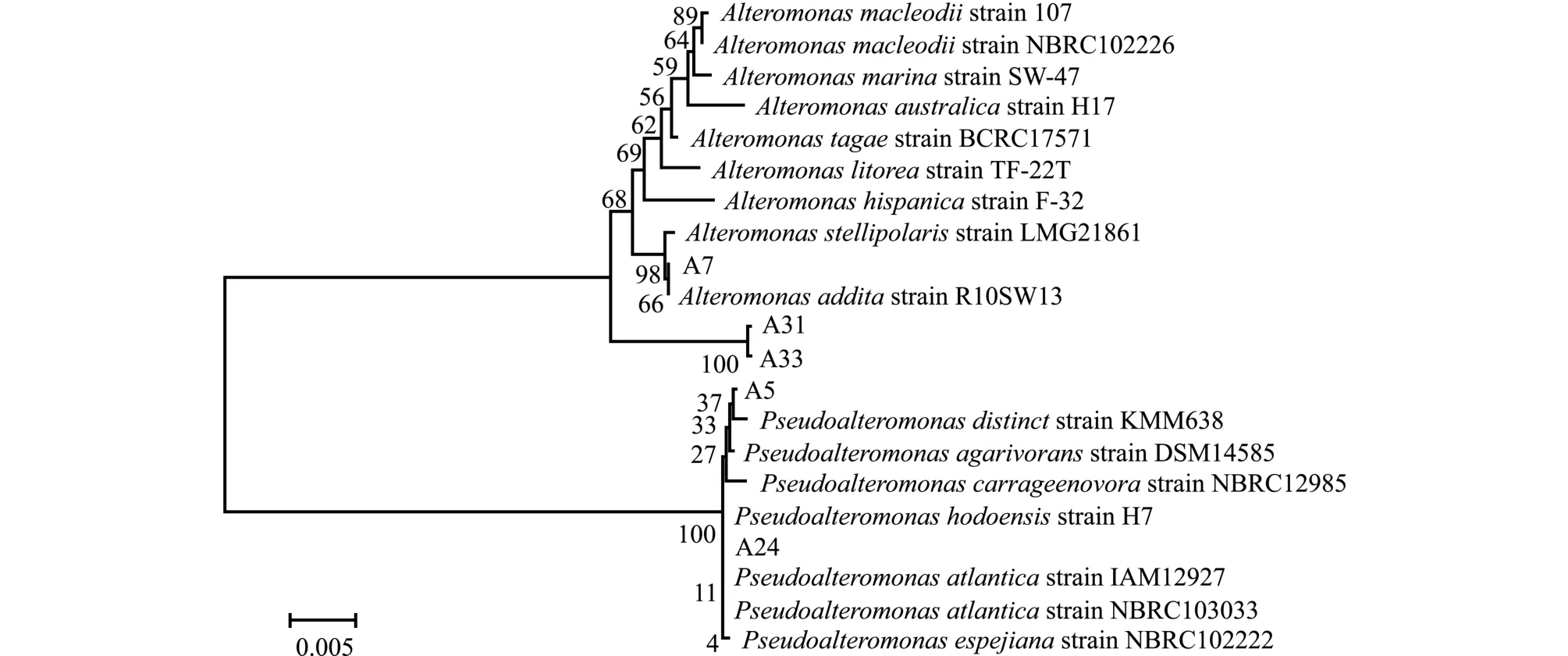
图5 基于16S rDNA序列的5株细菌系统进化树Fig.5 Phylogenetic tree of 5 bacterial strains based on 16S rDNA sequences
3 讨论
3.1 褐藻酸降解菌对育苗的影响
海带夏季育苗期间细菌监测结果表明,褐藻酸降解菌是海带、育苗海水和苗帘的主要栖居菌,其中交替单胞菌属和假交替单胞菌属菌株表现出较高的褐藻酸降解能力与感染性。有研究证实,褐藻酸降解菌A.espejiana和A.baumann是海带幼苗病烂和绿烂的病原菌[18-19],假交替单胞菌是海带孔烂病害孢子体表面菌中的主要菌群[6],交替单胞菌是引起海带配子体膨大死亡和孢子体白化病的病原菌[2,5]。还有研究表明,褐藻酸降解菌是海带烂苗的条件致病菌[4],且不同菌株间表现出明显的褐藻酸降解能力和感染性差异[4,18-19]。从本试验结果也可知,褐藻酸降解菌在育苗初期与中期的个别时间段内并没有引起病害发生,感染试验也表明,菌株间致病性有明显差异。从苗帘A/H峰值与变形烂发病在时间上的一致性来看,褐藻酸降解菌异常增殖与变形烂间存在密切联系,但因此时海带幼苗只能在显微镜下观察及试验条件的限制,无法对褐藻酸降解菌致病机理做一步研究。但有感染试验发现:感染第3天时,褐藻酸降解菌在有伤口海带的内皮层聚集,造成个别细胞破裂,形成空腔;第5天时内皮层细胞完全破碎,而表皮细胞相对完好[7,20]。另外,褐藻酸降解菌不仅能利用褐藻酸,还能利用褐藻糖胶、淀粉、甘露醇和海带多糖等成分[5,10],而这些物质均是海带的重要组成成分,这可能也是褐藻酸降解菌对藻类的重要感染途径。从褐藻酸降解菌与好氧异养细菌的比值来看,海带养殖区海水和藻体的A/H值分别为30%~80%和35% ~90%[13],脱落烂苗上的比值达到61.98%[4]。本试验育苗期间,育苗池水与苗帘的A/H最高值虽仅为53.33%和40.56%,但育苗系统菌群有一个重要特征,即随育苗时间的延长,高活性褐藻酸降解菌呈上升趋势。研究表明,人工育苗系统中褐藻酸降解菌菌落形态与培养特征虽较为单一,但多数菌株均有强烈降解褐藻酸钠和海带藻体的特点,育苗后期具有较强降解能力的褐藻酸降解菌的比例高达95.6%[12]。由此可知,正常海带、海水中均自然存在较高数量级的褐藻酸降解菌,正常情况下不会对育苗造成明显的影响。但随着育苗时间的延长,高活性褐藻酸降解菌的比例增加,再加上育苗条件恶化 (如密度过大、损伤等使海带的抵抗力下降),细菌就易于侵入并大量繁殖,从而导致病害发生。
3.2 对海带夏季育苗期的管理建议
采苗过程中为了操作上的方便,往往会保留种海带假根与养殖绳,但对其上细菌的分析发现,假根与养殖绳的菌量要比海带叶片高出1~2个数量级以上,A/H值和高活性褐藻酸降解菌均比叶片明显增加,且这些部分不易清洗。种海带的菌量与组成成为育苗早期病害的潜在因素,这一问题值得注意。因此,建议采苗时将假根、养殖绳、海带边缘和病烂部分一起去除,加大清洗力度,减少附苗后苗帘上的菌量。
从育苗期间跟踪监测结果来看,育苗池水与苗帘的好氧异养细菌量较为稳定,而褐藻酸降解菌数量与菌群组成均随育苗时间的延长发生变化。育苗海水中褐藻酸降解菌量前期保持稳定,且以低活性菌为主,第28天时出现峰值,随后保持高A/H 值,高活性菌量迅速增加,成为优势菌;苗帘上菌量比育苗海水高2~3个数量级,育苗初始阶段受采苗的影响菌量较高,但随育苗系统低温运行后呈下降趋势,且以低活性菌为主,第21~28天时菌量异常增殖且高、中活性褐藻酸降解菌成为主要组成菌。这一时期又正是幼苗变形烂发病最重的阶段,表明褐藻酸降解菌的异常增殖可能对育苗造成危害。育苗水循环系统中,在第27~39天时增加臭氧设备,处理1/3体积量的循环水,这是育苗海水和苗帘褐藻酸降解菌第35天时出现低谷的原因,患变形烂病的幼苗数量下降直至消失。随后停止臭氧处理循环海水,A/H值快速恢复,此时菌量大幅增殖因其协迫条件解除。育苗后期,高、中活性菌增长可能是幼苗柄部病烂或脱苗的重要影响因素。综上所述,育苗系统中特别是苗帘褐藻酸降解菌数量和菌群组成的变化与病害发生有密切关系,应是育苗过程中重要的监测指标。
本试验中发现,育苗海水与苗帘样品的褐藻酸钠固体筛选培养基计数结果和A/H值分析结果有着明显差异,前者在育苗期间变化较小,而A/H值分析不仅能反映出褐藻酸降解菌的数量变化,还能通过降解活性分析褐藻酸降解菌群落的变化,为育苗生产提供参考。卢戈试剂染色法能快速、有效地利用普通培养基从环境样品中将褐藻酸降解菌与其他菌分开,尤其在大量筛菌时更简单有效[21]。本试验中还发现,如果将环境样品直接涂板,然后染色,会因菌株活性圈的重叠而影响计数,而从2216E板转移菌落的方法耗时较长,造成结果在时间上是滞后的。另外,培养平板染色结果不能完全反映菌株的降解能力与致病性,尚需进一步地试验加以证明。
4 结论
对海带夏季育苗系统细菌监测发现,除采苗过程使苗帘的菌量增加外,育苗系统中好氧异养细菌量相对稳定,而褐藻酸降解菌数量与组成则随育苗时间发生变化,且与育苗期间病害发生事件有着密切联系。褐藻酸降解菌与好氧异养细菌比值 (A/H 值)不仅能反映出育苗系统中褐藻酸降解菌量的变化,还初步反映了其菌群落组成变化,应当成为海带育苗期间一个重要的管理指标,为生产提供防病预警信息。目前,仍缺乏对褐藻酸降解菌致病机理的系统研究,且其指标的测定在时间上较为滞后。建议解决此问题的同时,进一步深入研究褐藻酸降解菌致病机制与海藻免疫防御机制。
[1] Gachon C M M,Sime-Ngando T,Strittmatter M,et al.Algal diseases:spotlight on a black box[J].Trends in Plant Science,2010,15 (11):633-640.
[2] Peng Yanting,Li Wei.A bacterial pathogen infecting gametophytes of Saccharina japonica(Laminariales,Phaeophyceae)[J].Chinese Journal of Oceanology and Limnology,2013,31(2):366-373.
[3] Egan S,Fernandes N D,Kumar V,et al.Bacterial pathogens,virulence mechanism and host defence in marine macroalgae[J].Environmental Microbiology,2014,16(4):925-938.
[4] 林伟,张伟伟,严小军,等.褐藻酸降解菌在海带(Laminaria japonica)幼苗藻体表面数量分布特点及其对海带回染的初步研究[J].海洋与湖沼,2004,35(6):562-567.
[5] Vairappan C S,Suzuki M,Motomura T,et al.Pathogenic bacteria associated with lesions and thallus bleaching symptoms in the Japanese kelp Laminaria religiosa Miyabe(Laminariales,Phaeophyceae)[J].Hydrobiologia,2001,445(1-3):183-191.
[6] Wang Gaoge,Shuai Li,Li Yun,et al.Phylogenetic analysis of epiphytic marine bacteria on hole-rotten diseased sporophytes of Laminaria japonica[J].Journal of Applied Phycology,2008,20(4): 403-409.
[7] Wang You,Tang Xuexi,Yang Zhen,et al.Effect of alginic acid decomposing bacterium on the growth of Laminaria japonica(Phaeophyceae)[J].Journal of Environmental Sciences,2006,18(3): 543-551.
[8] Li Jianwei,Dong Sheng,Song Jie,et al.Purification and characterization of a bifunctional alginate lyase from Pseudoalteromonas sp. SM0524[J].Marine Drugs,2011,9(1):109-123.
[9] Zhou Jiushun,Cai Menghao,Jiang Tao,et al.Mixed carbon source control strategy for enhancing alginate lyase production by marine Vibrio sp.QY102[J].Bioprocess and Biosystems Engineering, 2014,37(3):575-584.
[10] Sakatoku A,Wakabayashi M,Tanaka Y,et al.Isolation of a novel Saccharophagus species(Myt-1)capable of degrading a variety of seaweeds and polysaccharides[J].Microbiology Open,2012,1 (1):2-12.
[11] Huang Lishuxin,Zhou Jungang,Li Xiao,et al.Characterization of a new alginate lyase from newly isolated Flavobacterium sp.S20 [J].Journal of Industrial Microbiology&Biotechnology,2013,40 (1):113-122.
[12] 陈騳,刘秀云,刘秀珍,等.褐藻酸降解菌的研究:Ⅲ.海带育苗系统中脱苗和烂苗原因分析及其预防措施[J].海洋与湖沼,1984,15(6):581-589.
[13] 陈騳,刘秀云,刘秀珍,等.褐藻酸降解菌的研究:Ⅳ.褐藻酸降解菌在海带栽培区中的生态分布及其重要性[J].海洋与湖沼,1986,17(2):137-143.
[14] 张泽宇,范春江,曹淑青,等.长海带的室内培养与育苗的研究[J].大连水产学院学报,1998,13(4):1-6.
[15] Schlesner H,Bartels C,Sitting M,et al.Taxonomic and phylogenetic studies on a new taxon of budding,hyphal Proteobacteria, Hirschia baltica gen.Nov.,sp.nov[J].International Journal of Systematic Bacteriology,1990,40(4):443-451.
[16] 窦妍,丁君,曲凌云,等.秋、冬季刺参养殖池塘菌群的多样性分析[J].大连海洋大学学报,2015,30(2):143-148.
[17] Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[18] 王丽丽,唐学玺,王蒙,等.褐藻酸降解菌在海带绿烂病发生中的作用[J].青岛海洋大学学报,2003,33(2):245-248.
[19] 刘成圣,王丽丽,王蒙,等.褐藻酸降解菌对海带感染能力差异性分析[J].海洋科学,2002,26(6):44-47.
[20] 杨震,唐学玺,宫相忠,等.褐藻酸降解菌引起海带病烂的组织学研究[J].海洋科学,2000,24(12):1-2,50.
[21] Sawant S S,Salunke B K,Kim B S.A rapid,sensitive,simple plate assay for detection of microbial alginate lyase activity[J]. Enzyme and Microbial Technology,2015,77:8-13.
Quantity and composition of alginic acid decomposing bacterial community in summer seedling system of kelp Saccharina japonica
WANG Wei-wei,WANG Na,ZHANG Zhuang-zhi,CAO Zeng-mei, QU Yan-yan,WANG Qing-yan,LI Xiao-jie,QU Shan-cun
(National Engineering and Technique Research and Development Center of Algae and Sea Cucumber of China,Provincial Key Laboratory of Genetic Improvement and Efficient Culture of Marine Algae of Shandong,Shandong Oriental Ocean Sci-tech Company Limited,Yantai 264003,China)
The community composition,quantity and temporal variations in culturable heterotrophic aerobic bacteria (H)and alginic acid decomposing bacteria(A)were surveyed in seawater and palm curtains used in summer seedling of kelp Saccharina japonica to discuss the relationship between diseases during summer seedling and the bacteria.The results showed that the heterotrophic aerobic bacteria and alginic acid decomposing bacteria were increased an order of magnitude on the palm curtains attached by kelp spores compared to the palm curtain without kelp spores,and the A/H ratio of high and middle hydrolysis activity of bacteria was increased by 2.05 times on the palm curtains attached by kelp spores.No significant changes in umber of heterotrophic aerobic bacteria in the seedling seawater and palm curtains were observed,fluctuating 103-104cfu/mL and 106-107cfu/g,respectively during summer seedling.A/H ratio of the palm curtain was shown to be a downward trend in the early seedling,a peak(36.98%-38.82%)during 21-28 days,the proportion of bacteria with high hydrolysis activity being increased by more than one time.These changes were consistent with the occurrence of malformation disease in term of time,showing a close link between the proliferation of alginic acid decomposing bacteria and the disease of young spore.But A/H ratio of seedling seawater lagged,a peak in the 28 day(53.33%).A/H proportion in seedling seawater and palm curtains had high values(27.63%-43.67%and 31.38%-40.56%,respectively)in the middle and late seedling period.Low hydrolysis activity bacteria was dominant in the early,whereas high and middle hydrolysis activity bacteria ascended to the predominant bacteria in the middle and late seedling periods,which is involved in stipe rot or sporeling detachment disease.The 16S rDNA gene sequence alignment showed that alginic acid decomposing bacteria with high activity and infectivity had high homology with Alteromonas and Pseudoalteromonas,and that there were differences in hydrolysis activity and infectivity among strains.Therefore,the variations in quantity and community composition of alginic acid decomposing bacteria would be the important biological indicators for kelp seedling.
Saccharina japonica;summer seedling;alginic acid decomposing bacterium;heterotrophic aerobic bacterium
S946.1
A
10.16535/j.cnki.dlhyxb.2017.01.005
2095-1388(2017)01-0026-07
2016-04-18
国家 “十二五”科技支撑计划项目 (2012BAD55G01);国家 “863”计划项目 (2012AA10A406);烟台市科技发展计划项目(2013LGS002)
王伟伟 (1979—),女,工程师。E-mail:wangww2008@126.com
李晓捷 (1970—),女,博士,研究员。E-mail:yeslxj@sina.com
