滇桂艾纳香多糖的分离纯化及单糖组成分析
2017-03-14许子竞刘茜
许子竞+刘茜


摘要以滇桂艾纳香干燥全草为原料,以水为溶剂提取多糖BRP,经过D101大孔树脂脱色,DEAE纤维素柱分离,依次用水和0.15,0.3,0.45 mol/L NaCl溶液梯度洗脱,得BRP0,BRP1.5,BRP3和BRP4四个洗脱部分;将BRP0,BRP1.5采用Sevage法脱蛋白、活水透析和Sephadex G15柱层析,再经琼脂糖Sepharose 6FF柱层析分离纯化,得到BRP01,BRP1.51,BRP1.52,BRP1.53和BRP1.54五个组份;GPC检测其相对分子质量、分子质量分布及峰型,确定它们为均一组分多糖;HPLC分析结果显示,BRP0和BRP1.5主要由鼠李糖、果糖和半乳糖组成,其物质的量之比大致为:1.00∶0.962∶0.392和1.00∶1.125∶0.584.
关键词滇桂艾纳香多糖;DEAE纤维素分离;凝胶色谱纯化;HPGPC检测;单糖分析
中图分类号R284文献标识码A文章编号10002537(2017)01006506
滇桂艾纳香(Blumea riparia (BL.) DC)为菊科艾纳香属植物的干燥全草,又名假东风草,多见于云南和广西交接部,生于山草坡地或灌木丛中[1],其味甘、温、无毒,具有活血散瘀、祛風除湿、利水作用,在广西民间有几百年的药用历史,常用于妇女经期提前、产后血崩、浮肿、骨痛、受凉腹痛、腹泻等多种妇科常见疾病的防治[2].以滇桂艾纳香为原料的乙醇溶液提取物制成的中成药——妇血康颗粒,已用于临床,疗效显著;研究表明,其水提取物也具有显著的止血活性功效[34],但是其有效成分及其含量、药理作用均不是非常明确;因此,本文对其水提多糖(Blumea riparia Polysaccharides, abbreviated as BRP)成分进行提纯,并对多糖的组分进行分析[56],为进一步研究妇血康颗粒制剂的药理和作用机制打下基础.
1仪器与方法
1.1材料与设备
滇桂艾纳香干燥全草,广西桂西制药有限公司;DEAE纤维素,上海恒信化学试剂有限公司;Sephadex G15和Sepharose 6FF 生化试剂,南京森贝伽生物科技公司;葡萄糖(AR),上海医药公司;果糖、鼠李糖、半乳糖、半乳糖醛酸(生化试剂),上海伯奥生物科技有限公司;RC451k透析袋,上海绿岛科技发展有公司;硫酸、苯酚、无水乙醇、丙酮等均为国产AR试剂.
Nexus 470型FTIR红外分光光谱仪(Nicole,America);Agilent 1260高效液相色谱仪(America);Agilent Technotgies 1200 GPC System(America);UV265FW紫外可见分光光度计(Shimadzu Japan);DZF6020真空干燥箱(河南巩义科技仪器公司);ALPHAL型真空冷冻干燥机(Germany).
1.2实验方法
1.2.1滇桂艾纳香干燥全草多糖BRP的提取、分离、纯化
(1) 提取取滇桂艾纳香干燥全草5 kg,粉碎,过282 μm筛,称其碎片3.0 kg,加无水乙醇回流提取多次,除去脂溶性成分,药渣以蒸馏水为溶剂,用微波提取器(1 kW,10 L)在85 ℃下提取3次,每次20 min;提取液离心去杂、减压浓缩约至原体积的1/5,加乙醇至含醇80%左右,冰浴放置过夜,离心,得BRP沉淀物.BRP用无水乙醇多次浸提,去除残余脂溶性物质和部分色素.
(2) 脱色将上述BRP配成稀水溶液,直至沉淀物不再溶解,过滤,取滤液过D101大孔树脂,用水洗脱,直至洗脱液颜色浅淡,收集水洗脱液,浓缩[7].
(3) 分离将上述浓缩液进行DEAE纤维素柱层析[89],依次用蒸馏水和0.15,0.30,0.45 mol/L NaCl溶液梯度洗脱,用苯酚硫酸显色检测,收集各梯度洗脱液.
(4) 脱蛋白对各收集液采用Sevage法(V(氯仿)∶V(正丁醇)=4∶1)多次脱蛋白至紫外260~280 nm处无明显吸收峰为止[10].
(5) 透析脱蛋白后的BRP溶液装入GRC451k透析袋内,活水透析72 h以上.
(6) 脱盐透析后的BRP溶液过Sephadex G15柱层析,脱除BRP溶液中残留的盐,收集BRP溶液.
(7) 凝胶纯化将透析的BRP0和BRP1.5溶液浓缩,过0.45 μm微孔滤膜,经琼脂糖凝胶Sepharose 6FF层析,蒸馏水洗脱,自动部分收集器收集,苯酚硫酸显色检测,绘制洗脱曲线,根据峰型合并各洗脱部分,冷冻干燥,得BRP01,BRP1.51,BRP1.52,BRP1.53和BRP1.54五个组分.
1.2.2BRP性质表征
(1) BRP相对分子质量及分子质量分布测定采用凝胶渗透色谱法,Agilent 1260HPLC仪,柱型为PL.AqnagelOH(300 mm×7.8 mm),柱温,35 ℃;流动相:0.05 mol/L H3PO4Na2HPO4缓冲液(pH6.7,加0.05%NaN3);流速:1.0 mL/min;示差折光检测,进样体积20 μL;以T系列葡聚糖T1,T3,T5,T7,T9,T11和T13为标样对照.
(2) BRP的酸水解分别取50 mg BRP01和BRP1.5置于安培管中, 加入6 mL 2 mol/L H2SO4,在油浴中保持110 ℃恒温加热8 h,水解液用BaCO3粉末中和除酸,离心,将上清液浓缩,定容至2 mL,供HPLC分析.
(3) BRP红外光谱分析取微量BRP样品,拌KBr研磨压片,在4 000~400 cm-1波数范围内扫描检测基团吸收峰类型.
(4) BRP单糖组成分析色谱条件:Kromasil NH2色谱柱(250 mm×4.6 mm);流动相:乙腈水(体积比为80∶20);柱温为30 ℃;流速为1.0 mL/min,示差折光检测;进样量:20 μL[1112].
2结果与分析
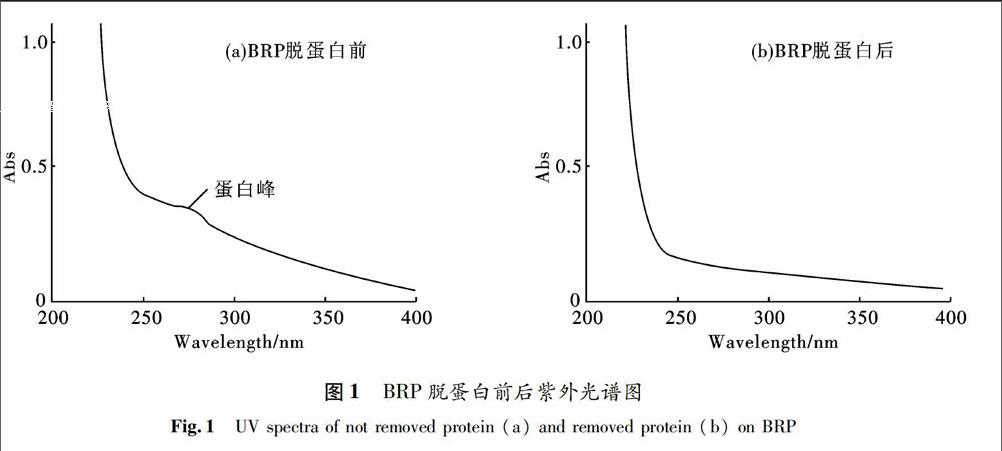
2.1BRP蛋白含量检测
BRP经紫外光谱扫描检测, 如图1所示,260~280 nm处几乎无紫外吸收峰,表明多糖中蛋白、多肽及核酸几乎脱除完全,达到分离纯化要求.
2.2DEAE纤维素对BRP的分离
BRP溶液经DEAE纤维素层析柱分离,分别用蒸馏水和0.15,0.3,0.45 mol/L NaCl溶液梯度洗脱,收集部分分别命名BRP0,BRP1.5,BRP3和BRP4.5,其洗脱曲线见图2.由于BRP3和BRP4.5组分还含少量难除色素,所以只对BRP0和BRP1.5进一步分离纯化研究.
2.3BRP0进一步纯化
将BRP0配成适当浓度溶液,经琼脂糖凝胶Sepharose 6FF柱层析纯化分离,蒸馏水洗脱,BRP0的洗脱曲线如图3所示,所得多糖命名BRP01.
2.4BRP1.5进一步纯化
将BRP1.5上Sepharose 6 FF层析洗脱,得4个洗脱组分,分别命名为BRP1.51,BRP1.52,BRP1.53和BRP1.54,洗脱曲线如图4所示.
2.5BRP纯化组分分子量及分子量分布测定
采用凝胶渗透色谱法(GPC 法)测定多糖BRP的相對分子质量(M)[13],BRP01,BRP1.51,BRP1.52,BRP1.53和BRP1.54各组分分子质量及分子质量分布测定和纯度如图5~6所示.
由表1可见,多糖组分BRP01,BRP1.51,BRP1.52,BRP1.53和BRP1.54的重均相对分子质量分别为1 394,11 754,8 319,7 208和5 936,分散系数分别为1.035,1.053,1.099,1.091和1081,这些组分均由单一色谱峰组成,峰型尖锐均匀对称,表明它们是均一组分多糖.
2.6BRP的红外光谱图
BRP红外光谱各吸收峰如图7所示,其对应基团振动类型如表2,从表2可知,波数1 616.82 cm-1处是〖KG-*2〗〖JG(〗C〖ZJLX,Y〗O〖JG)〗〖KG-1*2〗伸缩振动吸收峰,表明多糖BRP含有醛糖酸[14].
2.7BRP1.5的HPLC分析
HPLC对水解后的BRP多糖与单糖对照品对照,分析其单糖组成[15],见图8~9所示.结果表明,BRP0和BRP1.5除含少量半乳糖醛酸外,主要由鼠李糖、果糖和半乳糖组成,其物质的量之比大致为:1.00∶0.962∶0.392和1.00∶1.125∶0.584.
3结论
滇桂艾纳香干燥全草提取得粗多糖BRP,经DEAE纤维素层析分离得到BRP0,BRP1.5,BRP3和 BRP4.5,进一步将BRP0和BRP1.5纯化后获得BRP01,BRP1.51,BRP1.52,BRP1.53和BRP1.54组分,经HPGPC检测,它们为均一分子多糖,其重均相对分子质量分别为1 394,11 754,8 319,7 208和5 936,分散系数分别为1.035,1.053,1.099,1.091和1.081,说明其分子质量分布均一.通过HPLC分析,BRP0和BRP1.5主要由鼠李糖、果糖、半乳糖组成, 其单糖物质的量之比大致为:1.00∶0.962∶0.392和1.00∶1.125∶0.584.
参考文献:
[1]广西壮族自治区卫生厅.广西中药材标准:2册[S].南宁:广西科学技术出版社,1996:274278.
[2]黄泰康,丁志遵,赵守训,等.现代本草纲目[M].北京:中国医药科技出版社,2001:3061.
[3]杨瑜,刘萍,胡汉昆.妇血康胶囊质量标准研究[J].中成药, 2006,28(12):18411842.
[4]廖敏富,林翠梧,黄丽,等.滇桂艾纳香水溶性多糖BRPB的分离纯化及止血活性[J].应用化学, 2011,28(1):8386.
[5]许子竞,林翠梧,廖敏富.新的滇桂艾纳香寡糖BROS的结构分析[J].有机化学, 2011,31(11):18111819.
[6]许子竞,林翠梧.滇桂艾纳香多糖BRP的结构解析[J].化学学报, 2011,69(9):11011106.
[7]蓝闽波,郭晶,赵红莉,等.大孔吸附树脂对厚朴多糖的脱色工艺研究[J].时珍国医国药, 2012,33(5):12191220.
[8]柯庆勇,黄雅燕,叶静,等.DEAE纤维素法从琼脂中分离制备琼脂糖工艺研究[J].离子交换与吸附, 2015,31(1):2131.
[9]孙晓雪,康杰,王昶,等.DEAE纤维素纯化玉米须总多糖的工艺优选[J].中国实验方剂学杂志, 2014,20(15):2830.
[10]常飞,王绍云,陈飞.贵州野生甜藤多糖的提取与脱蛋白方法研究[J].天然产物研究与开发, 2015,27(2):294300.
[11]蔡铭,罗印龙,孙培龙.黑木耳多糖的抑菌活性与单糖组分分析[J].浙江工业大学学报, 2014,42(5):533538.
[12]何晋浙,蔡如繁,孙培龙.南极海茸多糖结构及其单糖组分的分析[J].食品与发酵工业, 2014,40(3):196200.
[13]YUAN F, YU R M, YIN Y, et al. Structure characterization and antioxidant activity of a novel polysaccharide isolated from Ginkgo biloba.[J]. Int J Biol Macrom, 2010,46(4):436439.
[14]尹艳.两种水溶性大豆多糖的红外光谱分析[J].食品研究与开发, 2013,34(8):6768.
[15]张海珠,周萍,刘光明,等.华山松松塔多糖中单糖组分的HPLC法分析及测定[J].中国医药工业杂志, 2013,44(2):189191.
