比率式荧光纳米氧传感器
2017-03-13赵婷婷卢思思姚秋虹
赵婷婷,卢思思,赵 丽,姚秋虹,陈 曦*
(1.厦门华厦学院,福建 厦门 361024;2.厦门大学 化学化工学院 化学系,谱学分析与仪器教育部重点实验室,福建 厦门 361005)
综 述
比率式荧光纳米氧传感器
赵婷婷1,卢思思2,赵 丽1,姚秋虹1,陈 曦2*
(1.厦门华厦学院,福建 厦门 361024;2.厦门大学 化学化工学院 化学系,谱学分析与仪器教育部重点实验室,福建 厦门 361005)
比率式荧光传感通过在同一传感基质中掺杂两种或两种以上对分析物具有不同响应的发光体,根据不同的光发射信号比值构建起来的光化学传感体系,能更好满足实际检测的需要。近年来,比率式荧光纳米传感器的构建已引起了人们的广泛关注。该文介绍了比率式荧光纳米氧传感器的制备方法、传感特性和应用情况,并对其传感检测的发展和应用前景进行了分析和展望。
氧;纳米传感;比率荧光;制备方法;应用;综述
氧是支持地球生命的重要物质,无色无味,其含量的检测在海洋、气象、生物、化学、深空探索、环境和生命科学,工业生产、水产养殖以及食品包装和储藏、矿井安全等诸多领域有着非常重要的意义和价值。如氧作为支持生物体活动的必需物质之一,是生物呼吸作用的第一保证,通过对体内氧浓度的监测,可以有效地对组织病变进行诊断和示踪病变组织的转移;在食品行业,特别是啤酒、饮料和乳制品的制造过程与封装中,含氧量与酵母的发酵和产品的保质息息相关。含氧量的高低,严重影响着产品质量和保质期;氧还是工业生产过程中的重要成分和控制参数,如火力发电厂必须对锅炉给水系统、凝结水系统、回水系统和热网水系统等中溶解氧含量进行监测,是安全生产的重要保证。

图1 氧对荧光试剂猝灭过程的雅布隆斯基图[1]Fig.1 Jablonski diagram for the fluorescence quenching process between oxygen and fluorescence reagent[1]E:energy,A:absorption,F:fluorescence,P:phosphorescence,IC:internal conversion,ISC:intersystemcrossing,VR:vibrational relaxation,S:singlet state,T:triplet state
与大多数的分子不同,氧单质基态下呈现电子自旋三重态,氧分子是常见的荧光和磷光猝灭剂,一般具有长荧光寿命的荧光探针对氧的响应比较灵敏,如芘及其衍生物和一些金属有机配合物(如钌、铱、铂贵金属配合物)等。受激发的荧光探针的电子通过跃迁和系间窜越过程到达第一激发三重态,与单质氧进行三重态-三重态的相互作用,此时基态氧被激发为单重态的氧,而探针的大部分能量以非辐射形式损耗,进而荧光被猝灭,所以可以通过氧敏感探针的荧光猝灭程度进行氧含量的测定。其猝灭过程可由雅布隆斯基图[1](图1)表示。
在均相介质中,荧光强度与荧光寿命与氧的定量关系一般使用Stern-Volmer方程描述[2]:
I0/I=τ0/τ=1+Ksv[Q]
(1)
式中,I0和τ0分别表示无氧环境下的荧光强度和荧光寿命,I和τ为不同氧浓度下的荧光强度和荧光寿命,Ksv为Stern-Volmer猝灭常数,[Q]是猝灭剂氧的浓度。而当氧敏感探针被固定到相容性不好的基质中时,探针所处的微观环境则是非均相的。在不同的环境下,氧对荧光探针的猝灭效率Ksv也不同。此时,氧对荧光探针的猝灭行为偏离了常规的Stern-Volmer线性方程。在微观非均相介质中,荧光探针与氧之间的关系应该是各探针猝灭行为的整合,所以需使用多态模型方程来描述:
(2)
式中,fi表示处于第i种环境下的荧光指示剂分子占总指示剂分子的百分数,Ksv,i为第i种环境下指示剂的猝灭常数,m指微观环境的总数。
事实上,氧分子的荧光猝灭过程十分复杂。激光闪光光谱技术证明氧单质对荧光探针的猝灭行为主要是动态猝灭的过程,所以探针的荧光强度和荧光寿命通常随氧浓度的升高而降低[3]。基于荧光强度变化的氧浓度检测方法较简单,器件易于集成小型化,但检测的强度信号易受光源稳定性、检测器灵敏度、光路系统、探针的光稳定性和浓度分布等影响。为校正这些干扰,一些研究对简单荧光强度测定方法进行了一定改进,如采用双光束法降低光源和光路波动造成的影响[4],基于荧光寿命的检测方法具有不受激发光强度、检测器灵敏度、探针浓度和探针光学稳定性等因素干扰的优点。但荧光寿命的检测需要依靠复杂且昂贵的设备仪器,这很大程度上限制了其在实际检测中的应用。利用双发射荧光探针或通过参比探针作为背景构建比率式荧光强度法,可对探针的浓度进行校正,并且可以有效地消除系统误差[5]。本文将对目前已有的比率式溶氧传感检测的发展现状(制备方法、传感特性和应用情况)进行综述。
1 比率式荧光纳米氧传感器的构建及其分类
光学氧传感器一般由氧敏感探针和探针固定材料构成。所以制备和研发对氧响应灵敏、精确度高、稳定性好的氧敏感探针,以及构建对氧通透性好、透光率高和光学性质佳的固定化材料是光学氧传感器发展的关键。通常单波长的荧光强度检测模式易受环境和仪器本身的影响,所以基于双发射的比率荧光强度检测法,可以有效弥补单波长荧光检测的不足,从而成为当前氧传感器的研究热点[1]。比率式光学氧传感器的一般构造是在同一传感基质中固定对氧具有不同响应,而且发射光分属于不同波段的两种或两种以上荧光发光体。通过两种发射光的比值变化与氧浓度作Stern-Volmer曲线,进而得到实际检测中氧的浓度。更重要的是,比率式荧光氧传感在不同的氧浓度下呈现的颜色变化更加明显,从而为可视化准确测定氧浓度提供了有效的手段。
通常固定氧敏感探针方法主要有化学键联法和物理掺杂法两种。通过化学键联法制备的氧传感器较稳定,但是化学键联的过程繁琐,耗时耗力,重现性较差;最主要的是,单质氧的荧光猝灭行为是一个动态猝灭的过程,当氧敏感分子通过化学键联法固定到固定材料中时,探针分子的自由振动和自由转动受到限制,与氧的动态碰撞效率减低,大大地影响了其对氧的响应性能。相对于化学键联法,物理掺杂法具有制备方法简单,易于重现,对氧响应灵敏等优点,但是探针泄露是物理掺杂法普遍存在的问题。所以发展对探针分子兼容性好,光学性质稳定且易于成型的固定材料是解决此问题的努力方向。在广大科研工作者的努力下,也取得了一定的进展。Chen等[6]通过对溶胶-凝胶法进行有机化改性,固定对氧无响应的绿色荧光量子点为参比背景,以发红光的PtTFPP为氧敏感探针,构建了一种基于双原色复合光的比色氧传感膜。该传感膜的稳定性好,对氧完全可逆,可用于氧浓度的快速检测且检测精度达到0.5%。在此比色氧传感膜上再固定一层葡萄糖氧化酶,通过二次传感可实现对葡萄糖的可逆比色光学检测(如图2)[7]。
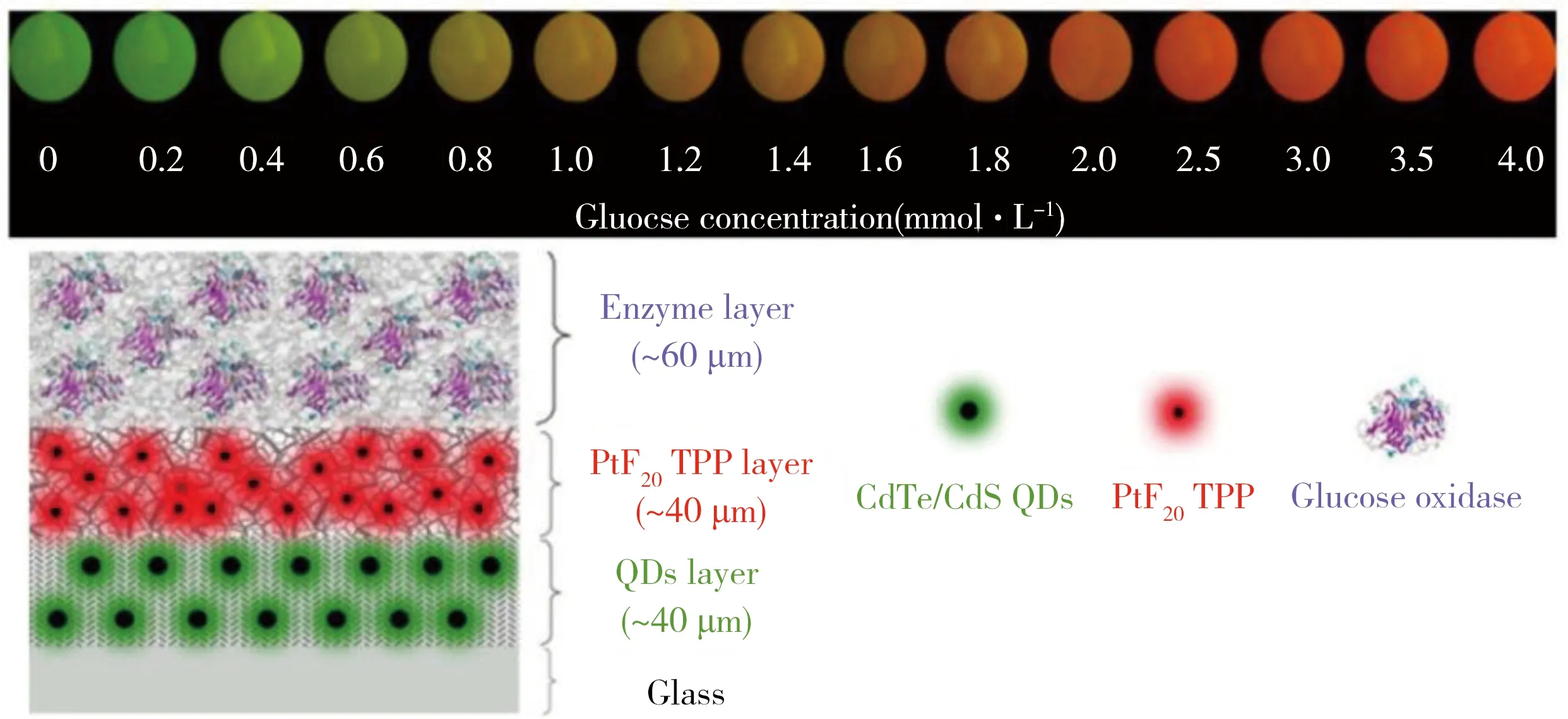
图2 35 ℃下,制备的葡萄糖传感膜在含不同浓度的葡萄糖缓冲液中呈现的颜色(上),以及比色葡萄糖传感器的构造示意图(下)[7]Fig.2 Apparent colors of the prepared sensor in different concentrations of glucose buffer solution at 35 ℃(up),and schematic diagram of the colorimetric glucose sensor(down)[7]
目前,比率式氧光学传感的方式主要有3种[8],分别为平板式、光纤式、纳米或微米粒子式(如图3所示)。其中平板式氧传感器[9]一般由透光基底(如石英或玻璃)、固定材料和氧敏感探针构成,该传感器制备简单且易于仪器化,对海水中氧浓度的检测有着诸多应用。光纤式氧传感器[10]一般是将氧敏感探针固定在光纤外壁上,多应用于环境中溶解氧的检测,特别是对于长距离的实时监测,光纤式传感有着明显的优势。而纳米或微米粒子式氧传感器也显现诸多的优点,如粒子式的氧传感器具有较大的比表面积,对氧通透性好,响应灵敏迅速。传感颗粒纳米化后可有效地减少氧敏感探针的自猝灭现象,实现对探针的高浓度固定,大大地提高了氧传感器的荧光发射强度,更有利于氧浓度的可视化检测。重要的是,纳米式的氧传感可以应用到微米或纳米尺寸的生物体系中,如细胞、组织和微生物生长环境等,可以通过直接的荧光成像,对生物体生长状态进行监测[11]。所以比率式纳米氧传感器的研制引起了研究者的高度重视。

图3 比率式氧光学传感模式Fig.3 Ratiometric fluorescence sensing models A.typical planar layer[9];B.optical fiber [10];C.nano or micro particles of luminescent oxygen sensor[11]
1.1 利用有机荧光小分子的比率式氧传感
基于有机小分子的比率式荧光氧敏感探针的构筑一般是通过桥联分子,将对氧敏感的发光分子和对氧无响应的参比分子连接起来,制备得到比率式分子探针。该方法可以使用单一激发光同时激发两个发光团或者通过共振能量转移(FRET)效应达到荧光双发射的效果,从而实现对氧的比率荧光检测。
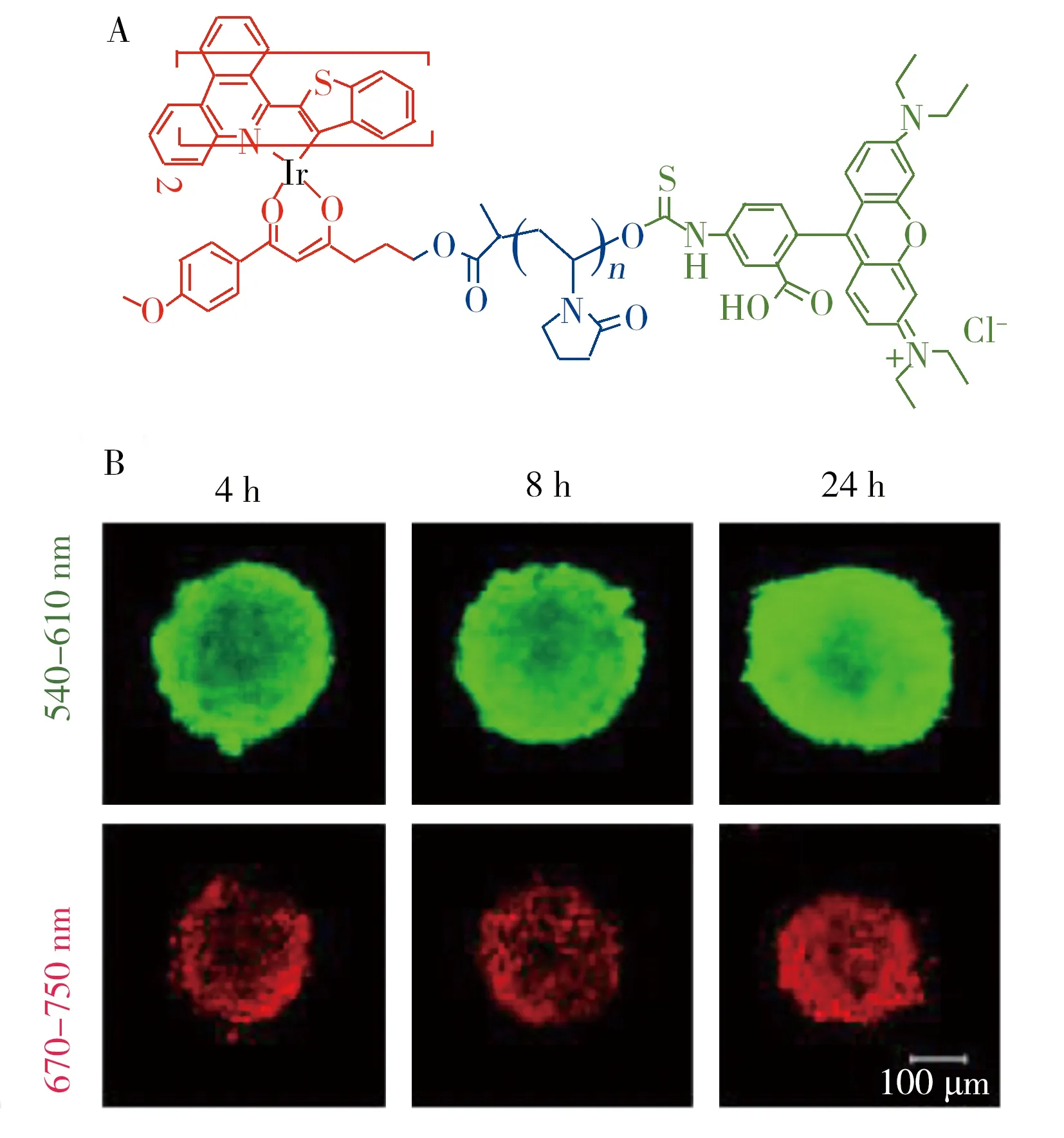
图4 比率型氧敏感探针Ir-PVP-RhB的化学结构(A),以及不同培养时间下被Ir-PVP-RhB染色后SH-SY5Y细胞群落的共聚焦显微镜图(B)[12]Fig.4 Chemical structure of Ir-PVP-RhB(A),and confocal luminescence images of SH-SY5Y MCs after incubation with Ir-PVP-RhB(0.2 mg/mL) for different times(B)[12]
2015年,南京大学蒋锡群教授课题组[12]首次合成了对缺氧肿瘤微环境具有高度特异性的近红外光学成像探针。探针分子结构如图4A所示,对氧敏感的磷光铱配合物与亲水的聚乙烯吡咯烷酮(PVP)键连,然后再连接发绿光的参比指示剂罗丹明B(RhB),构建了单一波长激发而双发射的氧敏感探针分子(Ir-PVP-RhB)。Ir-PVP-RhB具有近红外光发射,高度缺氧敏感性,良好的水溶性和生物相容性等优点。利用该传感探针,他们使用无损光学成像的手段,实现了对细胞及细胞群落的成像。图4B显示了SH-SY5Y细胞群落与Ir-PVP-RhB在不同培养时间下的荧光成像。由图可见,随着培养时间的增长,Ir-PVP-RhB逐渐扩散到细胞群落的中间,所发出的红光越来越明显,而绿光变化不大。实验结果进一步证实细胞群落内部的氧浓度较周围的低。
Tobita等[13]利用发红光的铱配合物[(btp)2Ir(acac),BTP]为氧敏感发光团,以发蓝光的香豆素染料(Coumarin 343,C343)为参比信号发光团,中间通过刚性的四脯氨酸(PrO4)为桥梁分子,将两发光团链接且保持合适的距离。构建的比率式分子探针(C343-PrO4-BTP,结构式见图5A)能够有效地通过FRET过程,将C343激发态的能量高效地传递给BTP,实现对氧浓度的高灵敏比率检测。实验表明,处于激发单线态的C343对基态的BTP的能量转移效率最高可达98%。作者将此探针应用于Hela细胞中氧浓度的检测,从图5B可以看到,在氧浓度较低时,BTP发出明亮的红光,而在氧浓度较高时,大部分红光被猝灭。参比的蓝光信号在不同的氧浓度下变化不大。
双光子吸收(Two-photon absorption,2PA)的荧光探针具有细胞穿透性好、激发光利用率高等优点,在生物体的检测中有着巨大的应用前景。近些年,基于双光子天线的氧敏感探针的构建也引起了研究人员的广泛关注。2005年,Vinogradov等[14]在功能化的卟啉铂(PtTMCPP)氧探针周围修饰上双光子吸收的天线分子香豆素343(C343),制备了对氧有比率响应的树状分子PtTMCPP-C343。在780 nm的近红外光激发下,C343通过分子内能量转移(ET)将能量转移给PtTMCPP,间接实现对PtTMCPP的近红外激发,以及对氧的比率检测。随后,他们利用PtTMCPP-C343探针分子,在双光子荧光寿命显微镜上实现了对小鼠大脑中毛细血管中血流的氧分布成像。探针的成像效果较一般的单光子成像高,并且可检测到的最大组织深度达300 μm[15]。2014年,该小组[16]对PtTMCPP-C343进行改进,制备得到磷光量子产率更高且灵敏度更好的双光子天线的氧气探针PtTCHP-C307,在同一效率的激发光下,PtTCHP-C307的亮度是PtTMCPP-C343的6倍,可直接用于活鼠骨髓造血干细胞内氧气压强的检测。
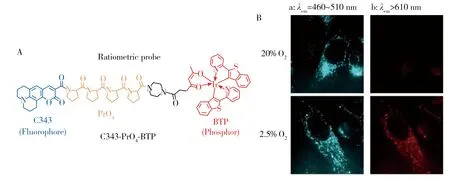
图5 C343-PrO4-BTP的化学结构式(A),以及染色后Hela细胞在氧浓度为20%和2.5%下的荧光成像图(B)[13]Fig.5 Structures of the ratiometric probe C343-PrO4-BTP(A) and luminescence images of HeLa cells incubated under 20% and 2.5% O2 conditions(B)[13]
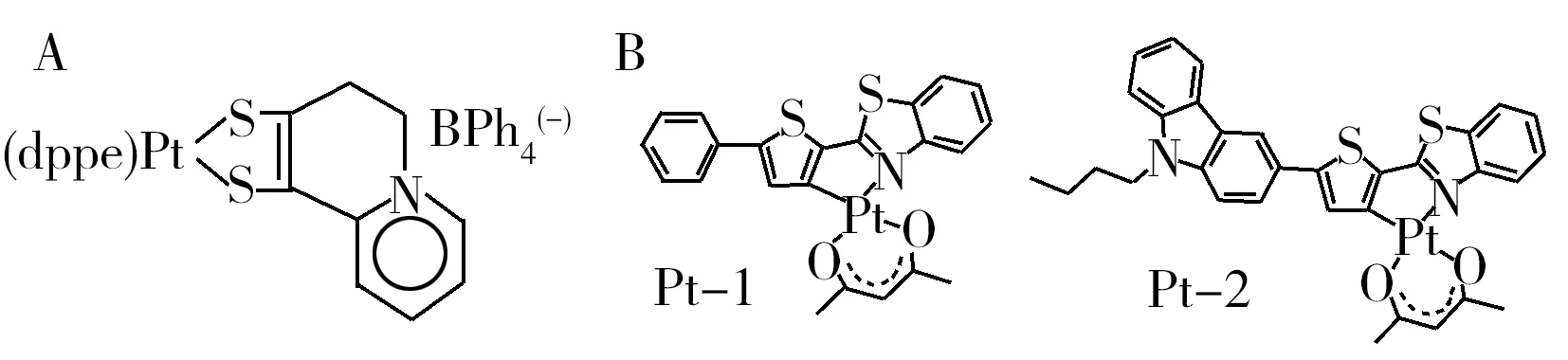
图6 荧光探针dppe-Pt2P(A)及环金属化的C^N Pt(Ⅱ)配合物Pt-1,Pt-2(B)的结构式[17,19]Fig.6 Structures of the fluorescent dye dppe-Pt2P(A) and fluorescence/phosphorescencedual emissive C^N Pt(Ⅱ)(acac) complexes Pt-1 and Pt-2(B) [17,19]
近些年,研究者还成功地研发了只包含单一发光体的比率式氧敏感探针分子,这种类型的分子比较少见。1998年,Pilato等[17]首次合成了具有双波长发射性质且对氧敏感的化合物dppe-Pt2P(分子结构式如图6A所示)。由于存在配体内电荷转移(ILCT*),dppe-Pt2P单重态的荧光寿命为0.5 ns,受激发后的三重态则达到15 μs。随后该小组以dppe-Pt2P为氧敏感探针,采用塑胶为固定材料,构建了只需单一滤波片的比率式氧传感器[18]。Zhao等[19]制备了两种环金属化的C^N Pt(Ⅱ)配合物(Pt-1,Pt-2),其结构式见图6B。该配合物室温下具有稳定的荧光/磷光双发射光谱,可应用于比率荧光强度和比率荧光寿命双模式的氧浓度检测。
上述的探针分子均建立在以贵金属配合物(如Ir或Pt配合物)为氧敏感发光体的基础上。基于非贵金属元素构筑的比率式氧敏感探针分子也是研究者努力的方向。Hochreiner等[20]利用Ferron铁试剂(8-Hydroxy-7-iodo-5-quinolinesulphonic acid)与铝的螯合作用,制备了一种对氧敏感的金属螯合物Al-Ferron。Al-Ferron具有单一波长激发而双波长发射的特性且可用于水中溶解氧的检测。2012年,Cheng课题组[21]合成了以吲哚衍生物为配体的中性亚铜配位化合物。这种亚铜配位化合物固定于刚性的基质(如聚甲基丙烯酸甲酯(PMMA)或固态的CH2Cl2)中时,由于金属-配体间的电荷转移和配体间电荷转移效应,表现出双发射现象,当氧浓度增加时,411 nm波长处的荧光发射强度增大,而610 nm的荧光发射不断降低,所以该探针分子对氧检测的灵敏度和分辨率较一般分子的高。Fraser等[22]发展了一种基于碘代二氟硼化物(BF2dnm(Ⅰ)PLA)的氧敏感探针分子。这种硼化合物可以同时发出橘红色和绿色的光,橘色光随着氧浓度的增加被不断猝灭,而绿色发射光则基本不受氧浓度变化的影响。将其制备成为纳米粒子后,可穿透小鼠胸腺细胞,实现细胞内的比率氧成像。
1.2 利用聚合物的比率式纳米氧传感
小分子氧传感探针具有分子量小、易于控制等优点,为生物学和环境学中氧气的检测提供了有效途径。但由于大多数有机分子的水溶性较差,需要经过繁琐的化学修饰才能改善其水溶性,而且有机分子在体内成像时存在较大的非特异吸附作用,抗光漂白能力差,不利于组织细胞中的检测应用。有机聚合物具有延展性好、易于制备成型、种类多、光化学性质稳定等特点,在氧传感探针的研制中起着非常重要的作用。氧敏感探针分子固定到聚合物后,可以有效地提高探针的水溶性和光稳定性,避免染料的高浓度聚集,减少探针分子的自猝灭现象,增强探针的发光强度等。
聚苯乙烯(PS)具有光学稳定性好、疏水性强、价格低廉等优点,是纳米氧传感制备中最常见的聚合物固定材料。2011年,Schäferling课题组[23]将卟啉钯配合物(PdTPTBP)和花青素(DY-635)通过溶胀过程吸附到氨基修饰的聚苯乙烯纳米球(PS-NPs)上。制备的纳米球可被635 nm的激光有效地激发,发出明显的近红外光和绿光。为提高PS-NPs的生物相容性,在其表面修饰一层生物分子聚乙二醇(PEG),实现活体内肿瘤组织的成像。同年,王旭东等[24]通过溶胀法,将氧敏感分子卟啉铂(PtTF20PP)和参比分子萘二甲酰亚胺的衍生物吸附到商品化的PS-NPs上,构筑了具有自参比功能的纳米粒子(RGB PEBBLE),并对细胞内的氧浓度分布进行了成像。但是,这种有机物之间的疏水吸附作用力较弱,染料容易脱落,导致制备的纳米氧敏感探针的稳定性不理想,限制了其发展。分散聚合法是制备氧敏感PS-NPs的另一种常见方法。Cywinski等[25]通过微乳液聚合法制备了粒径为20 nm的单分散的氧敏感PS-NP,实验以 PtTFPP为氧敏感分子,二萘嵌苯为参比分子。在聚合过程中,疏水的探针分子自动嵌入到PS-NPs内部。制备的PS-NPs对氧响应迅速且灵敏,可用于细胞培养基中氧浓度的检测。2011年,本课题组[26]制备了同时掺杂发红光的PtOEP和发蓝光的荧光增白剂(BBS)染料的微米PS球。两种荧光分子均在紫外区激发,发射光在可见区。将其高浓度地固定到布签上,构筑了一种新型的比色氧传感布签,可对氧浓度进行大面积的二维成像。但是,PS-NPs对生物体的副作用和作用机制至今还不清晰,有报道称,粒径为45~70 nm PS-NPs只有在高浓度下才会产生毒性,而带正电的PS-NPs会直接导致细胞的自吞死亡[27-28]。所以,发展其他有效的聚合物固定材料是非常有必要的。
2004年,Kopelman小组[29]发展了一种基于聚甲基丙烯酸酯(PDMS)的比率式纳米氧传感。实验中选用对氧响应非常灵敏的PtOEPK为氧敏感分子,以发红光的卟啉衍生物(OEP)为参比指示剂,通过疏水作用,掺杂到粒径为150~250 nm PDMS纳米粒子中。构建的PDMS纳米粒子在氧气中的猝灭效率达到97.5%,线性范围为0~45.2 ppm。由于PDMS具有良好的生物相容性,所以可利用制备的纳米粒子检测生物样品中氧浓度。后来,该小组通过微乳液法[30],将发近红外光的树状氧探针PdTPTBP和参比染料分子Alexa 647或HiLyte 680一起载入到聚丙烯酰胺水凝胶(PAA)纳米粒子中。在构建的PAA粒子表面修饰上细胞膜渗透多肽(TAT)和肿瘤特异识别多肽(F3)后,可有效地应用到细胞或者活体内氧浓度的检测中。但是,PAA粒子的合成单体丙烯酰胺(AA)是一种毒性大的神经毒素,所以该方法不适合推广到实际应用中。
两亲共聚物F127是一种商品化且具有良好生物相容性的三段嵌表面活性剂[14]。中间段由疏水的聚环氧丙烷(PPO)组成,两端是亲水的聚环氧乙烷(PEO)。与大多数的两亲活性剂类似,F127有稳定分散到溶液中的聚合物的作用。最近,本课题组使用两亲共聚物F127为软模板,制备了具有多孔结构的比率式氧敏感聚苯乙烯纳米球[31]。实验选用对氧不敏感的蓝光聚芴型聚合物PFO作为稳定的参比染料,以光学稳定的5,10,15,20-4-(5-氟基)卟啉铂(PtTFPP)为氧敏感探针。通过对这两种荧光体的掺杂比例进行调控,可使制备得到的氧传感粒子在无氧氛围中显红色,而在空气中呈现蓝色。随着氧浓度的增加,PtTFPP发出的红光不断被猝灭,而PFO的蓝光基本不变。通过这两种荧光探针荧光强度的比值对氧浓度做Stern-Volmer曲线,发现其在溶氧浓度为0~375 μmol/L范围内表现出良好的线性,且猝灭效率达到96%。
近几年,π-共轭聚合物也被成功地引用到氧纳米传感的制备体系中。2009年,McNeill等[32]首次利用聚芴型π-共轭聚合物PDHF或PFO包埋氧敏感染料PtOEP,发展了基于能量传递的纳米颗粒氧气探针。在此,共轭聚合不仅作为氧探针的包埋材料,而且还是参比信号的指示剂。构造的纳米粒子亮度高,可进行单粒子的荧光成像。2012年,Papkovsky等[33]以带正电的丙烯酸树脂RL-100为包埋材料,同时包裹染料PtTFPP和PFO,制备了毒性低、亮度高且生物相容性好的阳离子水凝胶纳米粒子,可应用于神经元细胞的2D和3D荧光强度和荧光寿命双模式成像。Huang等[34]通过化学键联法,将氧敏感的Ir配合物连接到聚芴聚合物的骨架上(WPF-Ir),再通过共沉淀作用,制备得到粒径小(6±2 nm)、耐光漂白能力好、水中分散性好的氧传感粒子。实验还以制备纳米粒子为光敏剂,考察了三线态-三线态猝灭过程中产生的单线态氧对Hela细胞的光动力治疗(PDT)效果,发现WPF-Ir可以加速癌细胞的凋零。随后,该课题组利用类似的方法,在聚芴型聚合物上键联卟啉铂氧敏感分子,构建了另一种比率纳米氧敏感粒子(FP-Pdots)[35]。
本研究小组发展了一种新型的比率型纳米氧传感,通过温和的共沉淀作用,将氧敏感探针5,10,15,20-4-(5-氟基)卟啉铂(Platinum(Ⅱ)-tetrakis(pentafluorophenyl) porphyrin,PtTFPP)和π-共聚物(Poly[(9,9-dioctyl-fluorenyl-2,7-diyl)-co-(1,4-phenylene)],PFO)包埋到疏水的聚苯乙烯(Polystyrene,PS)基质中[36]。两亲共聚物聚苯乙烯-co-顺丁烯酸酐(Poly(styrene-co-maleic anhydride,PSMA)是制备聚合物纳米粒子(如聚合物点和金属量子点)中常见的保护剂,而且PSMA中的酸酐可以水解成羧基,为纳米粒子的进一步修饰提供了有利条件。在该研究工作中,将PSMA引入纳米氧传感的制备体系中,在含有定量多聚赖氨酸(Poly-L-lysine,PLL)的碱性水溶液中,PSMA将疏水聚合物包裹成粒径小的疏水内核,同时,PSMA中的酸酐自发水解成带负电的羧基离子(-COO-),使得制备的纳米粒子表面布满负电荷。生物大分子PLL则可通过带正电的氨基与-COO-的静电吸附作用,包覆到疏水内核表面,形成具有良好生物相容性的核-壳结构的纳米氧传感粒子(简称PPMA/PLL NPs)。内核PPMA表面的负电荷被中和,制备的氧敏感粒子最终呈现正电性。壳层PLL的修饰,对于纳米传感在细胞成像的应用有着重要意义。一方面,由于细胞膜略微显电负性,通过非特异的电位差作用,带正电的纳米传感更易于被细胞膜吸附内吞,可提高粒子在细胞内的负载量。此外,如果制备的纳米粒子通过细胞内吞途径穿透细胞膜进入细胞后被束缚在溶酶体中,PLL上未带电的氨基可协助粒子逃逸出溶酶体,分布到细胞质中,使得传感粒子对细胞的氧浓度分布成像更加可靠。实验数据表明,制备得到的比率型纳米氧传感具备粒径小(~40 nm),水中分散性好,荧光强,对氧的比率响应理想和细胞负载量高等特点,可应用在细胞质氧浓度分布成像中。
1.3 利用二氧化硅的比率式纳米氧传感
2001年,Kopelman课题组[37]首次通过改进的Stober方法,以聚乙烯醇为稳定剂,四乙氧基硅烷(TEOS)为前驱体,制备了掺杂氧敏感探针邻菲罗啉钌([Ru(dpp)3]Cl2)和参比染料俄勒冈州绿(Oregon green 488)的二氧化硅纳米氧传感(PEBBLE)。通过显微注射法,将PEBBLE粒子导入小鼠胶质瘤细胞,达到测定细胞内氧浓度效果。随后,为了提高纳米粒子对氧的灵敏度,他们采用有机改性的烷苯基三甲氧基硅烷和甲基三甲氧基硅烷为前驱体[38],包埋对氧更加灵敏的卟啉铂探针(PtOEP或PtOEPK)和对氧不灵敏的染料3,3’-Dioctadecyloxacarbocyanine perchlorate(DiO)。制备的PEBBLE粒子对氧响应很灵敏,猝灭比达97%,并在氧浓度为0~43 ppm范围内表现出良好的线性关系。由于二氧化硅带有大量羟基,易于进行表面修饰,所以制备的粒子的疏水性、带电性、粒径大小和孔洞大小等可以有效地进行调节,并且可通过化学键联方式将探针固定于表面或内部。McShane等[39]在粒径为10 μm的二氧化硅表面键联上氧敏感探针PtTCPP和发近红外光的量子点QD,构建了具有高稳定性的氧敏感粒子。Leach等[40]通过溶胀法,将[Ru(dpp)3]Cl2和参比指示剂尼罗红吸附到二氧化硅粒子上,为了防止探针的泄露,在二氧化硅粒子表面修饰了一层聚二甲基硅氧烷(PDMS)。制备的粒子可以分散到生物培养基中对培养液中的氧进行比率检测。2012年,Peng等[41]构建了一种具有良好生物相容性的比率纳米氧传感。实验以十二烷基三甲氧基硅烷(DTS)和PS为基质,PtOEP为氧敏感分子,Coumarin 6和Dinaphthoylmethane(DNM)为参比指示剂。通过简单的共沉淀过程,将3种疏水染料固定到粒子内部。硅氧烷在碱性溶液中失去质子,使得粒子表面呈现电负性。通过静电吸附,在表面包裹上一层生物大分子聚赖氨酸(PLL)以提高粒子的生物相容性。制备的粒子具有FRET效应且可有效地进行细胞成像。但是制备粒子的粒径较大(130 nm),细胞成像时会对细胞产生一定的压力。
1.4 利用金属半导体量子点的比率式纳米氧传感
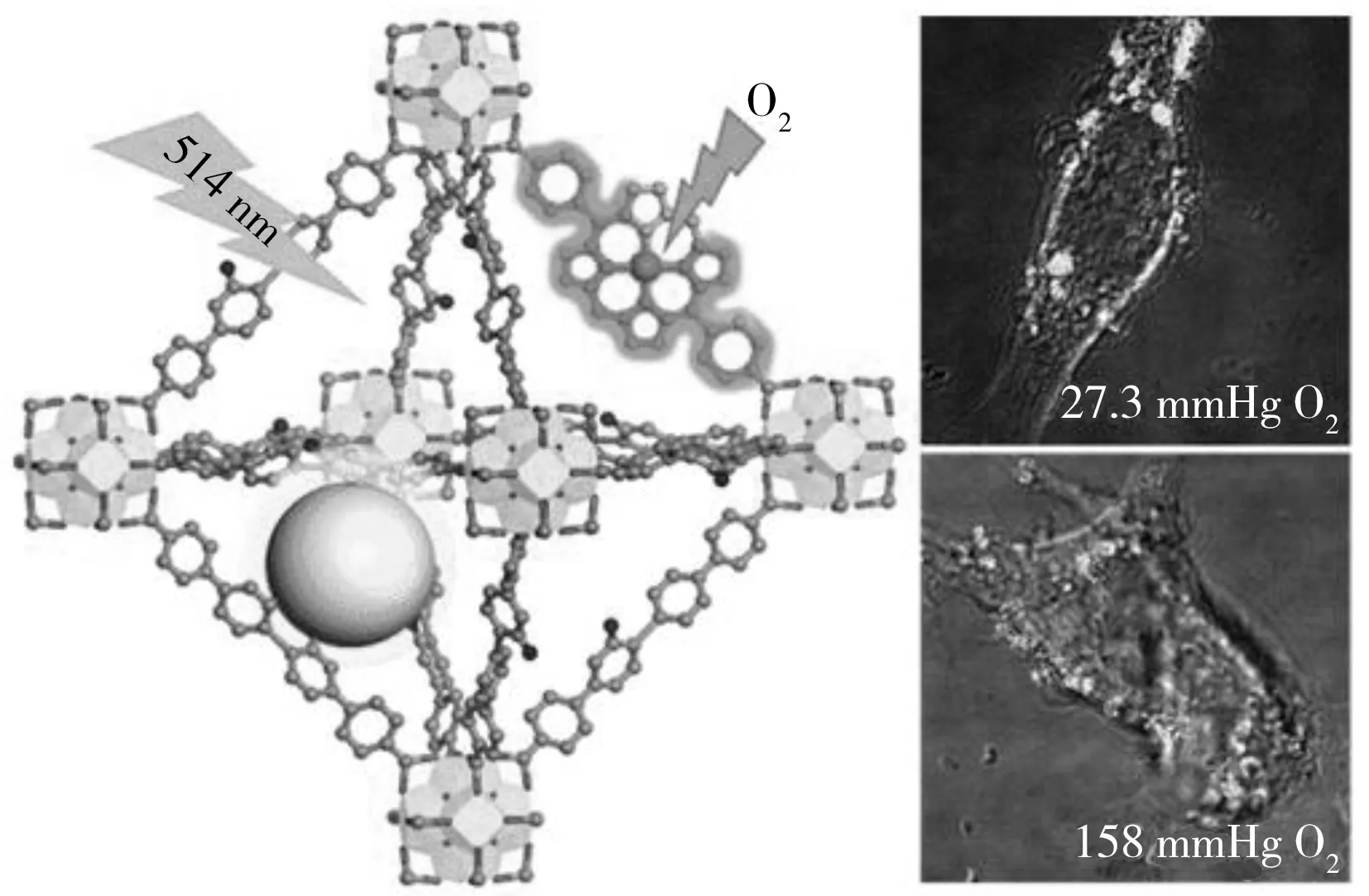
图7 构建的R-UiO纳米材料的结构示意图(左);粒子染色后的CT26细胞在不同氧浓度下的比率荧光显微成像图(右,激发光为514 nm)[49]Fig.7 Schematic structures of the R-UiO(left);and the ratiometric luminescence imaging(λex=514 nm) of CT26 cells after incubation with R-UiO-2 under different concentration of oxygen(right)[49]
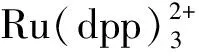
1.5 利用金属-有机框架化合物的比率式纳米氧传感
金属-有机框架化合物(MOF)具有纳米多孔结构,在氧气检测中表现出很大的优势。2012年,Faulkner等[48]合成了一种对氧有比率荧光响应的双金属镧系化合物。通过Ugi法,稀土金属离子铽和铕被固定到稳定的有机骨架中,构成具有双发光中心的化合物,其中铽中心发出的绿光随氧浓度增加而降低,而铕中心发出的红光不受氧浓度影响。但是,通常制备得到的MOF框架化合物的粒径较大且水溶性差,难以应用到生物样品检测。2015年,林文斌教授课题组[49]首次将MOF材料应用于细胞内比率氧浓度的检测,他们合成了羧基修饰的且与有机框架匹配的卟啉铂氧敏感探针(H2DPB-Pt),通过溶剂热法,H2DPB-Pt可以有效地与铪离子配位进而嵌入到纳米尺寸的MOF骨架中。为了实现对氧的比率检测,还在MOF配体上键联参比染料罗丹B,制备得到的纳米MOF材料(R-UiO)的结构示意图如图7所示。R-UiO具有很好的结晶度,呈现了规整的晶型结构。此外,R-UiO还可以透过细胞膜,对细胞体内氧浓度进行有效的成像,扩展了纳米MOF材料在生物传感中的应用。
2 比率式荧光氧传感的发展展望
比率式荧光纳米传感通过增加一个固定的背景光,可以有效地消除探针浓度分布不均匀和仪器不稳定造成的干扰,在生物检测中更加可靠。此外,利用二原色光复合的原理,比率式荧光纳米传感可将待测物浓度的变化转化为肉眼可识别的光信号,从而实现快速且精确的比色检测目的。
近年来,荧光纳米氧传感器的研制已取得长足的进步,但灵敏度低,光学稳定性不好,制备方法不够环保,生物穿透性弱等仍是这类传感器不可忽视的问题。针对这些问题,为了降低生物发光的背景干扰和提高成像效果,发展具备近红外激发和发射光谱性质的纳米传感器是研究者努力的主要方向之一,这种趋势会是近十年光学传感器的研究热点。此外,具备长荧光寿命的荧光纳米传感器的制备是光学传感器另一主要发展方向。因为长荧光寿命的传感器为使用时间分辨荧光测定目标分析物提供了非常有利的条件,时间分辨荧光测定法可以有效地避免周围环境光的干扰,如生物背景、杂质荧光等,在生物样品的研究中有着很大优势。相信随着纳米技术的发展和光学作用机理的不断完善,比率式纳米荧光传感器的应用领域将会不断被扩大,并最终走进人们的日常生活中。
[1] Feng Y,Cheng J H,Zhou L,Zhou X G,Xiang H F.Analyst,2012,137(21):4885-4901.
[2] Tang Y,Tehan E C,Tao Z Y,Bright F V.Anal.Chem.,2003,75(10):2407-2413.
[3] Chen G Z,Huang X Z,Xu J G.FluorescenceAnalysis(SecondEdition).Beijing:Science Press(陈国珍,黄贤智,许金钩.荧光分析法(第2版).北京:科学出版社),1990.
[4] Demas J N,DeGraff B A,Coleman P B.Anal.Chem.,1999,71(23):793-800.
[5] Lee E D,Werner T C,Seitz W R.Anal.Chem.,1987,59(2):279-283.
[6] Wang X D,Chen X,Xie Z X,Wang X R.Angew.Chem.Int.Ed.,2008,120(39):7560-7563.
[7] Wang X D,Chen H X,Zhou T Y,Lin Z J,Zeng J B,Xie Z X,Chen X,Wong K Y,Chen G N,Wang X R.Biosens.Bioelectron.,2009,24(12):3702-3705.
[8] Wang X D,Wolfbeis O S.Chem.Soc.Rev.,2014,43(10):3666-3761.
[9] Mayr T,Borisov S M,Abel T,Enko B,Waich K,Mistlberger G,Klimant I.Anal.Chem.,2009,81(15):6541-6545.
[10] Chu C S,Lo Y L.Sens.ActuatorsB,2007,124(2):376-382.
[11] Zheng X C,Tang H,Xie C,Zhang J L,Wu W,Jiang X Q.Angew.Chem.,2015,127(28):8212-8217.
[12] Zheng X C,Wang X,Mao H,Wu W,Liu B R,Jiang X Q.Nat.Commun.,2015,6.DOI:10.1038/ncomms6834.
[13] Yoshihara T,Yamaguchi Y,Hosaka M,Takeuchi T,Tobita S.Angew.Chem.Int.Ed.,2012,51(17):4148-4151.
[15] Finikova O S,Lebedev A Y,Aprelev A,Troxler T,Gao F,Garnacho C,Muro S,Hochstrasser R M,Vinogradov S A.ChemPhysChem,2008,9(12):1673-1679.
[16] Roussakis E,Spencer J A,Lin C P,Vinogradov S A.Anal.Chem.,2014,86(12):5937-5945.
[17] Van Houten K A,Heath D C,Barringer C A,Rheingold A L,Pilato R S.Inorg.Chem.,1998,37(18):4647-4653.
[18] Kostov Y,Harms P,Pilato R S,Rao G.Analyst,2000,125(6):1175-1178.
[19] Liu Y F,Guo H M,Zhao J Z.Chem.Commun.,2011,47(41):11471-11473.
[20] Hochreiner H,Sánchez-Barragán I,Costa-Fernández J M,Sanz-Medel A.Talanta,2005,66(3):611-618.
[21] Liu X H,Sun W,Zou L Y,Xie Z Y,Li X,Lu C Z,Wang L X,Cheng Y X.DaltonTrans.,2012,41(4):1312-1319.
[22] DeRosa C A,Samonina-Kosicka J,Fan Z Y,Hendargo H C,Weitzel D H,Palmer G M,Fraser C L.Macromolecules,2015,48(9):2967-2977.
[23] Napp J,Behnke T,Fischer L,Wuürth C,Wottawa M,Katschinski D M,Alves F,Resch-Genger U,Schaäferling M.Anal.Chem.,2011,83(23):9039-9046.
[24] Wang X D,Gorris H H,Stolwijk J A,Meier R J,Groegel D B M,Wegener J,Wolfbeis O S.Chem.Sci.,2011,2(5):901-906.
[25] Cywinski P J,Moro A J,Stanca S E,Biskup C,Mohr GJ.Sens.ActuatorsnB,2009,135(2):472-477.
[26] Wang X D,Zhou T Y,Song X H,Jiang Y Q,Yang C Y J,Chen X.J.Mater.Chem.,2011,21(44):17651-17653.
[27] Chiu H W,Xia T,Lee Y H,Chen C W,Tsai J C,Wang Y J.Nanoscale,2015,7(2):736-746.
[28] Murali K,Kenesei K,Li Y,Demeter K,Környei Z,Madarász E.Nanoscale,2015,7(9):4199-4210.
[29] Cao Y F,Koo Lee Y E,Kopelman R.Analyst,2004,129(8):745-750.
[30] Koo Lee Y E,Ulbrich E E,Kim G,Hah H,Strollo C,Fan W Z,Gurjar R,Koo S M,Kopelman R.Anal.Chem.,2010,82(20):8446-8455.
[31] Lu S S,Xu W,Chen Y Y,Jiang Y Q,Yao Q H,Luo F,Wang Y R,Chen X.Sens.ActuatorsB,2016,232:585-594.
[32] Wu C F,Bull B,Christensen K,McNeill J.Angew.Chem.Int.Ed.,2009,48(15):2741-2745.
[33] Kondrashina A V,Dmitriev R I,Borisov S M,Klimant I,O′Brien I,Nolan Y M,Zhdanov A V,Papkovsky D B.Adv.Funct.Mater.,2012,22(23):4931-4939.
[34] Shi H F,Ma X,Zhao Q,Liu B,Qu Q Y,An Z F,Zhao Y L,Huang W.Adv.Funct.Mater.,2014,24(30):4823-4830.
[35] Zhao Q,Zhou X B,Cao T Y,Zhang K Y,Yang L J,Liu S J,Liang H,Yang H R,Li F Y,Huang W.Chem.Sci.,2015,6(3):1825-1831.
[36] Lu S S,Xu W,Zhang J L,Chen Y Y,Xie L,Yao Q H,Jiang Y Q,Wang Y R,Chen X.Biosens.Bioelectron.,2016,86:176-184.
[37] Xu H,Aylott J W,Kopelman R,Miller T J,Philbert M A.Anal.Chem.,2001,73(17):4124-4133.
[38] Koo Y E L,Cao Y F,Kopelman R,Koo S M,Brasuel M,Philbert M A.Anal.Chem.,2004,76(9):2498-2505.
[39] Collier B B,Singh S,McShane M.Analyst,2011,136(5):962-967.
[40] Acosta M A,Ymele-Leki P,Kostov Y V,Leach J B.Biomaterials,2009,30(17):3068-3074.
[41] Wang X H,Peng H S,Ding H,You F T,Huang S H,Teng F,Dong B,Song H W.J.Mater.Chem.,2012,22(31):16066-16071.
[42] Wegner K D,Hildebrandt N.Chem.Soc.Rev.,2015,44(14):4792-4834.
[43] McLaurin E J,Greytak A B,Bawendi M G,Nocera D G.J.Am.Chem.Soc.,2009,131(36):12994-13001.
[44] Lemon C M,Curtin P N,Somers R C,Greytak A B,Lanning R M,Jain R K,Bawendi M G,Nocera D G.Inorg.Chem.,2013,53(4):1900-1915.
[45] Lemon C M,Karnas E,Bawendi M G,Nocera D G.Inorg.Chem.,2013,52(18):10394-10406.
[46] Lemon C M,Karnas E,Han X,Bruns O T,Kempa T J,Fukumura D,Nocera D G.J.Am.Chem.Soc.,2015,137(31):9832-9842.
[47] Park J,Lee J,Kwag J,Baek Y,Kim B,Yoon C J,Bok S,Cho S,Kim K H,Ahn G,Kim S.ACSNano,2015,9(6):6511-6521.
[48] Sørensen T J,Kenwright A M,Faulkner S.Chem.Sci.,2015,6(3):2054-2059.
[49] Xu R Y,Wang Y F,Duan X P,Lu K D,Micheroni D,Hu A G,Lin W B.J.Am.Chem.Soc.,2016,138(7):2158-2161.
Nano Sensors for Oxygen Based on Ratiometric Fluorescence
ZHAO Ting-ting1,LU Si-si2,ZHAO Li1,YAO Qiu-hong1,CHEN Xi2*
(1.Xiamen Huaxia College,Xiamen 361024,China;2.Department of Chemistry and the MOE Key Laboratory of Spectrochemical Analysis & Instrumentation,College of Chemistry and Chemical Engineering,Xiamen University,Xiamen 361005,China)
Ratiometric sensing nanoprobes derivatized from luminescent dyes show great application in a nano or micro system as well as in a sensing material.Nowadays,a ratiometric nano sensing system has attracted a wide variety of attentions.In this review,the meaning of measuring oxygen concentration was introduced and the determination approaches for O2was discussed.The research progress of nanosensors for O2based on ratiometric fluorescence including their preparation,characteristics and applications,was systematically reviewed.
oxygen;nanosensing;ratiometric fluorescence;preparation;applications;review
2016-07-30;
2016-09-23
国家自然科学基金资助项目(21375112)
10.3969/j.issn.1004-4957.2017.02.025
O657.3;G353.11
A
1004-4957(2017)02-0288-09
*通讯作者:陈 曦,博士,教授,研究方向:荧光分析,Tel:0592-2184562,E-mail:xichen@xmu.edu.cn
