组织样品的直接质谱分析及其应用
2017-03-13卢海艳肖义坡顾海巍陈焕文
卢海艳,张 华,肖义坡,李 毅,顾海巍,陈焕文
(东华理工大学 江西省质谱科学与仪器重点实验室,江西 南昌 330013)
专题策划
组织样品的直接质谱分析及其应用
卢海艳,张 华,肖义坡,李 毅,顾海巍,陈焕文*
(东华理工大学 江西省质谱科学与仪器重点实验室,江西 南昌 330013)
质谱技术具有灵敏度高、分析速度快、能提供分子结构信息等特点,在生命科学研究领域扮演着重要角色,常用于组织样品分析。传统地,组织样品分析一般需经过研磨、萃取、分离等繁杂的预处理过程,导致耗时低效,无法满足大量样品高通量分析的实际需求,且不可避免地使组织样品中的一些活性成分损失。近年来,随着新型常压质谱技术的发展,使得组织样品可在无需样品预处理的条件下进行实时、非破坏、在线直接质谱分析,大大提高了分析效率。该文着重介绍了新型直接质谱技术在组织样品分析中的应用,并简要展望了该技术在生命科学、临床医学、食品科学、活体分析等领域的发展趋势。
质谱技术;组织样品;应用;综述
组织样品是由许多形态相似的细胞和细胞间质所组成的一个极其复杂的有机体,含有丰富的生物学信息,是代谢组学、脂质组学、蛋白质组学等研究的物质基础。特别是随着生命科学的发展,生物组织样品从传统的形态学观察、组织成分研究发展到发病机制研究,这就迫切需要发展原位、实时、在线、非破坏、高通量、低损耗的生物组织研究的新方法。质谱技术具有灵敏度高、分析速度快、能提供分子结构信息等特点,在生命科学研究领域扮演着重要角色,常用于组织样品分析。但是,传统的质谱技术包括电喷雾电离质谱技术(ESI-MS)[1-2]、液相色谱-质谱联用技术(LC-MS)[3-6]和毛细管电泳-质谱联用技术(CE-MS)[7-8]等,一般仅适用于经过匀浆、萃取、分离等多步骤精细处理的分析样品,导致耗时低效,无法满足大量组织样品高通量分析的实际需求。在复杂冗长的组织样品预处理过程中,不可避免地使组织样品中的一些活性成分损失,或者发生生物降解而导致待测组分变化,使得这些技术在组织样品等这类基质复杂样品中的应用受到一定限制。显然,复杂样品预处理过程已成为制约组织样品分析的瓶颈。
近年来,随着复杂样品直接电离技术包括电喷雾解吸电离(DESI)[9]、低温等离子体探针(LTP)[10-11]、表面解吸常压化学电离(DAPCI)[12-14]、实时在线分析(DART)[15]、空气动力辅助电离(AFAI)[16]、纸喷雾(Paper spray)[17]及探针电喷雾离子源(PESI)[18-19]等的发展,使得组织样品可在无需样品预处理的条件下进行实时、非破坏、在线直接质谱分析,大大提高了分析效率。同时,使组织样品中内源性化合物如脂质、蛋白质、药物分子等从细胞和亚细胞水平进行鉴定、从空间分布进行研究成为可能,极大地拓宽了对组织样品所揭示的不同生理过程进行深入理解的角度和维度[20]。此外,基于ESI技术发展起来的利用生物组织样品直接产生电喷雾的技术包括组织喷雾(Tissue spray)[21]、叶喷雾(Leaf spray)[22]、直接离子化(DI)动植物组织技术[23]等,进一步为分析组织样品提供了更为广阔的手段。
如何在无需样品预处理的条件下对组织样品进行实时、非破坏、在线直接质谱分析是提高分析效率的重要问题。本文着重介绍了新型常压质谱技术在组织样品分析中的应用,并简要展望了新型常压质谱技术在生命科学、临床医学、食品科学、活体分析等领域的发展趋势及意义。
1 直接质谱分析组织表面
近年来,随着复杂样品直接电离质谱技术的发展,使得组织样品可在无需样品预处理的条件下进行直接质谱分析,大大提高了分析效率。常见的表层解吸电离技术包括电喷雾解吸电离(DESI)[24]、低温等离子体探针(LTP)[11,25-26]、表面解吸常压化学电离(DAPCI)[12-14]、实时在线分析(DART)[15]、空气动力辅助电离(AFAI)[16]、中性解吸电喷雾萃取电离(ND-EESI)[27-29]等,上述技术可直接快速分析复杂组织样品表面的痕量分析物,甚至对组织样品表面的某些化学组分进行质谱成像分析,包括对半脑缺血、肿瘤转移等生物模型小鼠的脑、肾、脾等组织的质谱成像研究[30-31]。
1.1 电喷雾解吸电离质谱技术(DESI-MS)
电喷雾解吸电离质谱技术(DESI-MS)能够在大气压条件下直接对固体表面的痕量物质进行解吸电离,然后进行质谱分析,具有无需复杂样品预处理、化学特异性、高通量分析等优点[9]。自2004年问世以来,已广泛应用于植物组织分析[32]、食品分析[33]、药物分析[34]、临床样品分析[35]、法医分析[36]和生物组织的质谱成像等领域[36-37]。质谱成像(MSI)技术是结合质谱的离子扫描技术和成像处理软件的一种新型成像方法,具有免标记、无需复杂样品预处理、空间分辨率高等优点[20,38]。Wiseman等[39]利用DESI-MS技术检测完整鼠脑切片中的脂类物质,发现该方法可以有效地检测出神经节苷脂类物质(包括GQ1,GT1,GD1和GM1)和硫代鞘糖脂。Masterson等[40]利用DESI-MS成像技术分析人类精原细胞瘤及正常组织,并对照(HE)染色发现正常睾丸组织中甘油磷酸肌醇(PI)的含量高于精原细胞瘤组织。此外,利用DESI-MS成像技术对人体肝癌组织表面化合物的空间分布分析发现,癌症组织中某些磷脂类物质的含量高于正常组织,该结果推动了直接质谱分析技术在外科手术、病理研究中的发展[9]。DESI-MS技术除应用在人体组织样品分析外,还常应用于植物组织化学成分的原位检测,如新鲜毒参、吴茱萸、曼陀罗和颠茄组织表面生物碱的检测[32,41],衰老植物组织中叶绿素降解产物的快速鉴别和空间分布分析[42],葱属物种表型区分和挥发性硫化物分析[43]等。此外,长春花、番茄、马铃薯和香菜等叶子表面特异性化学成分的直接DESI-MS表征[44],对鉴定品种差异、研究植物生长过程受到害虫或病原体攻击时代谢物的变化等具有重要指导意义。
1.2 表面解吸常压化学电离质谱技术(DAPCI-MS)
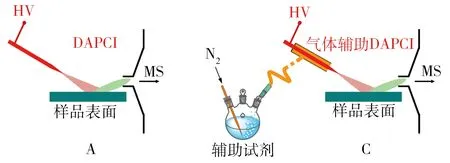
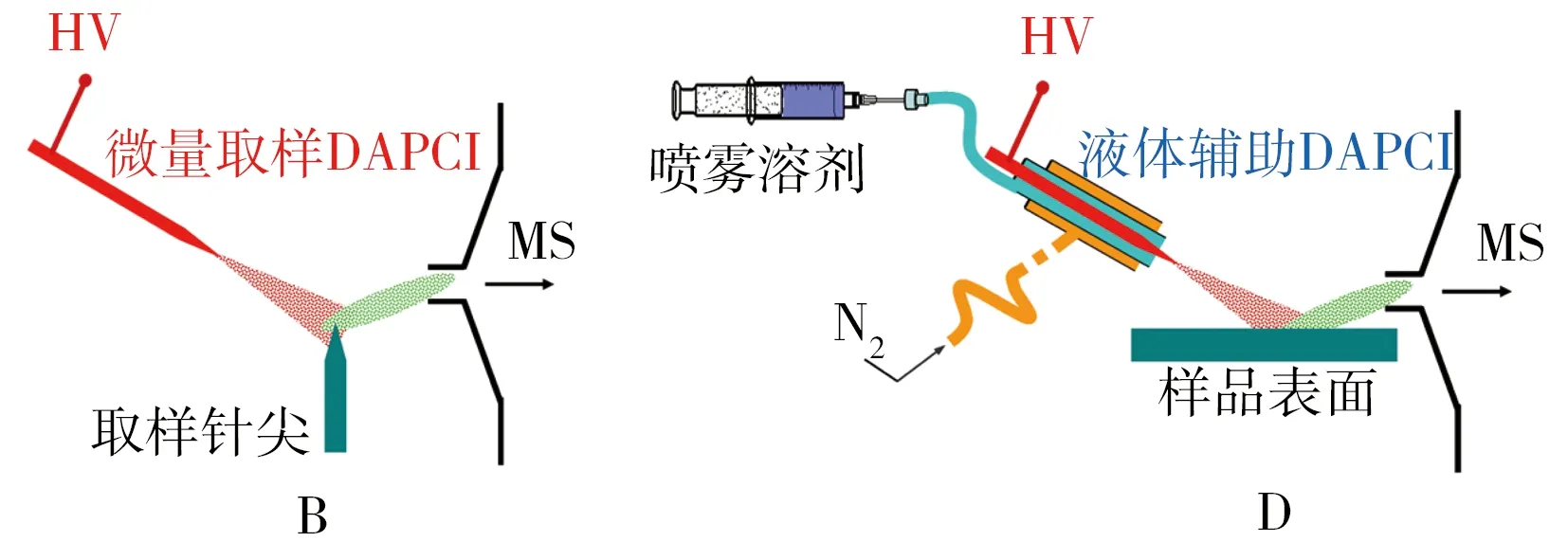
图1 4种不同工作方式的表面解吸常压化学电离质谱(DAPCI-MS)的原理示意图Fig.1 Schematic illustration of four types of desorption atmospheric pressure chemical ionization mass spectrometry(DAPCI-MS)
表面解吸常压化学电离质谱技术(DAPCI-MS)是一种对表面痕量物质进行直接电离的质谱技术[12-13],具有比早期的DESI-MS技术更高的灵敏度。DAPCI-MS技术的主要特点包括:①灵敏度高,选择性好,基体耐受性强;②直接分析包括粉末在内的各种固体、液体样品;③易于小型化,适宜与质谱、淌度谱等联用;④可用空气或水蒸气为试剂,对样品表面无污染;⑤对弱极性和非极性物质的检测能力较ESI/DESI高;⑥可直接进行质谱成像,灵敏度高,准确度好。4种不同工作形式的DAPCI-MS原理示意图见图1。目前,该技术已应用在不同品种茶(如绿茶、乌龙茶和茉莉花茶)[45]和蔬菜表面痕量氨基甲酸酯残留[46]的高通量分析、猪肉新鲜度评价[47]和羊肉真假鉴别[48],不同产地干海参[14]、硫磺熏蒸八角[49]和樟树化学型的判别[50],土豆泥中痕量可卡因[51]和萝卜根中芥子碱的检测[52],不同地方蜂胶样品的快速鉴别[53],脐橙果皮中香气成分、糖类和黄酮类物质等的分析[54]。上述研究不仅证明DAPCI-MS技术有望为植物组织中活性成分分析和食品品质监管提供一种技术支撑,而且进一步推动了常压质谱技术在植物学研究中的应用价值。此外,基于DAPCI离子源改进的液体辅助表面解吸常压化学电离源(LA-DAPCI)具有较高的离子化效率,适合复杂基体样品的质谱成像研究[55]。
除上述DESI-MS技术和DAPCI-MS技术之外,ND-EESI-MS,LTP-MS,AFAI-MS和DART-MS等技术也可实现组织样品表面分析物的快速分析。例如,Chen等[56]利用ND-EESI-MS技术分析了无需解冻的冷冻肉类和不同成熟度水果的鉴定等,结果表明ND-EESI-MS技术能够有效地获取与组织样品相关的化学成分信息,其原理示意图见图2。LTP-MS技术可直接分析水果和蔬菜表面农残[10],以及烘焙咖啡豆品质相关的化合物[57];AFAI-MSI技术可分析化合物的空间分布、追踪它们在整体组织中的生物转化情况[16],再帕尔等[58]利用AFAI-MSI技术通过分析磷脂类物质,实现了分子水平上乳腺浸润性导管癌(IDC)和乳腺导管原位癌(DCIS)的识别。此外,再帕尔等[59]还利用AFADESI-MSI技术在52例肺癌组织样品中发现了病理学诊断可参考的潜在生物标志分子包括磷脂、氨基酸、胆碱、多肽、肉碱等,并用这些生物标志物获得了快速、无需标记的病理学图像,通过AFADESI-MSI技术也实现了给药大鼠组织切片中抗失眠药物N6-羟苄腺苷(NHBA)及其内源性代谢产物的分析[60];同样地,利用DART-MS技术可直接分析水果皮表面的外源性化学物质[61]和姜黄中具有药用价值的姜黄素[15]等,这些结果表明,新型直接质谱分析技术在药用植物或食品原料的质量控制、临床诊断等方面具有潜在应用价值。
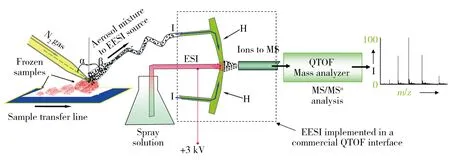
图2 中性解吸-电喷雾萃取电离质谱(ND-EESI-MS)分析冷冻肉类组织样品的原理示意图[56]Fig.2 Schematic illustration of neutral desorption-extractive electrospray ionization mass spectrometry(ND-EESI-MS) analyzed frozen meat tissue samples[56]
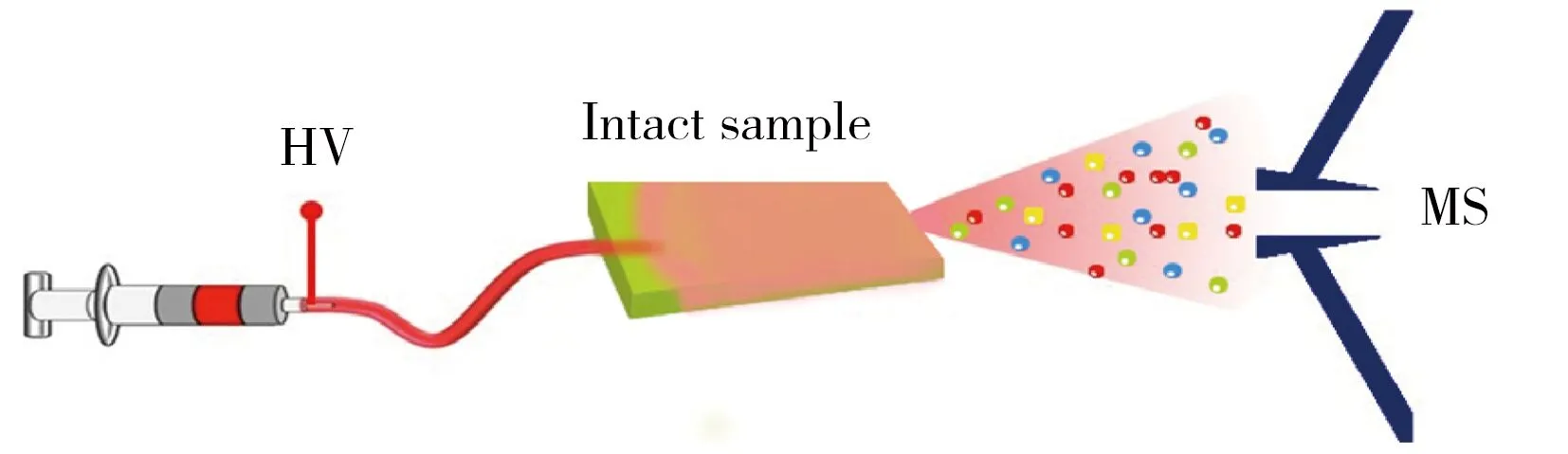
图3 内部萃取电喷雾电离质谱(iEESI-MS)分析组织样品的原理示意图[63]Fig.3 Schematic illustration of internal extractive electrospray ionization mass spectrometry(iEESI-MS) analyzed tissue samples[63]
2 直接质谱分析整体组织样品
相比于传统质谱技术(包括ESI-MS,LC-MS,CE-MS等)分析组织样品,可分析复杂组织样品表面的新型常压直接质谱技术(包括DESI-MS,DAPCI-MS,LTP-MS,ND-EESI-MS,AFAI-MS,DART-MS等)由于无需复杂样品处理过程,可显著提高分析效率。但这些技术存在分析过程中组织样品中的有效成分直接暴露在空气中会发生降解、失活等问题。针对这些问题,基于前期研究的工作基础,本课题组于2013年提出了一种在不破坏样品的前提下直接获取凝聚态整体组织样品(如动植物组织)内部化学信息的内部萃取电喷雾电离质谱技术(iEESI-MS)[62-64],该技术萃取、分离、电喷雾电离3个过程在时间与空间上紧密相连,能直接获取整体组织样品3-D体积内的分子信息,其原理示意图见图3。
iEESI-MS的具体工作方式如下:作为ESI通道的石英毛细管一端与微量进样针相连,另一端平行插入组织样品内部,但石英毛细管尖端不露出,插入组织样品内部的石英毛细管前端距离样品前端约2 mm,样品前端距离质谱入口约5~6 mm。带有一定电压的萃取溶剂经ESI通道以一定流速导入到组织样品内部,对组织样品内部的化学物质进行选择性萃取,在电场的作用下,含有待测物的微小带电液滴朝着质谱口定向移动并在样品尖端形成电喷雾,所形成的带电液滴随后去溶剂化,获得气态待测物离子,进入质谱仪分析。iEESI-MS技术主要包括以下特点:①iEESI无需辅助气体;②iEESI将溶剂直接导入到组织样品内部,萃取过程发生在整体组织样品内部,待测物绝对量大,灵敏度比表面分析高;③iEESI使用的溶剂可方便地进行更换,并根据需要有针对性的选择,从而实现对目标物的选择性萃取,方法的萃取效果较明显,离子化过程可控性强;例如对不同成熟度草莓内部具有生物活性、能显现草莓成熟度的天竺葵色素分子分析发现,随着iEESI-MS分析时间的增加,草莓尖端颜色逐渐变浅(见图4),说明草莓组织内部的天竺葵色素分子被萃取[62]。④iEESI电离过程是一种特定条件下小体积范围内的色谱分离过程与电喷雾过程的综合体现,既具有分离作用,也有电喷雾的效果;⑤iEESI-MS实验所需样品耗量少,实验过程可根据样品质地等实际情况进行取样,如样品形状可以为小三角形薄片、小圆锥体、矩形等;⑥iEESI操作简单,分析速度快,易于与小型质谱仪联用。目前,该技术已在植物代谢组学研究(如草莓成熟机制、吊兰发病机理研究、银杏叶品种鉴别),食品安全(肉质食品中痕量瘦肉精成分的快速筛查、蔬菜水果新鲜度和保鲜期的预测),临床诊断(寻找肿瘤分子标志物、快速判断临床手术过程癌变组织是否切除完全)等方面进行了初步应用研究。

图4 随着iEESI-MS分析时间的增长,成熟草莓尖端颜色的改变[62]Fig.4 Color change of a ripe strawberry with the time prolongation of an iEEI process[62]time(A-C):0,2.5,6 min
2.1 iEESI-MS在植物代谢组学研究中的应用
植物代谢组学是代谢组学中的一个重要组成部分,将为植物的生理代谢研究提供重要的科学依据[65]。当然,对植物代谢组学进行研究,首先要从分子水平上获得植物组织(特别是活体组织)内部的分子信息。利用iEESI-MS技术在无需任何样品预处理条件下能直接获取整体组织内部分子信息的独特性能,对不同成熟度的草莓、不同生理状态的吊兰及不同品种的银杏叶[62]、不同产地脐橙表皮组织与果肉组织[66]、新鲜芦笋茎块与干燥芦笋茎块等进行直接iEESI-MS分析,快速获得组织内部氨基酸、糖类、生物碱、黄酮、色素等多种化学成分。这些结果表明,iEESI-MS技术不仅能实现植物组织样品内部化学成分的快速分析,也可从分子层次上很好地识别由植物生理状态变化造成组织内部代谢组分的变化。芦笋作为一种高档蔬菜,人们一般只摘取其嫩茎部分进行食用,导致在鲜销、深加工过程产生大量的根茎,基本以废弃物的方式进行处理。而通过对新鲜芦笋茎块与干燥芦笋茎块进行直接iEESI-MS分析发现,利用废弃茎块加工制得的干燥茎块,其内部具有消除疲劳、减肥、利尿等特殊功效的营养成分含量甚至高于新鲜芦笋茎块。这种变废为宝的做法,不仅实现了芦笋的经济价值,更改善了人们的健康[67]。这些结果表明,iEESI-MS技术不仅可给食源性植物组织样品的分析提供一种可靠的质谱分析新方法,而且对农业发展具有一定的指导意义。
2.2 iEESI-MS在食品分析中的应用
质谱技术在食品安全中也具有重要应用,近年来随着“瘦肉精”事件的发生,食品安全问题引起了人们的高度恐慌。因此,建立一种在分子水平上快速、准确检测肉质食品中痕量“瘦肉精”的方法,对保障食品安全、人体健康具有重大意义。通过对大众日常消费的猪肉等组织样品进行直接iEESI-MS分析发现,iEESI-MS技术可快速检测到猪肉中痕量克伦特罗(Clenbuterol)、丙卡特罗(Procaterol)等,有望成为动物组织样品中痕量瘦肉精成分快速、高通量筛查的可靠技术[68]。通过对生姜以及不同品种、不同加工方式处理的蒜瓣组织进行直接iEESI-MS分析发现,该技术可快速获取组织内部生物化学信息和识别蒜瓣组织中代谢组分的变化[62,69]。iEESI-MS通过对4种红辣椒腐败过程中组织内部胆碱、果糖和蔗糖等主要成分的连续监测,绘制了胆碱或果糖与蔗糖相对丰度比值的代谢衰减曲线,从而为预测辣椒的新鲜度、保鲜期和其它蔬菜水果的品质保障提供了技术参考[70]。
2.3 iEESI-MS在临床诊断分析中的应用
上述iEESI-MS技术除广泛应用在植物代谢组学研究、食品安全方面,它的独特性能在临床诊断中也极具吸引力。直接质谱技术真正意义上应用于临床样品分析是1997年,De Nollin等[71]运用傅立叶变换激光微探针质谱(Fourier transform laser microprobe MS,FT LMMS)技术分析体内植入物周边炎性组织,证实人体内植入物周边的炎症组织中金属钛的含量增加。然而,FT LMMS技术较适用于金属离子等性质稳定的成分,不适合组织样品中其他物质的检测。例如胎盘中乙酰胆碱的定性和定量分析,需要采用色谱等分离技术将待测物组分分离后才可进行后续的质谱检测,耗时较长[72]。
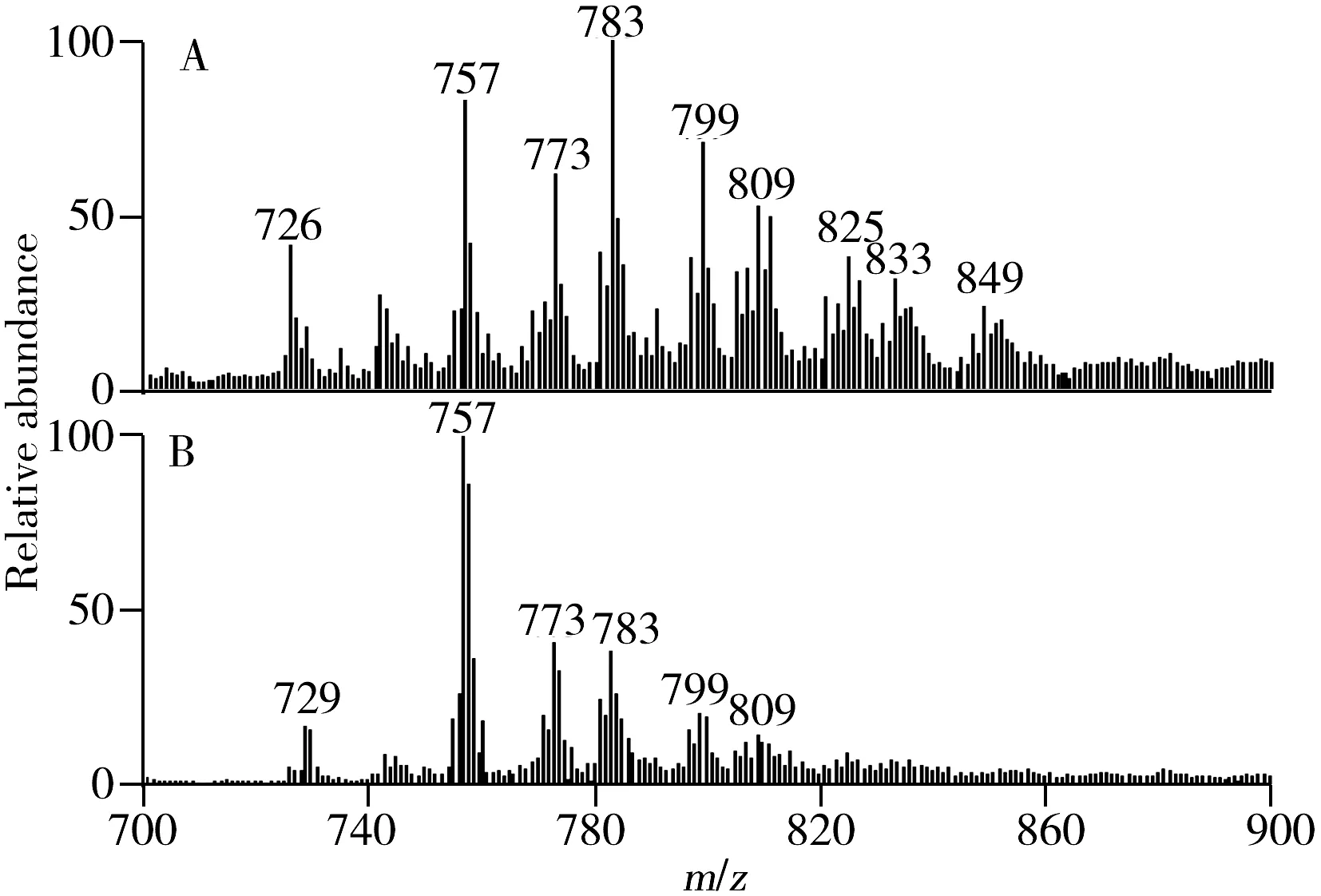
图5 iEESI-MS分析不同组织的化学指纹谱图[73]Fig.5 iEESI-MS analysis of different tissues[73]A.lung cancer tissues,B.lung cancer normal tissues
近年来,随着生物组织内复杂机理过程研究的深入和电离技术的发展,开发出多种直接分析离体生物组织样品的直接质谱技术。如:以磷脂类物质信号强度高、种类多为目标,对不同溶剂体系下的癌症组织与癌旁组织进行直接iEESI-MS分析,得到CH3OH-H2O(30∶70,体积比)是适合直接获取不同生物组织样品(包括食管癌、猪肺等)内部磷脂类物质的最佳溶剂体系,从而建立了一种无需破坏、研磨即可获取生物组织样品内部磷脂类物质的质谱学新方法[73]。利用CH3OH-H2O(30∶70,体积比)作萃取溶剂,对肺癌癌症组织与癌旁组织进行直接iEESI-MS分析发现,癌症组织(图5A)与癌旁组织(图5B)的化学指纹谱图存在明显差异(图5),这说明iEESI-MS可快速辨别出癌症组织与癌旁组织在分子层次上的差异,该结果在寻找潜在肿瘤分子标志物、快速判断临床手术过程癌变组织是否切除完全和进一步探究癌症发病机制等方面具有广阔应用前景[63,73]。
此外,利用iEESI-MS技术对不同外界刺激下的活体蒜瓣组织内部蒜氨酸水解酶的反应活性进行直接在线监测,结果表明该方法不仅可在尽可能保持组织生理状态完整的条件下实时监测蒜氨酸水解酶在多种外界刺激下的应激活性,而且还可在线获取组织内部酶促反应体系中底物和反应产物含量的动态变化信息,有望成为在分子层次理解酶促反应机制的新型工具[64]。
3 直接质谱分析在活体分析中的应用
呼吸气体携带大量与疾病、代谢、脏器状况等相关的生物标志物分子,且呼出气体检测具有无损、快速、采样方便且非侵入性、不涉及个人隐私等优势,在临床医学、分析检测等研究领域备受关注[74-76]。由于呼出气体中代谢物的含量极低,对检测仪器的灵敏度有较高的要求。电喷雾萃取电离质谱技术(EESI-MS)具有灵敏度好、分析速度快、基体耐受强、便于活体分析等优点,从而为人体呼吸气体中挥发性、非挥发性化合物的检测提供了可靠的技术支撑[77-79]。此外,EESI-MS技术还能通过呼出气体中化学成分的变化来监测人体服用药物在体内的代谢过程。Gamez等[80]利用EESI-MS技术监测了丙戊酸(VPA)在体内的代谢情况,研究结果表明EESI-MS技术在临床诊断、代谢组学研究中具有潜在的应用价值。除EESI-MS技术应用于呼出气体分析外,Garcia-Gomez等[81]利用二次离子高分辨质谱技术(SESI-HRMS)分析了人体呼出气体中的20多种色氨酸代谢物。Kumar等[82]利用SIFT-MS技术对210例呼吸气体样品(包括食管癌、胃癌患者、健康人)中的挥发性有机化合物(VOCs)进行了分析,结果发现脂肪酸、酚、醛类化合物在一定程度上可作为食管癌、胃癌患者呼出气体中潜在的标志物分子。Ghimenti等[83]通过热解吸气相色谱-质谱联用技术(TD-GC-MS)成功检测了医院工作人员呼出气体中的代表性污染物七氟醚和异丙醇,并将该技术应用于其它外源性化合物挥发性代谢物的分析,以试图对工作人员的健康风险评估提供参考依据。此外,通过分析手术过程使用电刀、超声刀、激光刀等手术器械产生的气溶胶(烟雾、电刀废气)来实时鉴定人体组织成分的快速汽化电离质谱(REIMS,也称智能刀),该技术可直接对生物组织进行快速分析,避免了样品在处理过程的损失及繁琐的提取、纯化工作[84]。表1为直接质谱技术在组织样品及活体分析中的部分应用。
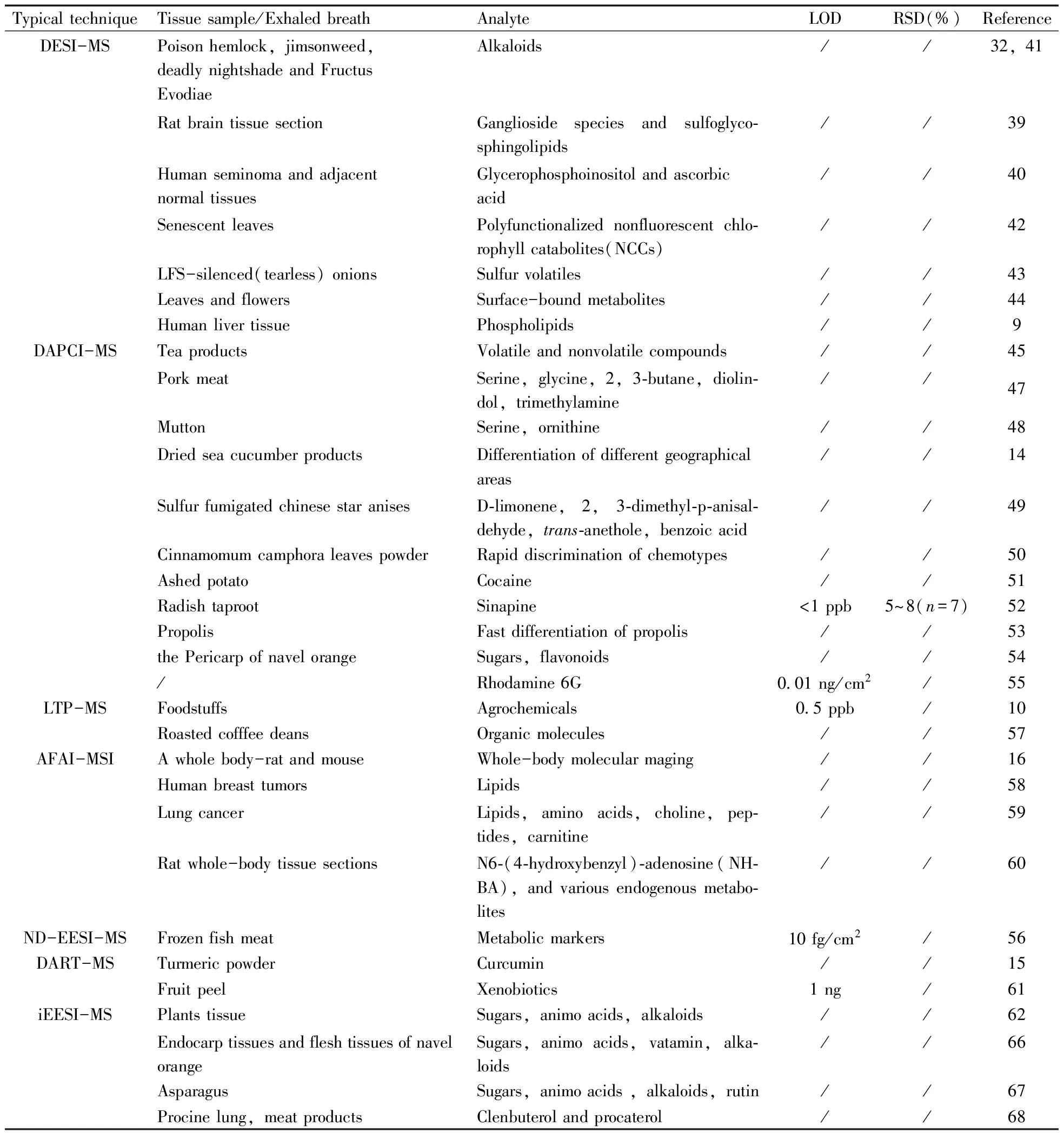
表1 直接质谱技术在组织样品及活体分析中的部分应用Table 1 Direct mass spectrometry techniques and their applications in tissue samples and in vivo analysis
(续表1)
TypicaltechniqueTissuesample/ExhaledbreathAnalyteLODRSD(%)ReferenceGarlicandgingertuberAminoacids,saccharides/7 3~11 262,69RedpeppersDifferentaitionfreshnessofredpepper//70DifferentbiologicaltissuesamplesPhospholipids//73PorkmeatSalbutamol0 039ppb6~1563RawgarlicclovesEnzymaticreaction//64EESI-QTOF-MSExhaledbreathNonvolatilecompounds//78ExhaledbreathNicotine0 05fg/mL5 0079ExhaledbreathValproicacid//80SESI-HRMSExhaledbreathTryptophanpathwaymetabolites//81SIFT-MSExhaledbreathofesophagealandgastricadenocarcinomaVolatileorganiccompoundbiomarkers//82TD-GC-MSExhaledbreathSevofluraneandisopropylalcohol//83FTLMMSInflammatorytissueTitaniumoxideandmetallictitanium//71GC-MSHumanplacentaAcetylcholine//72REIMSHumantissueLipids//84
4 结论与展望
目前,直接质谱技术已实现在无需样品预处理的条件下对组织样品进行实时、非破坏、在线分析,同时也实现了从分析组织样品表面到分析整体组织样品的过渡。重要的是,使组织样品内部小分子代谢物、大分子脂质和蛋白质等从细胞和亚细胞水平进行鉴定、从空间分布进行研究成为可能,极大地拓宽了对组织样品所揭示的不同生理过程进行深入理解的角度和维度,预示着新型直接质谱分析技术将成为未来生命科学、临床医学、食品科学、活体分析等领域发展过程中起推动作用的关键技术。质谱技术具有灵敏度高、分析速度快、能提供分子结构信息等特点,解决了组织样品内部化学成分的定性分析问题,但由于组织样品基质复杂,在生物标志物分子筛选、精准定量等方面依然面临着一定的挑战。
[1] Fenn J B,Mann M,Meng C K,Wong S F,Whitehouse C M.Science,1989,246(4926):64-71.
[2] De Souza L M,Cipriani T R,Iacomini M,Gorin P A,Sassaki G L.J.Pharm.Biomed.Anal.,2008,47(1):59-67.
[3] Wang H,Xu J,Chen Y,Zhang R,He J,Wang Z,Zang Q,Wei J,Song X,Abliz Z.Anal.Chem.,2016,88(7):3459-3464.
[4] Han J,Tschernutter V,Yang J,Eckle T,Borchers C H.Anal.Chem.,2013,85(12):5965-5973.
[5] Mok H J,Lee J W,Bandu R,Kang H S,Kim K H,Kim K P.RSCAdv.,2016,6(38):32130-32139.
[6] Hu Y,Zhou S,Khalil S I,Renteria C L,Mechref Y.Anal.Chem.,2013,85(8):4074-4079.
[7] Fonslow B R,Yates J R.J.Sep.Sci.,2009,32(8):1175-1188.
[8] Shama N,Bai S W,Chung B C,Jung B H.J.Chromatogr.B,2008,865(1/2):18-24.
[9] Cooks R G,Ouyang Z,Takats Z,Wiseman J M.Science,2006,311(5767):1566-1570.
[10] Wiley J S,Garcia-Reyes J F,Harper J D,Charipar N A,Ouyang Z,Cooks R G.Analyst,2010,135(5):971-979.
[11] Garcia-Reyes J F,Harper J D,Salazar G A,Charipar N A,Ouyang Z,Cooks R G.Anal.Chem.,2011,83(3):1084-1092.
[12] Zhu L,Yan J P,Zhu Z Q,Ouyang Y Z,Zhang X L,Zhang W J,Dai X M,Luo L P,Chen H W.J.Agric.FoodChem.,2013,61(3):547-552.
[13] Zhang X L,Jia B,Huang K K,Hu B,Chen R,Chen H W.Anal.Chem.,2010,82(19):8060-8070.
[14] Wu Z C,Chen H W,Wang W L,Jia B,Yang T L,Zhao Z F,Ding J H,Xiao X X.J.Agric.FoodChem.,2009,57(20):9356-9364.
[15] Kim H J,Jang Y P.Phytochem.Anal.,2009,20(5):372-377.
[16] Luo Z G,He J M,Chen Y,He J J,Gong T,Tang F,Wang X H,Zhang R P,Huang L,Zhang L F,Lv H N,Ma S G,Fu Z D,Chen X G,Yu S S,Abliz Z.Anal.Chem.,2013,85(5):2977-2982.
[17] Wang H,Manicke N E,Yang Q,Zheng L X,Shi R Y,Cooks R G,Ouyang Z.Anal.Chem.,2011,83(4):1197-1201.
[18] Zaitsu K,Hayashi Y,Murata T,Ohara T,Nakagiri K,Kusano M,Nakajima H,Nakajima T,Ishikawa T,Tsuchihashi H,Ishii A.Anal.Chem.,2016,88(7):3556-3561.
[19] Chen F,Lin L,Zhang J,He Z,Uchiyama K,Lin J M.Anal.Chem.,2016,88(8):4354-4360.
[20] Chughtai K,Heeren R M.Chem.Rev.,2010,110(5):3237-3277.
[21] Wei Y P,Chen L R,Zhou W,Chingin K,Ouyang Y Z,Zhu T G,Wen H,Ding J H,Xu J J,Chen H W.Sci.Rep.,2015,5:10077.
[22] Liu J J,Wang H,Cooks R G,Ouyang Z.Anal.Chem.,2011,83(20):7608-7613.
[23] Hu B,Lai Y H,So P K,Chen H,Yao Z P.Analyst,2012,137(16):3613-3619.
[24] Takats Z,Cotte-Rodriguez I,Talaty N,Chen H W,Cooks R G.Chem.Commun.(Camb.),2005,(15):1950-1952.
[25] Harper J D,Christopher N A,Mulligan C C,Zhang X R,Cooks R G,Ouyang Z.Anal.Chem.,2008,80(23):9097-9104.
[26] Martinez-Jarquin S,Moreno-Pedraza A,Guillen-Alonso H,Winkler R.Anal.Chem.,2016,88(14):6976-6980.
[27] Li X,Hu B,Ding J H,Chen H W.Nat.Protoc.,2011,6(7):1010-1025.
[28] Huang X Y,Fang X W,Zhang X,Dai X M,Guo X L,Chen H W,Luo L P.Anal.Bioanal.Chem.,2014,406(29):7705-7714.
[29] Chen H W,Zenobi R.Nat.Protoc.,2008,3(9):1467-1475.
[30] Liu H H,Chen R,Wang J Y,Chen S M,Xiong C Q,Wang J N,Hou J,He Q,Zhang N,Nie Z X,Mao L Q.Anal.Chem.,2014,86(20):10114-10121.
[31] Wang J N,Qiu S L,Chen S M,Xiong C Q,Liu H H,Wang J Y,Zhang N,Hou J,He Q,Nie Z X.Anal.Chem.,2015,87(1):422-430.
[32] Talaty N,Takats Z,Cooks R G.Analyst,2005,130(12):1624-1633.
[33] Chen H W,Zhang X,Luo M B.Chin.J.Anal.Chem.(陈焕文,张燮,罗明标.分析化学),2006,34(4):464-468.
[34] Chen H W,Talaty N N,Takats Z,Cooks R G.Anal.Chem.,2005,77(21):6915-6927.
[35] Chen H W,Li M,Zhou J G,Fei Q,Jiang J,Jin Q H,Zhang T M,Zhang X.Chem.J.Chin.Univ.(陈焕文,李明,周建光,费强,姜杰,金钦汉,张天幕,张燮.高等学校化学学报),2006,27(8):1439-1442.
[36] Justin M,Wiseman B C L.Curr.Sep.DrugDev.,2007,22(1):11-14.
[37] Tata A,Gribble A,Ventura M,Ganguly M,Bluemke E,Ginsberg H J,Jaffray D A,Ifa D R,Vitkin A,Zarrine-Afsar A.Chem.Sci.,2016,7(3):2162-2169.
[38] Alexandrov T,Bartels A.Bioinformatics,2013,29(18):2335-2342.
[39] Wiseman J M,Li J B.Anal.Chem.,2010,82(21):8866-8874.
[40] Masterson T A,Dill A L,Eberlin L S,Mattarozzi M,Cheng L,Beck S D,Bianchi F,Cooks R G.J.Am.Soc.MassSpectrom.,2011,22(8):1326-1333.
[41] Chen H W,Zheng J,Wang W P,Chen C L,Wang Z C.Chin.J.Anal.Chem.(陈焕文,郑健,王伟萍,陈昌林,王志畅.分析化学),2009,37(2):237-241.
[42] Muller T,Oradu S,Ifa D R,Cooks R G,Krautler B.Anal.Chem.,2011,83(14):5754-5761.
[43] Joyce N I,Eady C C,Silcock P,Perry N B,Van Klink J W.J.Agric.FoodChem.,2013,61(7):1449-1456.
[44] Hemalatha R G,Pradeep T.J.Agric.FoodChem.,2013,61(31):7477-7487.
[45] Chen H W,Liang H Z,Ding J H,Lai J H,Huan Y F,Qiao X L.J.Agric.FoodChem.,2007,55(25):10093-10100.
[46] Liang H Z,Yang S P,Huan Y F,Zhang X,Chen H W,Liu Q,Liu Q Y,Zheng J.Chin.J.Appl.Chem.(梁华正,杨水平,郇延富,张燮,陈焕文,刘清,刘清瑶,郑健.应用化学),2009,26(10):1222-1226.
[47] Li Y,Li Q,Wang J,Zhang X L.J.Chin.MassSpectrom.(李毅,李倩,王姜,张兴磊.质谱学报),2016,37(3):273-281.
[48] Li Q,Wang J,Chen H W,Guo X D,Yang S P.J.Chin.MassSpectrom.(李倩,王姜,陈焕文,郭晓暾,杨水平.质谱学报),2014,35(6):502-508.
[49] Luo L P,Wang J,Zhang W J,Dai X M,Fang X W,Zhang Q,Liu Y L,Chen H W.Chin.J.Anal.Chem.(罗丽萍,王姜,章文军,戴喜末,方小伟,张茜,刘亚丽,陈焕文.分析化学),2013,41(7):1050-1056.
[50] Liu X X,Fang X W,Huang X Y,Zhang T T,Chen H W,Luo L P.Chem.J.Chin.Univ.(刘星星,方小伟,黄学勇,张婷婷,陈焕文,罗丽萍.高等学校化学学报),2016,37(4):654-660.
[51] Zhang H,Jia B,Wang J,Yang S P,Chen H W.LifeSci.Instrum.(张华,贾滨,王姜,杨水平,陈焕文.生命科学仪器),2011,9:49-52.
[52] Huang D J,Luo L P,Jiang C C,Han J,Wang J,Zhang T T,Jiang J,Zhou Z Q,Chen H W.J.Agric.FoodChem.,2011,59(6):2148-2156.
[53] Huang X Y,Guo X L,Luo H L,Fang X W,Zhu T G,Zhang X L,Chen H W,Luo L P.Int.J.Anal.Chem.,2015,2015(9/10):A191.
[54] Fang X W,Zhong T,Yao G C,Gao X,Yang M L,Li H,Le Z G,Zhang X L.Chin.J.Appl.Chem.(方小伟,钟涛,姚国灿,高翔,杨美玲,李慧,乐长高,张兴磊.应用化学),2015,32(10):1201-1207.
[55] Li X X,Chen L F,Ouyang Y Z,Feng F,Chen H W.Chin.J.Anal.Chem.(李欣昕,陈林飞,欧阳永中,冯芳,陈焕文.分析化学),2016,44(1):25-31.
[56] Chen H W,Wortmann A,Zenobi R.J.Mass.Spectrom.,2007,42(9):1123-1135.
[57] Martinez-Jarquin S,Winkler R.RapidCommun.MassSpectrom.,2013,27(5):629-634.
[58] Mao X X,He J M,Li T G,Lu Z H,Sun J,Meng Y X,Abliz Z,Chen J.Sci.Rep.,2016,6:21043.
[59] Li T G,He J M,Mao X X,Bi Y,Luo Z G,Guo C G,Tang F,Xu X,Wang X H,Wang M R,Chen J,Abliz Z.Sci.Rep.,2015,5:14089.
[60] He J J,Luo Z G,Huang L,He J M,Chen Y,Rong X F,Jia S B,Tang F,Wang X H,Zhang R P,Zhang J J,Shi J G,Abliz Z.Anal.Chem.,2015,87(10):5372-5379.
[61] Farre M,Pico Y,Barcelo D.Anal.Chem.,2013,85(5):2638-2644.
[62] Zhang H,Zhu L,Luo L P,Wang N N,Chingin K,Guo X L,Chen H W.J.Agric.FoodChem.,2013,61(45):10691-10698.
[63] Zhang H,Gu H W,Yan F Y,Wang N N,Wei Y P,Xu J J,Chen H W.Sci.Rep.,2013,3:2495.
[64] Zhang H,Chingin K,Zhu L,Chen H W.Anal.Chem.,2015,87(5):2878-2883.
[65] Urbanczyk-Wochniak E,Baxter C,Kolbe A,Kopka J,Sweetlove L J,Fernie A R.Planta,2005,221(6):891-903.
[66] Lu H Y,Zhang H,Zhou P,Yang M L,Zhong T,Yao G C,Chen H W.Chem.J.Chin.Univ.(卢海艳,张华,周鹏,杨美玲,钟涛,姚国灿,陈焕文.高等学校化学学报),2015,36(10):1912-1918.
[67] Lu H Y,Zhang H,Peng X M,Chen H W.Chin.J.Appl.Chem.(卢海艳,张华,彭小明,陈焕文.应用化学),2016,33(4):481- 488.
[68] Lu H Y,Zhang H,Zhou W,Chen H W.Mod.FoodTechnol.(卢海艳,张华,周炜,陈焕文.现代食品科技),2016,32(6):298-303.
[69] Zhang H,Zhu L,Chen H W.Chin.J.Anal.Chem.(张华,朱亮,陈焕文.分析化学),2014,42(11):1634-1639.
[70] Zhang H,Ren P P,Chen J,Wang L Z,He H Y,Ouyang Y Z,Chen H W.J.Chin.MassSpectrom.(张华,任盼盼,陈健,王礼治,贺含毅,欧阳永中,陈焕文.质谱学报),2015,36(5):411-416.
[71] De Nollin S,Poels K,Van Vaeck L,De Clerck N,Bakker A,Duwel V,Vandevelde D,Van Marck E.Pathol.Res.Pract.,1997,193(4):313-318.
[72] Welsch F,Wenger W C.NaunynSchmiedebergsArchPharmacol.,1980,311(2):113-118.
[73] Lu H Y,Zhang J Y,Zhou W,Wei Y P,Chen H W.Chin.J.Anal.Chem.(卢海艳,张建勇,周炜,魏益平,陈焕文.分析化学), 2016,44(3):329-334.
[74] Zhang Y,Pan S S,Zhu Z Q,Zhang X L,Xu G S,Wei Y P,Chen H W,Ding J H.Chin.J.Anal.Chem.(张燕,潘素素,朱志强,张兴磊,徐高四,魏益平,陈焕文,丁健桦.分析化学),2013,41(8):1220-1225.
[75] Li P H,Deng L L,Luo J,Li Wei,Ning J,Ding J H,Wu X P.Chem.J.Chin.Univ.(李鹏辉,邓伶俐,罗娇,李巍,宁晶,丁健桦,邬小萍.高等学校化学学报),2016,37(4):626-632.
[76] Wang H D,Pan S S,Zhang Y,Qu Y,Han C,Chen H W.Mod.Sci.Instrum.(王海东,潘素素,张燕,屈颖,韩超,陈焕文.现代科学仪器),2013,(4):40-45.
[77] Gu H W,Xu N,Chen H W.Anal.Bioanal.Chem.,2012,403(8):2145-2153.
[78] Chen H W,Wortmann A,Zhang W H,Zenobi R.Angew.Chem.Int.Ed.Engl.,2007,46(4):580-583.
[79] Ding J H,Yang S P,Liang D P,Chen H W,Wu Z Z,Zhang L L,Ren Y L.Analyst,2009,134(10):2040-2050.
[80] Gamez G,Zhu L,Disko A,Chen H W,Azov V,Chingin K,Kramer G,Zenobi R.Chem.Commun.(Camb.),2011,47(17):4884-4886.
[81] Garcia-Gomez D,Gaisl T,Bregy L,Martinez-Lozano Sinues P,Kohler M,Zenobi R.Chem.Commun.(Camb.),2016,52(55):8526-8528.
[82] Kumar S,Huang J,Abbassi-Ghadi N,Mackenzie H A,Veselkov K A,Hoare J M,Lovat L B,Spanel P,Smith D,Hanna G B.Ann.Surg.,2015,262(6):981-990.
[83] Ghimenti S,Tabucchi S,Bellagambi F G,Lomonaco T,Onor M,Trivella M G,Fuoco R,Di Francesco F.J.Pharm.Biomed.Anal.,2015,106:218-223.[84] Balog J,Sasi-Szabo L,Kinross J,Lewis M R,Muirhead L J,Veselkov K,Mirnezami R,Dezso B,Damjanovich L,Darzi A,Nicholson J K,Takats Z.Sci.Transl.Med.,2013,5(194):153-154.
Direct Mass Spectrometry Techniques and Their Applications in Tissue Samples Analysis
LU Hai-yan,ZHANG Hua,XIAO Yi-po,LI Yi, GU Hai-wei, CHEN Huan-wen*
(Jiangxi Key Laboratory for Mass Spectrometry and Instrumentation,East China University of Technology,Nanchang 330013,China)
Ambient mass spectrometry has been increasingly applied in tissue sample analysis with the advantages of high sensitivity,high speed and the capability for providing molecular structure information of compounds in complex matrices.Traditionally,the time-consuming sample pretreatment procedures including homogenization,extraction and separation are inevitable for tissue sample analysis,and commonly associated with biological degradation,chemicals contamination and bioactive components loss in sample preparations.Recently,with the development of novel ambient mass spectrometry techniques,insitutissue samples analysis has become possible without sample pretreatment. The applications of ambient mass spectrometry in tissue samples analysis are mainly discussed in this review,and their impacts in different fields,such as life science,clinical medicine,food science andinvivoanalysis are prospected.
mass spectrometry;tissue sample;applications;review
2016-09-14;
2016-09-30
国家自然科学基金(21565004);长江学者和创新团队发展计划项目(IRT13054);江西省科技计划项目(20142BCB24005,20124ACB00700)
10.3969/j.issn.1004-4957.2017.02.001
O657.63
A
1004-4957(2017)02-0152-09
*通讯作者:陈焕文,博士,教授,研究方向:质谱分析,Tel:0971-83896370,E-mail:chw8868@gmail.com
