局部复发食管鳞癌再程三维适形放疗剂量选择及疗效评价
2017-03-13姚春飞魏洁杜兴龙项飞吕星旺
姚春飞,魏洁,杜兴龙,项飞,吕星旺
(滁州市第一人民医院,安徽滁州239000)
局部复发食管鳞癌再程三维适形放疗剂量选择及疗效评价
姚春飞,魏洁,杜兴龙,项飞,吕星旺
(滁州市第一人民医院,安徽滁州239000)
目的 评价不同再程三维适形放疗剂量对局部复发食管鳞癌治疗效果的影响。方法 选择行食管癌根治性放疗后局部复发食管鳞癌患者33例,随机分为3组,每组11例。三组均行再程三维适形放疗,根据照射剂量不同,设为低、中、高剂量组(照射剂量分别为≥50.4~<54 Gy、≥54~≤60 Gy、>60~<66 Gy,1.8~2.0 Gy/次,1次/d,5次/周)。放疗结束1周,比较各组近期疗效、不良反应及1年生存率。结果 所有患者顺利完成再程三维适形放疗。低剂量组近期缓解率为45.45%(5/11),中剂量组为90.91%(10/11),高剂量组为81.82%(9/11),组间两两比较P均<0.05。各组主要不良反应为放射性食管炎、放射性肺炎、骨髓抑制和上消化道反应,多为1~3级,对症治疗后均好转,未出现4级放射性损伤和治疗相关性死亡。低剂量组1年生存率为27.27%,中剂量组为72.72%,高剂量组为54.54%,组间两两比较P均<0.05。结论 再程三维适形放疗治疗局部复发食管鳞癌患者近期疗效较好,且较为安全,以照射剂量≥54~≤60 Gy时患者获益最大。
食管鳞癌;再程三维适形放疗;放疗剂量
《2015中国肿瘤登记年报》数据显示,食管癌的发病率和病死率均居所有消化系统恶性肿瘤的第三位[1]。目前,食管癌的首选治疗仍以手术为主,但由于早期症状不明显,多数患者就诊时已属中晚期,错过了最佳手术时机。临床就诊时约50%患者因病情较晚不能接受手术治疗,由于中老年患者多伴有慢性疾病,其中20%患者因存在手术禁忌证无法手术[2],故多数患者采取以放疗为主的综合治疗。临床研究发现,食管癌根治性放疗后复发率较高,一旦复发,患者1年生存率极低[3]。对局部复发患者临床上比较认同的治疗方案是姑息性治疗,如再程放疗,以延长患者的生存时间。但目前关于再程放疗时的照射剂量尚无统一标准。本研究观察了行食管癌根治性放疗后局部复发食管鳞癌患者再程三维适形放疗时,不同放疗剂量对患者近期缓解率、不良反应以及1年生存率的影响。现分析结果并报告如下。
1 资料与方法
1.1 临床资料 选择2011年1月~2014年12月滁州市第一人民医院收治的行食管癌根治性放疗后局部复发食管鳞癌患者33例,男20例、女13例,年龄47~73(65.5±7.1)岁,距离首次根治性放疗12~53个月复发。纳入标准:①再程放疗间隔时间≥1年,野内复发;②经胃镜活检组织病理检查,确诊为食管鳞癌;③KPS评分≥70分,可耐受放疗;④行食管钡餐X线、CT检查证实,无食管穿孔、穿孔前征象及远处转移。随机将患者分为3组,每组11例。三组均行再程三维适形放疗,根据照射剂量不同分别设为低、中、高剂量组。三组性别、年龄具有可比性。本研究经医院伦理委员会批准,患者及其家属均知情同意。
1.2 再程三维适形放疗方案设计 所有患者取仰卧位,双臂上举交叉抱肘,采用热塑体膜固定,行CT放射治疗模拟定位机扫描,层厚5 mm,扫描范围由环状软骨水平至肝脏右叶下缘水平,扫描图像传至XIO治疗计划系统。由医师逐层勾画大体肿瘤体积(GTV),包括食管病变和区域肿大淋巴结,在GTV基础上前后左右外扩0.5~0.8 cm、上下外扩1.0~1.2 cm作为临床靶体积(CTV),在CTV基础上外扩0.3~0.5 cm作为计划靶体积(PTV),并设定重要剂量限制性器官的剂量限值,双肺V20≤20%,脊髓Dmax≤15 Gy。采用6 MV-X线西门子加速器实施治疗,处方剂量定义为95%PTV所接受的剂量。处方剂量范围为50.4~66 Gy,其中低剂量组为≥50.4~<54 Gy、中剂量组为≥54~≤60 Gy、高剂量组为>60~<66 Gy,1.8~2.0 Gy/次,1次/d,5次/周。
1.3 疗效观察 ①近期疗效:放疗结束1个月,复查食管钡餐X线及胸部CT等,根据万钧等[4]的食管癌放疗后近期疗效评价标准进行评价。完全缓解(CR):肿瘤完全消失,食管边缘光滑,管壁可稍强直;部分缓解(PR):病变大部分消失,无明显扭曲、溃疡,但食管壁欠光滑,有小充盈缺损或小龛影;无缓解(NR):病变残留或无好转,有明显充盈缺损、龛影,或狭窄加重。以CR+PR计算近期缓解率。②不良反应:根据美国肿瘤放射治疗协作组织制定的标准对急性放射性损伤进行评价。③生存情况:放疗结束1个月复查,之后每3个月复查一次,跟踪随访患者生存时间。随访截至2016年1月。
1.4 统计学方法 采用SPSS17.0统计软件。计数资料比较采用非参数Kruskal Wallis检验。生存分析采用Kaplan-Meier法,生存率比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组近期疗效比较 所有患者顺利完成再程三维适形放疗,放疗结束1个月,低剂量组CR 1例、PR 4例,近期缓解率为45.45%(5/11);中剂量组CR 3例、PR 7例,近期缓解率为90.91%(10/11);高剂量组CR 5例、PR 4例,近期缓解率为81.82%(9/11)。组间两两比较P均<0.05。
2.2 各组不良反应情况 所有患者的不良反应主要为放射性肺炎、放射性食管炎、骨髓抑制、上消化道反应(见表1),经对症治疗均缓解。三组均未出现4级放射性损伤及治疗相关性死亡。各组间不良反应的发生率比较差异均无统计学意义(P均>0.05)。

表1 各组再程三维适形放疗不良反应情况(例)
2.3 各组生存情况比较 随访截至2016年1月,低剂量组1例、中剂量组2例、高剂量组1例存活。低、中、高剂量组中位生存时间分别为9、14、11个月,1年生存率分别为27.27%、72.72%、54.54%。各组1年生存率比较P均<0.05。见图1。
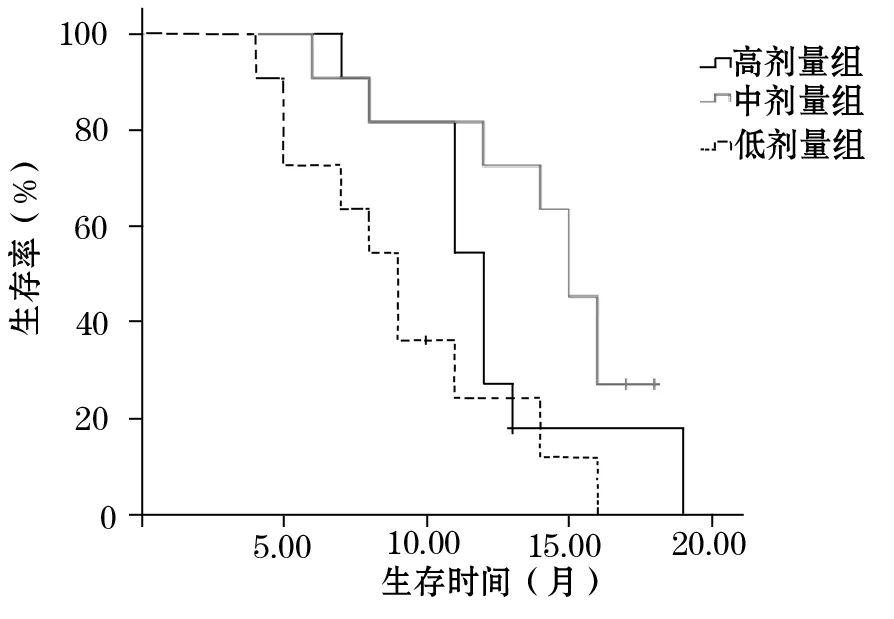
图1 不同剂量再程三维适形放疗局部复发食管鳞癌患者的生存曲线
3 讨论
食管癌根治性放疗的局部控制率和生存预后均不理想,多数患者于2年内复发,其中1年复发率高达70%[5]。根治性放疗后局部复发者多采取手术、化疗或再程放疗等[6]治疗,但未形成临床权威的标准治疗方案。行根治性放疗的食管癌患者多失去手术机会或因其他原因无法手术,放疗后复发者能够行手术治疗的比例更低。美国安德森癌症中心报道,根治性放化疗失败患者仅8%的患者能够行手术治疗[7];并且放疗后复发局部组织发生纤维化、粘连,挽救性手术难度大,术后并发症发生率高。Rice[8]研究认为,挽救性手术切除的要求较高,且不容易操作;即使可以成功实施手术,也会面临术后伤口愈合不佳以及肺部感染等不良预后风险;故不建议将挽救性食管切除术作为首选的治疗方案。而化疗由于毒副作用大、临床有效率低,目前仅作为食管癌放疗后局部复发者的辅助性治疗手段[9~15],且国内食管癌的病理类型多为鳞癌[16],分化程度高,对化疗的有效率更低。
首程放疗后,患者脊髓、肺等器官受到一定剂量照射,使得再程放疗受到一定限制。三维适形放疗可优化靶区剂量分布,使得靶区剂量与高剂量区剂量一致,提高靶区照射剂量的同时降低周围组织照射剂量,减轻放疗不良反应,近年来已在临床上广泛应用[17~19]。Jereczek-Fossal等[20]研究发现,108例局部复发或转移的肿瘤患者行再程放疗,部分患者病情可得到控制,预后得到改善,且未出现严重不良反应。有研究表明,照射剂量的精准把握和靶体积的精准勾画均可对治疗效果产生直接影响[21]。但目前三维适形放疗应用于局部复发食管鳞癌治疗时,放疗剂量往往根据临床经验而定,缺乏可依循的临床客观证据。再程放疗的食管癌患者因其正常组织器官累积剂量较高,再程放疗时放疗剂量不宜过高,但具体剂量目前尚无统一标准。国外有研究结果显示,食管癌放疗后复发者再程放疗照射剂量≥45 Gy时,其生存率较<45 Gy有所提高;而照射剂量>60 Gy时,患者生存率并未提高,却增加了放疗的不良反应[22]。本研究三组均顺利完成放射治疗,近期缓解率中剂量组>高剂量组>低剂量组,与Fakhrian等[22]报道基本一致。本研究再程三维适形放疗后主要不良反应为放射性食管炎、放射性肺炎、骨髓抑制和上消化道反应,多为1~3级,经对症治疗后均可好转,均未出现4级放射性损伤和治疗相关性死亡。其原因是行食管癌根治性放疗后,大部分患者靶区内存在管壁纤维化、管腔僵硬、扩张受限,使得靶区内癌组织内血运相对差、乏氧细胞多,从而使得再程放疗时敏感性降低;随着放疗剂量的升高,虽然放射性损伤的发生率并未增加,但其严重程度却越来越明显。本研究还发现,1年生存率中剂量组>高剂量组>低剂量组,可见放疗剂量与局部复发食管鳞癌的临床预后有关,与Shridhar等[23]研究结果相符。
综上所述,再程三维适形放疗治疗局部复发食管鳞癌患者近期疗效较好,且无严重放射性损伤,以照射剂量≥54~≤60 Gy时患者获益最高。但本研究为单中心的小样本量研究,对于剂量的具体标准还需要更多的临床证据来支持。
[1] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] 孔雁,高红梅.食管癌放射治疗10年生存分析及不同治疗方式的疗效比较[J].肿瘤防治研究,2015,42(1):56-61.
[3] 宋美芳,邱灏,王国民.27例食管癌放疗后复发的再放疗疗效分析[J].中国癌症杂志,2000,10(5):463-464.
[4] 万钓,肖爱勤,高淑珍,等.食管癌放疗后近期疗效评价标准——附1000例分析[J].中国放射肿瘤学,1989,3(4):205-207.
[5] Polee MB, Tilanus HW, Eskens FA, et al. Phase Ⅱ study of neo-adjuvant chemotherapy with paclitaxel and cisplatin given every 2 weeks for patients with a resectable squamous cell carcinoma of the esophagus[J]. Ann Oncol, 2003,14(8):1253-1257.
[6] 张清琴,王军民,杨萌,等.替吉奥联合调强放疗对食管癌再程放疗的疗效观察[J].山东医药,2015,55(1):52-52.
[7] Sudo K, Xiao LC, Wadhwa R, et al. Importance of surveillance and success of salvage strategies after definitive chemoradiation inpatients with esophageal cancer[J]. J Clin Oncol, 2014,32(30):3400-3405.
[8] Rice TW. Esophageal nightmare:cancer recurrence after definitive chemoradiation. Is salvage esophagectomy possible[J]. Semin Thorac Cardiovasc Surg, 2013,25(2):83-86.
[9] Ojima T, Nakamori M, Nakamura M, et al. Phase Ⅰ/Ⅱ study of divided-dose docetaxel, cisplatin and fluorouracil for patients with recurrent or metastatic squamous cell carcinoma of the esophagus[J]. Dis Esophagus, 2016,Jan 3. doi:10.1111/dote.12450.[Epub ahead of print]
[10] Akiyama Y, Iwaya T, Shioi Y, et al. Effectiveness of neoadjuvant chemotherapy with cisplatin and irinotecan followed by surgery on small-cell carcinoma of the esophagus: a case report[J]. Int J Surg Case Rep, 2015(17):121-125.
[11] Kumagai K, Mariosa D, Tsai JA, et al. Systematic review and meta-analysis on the significance of salvage esophagectomy for persistent or recurrent esophageal squamous cell carcinoma after definitive chemoradiotherapy[J]. Dis Esophagus, 2016,29(7):734-739.
[12] Haj Mohammad NH, ter Veer E, Ngai L, et al. Optimal first-line chemotherapeutic treatment in patients with locally advanced or metastatic esophagogastric carcinoma:triplet versus doublet chemotherapy: a systematic literature review and meta-analysis[J]. Cancer Metastasis Rev, 2015,34(3):429-441.
[13] Ordu AD, Nieder C, Geinitz H, et al. Radio (chemo) therapy for locally advanced squamous cell carcinoma of the esophagus:long-term outcome[J]. Strahlenther Onkol, 2015,191(2):153-160.
[14] Ojima T, Nakamori M, Nakamura M, et al. Neoadjuvant chemotherapy with divided-dose docetaxel, cisplatin and fluorouracil for patients with squamous cell carcinoma of the esophagus[J]. Anticancer Res, 2016,36(2):829-834.
[15] Miyawaki Y, Nakajima Y, Kawada K, et al. Efficacy of docetaxel, cisplatin, and 5-fluorouracil chemotherapy for superficial esophageal squamous cell carcinoma[J]. Dis Esophagus, 2016, Mar 22. doi:10.1111/dote.12485.[Epub ahead of print]
[16] 赫捷,邵康.中国食管癌流行病学现状、诊疗现状及未来对策[J].中国癌症杂志,2011,21(7):501-504.
[17] 陈传喜,杨志勇,袁红,等.三维适形放疗同步化疗治疗中晚期食管癌的疗效观察[J].实用临床医药杂志,2016,20(3):125-126.
[18] 刘粉霞.三维适形放射治疗局部复发性食管癌疗效观察[J].中国实用医刊,2010,37(19):37-38.
[19] 古金耀,古筝,谈小乐.食管癌三维适形放射治疗87例临床观察[J].九江学院学报:自然科学版,2014,29(2):65-67.
[20] Jereczek-Fossa1 BA, Kowalczyk A, D′onofrio A, et al. Three-dimensional conformal or stereotactic reirradiation of recurrent, metastatic or new primary tumors. Analysis of 108 patients[J]. Strahlenther Onkol, 2008,184(1):36-40.
[21] 惠蓓娜,张晓智,王蕊华,等.颈段、胸上段食管癌3DCRT/IMRT剂量学比较[J].临床肿瘤学杂志,2012,17(1):36-41.
[22] Shridhar R, Almhanna K, Meredith KL, et al. Radiation therapy and esophageal cancer[J]. Cancer Control, 2013,20(2):97-110.
[23] Fakhrian K, Gamisch N, Schuster T, et al. Salvage radiotherapy in patients with recurrent esophageal carcinoma[J]. Strahlenther Onkol, 2012,188(2):136-142.
安徽省“十二五”临床重点建设计划(01T50);滁州市科技局医疗卫生类计划项目(201407)。
魏洁(E-mail: w_j_doc@sina.com)
10.3969/j.issn.1002-266X.2017.08.020
R730.55
B
1002-266X(2017)08-0064-03
2016-09-01)
