重复经颅磁刺激对不完全性脊髓损伤患者痉挛的影响
2017-03-13董璐洁于利国陈沫刘雅丽
董璐洁,于利国,陈沫,刘雅丽
研究显示痉挛在脊髓损伤(Spinal Cord Injury,SCI)患者中发生率为12%~37%,在慢性SCI患者中的发生率为65%~78%,其中40%的患者由于下肢肌肉痉挛而阻碍康复治疗,25%以上为严重的痉挛[1]。未经治疗的下肢痉挛常导致异常步态及肌肉僵硬,引起疼痛和疲劳,进而引起相应关节的关节挛缩,增加压力性溃疡和感染的风险,并且会妨碍轮椅使用者的坐位、转移和行驶,对SCI患者个人及家庭的日常生活造成极大不便。重复经颅磁刺激(Repetitive Transcranial Magnetic Stimulation,rTMS)已经被用于研究和改善各种神经疾病导致的肌肉痉挛,如SCI[1]、多发性硬化等[2]。高频rTMS(>1Hz)可对大脑皮层的兴奋性产生影响[3-4],其是否可以通过皮层对SCI下位运动神经元的控制的影响进而对SCI后痉挛起作用是当前研究的热点[5-6]。本研究采用10Hz的rTMS作为干预方法,观察其对不完全性SCI患者痉挛状态的影响。
1 资料与方法
1.1 一般资料 选取2014年9月~2015年12月期间在我科收治的SCI患者。纳入标准:符合SCI的诊断标准,且ASIA分级B~D级;非脊髓休克期;受累双下肢肢体肌张力增高;如使用口服抗痉挛药则记录药物种类剂量等,稳定性使用已有1个月以上。排除标准:合并颅脑损伤或伴有意识障碍者;颅内或颈椎有金属内固定、装有心脏起搏器、癫痫等不适宜接受磁刺激治疗;合并下肢骨折、严重的关节炎、截肢、或其他疾患引起的关节挛缩者;在本研究开始前3个月接受过肉毒毒素或酒精等神经阻滞术治疗的患者,以及在研究过程中的任何时间点可能需要使用上述治疗的患者;严重心、肝、肾功能障碍及休克者;合并肿瘤、妊娠者;试验前6个月参加其它临床研究者;rTMS禁忌症的患者。该研究经华中科技大学同济医学院附属同济医院伦理委员会审查和批准。所有受试者均签署了知情同意书。18例SCI患者入选成为SCI组:男14例,女4例;年龄(32.5±12.1)岁;其中颈段10例,胸段8例;ASIA分级:B级6例,C级8例,D级4例。同时纳入7名健康成年人作为正常组:男5例,女2例;年龄(31.7±10.7)岁。2组性别、年龄差异无统计学意义。
1.2 方法 SCI组患者在接受临床常规综合康复疗法的同时接受rTMS干预。采用YRD CCY-I经颅磁刺激仪,磁刺激线圈为“8”字形线圈,直径75mm,脉冲磁场峰值强度为3.0T。患者取仰卧位,“8”字形线圈中心刺激皮层M1区;采用的刺激频率为10Hz,刺激强度为90%静息运动阈值(Rest Motor Threshold,RMT)rTMS治疗,每个序列刺激时间1s,10个脉冲,间歇10s,连续100个序列;每次治疗20min;每日1次,每周连续5d,共4周。
1.3 评定标准 SCI组治疗前后进行如下检测:①改良的Ashworth量表法(MAS)评估患者双下肢痉挛水平;②F波:受试者取仰卧位,双手放置身体两侧,嘱患者充分放松。记录电极置于被测肢体踇长伸肌上,参考电极置于第一掌趾关节上,地线放在刺激电极和记录电极之间。刺激电极为Dantec双极电极,将其放置在内踝后下方距离记录点约10cm处,阴极摆放离心端。在双下肢刺激点分别给予连续10次的超强刺激,频率1Hz,波宽0.2ms。记录所测得的F波平均潜伏期;③H反射:受试者取俯卧位,足踝关节处放置一个枕头以使足踝微屈,小腿充分放松。记录电极放置于内踝与胫骨内上髁的连线的腓肠肌内侧头处,参考电极置于跟腱。地线位于刺激电极和记录电极之间以最大程度减小伪迹,刺激电极置于腘窝横纹中点的胫神经体表。刺激电流从H反射阈值以下开始按1mA递增,进行H反射的检测。测定H反射潜伏时、H反射的最大波幅以及M波最大波幅比值(Hmax/Mmax值)。④运动诱发电位(Motor Evoked Potential,MEP):采用MagVentre公司的MagPro经颅磁刺激仪(R30incl型),刺激线圈为“8”字形,单个线圈内径为75mm。采用Keypoint 9031A070肌电图仪同步记录。受试者取仰卧位,磁刺激线圈中心刺激皮层M1区,记录对应下肢肌肉所得到的MEP。记录所检测到的MEP的波幅以及潜伏时。正常组检测F波和H反射。

2 结果
治疗前,SCI组MAS分级为Ⅰ级1例(5.6%)、Ⅰ+级6例(33.3%)、Ⅱ级8例(44.4%)、Ⅲ级2例(11.1%)、Ⅳ级1例(5.6%),治疗后,为Ⅰ级5例(27.8%)、Ⅰ+级7例(38.9%)、Ⅱ级6例(33.3%),MAS分级较治疗前明显改善(P<0.05)。
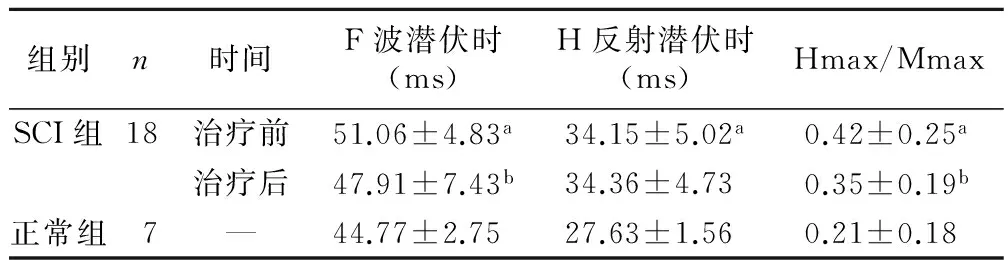
治疗前,SCI组F波潜伏时和H反射潜伏时较正常组明显延长(P<0.05),Hmax/Mmax值较正常组明显增高(P<0.05)。治疗后,SCI组F波潜伏时与治疗前比较明显缩短(P<0.05),H反射潜伏时治疗后前相比差异无统计学意义; Hmax/Mmax值较治疗前降低(P<0.05)。见表1。
SCI组治疗前Hmax/Mmax值和MAS无相关性,治疗后Hmax/Mmax值和MAS也无相关性。
18例SCI患者中仅5例患者治疗前后均可诱发出皮层MEP;1例患者治疗前未能诱发检测出MEP,但在rTMS治疗后可引出MEP;其余12例患者即使将磁刺激输出强度调整到100%治疗前后均未能诱发出MEP。

组别n时间F波潜伏时(ms)H反射潜伏时(ms)Hmax/MmaxSCI组18治疗前51.06±4.83a34.15±5.02a0.42±0.25a治疗后47.91±7.43b34.36±4.730.35±0.19b正常组7—44.77±2.7527.63±1.560.21±0.18
与正常组比较,aP<0.05;与SCI组治疗前比较,bP<0.05
3 讨论
痉挛是SCI患者长期残疾的主要原因之一。痉挛是因牵张反射兴奋性增高所致的速度依赖性肌肉张力增高、腱反射亢进为特征的运动障碍,会优先影响特定的肌群。针对SCI后肢体痉挛有学者提出假设[7]:脊髓上支配脊髓环路的神经元兴奋性或者传导频率发生变化。多种损伤因素造成的皮质脊髓束、网状脊髓束和红核脊髓束等下行通路神经轴突发生不同程度的损伤,改变了上位神经元和被其支配的脊髓下段中间神经元的兴奋性,并表现在神经冲动发放频率的变化上。高频rTMS作用于大脑皮层通过磁场产生感应电流,改变大脑皮层兴奋性和皮质脊髓细胞的动作电位,能影响中枢神经系统代谢和神经元电活动,使被刺激部位皮质及与之有神经联系的远处中枢神经系统产生抑制或易化作用,远程诱导脊髓环路调节脊髓兴奋性[8]。因此,目前治疗SCI后痉挛除常规的康复治疗方法如运动疗法、常规物理因子以及传统的针灸推拿等治疗、口服抗痉挛药物治疗,局部注射(如肉毒毒素)以及外科手术之外,rTMS对痉挛的影响也是目前广大的临床以及研究工作者正在寻求和探索的一种无创的治疗方法。
本研究观察到,采用高频rTMS作用于SCI患者运动皮层,MAS分级明显改善。可能是因为rTMS改变运动皮层兴奋性,调节皮质脊髓通路的活性,提高下行性皮质脊髓的投射,直接或间接地调节α运动神经元的兴奋性,降低脊髓环路兴奋性,从而改善痉挛症状;这与既往的研究是相符的[9-11]。
本研究发现不完全性SCI患者治疗前F波的潜伏时和H反射潜伏时较与健康正常受试者明显延长;F波潜伏时与治疗前相比明显缩短。当神经某一节段因病变破坏其完整性导致传导减慢,F波的潜伏期就会延长。这在以往研究也有报道[12],SCI患者F波的平均潜伏时较正常人延长,并且F波的时间离散度(F Chronoclispersion,F-CD)和F波的出现率与MAS评分呈线性相关[13]。SCI后F-CD延长是因为Renshaw细胞抑制功能丧失,致使更多的神经纤维参与并累计放电,F波即出现暂时离散,表现为F波的潜伏时缩短。本研究观察到rTMS刺激后SCI患者F波的潜伏时延长后的回调,提示rTMS可以促进损伤后的神经功能的部分恢复。
本研究发现不完全性SCI患者治疗前的Hmax/Mmax值较健康正常受试者增高,且增高接近正常人的2倍。H波的最大波幅可以反映被募集的α运动神经元总量。由于M波容易对H波的波幅产生影响,变化幅度较大,所以Hmax/Mmax 值能够更直观地反映较小的α运动神经元的兴奋性变化[14]。本研究所测得SCI患者Hmax/Mmax值;H反射潜伏时治疗后与治疗前相比无显著差异;同时发治疗后Hmax/Mmax值较治疗前降低,rTMS治疗前后Hmax/Mmax值和MAS均无相关性。这一结果与以往的研究结果并不完全一致,如Nielsen等[15]采用rTMS作用于多发性硬化患者运动皮层,发现此类患者肌张力有改善,且其Hmax/Mmax波幅比值降低和临床症状改善有相关性。这或许与本研究的样本量偏少有关,同时由于H波易受各种因素干扰,Hmax/Mmax值的正常范围变化较大,因此研究Hmax/Mmax值如何有效的应用于SCI后痉挛的评估需要行更多更深入的研究。
所有健康正常受试者均可检测到MEP。而在本研究中,仅5例患者在rTMS治疗前后均可诱发出皮层MEP;1例患者治疗前未能诱发检测出MEP,但在rTMS治疗后可引出MEP;其余12例患者治疗前后均未能诱发出MEP。因此,本研究中MEP的检测未能进行统计学分析。一方面,这一研究发现是否可以说明采用MEP检测并不能很敏感的检测SCI患者脊髓运动传导通路,但尚无确切依据支持这一猜测;另一方面也可能与本研究的样本量较少有关。研究中仅1例患者rTMS治疗前诱发不出MEP,但治疗后可诱发出波幅较低,且可诱发出潜伏期明显延长的MEP波形;其可能机制或许是由于患者在接受高频rTMS后,提高了部分仍有连续的皮质脊髓束兴奋性,因而当再次予以皮层rTMS刺激时,可在相应下肢记录到微弱的动作电位。因此,针对rTMS干预后MEP的变化以及及作用机制需要更深入和大样本量的研究,这一方向的研究或许对SCI后运动功能的恢复以及预后有潜在的意义和价值。
rTMS作用于人体研究的安全性是已经得到公众认可的。本研究也同样证实了rTMS应用的安全性。本研究中,受试者在接受rTMS过程中:2例患者诉磁刺激作用的局部区域有一过性头皮疼痛,但可以耐受;6例患者仅在第一次rTMS治疗时有短暂性的面部肌肉抽搐;5例患者诉治疗结束后睡眠时间有所延长、睡眠质量有提高。
本研究尚存在一定的局限性和不足。首先在研究中仅仅采用了MAS分级这一指标评估痉挛,较为主观和局限;其次,本文观察的是不完全性SCI患者,并未包括完全性SCI患者;再次,由于SCI后痉挛的影响因素很多,以及痉挛形成机制和痉挛检测在神经生理学上表现的复杂性,本研究仅仅采用自身前后对照研究观察rTMS结合综合康复治疗对患者痉挛以及相关电生理指标的影响,并不一定能完全认定所起的作用来源于rTMS的干预,因此,需要在下一步的研究中设置假rTMS干预组来进行更深入的研究;针对rTMS干预后痉挛的电生理指标变化的规律也需要加大样本量来研究其变化的趋势并对其潜在的机制做更进一步的研究探索和突破。
[1] Balioussis C, Hitzig SL, Flett H. Identifying and Classifying Quality of Life Tools for Assessing Spasticity After Spinal Cord Injury[J]. Top Spinal Cord Inj Rehabil, 2014, 20(3): 208-224.[2] Mori F, Ljoka C, Magni E, et al. Transcranial magnetic stimulation primes the effects of exercise therapy in multiple sclerosis[J]. J Neurol, 2011, 258(7): 1281-1287.
[3] Kumru H, Murillo N, Samso JV, et al. Reduction of spasticity with repetitive transcranial magnetic stimulation in patients with spinal cord injury[J]. Neurorehabilitation & Neural Repair, 2010, 24(5): 435-441.
[4] Kumru H, Benito J, Murillo N, et al. Effects of High-Frequency Repetitive Transcranial Magnetic Stimulation on Motor and Gait Improvement in Incomplete Spinal Cord Injury Patients[J]. Neurorehabilitation & Neural Repair, 2013, 27(5): 421-429.
[5] Valle AC, Dionisio K, Pitskel NB, et al. Low and high-frequency repetitive transcranial magnetic stimulation for the treatment of spasticity[J]. Developmental Medicine & Child Neurology, 2007, 49(7): 534-538.
[6] Bhidaysiri R, Bronstein JM. Improvement of cerivical dystonia: possible role of transcranial magnetic stimulation simulating sensory tricks effect[J]. Med Hypotheses, 2005, 64(5): 941-945.
[7] Jessica M, D'Amico, Elizabeth G, et al. Recovery of neuronal and network excitability after spinal cord injury and implications forspasticity[J]. Front Integr Neurosci, 2014, doi: 10.3389/fnint.2014.00036.
[8] Dietz V, Sinkjaer T. Spastic movement disorder: impaired reflex function and altered muscle mechanics[J]. Lancet Neurology, 2007, 6(8): 725-733.
[9] Elbasiouny SM, Moroz D, Bakr MM, et al. Management of Spasticity After Spinal Cord Injury: Current Techniques and Future Directions[J]. Neurorehabilitation & Neural Repair, 2010, 24(1): 23-33.[10]Valls-Solé. The circuitry of the human spinal cord: Its role in motor control and movement disorders[J]. Clinical Neurophysiology, 2008, 119(5): 1213-1214.
[11]Gao W, Yu LG, Liu YL, et al. Mechanism of GABA receptors involved in spasticity inhibition induced by transcranial magnetic stimulation following spinal cord injury[J]. Huazhong University of Science and Technology Med Sci, 2015, 35(2): 241-245.
[12]刘雅丽, 尤春景. 非急性期脊髓损伤患者F波与痉挛的相关性研究[J]. 中华物理医学与康复杂志, 2005, 27(6): 349-352.
[13]刘雅丽, 黄晓琳. 脊髓损伤患者下肢胫神经H反射和F波的临床观察[J]. 中国康复, 2003, 18(5): 278-280.
[14]Müller JF, Orekhov Y, Liu Y, et al. Homeostatic plasticity in human motor cortex demonstrated by two consecutive sessions of paired associative stimulation[J]. Eur J Neurosci, 2007, 25(11): 3461-3468.
[15]Nielsen JF, Sinkjaer T, Jakobsen J. Treatment of spasticity with repetitive magnetic stimulation: a double-blind placebo-controlled study[J]. Multiple Sclerosis, 1996, 2(5): 227-232.
