基于二硫代氨基甲酸盐自组装的糖芯片制备与表征
2017-03-10王汉奇
程 昉 王汉奇 许 旷 何 炜
(1大连理工大学精细化工国家重点实验室,辽宁 大连 116023;2大连理工大学制药科学与技术学院,辽宁 大连 116023;3大连理工大学化工学院,辽宁 大连 116023)
基于二硫代氨基甲酸盐自组装的糖芯片制备与表征
程 昉1,2,*王汉奇1,2许 旷1,2何 炜3
(1大连理工大学精细化工国家重点实验室,辽宁 大连 116023;2大连理工大学制药科学与技术学院,辽宁 大连 116023;3大连理工大学化工学院,辽宁 大连 116023)
糖基传感芯片是定量研究糖-蛋白相互作用的有力工具。传统糖基传感芯片的制备过程通常涉及糖基硫醇衍生物的合成,过程复杂且产率较低。本文采用脱氧氨基糖与二硫化碳温和条件下一步反应合成了一类新型糖基自组装功能分子-糖基二硫代氨基甲酸盐(DTC)化合物,进而在金衬底芯片上构筑了糖基传感功能膜。采用X 射线光电子能谱(XPS)分析了该糖基传感功能膜的元素组成和元素化学环境;采用表面等离子体共振(SPR)和酶联凝集素分析(ELLA)技术定量分析了其在蛋白质水平的糖生物学活性。通过混合自组装的方法,制备了一系列表面葡萄糖密度不同的糖基传感功能膜并测定了伴刀豆球蛋白(Con A)吸附的热力学和动力学数据。通过调控表面密度,我们观察到了蛋白在葡萄糖表面吸附的多价态现象。当自组装溶液中葡萄糖-DTC 摩尔分数低于 1%时,Con A 呈现单价态吸附,其解离平衡常数(Kd)为(39.10 ± 0.12) μmol·L-1;当自组 装 溶 液 中 葡萄糖-DTC 摩尔分 数 高 于 2%时 ,Con A 呈 现多价态 吸 附 , 解离平衡 常 数 降 至(1.17 ± 0.18) μmol·L-1。本文所发展的糖基自组装功能分子合成方法快速便捷、适用范围广,通过混合自组装可以实现蛋白结合价态的调控,是一种深入研究基于糖-蛋白相互作用的诸多生物过程的有效工具。
糖-蛋白相互作用;二硫代氨基甲酸盐;多价态吸附;热力学;动力学;自组装膜
1 引言
糖与蛋白质的相互作用在生命体内扮演着重要的角色。糖与受体蛋白的特异性识别介导了许多重要的生命活动,如细胞粘附、胞间信息传递、病毒感染、免疫应答等1-5。糖与植物凝集素的相互作用可以激活 T-细胞而刺激免疫系统,如刀豆球蛋白 A(Con A)可结合不同细胞膜受体而引发细胞增殖6。糖与蛋白质相互作用也会导致多种疾病,如免疫球蛋白(IgG)糖链上半乳糖的缺乏会导致IgG被甘露糖结合凝集素识别,从而导致类风湿关节炎的发生7。因此,研究糖与蛋白质的相互作用,获取相关的定量信息,在生物学和医学领域有着重要意义。
无标记生物传感技术,如石英晶体微天平(QCM)、表面等离子体共振(SPR)等,由于其即时检测、灵敏高、可定量等优点,已成为近年来研究糖与蛋白质相互作用的主要手段8-11。无标记生物传感技术检测分子间相互作用的关键是制备具有特异性识别和捕捉目标蛋白的生物传感功能膜。最常见的制备生物传感功能膜的方法是基于金衬底的硫醇自组装12。为了构建展示糖分子的生物传感功能膜,多种糖的巯基衍生物被合成和纯化并利用植物凝集素蛋白定量分析了所固定糖分子的生物学活性13。糖的巯基衍生物制备过程通常涉及羟基的保护与脱保护,以及构型的保持,导致总产率偏低。例如,Corn等以半乳糖和甘露糖为原料合成巯基末端糖衍生物,该过程涉及糖分子多个羟基保护和脱保护,多次重结晶保持糖的构型以及反复洗涤和干燥操作,耗时长,且总收率仅为11%8。
近年的研究表明二硫代氨基甲酸盐(DTC)化合物是一类良好的双齿配体,分子中的DTC结构能够与金原子形成配位键,从而在金衬底上形成自组装膜14。由于 DTC 有结构低电荷、齿距相对较小的优点,其形成的自组装结构相对于硫醇自组装膜具有高密度、高稳定性的特点,因此已被应用于金衬底上传感功能膜的构筑15。Morf等16使用扫描 隧 道 显 微 镜(STM)分 析 了 DTC 自 组 装 膜 的 结构,结果显示仅有硫原子在金表面成键,形成的自组装膜平整度高。Choi等17采用巯基乙醇溶液处理DTC自组装膜和硫醇自组装膜,比较了两种自组装膜结构的变化,实验表明DTC自组装膜具有更高的稳定性。用二硫化碳与氨基化合物在室温下在碱性水溶液中反应制备DTC类化合物,采用该溶液处理金衬底传感元件即可制备高质量的DTC 自组装膜18。该方法操作简单、条件温和,是一种快速制备生物传感功能膜的方法。尤其对于许多天然珍稀样品,反应步骤少、条件温和,能够保证较高的产率与活性。鉴于DTC化合物在自组装中的优势,制备糖基DTC化合物将能很大程度简化糖基传感功能膜的制备过程,从而推动糖-蛋白质相互作用的研究。
本文以单糖和二糖为例,通过氨基化糖分子与二硫化碳反应,合成了一类糖基DTC化合物。采用所合成的糖基DTC化合物制备了基于金衬底的糖基传感功能膜,采用X射线光电子能谱(XPS)表征糖基传感功能膜的元素组成、高分辨碳谱和硫谱。使用SPR传感技术在蛋白质水平研究了多种糖基自组装膜的生物活性。通过混合自组装调控表面糖基密度,并结合酶联凝集素检测(ELLA)技术和SPR技术定量研究了表面糖基化密度介导的蛋白质多价态生物现象。
2 实验部分
2.1 试剂与仪器
葡萄糖(98%)、阿拉伯糖(98%)、N-乙酰葡萄糖胺(98%)和乳糖(98%)均购于阿拉丁试剂有限公司;碳酸铵(98%)、氨水(25%)和二硫化碳(99%)均购于天津市富宇精细化工有限公司;可溶型单组分四甲基联苯胺(TMB)底物溶液购于天根生化科技(北京)有限公司;4-羟乙基哌嗪乙磺酸(HEPES,98%)和牛血清蛋白(BSA,98%)购于大连美仑生物有 限 公 司 ; 伴 刀 豆 球 蛋 白 (Concanavalin A, Con A,SDS-PAGE 级)、麦胚凝集素(Wheat germ agglutinin,WGA,SDS-PAGE 级)、花生凝集素(Peanut agglutinin, PNA, SDS-PAGE 级)、 荆 豆 凝 集 素 I (Ulex europaeusI,UEAI,SDS-PAGE级)均购于Vector Laboratories(美国);牛血清蛋白辣根过氧化酶复合物(BSA-hrp,> 95%)和伴刀豆球蛋白辣根过氧化物酶复合物(Con A-hrp,> 95%)购于北京博胜经纬科技有限公司。
糖基二硫代氨基甲酸盐结构分析采用 Bruker Avance II 400M 核磁共振仪(Bruker公司,德国)和Thermo Fisher 6700 高 级 傅 里 叶 变 换 红 外 光 谱 仪(Thermo Fisher Scientific公司,美国)测定。紫外-可见光谱采用 Eppendorf BioSpectrometer(Eppendorf公司,德国)测定。糖基功能化传感芯片的表面结构采用 Thermo Scientific ESCALAB 250Xi X 射线光电子能谱仪(Thermo Fisher Scientific 公司,美国)表征。X 射线源采用 Al Kα(hv=1486.6 eV),光电子出射角为 90°,采用污染碳 C 1s(结合能(EB)=285.0 eV)作为能量校正。采用 Thermo Advances和 XPS Peaker软件分别对元素组成和高分辨谱图进行分析。蛋白吸附实验采用 BioSUPLAR 400 型双通道角度分辨表面等离子共振仪(BioSuplar公司,德国)测定。
2.2 二硫代氨基甲酸盐糖的合成
2.2.1 脱氧氨基糖的制备
以葡萄糖为例,制备 1-氨基脱氧葡萄糖。在15 mL 甲醇中加入 1.80 g 葡萄糖(0.01 mol)和 1.57 g碳酸铵(0.01 mol),加热至 46 °C 后,缓慢滴加氨水至溶液澄清。回流反应12 h,冷却结晶、抽滤、干燥,得到1-氨基脱氧葡萄糖。
2.2.2 糖基二硫代氨基甲酸盐(glycol-DTC)的制备
将上述产物全部加入15 mL 甲醇中。取氢氧化钠 0.4 g(0.01 mol)溶于 2 mL 水,加入其中,溶解后加入二硫化碳 0.605 mL(0.01 mol)。室温反应 12 h 后,加入乙醇结晶,抽滤、干燥得产物 1.55 g,收 率 60.7% 。 核 磁 共 振 碳 谱 (13C NMR)(100 MHz D2O): δ 163.1(C=S), δ 95.8(CHNH), δ 60.8 (CH2OH), δ 69.7 - 76.6(other CHOH). 质 谱 峰 (Ms): 254.04[M-H]-。
2.2.3 肌氨酸二硫代氨基甲酸盐(sarcosine-DTC)的制备
将 1.0 g 肌 氨 酸(0.011 mol)溶 于 3 mL 氨 水 中 ,冰浴下搅拌 5 min。将 1.2 mL 二硫化碳(0.020 mol)溶于 3 mL甲醇中,冰浴下缓慢滴入肌氨酸氨水溶液 中 , 升温至 40 °C 反 应 30 min,4 °C 结 晶 。抽滤、甲醇洗涤、干燥,得肌氨酸二硫代氨基甲酸盐 1.38 g,收率 63.0%。13C NMR(100 MHz D2O):δ 209.7(COOH),δ 176.3(C=S),δ 60.4(NCH2COOH),δ 43.9(NCH3)。
2.3 糖基功能化传感芯片的制备和应用
将 SPR 芯 片 至 于 紫 外-臭 氧 清 洗 仪 处 理 30 min, 水 超 声 清 洗 5 min × 3 次 , 乙 醇 超 声 清 洗 5 min × 3次,氮气吹干备用。将清洗后的SPR芯片浸 入 2 mmol·L-1的 DTC 溶 液 中 , 室 温 静 置 12 h,超纯水冲洗3次,氮气吹干,避光保存。
2.4 SPR检测流程
(1)将处理后的SPR芯片装入SPR仪内,固定流速 50 μL·min-1,通入缓冲液 5 min 测得基线 ;
(2) 使 用 HEPES 缓 冲液(pH 8.5,含 0.1 mmol· L-1Ca2+)配置 0.1 mg·mL-1的 BSA、PNA、Con A、WGA、UEA I溶液,分别通入蛋白质溶液 10 min测得吸附曲线;
(3)通入缓冲液 5 min,测得解离曲线;
(4) 通入 8 mol·L-1的尿素溶液 5 min 再生 ;
(5) 通入缓冲液 10 min 冲洗尿素溶液,重新构筑基线。
2.5 表面自组装密度对糖基化表面生物活性的影响
2.5.1 不同表面密度的糖基化表面的制备
将 1 cm × 1 cm 镀 金 硅 片 浸 入 食 人 鱼 溶 液(浓V(H2SO4):V(H2O2)=3:1,注意:食人鱼溶液对有机物有强烈的腐蚀性)室温处理 1 h,用水超声清洗5 min × 2 次,乙醇超声清洗 5 min × 2 次,氮气吹干 备 用 。 分 别 配 置 glycol-DTC 摩 尔 分 数 为 0% 、25% 、50%、75%、100%的 glycol-DTC/sarcosine-DTC混合溶液。将清洗后的镀金硅片浸入上述混合溶液中,室温自组装12 h,水冲洗3次,氮气吹干,避光保存。
2.5.2 不同表面密度的糖基化表面生物活性定性实验
(1)蛋白质非特异性吸附实验:将清洗后的镀金硅片置于 BSA-hrp 溶液(0.01 mg·mL-1)中,37 °C孵育 1.5 h。HEPES 缓冲液冲洗 3 次后置于 200 μL HEPES 缓 冲 液 中 , 加 入 200 μL 四 甲 基 联 苯 胺(TMB)溶液,37 °C 孵育 5 min 后加入 200 μL 硫酸(1 mol·L-1)终止反应,测定反应液在 450 nm 处的吸光度。
(2)植物凝集素特异性结合实验:将清洗后的镀金硅片置于 BSA 溶液(0.01 mg·mL-1)中,37 °C孵育 1.5 h。用 HEPES 缓冲液冲洗 3 次后置于 Con A-hrp 溶 液 (0.01 mg ·mL-1)中 , 37 °C 孵 育 1.5 h。HEPES 缓冲液冲洗 3 次后置于 200 μL HEPES 缓冲液中,加入 200 μL TMB 溶液,37 °C 孵育 5 min 后加入 200 μL 硫酸(1 mol·L-1)终止反应,测定反应液在450 nm处的吸光度。
2.5.3 不同表面密度的糖基化表面生物活性定量实验
将清洗后的SPR芯片置于葡萄糖二硫代氨基甲 酸 盐(glucose-DTC)摩 尔 分 数 分 别 为 1%、2% 、5%和 100%的 glucose-DTC/sarcosine-DTC 混合溶液中室温下自组装 12 h 制备表面密度不同的糖基化功能芯片。装入SPR仪中,依次通入不同浓度的Con A 溶液,测定其吸附量,作等温吸附曲线并获取热力学与动力学常数。
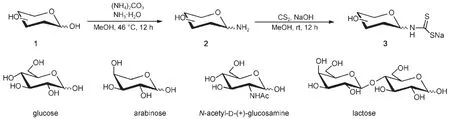
图1 糖基二硫代氨基甲酸盐的制备流程Fig.1 Synthesis of glycol-DTC

图2 葡萄糖基二硫代氨基甲酸盐化合物的紫外-可见(a)和红外(b)光谱表征Fig.2 UV-Vis(a)and IR(b)spectra of glucose and glucose-DTC
3 结果与讨论
3.1 糖基二硫代氨基甲酸盐的合成与表征
糖基二硫代氨基甲酸盐的制备如图1所示。首先,糖和碳酸铵在甲醇和氨水中反应,糖分子中异头碳羟基活性较高,溶液中的氨与异头碳羟基发生亲核取代反应生成脱氧氨基糖(2)。反应中氨水提供氨源,碳酸铵维持溶液中氨的浓度,促进反应正向进行。然后,脱氧氨基糖与二硫化碳在碱性条件下发生亲电加成反应,生成 glycol-DTC(3)。
DTC结构是具有共轭体系,含有DTC结构的化合物在紫外光区有两个明显的吸收峰,可以分别 归 属 为 N―C―S 结 构 中 双 键 的 π- π*跃 迁(255 nm)和 S―C―S 结构中硫原子上非键电子的 n-π*跃迁(290 nm)19,因此,使用紫外-可见光谱可以监测化 合 物 分 子 中 的 DTC 结 构 。 以 葡 萄 糖 为 例(图2(a)), 原 料 葡 萄 糖 在 255 和 290 nm 处 无 吸 收 峰 ,而 glucose-DTC 在 255 和 290 nm 处有明显吸收峰 ,表明通过两步反应成功在糖分子中引入DTC结构。
采用红外光谱对化合物(3)进行进一步表征,以葡萄糖为例,结果如图 2(b)所示。与原料葡萄糖的红外吸收谱图相比,glucose-DTC 在 830 和 890 cm-1左右的吸收峰可归属为糖 的 α 或 β 构型吸收峰,表明了反应过程中未破坏糖分子的环状结构;1609 cm-1处出现一个新的吸收峰,可以归属为 N―H 伸缩振动峰;1498 和 1350 cm-1处吸收峰为碳氮键伸缩振动吸收,二者分别对应碳氮单键和碳氮双键的伸缩振动,该结果是由DTC结构的共振变换造成的;950 cm-1处吸收峰可归属为碳硫双键伸缩振动峰20。红外光谱表征结果表明了化合物(3)中糖环结构和DTC结构的存在。
3.2 糖基二硫代氨基甲酸盐自组装膜表征
将金衬底生物传感元件浸泡在 glycol-DTC 水溶液中,即可获得糖基二硫代氨基甲酸盐自组装膜(glycol-DTC SAMs),流程如图 3 所示。
本文对金衬底上的自组装膜进行了XPS全谱扫描(图 4(a))并定量分析了表面元素组成(表 1)。未经自组装修饰的裸金表面仅检测出少量碳元素,可以归 属 为 表 面 存 在 的 少 量 有 机 污 染 。 glycol-DTC SAMs表面Au元素含量明显降低,表明金衬底上有机膜的形成。XPS检测到的硫、氮、氧三种元素,分别来自于二硫代氨基化合物中的硫和氮以及糖基团的氧。其中表面的硫元素与氮元素的摩尔比小于2,可能是由于硫原子存在于自组装膜结构的最下层,其信号强度受到表层原子的遮蔽效应而降低。
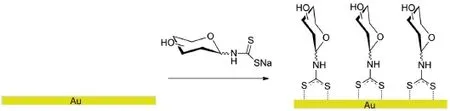
图3 糖基二硫代氨基甲酸盐自组装膜的制备流程Fig.3 Preparation of glycol-DTC SAMs
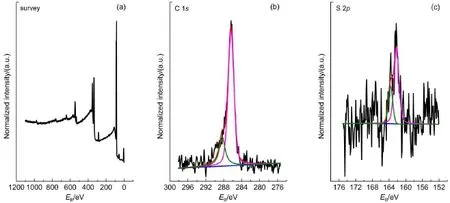
图4 糖基二硫代氨基甲酸盐自组装膜 XPS 扫描谱图(a)、高分辨 C 1s谱图(b)和高分辨 S 2p 谱图(c)表征Fig.4 Survey(a),high resolution C 1s(b)and high resolution S 2p(c)spectra of glycol-DTC SAM determined by XPS
自组装膜的的高分辨 C 1s谱图(图 4(b))和 S 2p谱图(图 4(c))可以提供碳和硫元素的化学环境。自组装膜的高分辨 C 1s谱图中在 286.2 eV 附近出现明显峰,可以归属为糖分子中连接羟基和氨基的碳原子。288.2 eV 附近出现较弱的峰,可以归属为DTC结构中碳原子。该结果表明自组装膜结构中存 在 糖 分 子 和 DTC 结 构 。 高 分 辨 S 2p 谱 图 中 在162.0 eV 附近出现含硫化合物自组装膜的经典双峰,两个峰面积比接近1:2,表明自组装结构的存在。然而该双峰的结合能差比经典硫醇自组装结构小约 0.2 eV,表明该自组装结构中硫原子比硫醇中的硫原子具有更多负电荷,有可能是DTC结构中共振结构造成的21。自组装膜室温放置 2 周,其高分辨 S 2p 谱图未发现显著变化,表明了 glycol-DTC SAM具有较高的稳定性。这可能是由于在二硫代氨基甲酸盐中,两个硫原子的间距接近金原子尺寸,并且硫原子和氮原子均提供了孤对电子,其电子云密度更高,与金表面的结合强度更高15。
综上,XPS表征结果表明,通过二硫代氨基甲酸糖在金表面自组装,我们成功构筑了展示糖分子的表面,并且由于DTC结构的特殊性质,该自组装膜具有较好的稳定性。

表1 X射线光电子能谱测定的糖基二硫代氨基甲酸盐自组装膜的元素摩尔分数(x)Table 1 Elemental molar fraction(x)of glycol-DTC SAM determined by XPS
3.3 糖基化功能芯片生物活性检测
凝集素是一类能够识别糖分子的蛋白质,不同凝集素可以特异性识别相应的糖,因此可以通过凝集素与糖的相互作用评价糖基化芯片的生物活性。本文使用 SPR 技术监测凝集素蛋白在 glycol-DTC SAM 上的吸附/解离行为对其生物活性进行了评价,如图5所示。未通入蛋白时,SPR信号平稳,形成基线;通入 Con A 后,Con A 与表面葡萄糖发生特异性结合,SPR信号上升,形成吸附曲线;通入 HEPES 缓冲液,部分 Con A 发生解离,SPR 信号降低,形成解离曲线;通入 8 mol·L-1尿素溶液洗脱再生,高浓度尿素溶液折光率使曲线呈现急剧上升,形成洗脱曲线;再通入HEPES缓冲液,由于表面吸附的蛋白被尿素洗脱,曲线回归基线。而在通入BSA和PNA时,SPR信号未发生明显变化,表明蛋白吸附量很低,这是由于糖具有多羟基结构,在表面固定后,形成了一层水合层,具有良好的抗蛋白非特异性吸附性能。该结果表明通过自组装制备的糖基表面在蛋白质水平具有糖的生物活性,并且该表面具备一定的抗非特异性蛋白吸附的功能。
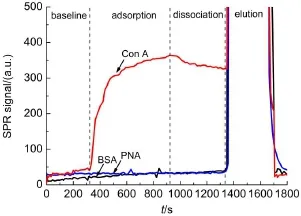
图5 蛋白在葡萄糖二硫代氨基甲酸盐自组装膜上吸附/解离的典型SPR曲线Fig.5 Typical surface plasmon resonance(SPR)image of protein adsorption/dissociation behavior on glucose-DTC self-assembled monolayer(SAM)

图6 凝集素蛋白在不同糖基表面的吸附情况Fig.6 Adsorption behavior of lectins on different carbohydrates surfaces
本文使用不同的糖制备糖基功能芯片来验证该 方 法 的 广 谱 性 , 并 分 别 通 入 Con A、 WGA、PNA、UEA I检测凝集素蛋白在糖基功能芯片上的吸附情况,通过吸附曲线终点减去基线计算蛋白吸附量,实验结果如图6所示。结果表明,葡萄糖、N-乙酰葡萄糖胺、乳糖、阿拉伯糖分别能与凝 集 素 Con A、 WGA、 PNA、UEA I分 别 发 生 结合,与已有报道22相符。WGA 与葡萄糖,ConA 与N-乙酰葡萄糖胺之间的结合是由于葡萄糖与 N-乙酰葡萄糖胺化学结构的相似性造成的23,24。阿拉伯糖与 Con A,WGA 的结合未见文献报道,对于该结果,我们推测可能是阿拉伯糖的结构在修饰并在 金 片 表 面 完 成 自 组 装 后 , 其 构 型 与 Con A 和WGA的结合位点部分吻合,因此会发生结合。
3.4 混合自组装调控糖基表面生物活性
混合自组装是控制表面配基密度的有效方法。当金衬底传感元件浸入多种自组装分子的混合溶液时,溶液中各组分均可以在金表面自组装,形成的自组装膜上某一组分的表面密度随溶液中该组分摩尔分数升高而升高,从而达到调控自组装膜表面配基密度的目的25。本文合成了同样具有DTC结构,但不与凝集素发生特异性结合的肌氨酸基二硫代氨基甲酸盐,将两种DTC化合物以不同摩尔比例制备混合溶液,用于制备含糖基的混合自组装膜。
为了检测表面糖基密度对生物活性的影响,本文首先采用ELLA评价了上述一系列混合自组装膜的生物活性26,结果如图 7 所示。图 7(a)展示了BSA在不同摩尔比例的混合自组装膜吸附的结果,可以发现,随着自组装溶液 glucose-DTC 摩尔分数升高,BSA蛋白吸附量降低。这是由于糖具有多个羟基,能够与水分子通过氢键形成一层致密的水合层,从而达到抗蛋白的非特异性吸附的作用27,28;而肌氨酸结构中仅存在一个羧基,水合层相对稀疏,因此抗蛋白非特异性吸附的性能相对较差。为排除非特异性吸附的影响,在使用Con A 检测其生物活性前,先用 0.1 mg·mL-1BSA进行封闭,Con A 吸附结果如图 7(b)所示。随着自组装溶液 glucose-DTC 摩尔分数的增加,Con A 的吸附量增大,也表明表面葡萄糖密度的增加。我们认为通过混合自组装的方法,可以实现对表面糖基密度的控制。
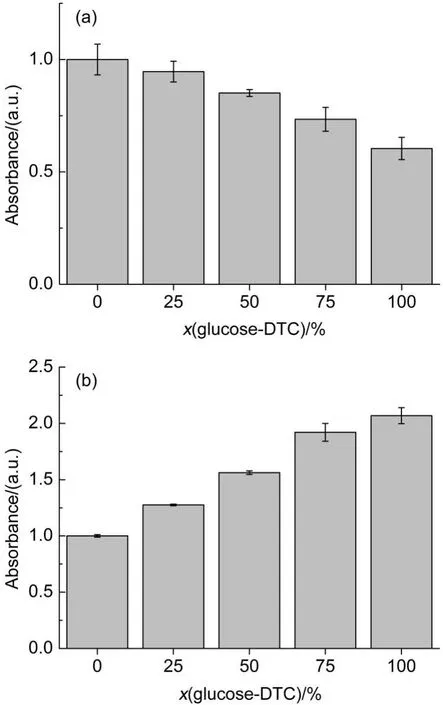
图7 BSA(a)和 ConA(b)在含葡萄糖混合自组装膜表面上的吸附情况Fig.7 Adsorption of BSA(a)and ConA(b)on mixed SAMs presenting glucose determined by ELLA

图8 ConA在含葡萄糖的混合自组装表面上的解离平衡常数(Kd)Fig.8 Dissociation constant(Kd)of Con A adsorption on mixed SAMs presenting glucose
3.5 糖基表面密度对蛋白吸附的影响
凝集素蛋白与糖分子之间的相互作用存在多价态现象,多价态结合能够增强糖与蛋白之间的相互作用29。本文通过调节自组装溶液中葡萄糖二硫 代 氨 基 甲 酸 盐 的 摩 尔 分 数 (1% , 2% , 5% ,100%)制备了一系列含有葡萄糖的混合自组装膜,并采用SPR技术检测不同浓度ConA蛋白在各个自组装膜上的吸附情况,使用 Langmuir等温吸附方程(1)进行拟合,计算出 Con A 蛋白在糖基密度不同的自组装表面上的解离平衡常数30。

式中,Req和 Ceq分别为在平衡 吸附时的 SPR 响应值和凝集素浓度;Rmax为最大响应值,Kd为平衡解离常数。
如图 8 所示,当自组装溶液 glucose-DTC 摩尔分数为 100%时,Con A 与葡萄糖之间为多价态结合 , 结 合 强 度 较 高 , 其 解 离 平 衡 常 数 为 (1.17 ± 0.18)μmol·L-1,与已有报道相符31。当自组装溶液glucose-DTC 摩尔分数降为 2%时,Con A 的解离平衡常数为(1.38 ± 0.12)μmol·L-1,与 glucose-DTC 摩尔分数为100%制备的自组装膜表面相近,即Con A仍处于多价态结合状态。该结果表明了自组装表面的配基密度高,表明了二硫代氨基甲酸盐化合物自组装的高效性。当自组装溶液 glucose-DTC 摩尔分数降至 1%时,Con A 解离平衡常数为(39.1 ± 1.8) μmol·L-1,是高 密 度 糖基表面的 35 倍 ,表明Con A 与表面葡萄糖的结合强度发生了显著降低 ,推测是由于蛋白与表面糖分子之间出现了单价态结合现象。这是由于Con A由四个亚基组成,每个亚基上有一个葡萄糖结合位点,在糖基表面上由于位阻的关系通常会有两个亚基发生结合。Con A相邻亚基上的结合位点间距离约为 6 nm,当表面糖基密度较高时,相邻糖分子之间的距离小于或等于 6 nm,此时 Con A 蛋白中有两个亚基与葡萄糖发生结合,呈现多价态结合,结合强度较高,如图8 中 glucose-DTC摩尔分数为 2%-100%形成的糖基表面所示。随着表面糖基密度降低,当相邻糖分子之间的距离大于 6 nm 时,Con A 蛋白一个亚基发生结合之后,相邻亚基无法发生结合,呈现单价态结合,结合强度降低,如图 8 中 glucose-DTC摩尔分数为1%形成的糖基表面所示32。
多价态现象对于蛋白吸附的动力学也有着重要影响,蛋白分子的一个亚基与表面配基的结合能够促进相邻亚基与表面其余配基的结合,从而提高蛋白吸附速率常数(ka),并降低其解离速率常数(kd)。本文采用 SPR 技术对 Con A 在上述一系列混合自组装表面上吸附和解离过程进行监测,并通过吸附动力学公式(2)与解离平衡方程(3)进行计算,结果如图9所示。

式中,R(t)和 Ceq分别为在平衡吸附时的 SPR 响应值和凝集素浓度;Rmax为最大吸附量,Kd为平衡解离常数,ka为吸附速率常数,kd为解离速率常数。
由图9可知,随着表面糖基密度的上升,Con A的吸附速率常数逐渐降低,这是由于表面结合位点增大了降低了蛋白结合的概率。当自组装溶液中 glucose-DTC 摩尔分数由 1%增 至 2%时,Con A解离速率常数急剧降低。这是由于蛋白在糖基密度低的自组装膜表面上呈现单价态结合,结合强度低;自组装溶液中 glucose-DTC 摩尔分数增加到2%时,蛋白呈现多价态吸附,结合强度增大造成其解离速率常数降低。自组装溶液中 glucose-DTC摩尔分数由2%上升至100%,解离速率常数随吸附速率常数增大,在该密度范围内解离平衡常数基本维持恒定。该结果表明通过调控表面糖基密度可以实现蛋白多价态结合的调控,从而达到蛋白结合动力学调控的目的。相较于通过链霉亲和素-生物素体系调控蛋白质与糖结合价态的方法32,本文提供的方法不需要通过复杂的反应合成含有生物素分子的糖衍生物,而且可以通过混合自组装一步完成糖基密度控制,快捷方便,经济绿色,是一种研究糖-蛋白相互作用的有效方法。

图9 Con A在含葡萄糖的混合自组装表面上的吸附速率常数(ka)与解离速率常数(kd)Fig.9 Adsorption rate constant(ka)and dissociation rate constant(kd)of Con A adsorption on mixed SAMs presenting glucose
4 结论
本文发展了一种制备糖基自组装分子的合成方法,成功制备了一系列糖的二硫代氨基甲酸盐衍生物,并对其进行了表征;利用二硫代氨基甲酸盐化合物在贵金属表面的自组装,制备出相应展示糖分子的生物传感功能表面。研究中运用SPR技术,依据糖与凝集素的特异性结合,证实了该糖基化自组装膜在蛋白质水平具备良好的糖生物活性。本文还通过混合自组装技术制备出一系列表面糖基密度不同的自组装表面,并使用ELLA和SPR技术研究了自组装密度与糖基表面生物活性的关系。实验研究表明,自组装溶液中糖基二硫代氨基甲酸盐摩尔分数越高,混合自组装膜表面的糖基密度越高,对相应的凝集素蛋白的吸附越多,且对非特异性蛋白吸附有较好的抗垢性能。通过上述的混合自组装技术,我们观测到蛋白结合的单价态和多价态现象,当自组装溶液中 glycol-DTC摩尔分数低于1%时,蛋白在糖基自组装表面上呈现单价态吸附,结合强度低;自组装溶液中 glycol-DTC摩尔分数大于2%时,蛋白在糖基自组装表面上呈现多价态吸附,结合强度高。本文所发展的糖基自组装功能分子合成方法快速便捷、适用范围广,制备的糖基化自组装膜稳定性高且在蛋白水平有较好的糖生物活性。通过混合自组装技术控制表面糖基密度,实现了蛋白不同价态的结合。上述方法可以用于深入阐明基于糖-蛋白相互作用的病原体感染和细胞黏附等多种生物过程。
(1)Lorenz,B.;Alvarez de Cienfuegos,L.;Oelkers,M.;Kriemen, E.;Brand,C.;Stephan,M.;Sunnick,E.;Yuksel,D.;Kalsani,V.; Kumar,K.;Werz,D.B.;Janshoff,A.J.Am.Chem.Soc.2012,134(7),3326.doi:10.1021/ja210304j
(2)He,X.P.;Zeng,Y.L.;Zang,Y.;Li,J.;Field,R.A.;Chen,G.R.Carbohydr.Res.2016,429,1.doi:10.1016/j.carres.2016.03.022
(3)Ghosh,H.P.Rev.Infect.Dis.1980,2(1),26.
(4)Park,S.;Gildersleeve,J.C.;Blixt,O.;Shin,I.Chem.Soc.Rev.2013,42(10),4310.doi:10.1039/c2cs35401b
(5)Ge,C.H.Chinese Journal of Biochemistry and Molecular Biology2009,25(12),1083.[葛长辉 .中国生物化学与分子生物学报,2009,25(12),1083.]doi:10.13865/j.cnki. cjbmb.2009.12.003
(6)Victorino,R.M.;Hodgson,H.J.Acta Med.Port.1983,4(11), 465.
(7)Bernard,N.J.Nat.Rev.Rheumatol.2013,9(12),697. doi:10.1038/nrrheum.2013.162
(8)Smith,E.A.;Thomas,W.D.;Kiessling,L.L.;Corn,R.M.J.Am.Chem.Soc.2003,125(20),6140.doi:10.1021/ja034165u
(9)Cheng,F.;Shang,J.;Ratner,D.M.Bioconjug.Chem.2011,22(1),50.doi:10.1021/bc1003372
(10)Mahon,E.;Mouline,Z.;Silion,M.;Gilles,A.;Pinteala,M.; Barboiu,M.Chem.Commun.2013,49(29),3004.doi:10.1039/ c3cc41074a
(11)Liu,W.;Chen,Y.Chem.J.Chin.Univ.2008,29(9),1744. [刘 巍,陈 义 .高等学校化学学报,2008,29(9),1744.]
(12)Vericat,C.;Vela,M.E.;Benitez,G.;Carro,P.;Salvarezza,R.C.Chem.Soc.Rev.2010,39(5),1805.doi:10.1039/b907301a
(13)Baradel,N.;Fort,S.;Halila,S.;Badi,N.;Lutz,J.F.Angew Chem.Int.Ed.2013,52(8),2335.doi:10.1002/anie.201209052
(14)Zhao,Y.;Perez-Segarra,W.;Shi,Q.;Wei,A.J.Am.Chem.Soc.2005,127(20),7328.doi:10.1021/ja050432f
(15)Zhu,H.;Coleman,D.M.;Dehen,C.J.;Geisler,I.M.; Zemlyanov,D.;Chmielewski,J.;Simpson,G.J.;Wei,A.Langmuir2008,24(16),8660.doi:10.1021/la801254b
(16)Morf,P.;Ballav,N.;Petero,M.;Wrochem,F.;Wessels,J.M.; Jung,T.A.J.Phys.Chem.Lett.2010,1(5),813.doi:10.1021/ jz900435w
(17)Choi,S.R.;Seo,J.S.;Bohaty,R.F.H.;Poulter,C.D.Bioconjugate Chem.2014,25(2),269.doi:10.1021/bc400413d
(18)Almeida,I.;Cascalheira,A.C.;Viana,A.S.Electrochim.Acta2010,55,8686.doi:10.1016/j.electacta.2010.07.084
(19)Yin,H.D.;Wang,Y.;Zhang,R.F.;Ma,C.L.Chem.Chin.Univ.2000,21(8),1231.[尹汉东,王 勇,张如芬,马春林.高等学校化学学报,2000,21(8),1231.]
(20)Feng,S.Chelating Properties for Heavy Metals of Modified Corn Starch.M.S.Dissertation,Tongji University,Shanghai, 2006.[封 盛.DTC改性淀粉对重金属捕集性能的研究[D].上海:同济大学,2006.]
(21)Morf,P.;Raimondi,F.;Nothofer,H.G.;Schnyder,B.;Yasuda, A.;Wessels,J.M.;Jung,T.A.Langmuir2006,22(2),658. doi:10.1021/la052952u
(22)Hirabayashi,J.;Yamada,M.;Kuno,A.;Tateno,H.Chem.Soc. Rev.2013,42(10),4443.doi:10.1039/c3cs35419a
(23)Li,X.B.;Tushima,Y.;Morimoto,M.;Saimoto,H.;Okamoto, Y.;Minami,S.;Shigemasa,Y.Polym.Advan.Technol.2000,11(4),176.
(24)Liu,J.M.;Wang,H.X.;Zhang,L.H.;Zheng,Z.Y.;Lin,S.Q.; Lin,L.P.;Wang,X.X.;Lin,C.Q.;Liu,J.Q.;Huang,Q.T.Anal.Biochem.2010,404(2),223.doi:10.1016/j. ab.2010.05.018
(25)Wirth,M.J.;Fairbank,R.W.;Fatunmbi,H.O.Science1997,275(5296),44.doi:10.1126/science.275.5296.44
(26)McCoy,J.P.,Jr.;Varani,J.;Goldstein,I.J.Exp.Cell Res.1984,151(1),96.doi:10.1016/0014-4827(84)90359-8
(27)Blaszykowski,C.;Sheikh,S.;Thompson,M.Chem.Soc.Rev.2012,41(17),5599.doi:10.1039/c2cs35170f
(28)Dai,Z.W.;Wan,L.C.;Xu,Z.K.J.Membrane Sci.2008,325 (1),479.doi:10.1016/j.memsci.2008.08.013
(29)Thomas,G.B.;Rader,L.H.;Park,J.;Abezgauz,L.;Danino,D.; DeShong,P.;English,D.S.J.Am.Chem.Soc.2009,131(15), 5471.doi:10.1021/ja8076439
(30)Cheng,F.;Li,M.Y.;Wang,H.Q.;Lin,D.Q.;Qu,J.P.Langmuir2015,31(11),3422.doi:10.1021/la5044987
(31)Heeboll-Nielsen,A.;Dalkiaer,M.;Hubbuch,J.J.;Thomas,O. R.Biotechnol.Bioeng.2004,87(3),311.doi:10.1002/bit.20116
(32)Mori,T.;Toyoda,M.;Ohtsuka,T.;Okahata,Y.Anal.Biochem.2009,395(2),211.doi:10.1016/j.ab.2009.08.029
Preparation and Characterization of Dithiocarbamate Based Carbohydrate Chips
CHENG Fang1,2,*WANG Han-Qi1,2XU Kuang1,2HE Wei3
(1State Key Laboratory of Fine Chemicals,Dalian University of Technology,Dalian 116023,Liaoning Province,P.R.China;2School of Pharmaceutical Science and Technology,Dalian University of Technology,Dalian 116023,Liaoning Province,P.R.China;3School of Chemical Engineering,Dalian University of Technology,Dalian 116023,Liaoning Province,P.R.China)
Carbohydrates chips are powerful tools for quantitatively studying protein-carbohydrate interactions. Typically,carbohydrate chips are prepared using the self-assembly of carbohydrate thiol/disulfide,which always requires multiple hydroxyl group protection/deprotection steps resulting low conversion in the preparation.In this paper,a kind of carbohydrate derivatives containing dithiocarbamate(DTC)group was synthesized through a two-step reaction to prepare self-assembled monolayers presenting carbohydrate(glycol-DTC SAMs).The glycol-DTC SAMs was characterized using X-ray photoelectron spectroscopy(XPS)and the protein binding activity was quantitatively analysized using surface plasma resonance(SPR)and enzyme linked lectin assay (ELLA).By mixed self-assembly of carbohydrate dithiocarbamate and sarcosine dithiocarbamate,Glycol-DTC SAMs with different glucose density were prepared.The protein binding kinetics was monitored in real time and the thermodynamics was calculated.Interestingly,a 1 ∶1 binding of concanavalin A(Con A)was obtained on the SAMs prepared in solution containing 1%glucose-DTC,as the dissociation constant(Kd)was calculatedto be(39.10 ± 0.12) μmol·L-1.A 1 ∶2 binding of Con A was obtained on the SAMs prepared in solutions containing > 2%glucose-DTC,as the Kdwas calculated to be(1.17 ± 0.18) μmol·L-1.By simply mixed selfassembly,multivalent binding of Con Acan be realized and separate kinetic parameters can be obtained.Our work would promote the study of protein-carbohydrate interactions and be helpful for revealing the relevant biological progress.
Carbohydrate-protein interaction;Dithiocarbamate;Multivalent adsorption; Thermodynamics;Kinetics;SAM
O642
10.3866/PKU.WHXB201609291
Received:August 12,2016;Revised:September 28,2016;Published online:September 29,2016.
*Corresponding author.Email:ffcheng@dlut.edu.cn;Tel:+86-411-84986336.
The project was supported by the National Natural Science Foundation of China(21104008,21231003),Fundamental Research Funds for the Central Universities,China(DUT16RC(3)019)and Recruitment Program of Global Youth Experts,China.
国家自然科学基金(21104008,21231003),中央高校基本科研业务费(DUT16RC(3)019)和青年千人计划资助项目© Editorial office of Acta Physico-Chimica Sinica
