基于自制水培装置培养的花生芽苗白藜芦醇含量分析
2017-03-10林贤伟刘展眉程杏安蒋旭红叶静敏
林贤伟,刘展眉,程杏安,蒋旭红,吴 波,叶静敏
(仲恺农业工程学院天然产物化学研究所,广东 广州 510225)
植物水培是无土栽培领域的一种重要方法。水培具有突出优点,目前被广泛地应用于科学研究和农业生产实践[1-2]。立体管道水培种植装置是利用室内阳台空间进行无土栽培植物的一种新型种植容器,具有制作工艺简单、成本低等特点[3],可以用来大量培养植物幼苗。花生种子发芽后得到花生芽,又称长寿芽,可以作为芽菜食用[4]。芽菜是我国人民喜食的一种传统蔬菜,与其他蔬菜相比具有营养丰富等鲜明特点。芽菜中还含有较多的维生素B1、B2。芽菜中矿质元素,特别是磷含量也较丰富,而且种子中丰富的磷在萌发及芽苗生长时,以无机态转移到芽苗当中,便于人体吸收、消化。近年来国内外研究者在花生芽菜中发现了一种生物活性很强的天然多酚类物质—白藜芦醇[5]。白藜芦醇作为一种重要活性化合物,存在于花生[6]、葡萄[7]、虎杖、桑树等植物中。白藜芦醇具有高疏水性,外界环境如空气、光、氧化酶等因素均影响其生物活性、分子结构以及在功能性食品中的作用[8]。由于白藜芦醇和白藜芦醇苷具有抗炎症、强效抗氧化、抗自由基、预防动脉硬化、抗癌、心血管保护、抗老化、免役调节、化学敏化和化学预防等多种药物活性,现被广泛用于医药和保健产品中,成为治疗组织癌变和肿瘤最有前途的药物之一[9-10]。目前,人类饮食中白黎芦醇的主要来源为花生、花生酱、葡萄和红酒。白黎芦醇在自然界的含量并不是很丰富,且多分布在果皮、果穗轴等在食用时丢弃的部位,因此通过日常的饮食摄取的白黎芦醇量远远小于其能发挥功能的水平[11]。芽菜作为白藜芦醇补充源,经济价值高、培养条件简单、不受地方影响、生产周期短,富含白藜芦醇及其他营养物质。我国又是花生生产大国,在20世纪90年代花生高产田667 m2产量就已突破750 kg大关[12]。2011年花生种植面积达470万hm2,总产量达1 620万t[13],可见我国花生资源丰富,开展花生芽培养、花生芽白藜芦醇提取及含量检测等技术的相关研究具有重要意义。本研究拟用当年采收、种粒饱满、大小一致、完整无损的花生品种ZK-826种子进行实验,测定花生芽不同培养方式、不同生长天数以及不同组织部位白藜芦醇的含量。同时分析花生芽在自制水培装置培养成苗后,花生苗不同部位白藜芦醇的含量,以期为确定花生芽采收适期提供理论依据。
1 材料与方法
1.1 试验材料
花生品种仲恺花826:为仲恺农业工程学院种子科学与工程研究所培育,2015年2月28日播种于仲恺农业工程学院钟村农场,于播种后120 d获得;φ110 mm硬聚氯乙烯(PVC-U)管、PVC-U-90°φ110/50 mm弯头、不锈钢支架;98%白藜芦醇标准品,购买于杭州瑞树生化有限公司; 无水乙醇(分析纯),购买于天津市大茂化学试剂厂; 甲醇、乙腈(色谱纯),分别购买于天津市科密欧化学试剂有限公司、上海安普科学仪器有限责任公司。
Agilent 1200S 高效液相色谱仪,美国安捷伦科技有限公司;SCIENTZ-ⅡD 超声波细胞粉碎机,宁波新芝生物科技股份有限公司;湘仪L400 离心机,湘南湘仪实验室仪器开发有限公司;DLSB-5L/25低温冷却液循环泵、SHZ-D(Ⅲ)循环水式真空泵、RE-201D旋转蒸发机,巩义市予华仪器有限责任公司;KQ-50DA型数控超声波清洗器,昆山市超声波仪器有限公司;QE-100g高速粉碎机,浙江屹立工贸有限公司。
1.2 试验方法
1.2.1 自制花生水培装置 分割PVC-U管:用锯子切割φ110 mmPVC-U管,截取4段长度为1 m的种植管,在切口处打磨平滑。
钻定植孔:将切割好的PVC-U管,两端分别距端口10 cm,用电钻打定植孔,孔径为5 cm。
支架由立架和斜架组成,种植管固定在斜架上,立架支撑斜架。立架:架体高度110 cm,宽度100 cm,由φ25 mm的不锈钢管组成。
1.2.2 种植花生 选用粒大饱满、色泽新鲜、表皮光滑的花生种子,用30℃的清水浸泡10 h,避光,使种子充分吸水膨胀。每隔2 h换一次清水。播种:播种前将栽培容器清洗消毒干净。温度应控制在18~25℃,保持花生芽体的湿润,每天换一次水。
1.2.3 花生芽中白藜芦醇提取及含量测定 准确称取2.0 g花生芽粉末于100 mL烧杯中,70%乙醇为提取溶剂,料液比为1∶25,浸泡24 h。50℃恒温超声萃取30 min,离心,取上清液,浓缩至干。用甲醇溶解并定容至10 mL,再用HPLC分析检测。单个样品重复3次。
1.2.4 高效液相色谱分析条件 色谱柱:CNW Athena C18-WP,100A,4.6 mm×250 mm,粒度5μm;流动相∶乙腈∶水=30∶70(V/V);流速1.000 mL/min;紫外检测波长VWD=306 nm;柱温:28℃;进样量20μL。
1.2.5 白藜芦醇标准曲线绘制 准确称取白藜芦醇标品0.2000 mg,色谱纯甲醇定容至10 mL,得 20 μg/mL标准液,分别稀释至 2 、4、8、10、16 μg/mL,HPLC检测其峰面积,绘制标准曲线. 测得白藜芦醇甲醇溶液的吸附标准曲线为y= 106.8x- 14.82,R2= 0.999。
2 结果与分析
2.1 仲恺花826花生芽中白藜芦醇含量
2.1.1 仲恺花826花生芽生长情况 选用种粒饱满、完整无损的花生,花生发芽前3 d整体生长速度较慢,根部长度在2~3 cm,茎部未明显长出,发芽4 d后,花生芽茎部快速生长,主根开始长出侧根。发芽5 d后主根开始腐烂,但侧根继续生长。发芽6 d后根部已大部分腐烂,且发芽6 d花生芽尺寸较发芽5 d已没明显变化,所以其最佳培养天数为4~5 d。由表1可知,花生仁含水量很低,仅3.4%。花生芽的含水量随培养天数的递增而增加,水培花生芽含水量明显高于土培花生芽。发芽5 d时,其含水量在64%以上,其中水培花生芽含水量最高达82.2%。
2.1.2 仲恺花826不同发芽天数白藜芦醇含量 由表2可知,随着发芽天数增加,白藜芦醇含量也随之增加,发芽4 d达最大值,水培和土培花生芽分别达41.36、117.6 μg/g,发芽5 d后白藜芦醇含量开始减少,土培花生芽减少幅度较大。从表3可以看出,花生芽不同组织部位中根部白藜芦醇含量最高,从发芽5 d开始花生芽出现烂根导致花生芽白藜芦醇总含量的降低。土培花生芽烂根的情况比较严重,而土培花生芽白藜芦醇含量却又明显高于水培花生芽,其原因主要是土壤中含有较多微生物,而白藜芦醇是一种含有芪类结构的非黄酮类多酚化合物,被认为是一种植物抗毒素,是在植物受到病原性进攻和环境恶化时产生的[14],所以在土培前期,花生芽白藜芦醇的含量远高于水培白藜芦醇含量。另外,微生物会对花生芽根部进行腐蚀,当其培养到6 d时,根部已完全腐烂。再者,由于花生发芽是由自身提供营养物质,到发芽5 d,其营养物质供应不足,也是其烂根的原因之一。
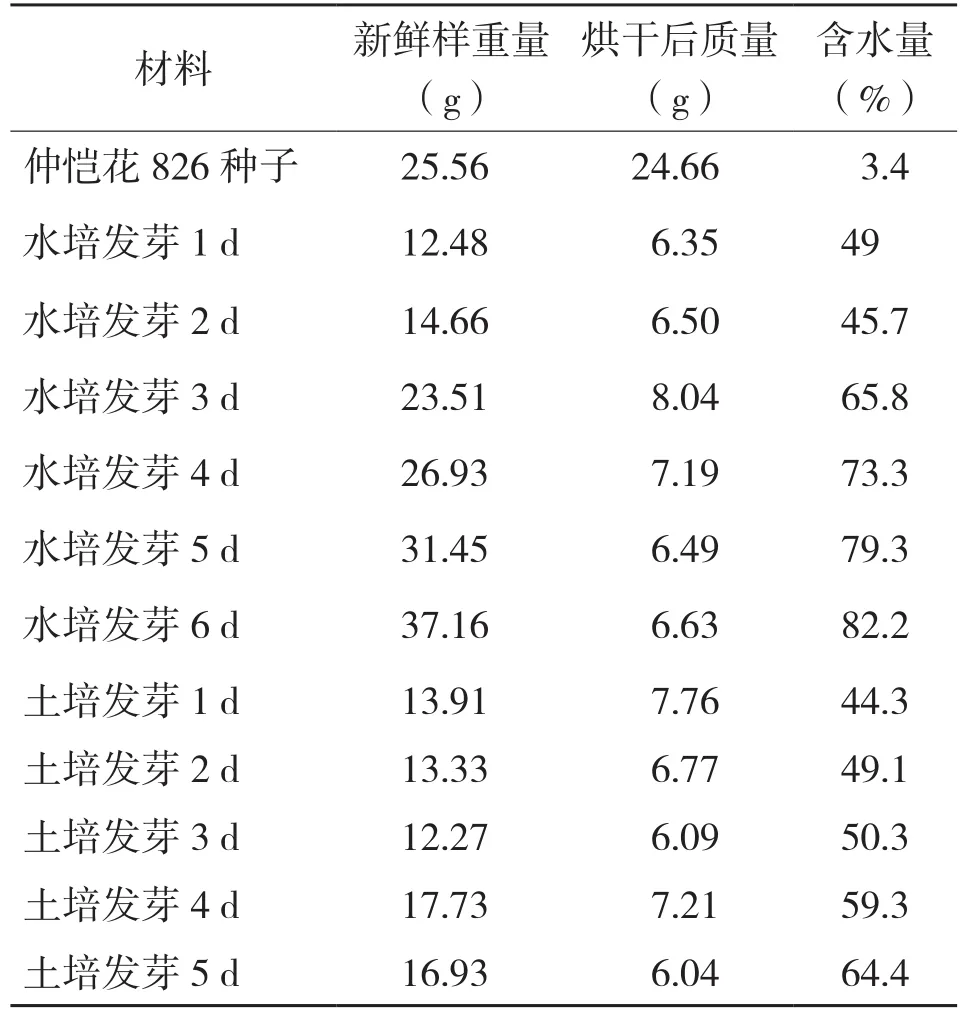
表1 原料烘干前后质量
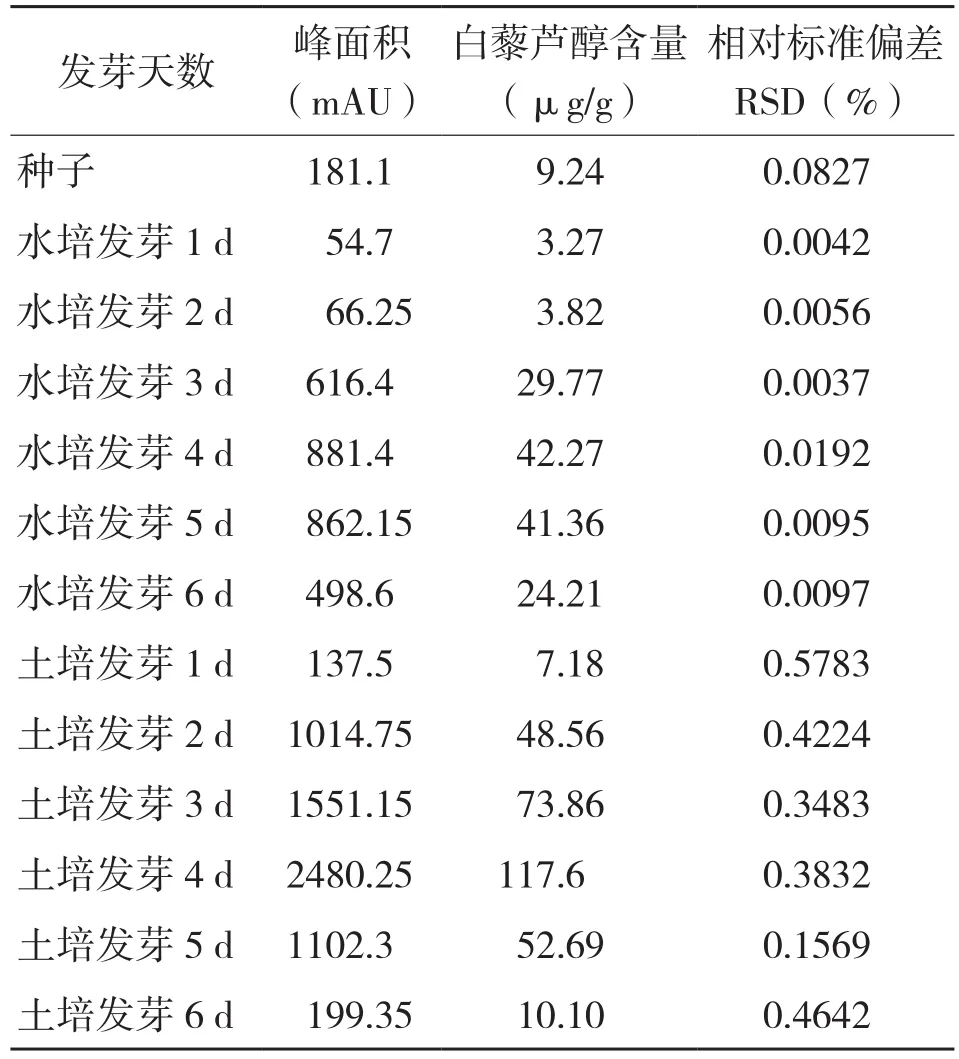
表2 仲恺花826不同发芽天数白藜芦醇含量
2.1.3 仲恺花826水培发芽5 d根、茎、子叶白藜芦醇含量 由图1(封二)可知,发芽5 d的花生芽根系发达,子叶与茎粗壮白嫩,可食用,其鲜嫩爽脆、香甜可口,且白藜芦醇较高。利用HPLC分析其白藜芦醇含量,结果见表3,根部白藜芦醇含量最高,达115.6 μg/g。子叶最低,白藜芦醇含量为22.18 μg/g。
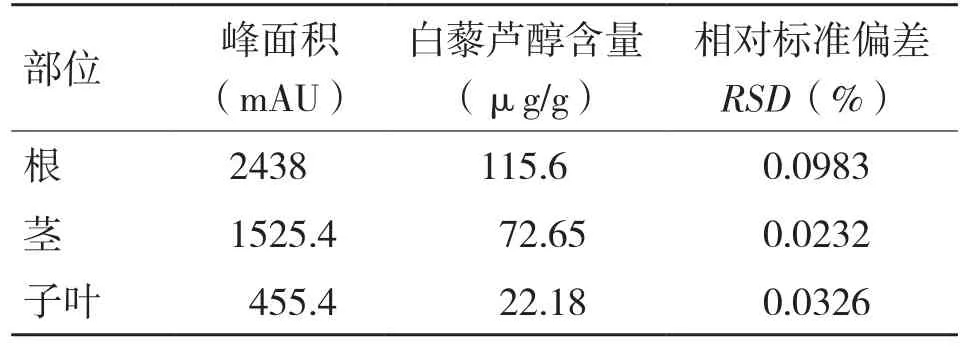
表3 水培发芽5d根、茎、子叶白藜芦醇含量
2.2 自制立体管道水培种植装置对花生芽的进一步培养
自制立体管道水培种植装置(图2,封二),其制作成本为350.0元,制作材料简单,使用操作简单,可种植各种蔬菜及花卉,改变了传统果蔬主要由大田种植的格局,本研究利用其对花生芽进一步培养,使其成长为花生苗。由于花生发芽靠自身提供营养物质,发芽5 d后,其营养物质供应不足,本自制装置在循环水中加入植物培养液,为花生芽生长提供营养。此外,可以利用自制装置对花生苗生长过程分泌的物质进行检测,对其中有价值的物质进行富集。
本试验将发芽4~5 d的花生芽转移到自制立体管道水培种植装置,花生芽发育情况良好(图3,封二),枝叶茂盛,根系发达。待花生苗生长速度到达稳定状态时,将其移出装置,烘干,按根、茎、叶分开,分别提取其中白藜芦醇,利用高效液相色谱测其含量。由表4可知,花生芽根系发达,根部白藜芦醇的含量达143.4 μg/g,远高于茎、叶的含量(分别为50.50、18.70 μg/g)。
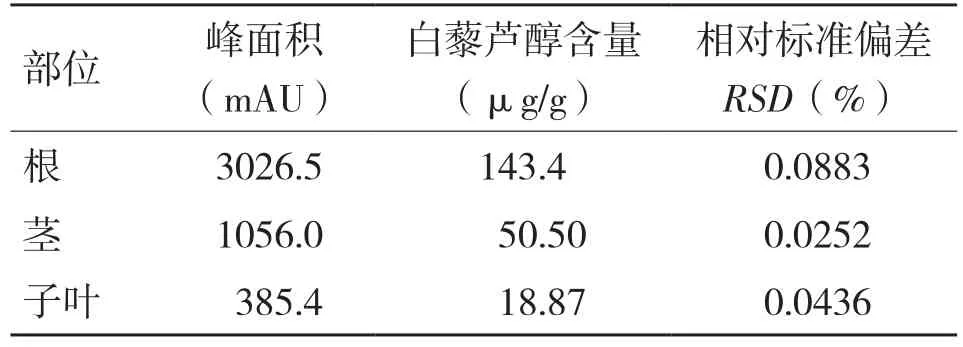
表4 花生苗根、茎、子叶白藜芦醇含量
3 结论与讨论
本研究发现花生种子发芽后白藜芦醇含量明显提高,当发芽5 d时,白藜芦醇含量达到最大值,而且土培花生芽白藜芦醇含量高于水培花生芽。由于白藜芦醇是一种含有芪类结构的非黄酮类多酚化合物,被认为是一种植物抗毒素,是在植物受到病原性进攻和环境恶化时产生的[14]。张俊等[15]研究发现花生根采收后,放置在潮湿环境中,很快就会有霉菌在上面生长,分别检测采收后直接干燥和发霉后干燥的花生根中白藜芦醇的含量,发霉花生根中白藜芦醇的含量要高于原样。花生在发芽过程,其所处环境必有微生物的滋长,其白藜芦醇含量增长是正常情况,且土培过程中,由于土壤环境的复杂性,花生芽分泌更多的白藜芦醇,所以土培花生芽白藜芦醇含量高于水培。花生芽发芽5 d时白藜芦醇量开始减少,其中土培花生芽减少的幅度较大,其原因是花生芽根部白藜芦醇含量较高,发芽5d花生芽开始出现烂根,烂根导致花生芽总白藜芦醇含量的剧减。本研究在花生芽培养方面,种子用30℃清水浸泡10 h,清水没过花生,避光,使种子充分吸水膨胀。每隔2 h换1次清水。这与梁德生等[5]通过单因素试验确定在浸种10 h,浸种温度30℃,发芽温度25℃的条件下培养的花生芽为最佳条件基本相符。浸种吸水是种子萌发的第一步,也是重要的一步,只有让种子充分吸水,才能膨胀软化种皮,增加氧透过率,促进营养物质转化,快速启动萌发的能力与生长的活力[16]。浸种时间太短花生萌发启动不充分,浸种时间太长会因种子的无氧呼吸而造成种子发臭腐烂。另外,于淼[11]通过添加不同的外源物研究其对花生发芽率、芽长及白黎芦醇含量的影响,结果发现不同外源添加物对花生发芽率、芽长及白黎芦醇含量均具有显著差异。其还发现对种子进行超声也能增加其白藜芦醇含量,甚至提高种子的发芽率。本研究是在正常环境下,研究不同发芽天数花生芽中白藜芦醇的含量,可给市场推广花生芽提供依据,下一步需要通过实验找出市购花生发芽白藜芦醇含量最高的品种。
目前有关花生芽不同组织部位白藜芦醇含量分析的研究鲜有报道。本研究分析了仲恺826花生芽、苗各个部位白藜芦醇的含量,发现花生芽、苗根部的白藜芦醇含量远高于茎、子叶,这与前人研究花生中白藜芦醇含量结果基本相符。薛晓丽等[17]采用反相高效液相色谱法(RP-HPLC)检测花生花生根、茎、叶、果壳、红衣、果仁中白藜芦醇的含量,结果发现花生植株中白藜芦醇含量依次为根、茎、叶、果壳、红衣、果仁,其中花生根含量最高为0.844 3 g/ kg。张烜等[18]分析花生不同部位白藜芦醇含量,结果发现花生根、茎、花、果壳、种衣5个部位中均含有白藜芦醇 ,其中花生根中含量最高。另外,杨振等[19]采用三维荧光法直接测定花生芽不同部位白藜芦醇的含量,结果表明花生芽不同部位白藜芦醇的含量有明显不同,以花生芽茎中白藜芦醇的含量最高;其次是花生芽瓣、芽根,芽叶含量最低。吴向阳等[20]采用HPLC法测定花生根、茎、叶中白藜芦醇的含量,发现山东产花生根、茎和叶中白藜芦醇的含量分别为 223.08、1 211.19、429.79 μg/g,也发现花生茎白藜芦醇含量远高于根白藜芦醇含量。这与本研究结论有差异,可能是选用花生品种、种植地域、环境等条件因素不同的原因引起。张磊等[21]的测定结果表明,不同品种花生其白藜芦醇含量不同,且花生各部位含量也有所不同。
通过自制水培种植装置,由其进一步培育花生芽,得到枝叶茂密、根系发达的花生苗。经检测,花生苗白藜芦醇含量高于花生芽中白藜芦醇含量,其根部白藜芦醇也比其茎、叶白藜芦醇含量高。其用途远不止种植植物果蔬,还可以利用循环泵,使装置内的水循环流动,植物分泌物能均匀分散到水中,不会集中停留在根系处,因为植物水培根系分泌物中,某些物质会对植物本身产生自毒作用[22],通过循环作用,降低化感物质的浓度,还能促进根系分泌更多物质。最后通过浓缩富集、检测水培植物在水中的分泌物。另外,本装置可以作为装饰,改进支架后的装置除在阳台种植外,悬挂于靠近阳面卧室见光窗台旁,能为卧室增添生机。配备LED植物生长灯后,可在室内任何空间种植植物,放置于电视、电脑旁可吸收家用电器使用过程中产生的辐射。此装置制作材料简单,使用操作简单、成本低,可种植各种蔬菜及花卉,改变了传统上果蔬只能由大田种植的格局,有利于推广和普及无土栽培技术,也有利于休闲农业朝绿色、无污染、安全、良性循环的方向蓬勃发展。
花生芽发芽5 d时,其白藜芦醇含量最高,土培和水培含量分别为117.6、42.27 μg/g,由于微生物会对花生芽根部进行腐蚀,而且于花生发芽是由自身提供营养物质,到发芽5 d后,其营养物质供应不足,导致其白藜芦醇含量无法再增加。自制水培装置培养的花生苗根系发达,花生苗根部白藜芦醇的含量达143.4 μg/g,远高于茎、叶的含量。装置制备成本为350元,制作材料简单,使用操作简单,可种植各种蔬菜及花卉,改变了传统果蔬主要由大田种植的格局。
[1]The Computer Society of Institute for Electronic Eingineers(IEEEJCS)and The association for Computing Machinery(ACM). Computing Curricula 2011 Computer Sci[R]. 2011:55-66.
[2]陈强,毕晓华,李雪梅,等. 植物水培装置的改进与创新[J]. 实验技术与管理,2012,29(1):66-67.
[3]刘全国. DIY立体管道水培种植装置工艺与应用[J]. 北方园艺,2014(11):47-48.
[4]谭属琼,谢勇武. 超声波辅助酶法优选花生芽中白藜芦醇提取工艺[J]. 贵州师范大学学报(自然版),2016,34(4):68-74.
[5]梁德生,朴美子. 花生芽培养条件优化及果冻产品的开发[J]. 食品工业,2011(1):24-27.
[6]潘月红,钱贵霞. 中国花生生产现状及发展趋势[J]. 中国食物与营养,2014,20(10):18-20.
[7]万书波. 山东花生六十年[M]. 北京:中国农业科学技术出版社,2010.
[8]刘博文,刘晓庚. 浅谈中国花生生产发展优势与策略[J]. 粮食科技与经济,2011,36(1):9-11.
[9]林治乾,闫静. 中国花生出口竞争力分析[J].西北农林科技大学学报:社会科学版,2007,7(4):82-85.
[10]杨伟强,王秀贞,张建成,等. 我国花生加工产业的现状、问题与对策[J]. 山东农业科学,2006,3:105-107.
[11]于淼. 花生发芽过程中白藜芦醇富集技术与机理研究[D]. 沈阳:沈阳农业大学,2016.
[12]田彩云. 中国花生国际竞争力分析[J]. 世界农业,2004 (12):12-15.
[13]陈艳君. 2011年我国花生及花生油市场分析及2012年展望[J]. 粮食与油脂,2012(2):42-44.
[14]董怀民. 白藜芦醇的修饰改造及其抗肿瘤活性的研究[D]. 南昌:南昌大学,2010.
[15]张俊,郜海燕,葛林梅,等. 花生根、茎中白藜芦醇含量影响因素[J]. 农业工程学报,2009,25(1):251-254.
[16]刘晓艳,蔡培钿,白卫东,等. 花生的加工现状及其研究进展[J]. 农产品加工学报,2009(6):115-118.
[17]薛晓丽,张红霞. 花生不同部位白藜芦醇RPHPLC含量分析[J]. 吉林农业科技学院学报,2012,21(3):7-10.
[18]张烜,胡君萍,韩玫,等. HPLC法测定花生不同部位中白藜芦醇的含量[J]. 新疆医科大学学报,2003,26(5):440-441.
[19]杨振,王雅洁,邢蓬蕊,等. 三维荧光法直接测定花生芽不同部位白藜芦醇的含量[J]. 泰山医学院学报,2013,34 (9):674-678.
[20]吴向阳,王彩霞,笪祖林,等. HPLC法测定花生根茎叶中白藜芦醇的含量[J]. 食品科学,2009,30(16):240-242.
[21]张磊,孙奎香,孙庆杰,等. 反相高效液相色谱法测定不同品种花生白藜芦醇含量[J]. 粮食与油脂,2012,25(2):33-34.
[22]林贤伟,谭杰安,刘展眉,等. 含喜树碱植物水培根系化感化合物的分离分析[J]. 中国农学通报,2017,33(23):10-15.
