SOCS3 及相关细胞因子在HIV/TB双重感染者血清中表达水平的研究
2017-03-10赵方刘晓宁程林徐六妹李莎茜蔡侃儒何云王辉刘映霞
赵方 刘晓宁 程林 徐六妹 李莎茜 蔡侃儒 何云 王辉 刘映霞
518112 深圳市第三人民医院
结核感染是艾滋病患者常见的机会性感染和主要死因[1]。调查显示,我国HIV/AIDS患者中合并结核的感染率为14.44 %[2],HIV/TB双重感染严重影响我国艾滋病患者预后和生存质量。了解HIV/TB双重感染的免疫机制,进一步研究出新的早期诊断指标及特异性治疗靶点成为我国当前艾滋病防治工作的当务之急。
SOCS3(Suppressor of cytokine signaling-3)是JAK/STAT信号通路上的负调节因子,能够被多种炎症因子和抗炎因子诱导表达,并抑制多种免疫分子的信号传导,在炎症性疾病、病毒感染、肥胖及肿瘤等疾病的发生发展中发挥重要作用。有临床研究表明,SOCS3的表达水平与结核的严重程度相关[3],我们前期研究也发现HIV/TB双重感染患者在抗病毒治疗后SOCS3的表达显著改变[4],有待于进一步证实。
本研究对HIV感染者、HIV/TB双重感染者及健康对照人群血清中SOCS3及相关细胞因子表达水平进行研究及比较,探求SOCS3在HIV/TB双重感染免疫机制中的作用。
1 对象与方法
1.1研究对象单纯HIV组(50例): 选取2015.07~2016.03期间在我院就诊HIV感染者。入选标准:年龄≥18岁,化学发光法HIV-1抗体阳性并通过蛋白质印迹法确认。HIV/TB双重感染者组(48例)入选标准:上述HIV组入选标准的患者并符合结核诊断标准:痰涂片或痰培养结核分枝杆菌阳性或痰GeneXpert阳性。健康对照组(50例):年龄≥18岁选取同期我院健康体检者,排除近期患有感染性或自身免疫性疾病。本研究内容均获得医院伦理委员会批准和参加者的书面知情同意。

表1 研究对象的基本信息
注:N/A不适用 Note:N/A denotes not applicable
1.2研究方法
1.2.1 CD4+T细胞绝对值测定: 入选病例的50 μl EDTA抗凝血全血放置CD4+T细胞绝对计数管中,再加入20 μl CD4 /CD8 /CD3 检测试剂、50 μl 免洗溶血素,随后在室温避光处放置15 min,用流式仪检测并进行自动分析,计数CD4+T细胞的绝对值。
1.2.2 HIV病毒载量检测: 取200 EDTA抗凝血浆加入smart32半自动核酸提取仪,使用达安基因HIV定量检测试剂盒测定病毒载量,全部操作按照操作说明书进行。检测范围250~1×108拷贝/ml。
1.2.3 细胞因子的检测: 采用酶联免疫吸附法(ELISA) 检测IFN-γ、IL-2、IL-4、IL-6、IL-10、 IL-17,IL-22及SOCS3血清中的浓度,所有试剂盒均购自美国R&D公司。严格按照检测试剂盒说明书操作,测定仪器为Beckman 公司DTX-880 酶标仪。
1.3统计学方法用SPSS17.0统计软件进行数据处理。计量资料采用均数±标准差表示,组间比较采用t检验,多组间均数比较采用方差分析,SOCS3与各细胞因子间采用pearson相关分析。P<0.05被认为差异有统计学意义。
2 结果
2.1调查对象的一般人口学特征所有入组者均未接受过抗HIV治疗,其中单纯HIV感染者50人,HIV/TB双重感染48人,对照组健康者50人。3组在年龄、性别构成上差异无统计学意义(P=0.752,P=0.543)。单纯HIV感染组和HIV/TB双重感染组在病毒载量及CD4+T细胞计数上差异无统计学意义(P=0.365,P=0.093)。(见表1)
2.2两两比较健康对照组、单纯HIV感染组及HIV/TB双重感染组中SOCS3和其他相关细胞因子水平SOCS3和IL-6在HIV/TB双重感染者的水平明显高于健康对照组及单纯HIV感染组(P<0.01),但在健康对照和单纯HIV感染两组间无明显差别(P>0.05,见图1 A、E)。IFN-γ、IL-2在单纯HIV组和HIV/TB双重感染者的水平明显低于健康对照组及(P<0.01,见图1B、C)。 IL-4、IL-10的浓度从对照组、HIV组、HIV/TB双重感染组逐步升高,且各组间差异有统计学意义(P<0.05,见图1D、1F)。对照组健康者IL-17的水平明显高于HIV组和HIV/TB双重感染组,但两个感染组之间却差异无统计学意义(P>0.05,见图1G)。IL-22在HIV组中的水平要低于健康组,同时也低于HIV/TB双重感染组(P<0.01,见图1H)。
2.3SOCS3与其他细胞因子相关性分析由表2各因素相关分析可见SOCS3在HIV/TB组中与其他细胞因子的相关性较好,其中与IFN-γ、IL-4、IL-6、IL-10、IL-22显著相关(P<0.01)。在健康对照组中SOCS3与IFN-γ、IL-17、IL-22显著相关(P<0.01)。而在HIV组中没有发现与SOCS3显著相关的细胞因子。
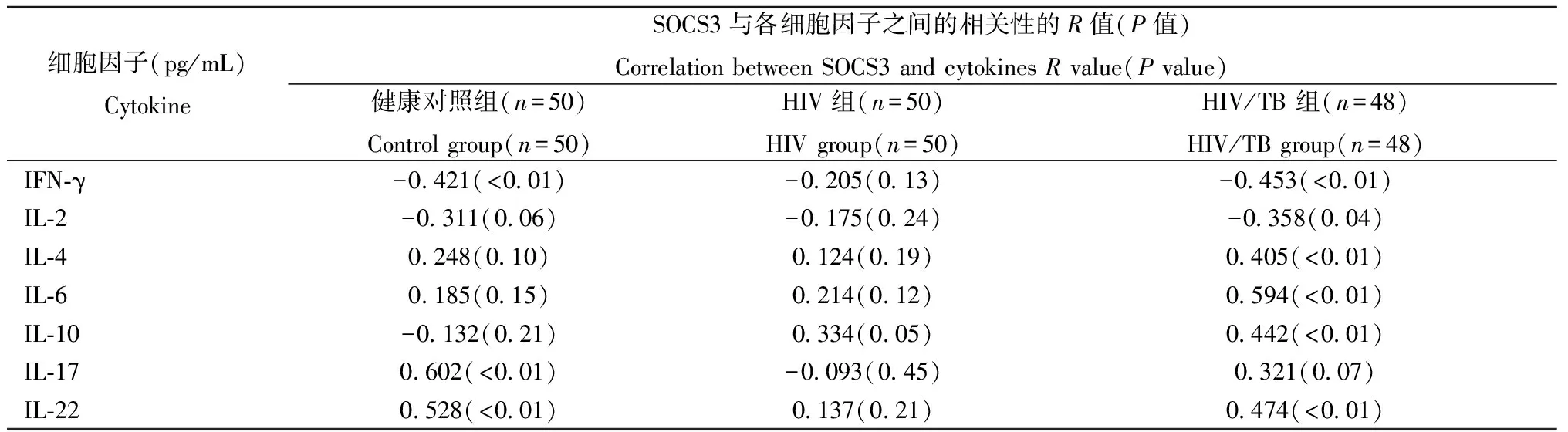
表2 健康对照、单纯HIV感染、 HIV/TB双重感染三组中SOCS3与其他细胞因子的相关性分析
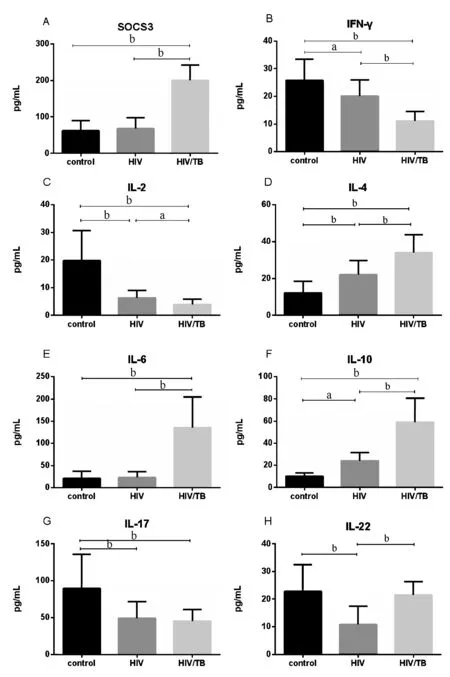
图1 健康对照、单纯HIV感染者、 HIV/TB双重感染者血清细胞因子水平的比较(*P<0.05,**P<0.01)Fig.1 Comparisons of cytokine levels among HIV, HIV/TB patients and healthy controls
3 讨论
结核病和艾滋病二者合并感染能够相互影响、相互促进,导致较高发病率和死亡率。HIV及TB的感染及发病均涉及复杂的细胞因子变化,细胞因子在机体的抗感染的免疫应答中发挥重要作用。较多的研究表明,Th1/Th2平衡紊乱及Th17细胞和调节性T细胞(Treg)相关细胞因子分泌调节失衡是导致艾滋病结核易感产生的主要原因[5,6]。
大多数细胞因子利用酪氨酸激酶信号转导与转录活化因子(JAK-STAT)传导信号,SOCS3作为JAK/STAT信号通路上的负调节因子,可调控IFN-γ、IL-1、IL-2、TNF-α、生长激素等多种细胞因子的信号转导,参与人体免疫反应。我们前期通过对HIV/TB双重感染患者的外周血单核细胞(PBMC)进行转录组分析, 发现HIV/TB双重感染患者在进行高效抗逆转录酶治疗(HAART)后SOCS3基因表达显著改变,提示SOCS3分子有可能是HIV/TB双重感染者体内的重要免疫调节分子[4]。本研究通过对临床样本的进一步调查,发现SOCS3在HIV/TB双重感染者的水平明显高于健康对照组和单纯HIV组,与有关文献报道SOCS在结核病中的表达升高相符。但同时发现SOCS3在健康对照组及单纯HIV组之间并无明显差异,提示SOCS3的升高主要与结核感染相关,受HIV感染的影响较小,对于HIV/TB双重感染的诊断有潜在的价值。
SOCS3作为细胞因子信号转导蛋白的负调节因子,对于Th1/Th2平衡发挥发挥了重要的调节作用。 在一些炎症性疾病中,SOCS3通过干扰TLR和IFN-γ介导的STAT通路,抑制Th1细胞分化[7]。另外,IL-6、IL-4可诱导SOCS3抑制IFN-γ的分泌,但SOCS3却不反馈抑制IL-4,从而促进Th2细胞功能活化[8]。我们的研究中,HIV/TB双重感染患者Th1细胞因子IFN-γ、IL-2水平下降,而Th2细胞因子IL-4及IL-6上升,支持Th1细胞功能向Th2转化,导致Th1/Th2失衡。同时发现,HIV/TB双重感染患者的IFN-γ、IL-2下降程度比单纯HIV感染要更加大,提示Th1/Th2失衡是由HIV感染和结核感染共同导致。
Th17与Treg的平衡在艾滋病和结核病的发病进展中具有重要作用[9-12]。研究也发现SOCS3可以促进Th17分泌IL-17和IL-22[13]。文献报道,在单纯结核感染中,Th17功能增强,血清中IL-17和IL-22表达水平升高[14]。而艾滋病患者细胞免疫功能缺陷,CD4+IL-17+T淋巴细胞显著下降,因而对于抵抗结核的保护性免疫减弱,从而增强了艾滋病患者的结核易感性。我们研究中HIV感染者及HIV/TB双重感染患者IL-17均下降与先前报道相符[15],也进一步解释了为何在HIV/TB双重感染患者中SOCS3升高,而IL-17和IL-22却没有相应升高的原因。
SOCS3是机体免疫信号转导网络中的关键蛋白,与许多细胞因子的调节密切相关,我们实验中的相关性研究也发现SOCS3与IFN-γ、IL-6、IL-17、IL-22等细胞因子的水平显著相关。但由于本研究未加入单纯结核组作为对照,不能够进一步了解SOCS3在单纯结核感染和HIV/TB双重感染之间是否存在差异,有待于今后进一步研究。总之,我们的研究表明,SOCS3在HIV/TB双重感染中显著性增高,与机体免疫反应密切相关。SOCS3有望成为HIV/TB合并感染诊断的分子指标。另外,继续深入研究该分子信号转导通路及其在HIV/TB合并感染的作用,将为以SOCS3作为靶标的结核治疗策略奠定理论基础。
[1] Hull MW, Phillips P, Montaner JS. Changing global epidemiology of pulmonary manifestations of HIV/AIDS[J]. Chest, 2008, 134(6): 1287-1298.doi:10.1378/chest.08-364.
[2] 刘娇, 吕冰, 颜艳. 中国结核分枝杆菌/艾滋病病毒双重感染率分析[J]. 中华流行病学杂志, 2013, 34(1): 85-87.doi:10.3760/cma.j.issn.0254-6450.2013.01.020.
[3] Masood KI, Rottenberg ME, Salahuddin N, et al. Expression of M. tuberculosis-induced suppressor of cytokine signaling (SOCS) 1, SOCS3, FoxP3 and secretion of IL-6 associates with differing clinical severity of tuberculosis[J]. BMC Infect Dis, 2013, 13: 13.doi:10.1186/1471-2334-13-13.
[4] Zhao F, Ma J, Huang L, et al. Comparative transcriptome analysis of PBMC from HIV patients pre- and post-antiretroviral therapy[J]. Meta Gene, 2017, 12: 50-61.doi:10.1016/j.mgene.2017.01.004.
[5] Etna MP, Giacomini E, Severa M, et al. Pro- and anti-inflammatory cytokines in tuberculosis: a two-edged sword in TB pathogenesis[J]. Semin Immunol, 2014, 26(6): 543-551.doi:10.1016/j.smin.2014.09.011.
[6] Almeida AS, Lago PM, Boechat N, et al. Tuberculosis is associated with a down-modulatory lung immune response that impairs Th1-type immunity[J]. J Immunol, 2009, 183(1): 718-731.doi:10.4049/jimmunol.0801212.
[7] Yoshimura A, Naka T, Kubo M. SOCS proteins, cytokine signalling and immune regulation[J]. Nat Rev Immunol, 2007, 7(6): 454-465.doi:10.1038/nri2093.
[8] Ashenafi S, Aderaye G, Bekele A, et al. Progression of clinical tuberculosis is associated with a Th2 immune response signature in combination with elevated levels of SOCS3[J]. Clin Immunol, 2014, 151(2): 84-99.doi:10.1016/j.clim.2014.01.010.
[9] 刘映霞, 杨桂林, 周泱, 等. HIV/TB重叠感染者HAART治疗前后Th17/Treg免疫调节的初步研究[J]. 中华实验和临床病毒学杂志, 2011, 25(5): 348-350.doi:10.3760/cma.j.issn.1003-9279.2011.05.010.
[10] 刘水腾, 杨桂林, 姚红艳, 等. CD4+CD25+调节性T细胞在HIV/AIDS患者中的作用及其与HIV病毒载量的相关性研究[J]. 中华实验和临床病毒学杂志, 2006, 20(4): 364-366.doi:10.3760/cma.j.issn.1003-9279.2011.05.010.
[11] Zhou Y, Wang H, Li SX, et al. Analysis of Tuberculosis-Associated Immune Reconstitution Inlfammatory Syndrome in HIV/TB Co-infected Patients During HAART[J]. Infection International, 2014, 3(3): 122-128.doi:10.1515/ii-2017-0086.
[12] 陈川铁, 赵方, 杨桂林, 等. 艾滋病患者抗反转录病毒治疗后外周血辅助性和调节性T淋巴细胞的变化及意义[J]. 中华传染病杂志, 2015, 33(1): 25-29.doi:10.3760/cma.j.insn.1000-6680.2015.01.007.
[13] Kleinsteuber K, Heesch K, Schattling S, et al. SOCS3 promotes interleukin-17 expression of human T cells[J]. Blood, 2012, 120(22): 4374-4382.doi:10.1182/blood-2011-11-392738.
[14] 梁华, 孙国宏, 余艺萍, 等. 肺结核病人血清中IL-22和IL-17的表达水平及临床意义分析[J]. 实验与检验医学, 2016, (5): 553-556.doi:10.3969/j.issn.1674-1129.2016.05.005.
[15] 彭巧丽, 张明霞, 李桂英, 等. 辅助性T细胞17在人类免疫缺陷病毒合并结核感染致病中的作用[J]. 中华传染病杂志, 2011, 29(10): 600-604.doi:10.3760/cma.j.issn.1000-6680.2011.10.009
