化学链燃烧中赤铁矿氧载体的本征反应动力学研究
2017-03-09苏明泽赵海波杜保周张鹏飞刘志刚
苏明泽, 赵海波, 杜保周, 张鹏飞, 刘志刚
(1. 山东省科学院流动与强化传热重点实验室,山东省科学院能源研究所,山东 济南250014;2. 华中科技大学能源与动力工程学院煤燃烧国家重点实验室, 湖北 武汉 430074)
【能源与动力】
化学链燃烧中赤铁矿氧载体的本征反应动力学研究
苏明泽1, 赵海波2, 杜保周1, 张鹏飞1, 刘志刚1
(1. 山东省科学院流动与强化传热重点实验室,山东省科学院能源研究所,山东 济南250014;2. 华中科技大学能源与动力工程学院煤燃烧国家重点实验室, 湖北 武汉 430074)
本文对一种化学链燃烧所用赤铁矿氧载体进行了本征还原反应动力学研究。氧载体颗粒的比表面积及孔径分布测试显示此种氧载体的孔隙率为0.031,表明此种氧载体结构致密,孔隙结构不发达。热重反应器上进行的程序升温还原实验结果显示氧载体的还原反应分阶段进行,并确定第一还原阶段的温度测试窗口为400~650 °C。在排除了氧载体颗粒内外扩散的影响后,批次流化床实验分析确定反应的本征活化能为138.55 kJ/mol,指前因子为6.8×1013s-1。通过对内外扩散因素的分析,加深了对此种氧载体颗粒与CO的宏观反应特性的认识。本研究结论与前人关于缩核模型、外扩散控制以及较小的表观活化能的研究结论具有良好的相容性。
化学链燃烧; 本征反应动力学; 赤铁矿氧载体
化学链燃烧(chemical looping combustion, CLC)是一种具有CO2内分离特性的新型化石燃料燃烧技术[1-2],是解决当前全球气候变暖问题最有前途的技术之一。化学链燃烧通过将传统燃烧方式中的一步燃烧反应分解为两个独立的氧化还原反应,从而实现了从传统CO2分离技术中的气体组分分离过程转变为较易实现的气固分离过程,这样的燃烧方式有助于降低燃烧及CO2捕集全过程的用损失,提高能源的利用效率[3]。类似于人体循环系统对机体的供氧模式,CLC借助于氧载体(oxygen carrier, OC)的循环实现氧在反应器内的输运。通常化学链燃烧反应器由两个相互串联的流化床反应器——燃料反应器(air reactor, AR)和空气反应器(fuel reactor, FR)组成,燃料与空气并不直接接触,分别进入各自的反应器,从而实现CO2的内分离。其工作原理如图1所示。当高氧势氧载体(MexOy)循环进入到燃料反应器后会被燃料还原成低氧势氧载体(MexOy-1),与此同时燃料被氧化为CO2和H2O,如式1所示。
(2n+m)MexOy+CnH2m→(2n+m)MexOy-1+mH2O+nCO2,
(1)
(2n+m)MexOy-1+(n+m/2)O2→(2n+m)MexOy,
(2)
CnH2m+(n+m/2)O2→mH2O+nCO2。
(3)
燃料反应器的尾气经过简单的冷凝处理能够直接得到高纯度的CO2。反应生成的MexOy-1随着固体在床内的循环传递而进入空气反应器,在空气反应器的强氧化气氛下,MexOy-1在此重新被氧化为MexOy,如式2所示。之后,新生成的MexOy重新进入到燃料反应器从而形成循环。如果将式1与式2相加即可得到传统一步燃烧反应化学方程式3。

图1 化学链燃烧系统示意图Fig.1 Schematic view of the CLC reactor
铁基氧载体具有价廉和环境友好的特点,天然铁矿石氧载体已经受到了研究者们的广泛关注。铁基氧化物的反应机理及反应动力学的相关文献已有报道。EL-Geassy等[4]和ET-Tabirou等[5]很早就通过实验测试了Fe2O3单晶与CO还原反应的活化能,但这些早期的研究主要着眼于冶金行业,并没有化学链燃烧的研究背景,而且仅得到的活化能并不能完全表征反应过程的速率。Wang等[6]在热重分析仪上研究了Fe2O3/Al2O3氧载体的还原特性,重点考虑了惰性氧载体Al2O3对反应速率的影响。Zafar等[7]指出Fe2O3/MgAl2O4氧载体还原反应的前半段即Fe2O3到Fe3O4段表现为非常快速的反应,而后半段即Fe3O4到FeO段的反应速度较慢。最近已经有不少的研究者将目光投入到化学链燃烧氧载体反应动力学的测试上来。Garcia-Labiano等[8-9]系统地考察了人工制备的铜基、铁基和镍基氧载体与CO、H2和CH4的还原反应动力学。Chen等[10]基于微型流化床反应器研究了赤铁矿被CO还原的反应特性并给出了相应的反应动力学参数。
氧载体与气体燃料的反应是一种在非平衡条件下的复杂气固异相反应,因此研究氧载体的反应性时应该综合考虑其本征化学反应因素和传质因素的综合影响。至于哪一方面占主导,在现有文献中意见并不统一,而且各种研究所给出的反应速率常数和反应活化能数值大小更是相差甚大。Monazam等[11]研究了赤铁矿氧载体被甲烷(体积分数为15 %、20%和35%)在不同反应温度(973 ~ 1 098 K)下还原为方铁矿的反应速率,作者使用基于两平行反应的综合反应动力学表达式来拟合实验得到的结果。Abad等[12]使用未反应收缩核模型(SCM)来表征Fe2O3/Al2O3与合成气的反应。Go等[13]指出铁基氧载体与甲烷的还原反应在1 073 ~ 1 173K之间时表现为扩散控制。而Piotrowski等[14-15]认为赤铁矿氧载体还原为方铁矿的过程的活化能为25 ~ 125 kJ/mol,反应级数为1,并且指出二维核生长模型更适用于描述整体的反应过程。Pineau等[16]测试了赤铁矿氧载体与氢气在493~1 003 K温度下的还原过程,确认第一阶段反应Fe2O3到Fe3O4的表观活化能为76 kJ/mol,而第二段反应Fe3O4到Fe的活化能仅有39 kJ/mol。作者还指出在更高温度下反应受到相边界层反应控制。Su等[17]指出铁基氧载体的第一阶段还原反应在900 ℃下的热重分析仪上表现为颗粒外边界层上的气体扩散控制,此时计算反应的表观活化能没有意义,而实际的应用赤铁矿氧载体的化学链燃烧反应器却往往设计为利用还原反应的第一阶段。Chuang等[18]利用流化床反应器对Cu基氧载体的本征还原动力学进行了详细的研究,在工作中反应器的特性和气体内外扩散的影响均已排除,他们认为对于355~500 μm的颗粒,当温度小于600 ℃时的实验结果可以用于分析反应的本征动力学常数,并且指出Cu2O被CO还原的反应的本征活化能为49 kJ/mol。
在铁基氧载体与CO反应的微观机理方面,Dong等[19-24]通过密度泛函理论(DFT)计算开展了一系列的研究工作。Dong等[19]研究了Fe2O3(1102)表面和(0001)表面与CO分子的反应过程,确定了CO的最佳吸附位,结果表明(1102)表面活性更高。Zhang等[20]指出以上反应分为两步,首先一个CO分子活化Fe2O3,形成Fe2O2O结构,之后第二个CO分子与活化的O原子成键生成CO2。Dong等[21]指出,第一还原阶段的反应能垒远小于第二还原阶段,因此实际的化学链燃烧中不宜深度还原Fe2O3。Tan等[22-24]应用DFT计算研究了ZrO2、MgO和Al2O3负载对Fe2O3与CO反应的影响机理,发现负载促进CO吸附在Fe2O3上。负载与Fe2O3之间的电子转移造成Fe2O3键长变长,有利于CO的转化。负载后电子在费米面以下连续分布,化学活性更高。同时,计算得到有无负载下Fe2O3与CO的还原能垒为Fe2O3:2.59 eV,Fe2O3/ Al2O3:0.99 eV,Fe2O3/MgO:0.98 eV,Fe2O3/ ZrO2:0.83 eV。
通过以上分析可以看出,对铁基氧载体与CO本征反应的研究还停留在相当表层的阶段,而且理论计算结果与实验结果之间存在巨大差异。基于此,本文通过实验进行了赤铁矿氧载体与CO反应的本征反应动力学研究。
1 实验方法
实验选用峨口产赤铁矿矿石作为氧载体,样品在实验之前已经过5 kW级双循环流化床300 h连续实验[25-26],可认为其各项物理化学性质均已达到稳定。因在测试前已经过充分的氧化,此氧载体根据X射线荧光光谱分析(XRF, EDAX EAGLE Ⅲ)结果确定其含Fe2O3的质量分数为66%[17]。经过筛分,氧载体颗粒粒径选择为180~200 μm,表观密度为3 472 kg/m3。对此种氧载体的其他表征,如X射线衍射(XRD)、BET比表面积测试等参见实验结果及分析部分。
实验首先在热重分析仪(Netzsch STA409PC)上进行程序升温实验,分别选择体积分数15%和50%的CO作为还原气体,N2作为平衡气,升温速率为15 ℃/min,直到970 ℃。观察分析DTG曲线中失重峰的位置及其变化。
之后,在批次流化床反应器中进行实验,以研究赤铁矿氧载体第一反应阶段的本征反应动力学。实验中选用5 g氧载体和15 g石英砂的混合物作为床料,分别以体积分数5%、7.5%和15%的CO作为还原气,N2为平衡气,总通气速率为常温下1 L/min。实验温度区间为400 ~ 650 °C。图2所示为批次流化床实验系统的示意图。主反应器的直径为33 mm,排出的尾气通过在线气体分析仪(Gasboard-3100P, Cubic Optoelectronics)检测。

图2 批次流化床实验系统示意图Fig.2 Schematic view of the batch fluidized bed experimental rig
2 结果与分析
2.1 样品比表面积及孔径分布测试


图3 样品孔隙尺度分布图Fig.3 Pore size distribution of the hematite oxygen carrier
2.2 程序升温还原实验
样品在热重分析仪上进行程序升温还原实验,其热重分析一次微分曲线(differentialthermalgravityanalysis,DTG)结果见图4。两DTG曲线均表现为双峰分布,显示反应为分步进行。根据还原气体浓度的不同失重峰的位置会出现变化,具体表现为:当在体积分数50%CO气氛下还原时,还原峰位429.8 ℃和711.3 ℃;而当15%CO时,还原峰位533.3 ℃和874.1 ℃。由此可以看出,高还原性气氛下反应有所提前。第一阶段还原反应发生的温度一般小于600 ℃,由此能够解释Su等[17]之前文章中指出的第一还原阶段反应在900 ℃的热重分析仪上表现为颗粒外气膜扩散控制的现象,同时能够说明如果专注探究此氧载体的第一还原阶段的本征反应动力学,不应该在实际CLC运行温度下进行实验,因为此时由于气体扩散的限制导致本征还原动力学不能够被实验结果所表达。基于此,我们在接下来的批次流化床中探究氧载体本征还原动力学的实验中采用温度窗口为400~650 °C。

图4 热重分析仪上程序升温还原DTGFig.4 DTG results for the temperature programmed reduction experiments by TGA
2.3 本征反应动力学测试及分析
2.3.1 转化率与转化速率计算
批次流化床实验中,在线监测反应器出口气体的流量和组分的体积分数。考虑到在实验的氧化阶段并没有观察到含碳气体的存在,因此可以认为在还原过程中并不存在积碳的现象。氧载体的转化率随时间的变化可表示如下:

(4)
其中,Fex表示检测到的尾气体积流量;yCO2表示尾气中CO2的体积分数。

图5 典型工况下批次流化床尾气体积分数监测曲线Fig.5 Typical profile for the volume fraction of the product gas
图5展示了一个典型工况下气体分析仪所监测到的批次流化床尾气气体浓度变化曲线。从图中可以看出,对于此反应,CO是足量的,因此不存在反应被通气速率限制的问题。另一方面,虽然本工况下所用还原气体体积分数为15%,但是,由于还原性气体通过床层时,部分气体被消耗,所以出口CO浓度并不能达到15%。为此我们根据对数平均的原则使用平均值表征床内还原气浓度以便于之后的分析。对数平均浓度表示为:

(5)
其中,CCO,in表示CO的入口浓度,CCO,out表示CO的出口浓度。事实上在我们的分析中出口浓度与入口浓度相差不大,其平均值与入口值亦相差不大,在之后的分析中我们也会直接使用入口值进行比较。
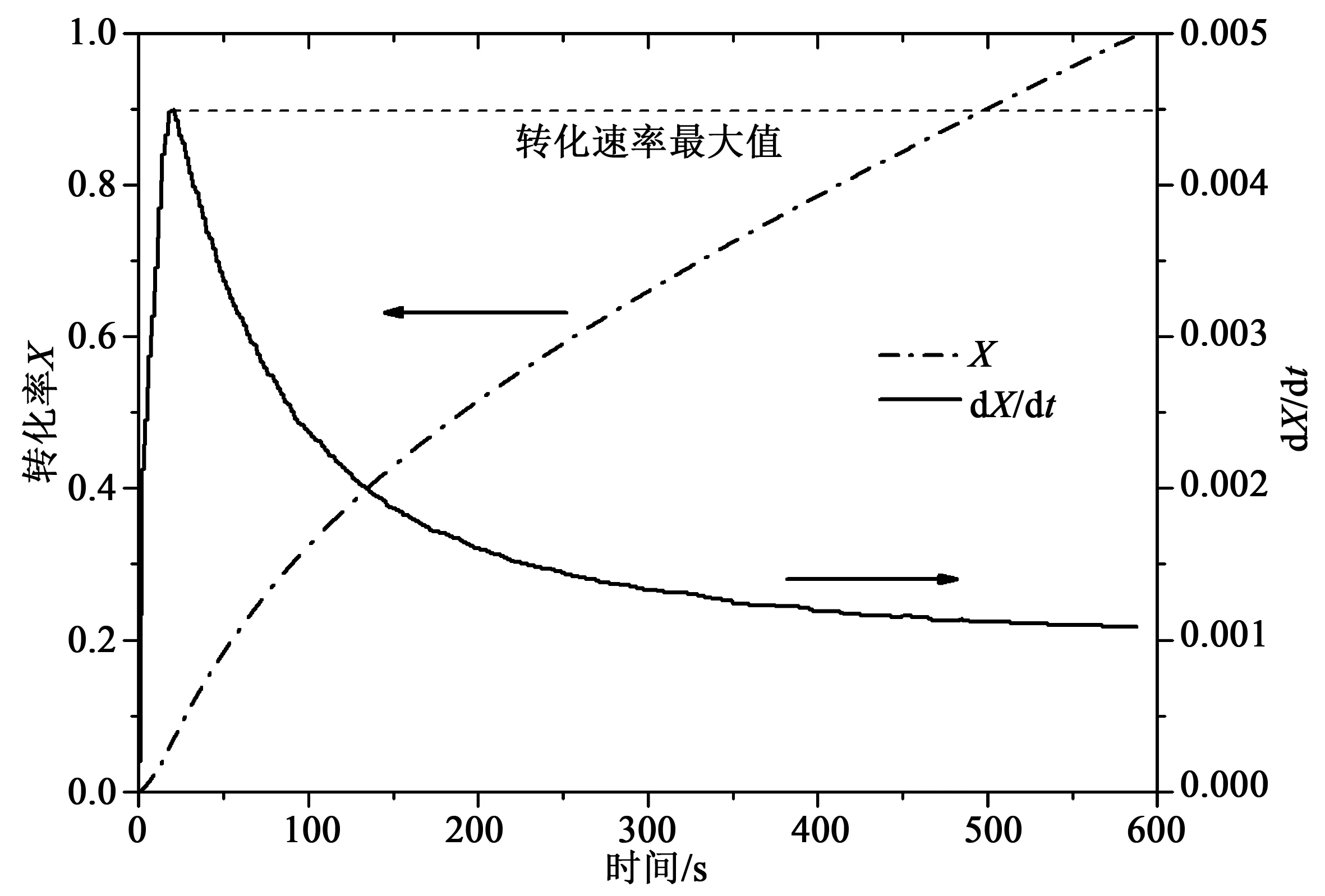
图6 典型工况下计算所得转化率与转化速率曲线Fig.6 Typical profile for the conversion and conversion rate as a function of time
图6所示为典型工况下氧载体的转化率与转化速率随时间的变化关系。可以看出,反应速率在最开始会有一个最大值,从反应刚开始到最大值存在一个上升阶段是由于反应器内气体掺混和颗粒表面气体初始扩散的共同影响所致。我们选择曲线上的最大值表征样品在此反应工况下的反应速率,可以认为此最大值是还原气体完全接触氧载体颗粒外表面后所表现出来的反应速率。对于整个曲线的描述可以根据阿伦尼乌斯形式的表观动力学关系式表示为:

(6)
其中,X表示氧载体的转化率;k′为表观指前因子;E为表观活化能;R表示气体常数;T表示反应温度;YCO表示还原气中CO的体积分数。函数f表示反应速率随反应进行的变化情况,本质上f描述了图6中转化率曲线的形状,根据反应发生的不同尺度,又可分为描述颗粒演化的函数和描述晶粒演化的函数。函数g表示反应速率随气体组分摩尔分数的变化关系,如果所研究的问题是固体表面上的气固反应,那么气体浓度的影响主要是分子尺度的吸附—反应—脱附过程。
2.3.2 外扩散因素分析
为了分析外扩散的影响,我们将实验得到的反应速率与完全受外扩散控制条件下所能达到的最大速率进行了对比,如图7所示。以平均粒径为例,CO的传质速率rcxt(mol/(g·s))可以由下式计算:
rcxt=kgSm(CB-CS) ,
(7)
其中,CB表示颗粒所处环境下CO的浓度;CS表示颗粒外表面上CO所达到的浓度,为了计算得到最大传质速率,在此假定CS为0;Sm表示单位质量(g)样品所具有的外表面积,在此假定本实验中的样品颗粒为标准的球型;kg为外传质系数,可以通过传质关联式的方式进行计算,如下所示:
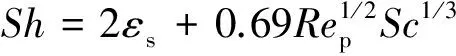
(8)
其中,Sh为舍伍德数,其定义为Sh=kgdp/DG,dp为氧载体颗粒的直径,DG为CO在N2中的分子扩散系数;εs为床层的空隙率;Rep为颗粒的雷诺数,由Rep=Udp/εsv计算,其中U为表观气速,v表示气体的运动粘度;施密特数Sc由Sc=v/DG计算。

图7 外扩散完全控制下氧载体颗粒所能达到的最大反应速率与实验测得的氧载体反应速率的对比Fig.7 Comparison between the maximum rate which could be reached under the gas diffusion control and the experimental measured reaction rate
从图中可以看出,在低温下,实验得到的反应速率与完全受外扩散控制条件下所能达到的最大速率差别较大,并且实际反应速率小于传质限制的最大反应速率。可以认为在此还原气氛下(体积分数15.02%),当温度T<500 ℃时,反应基本不受气体外扩散的影响;而在高温段即CLC实际应用的900 ℃范围内,第一阶段还原反应完全受气体的外扩散控制。
2.3.3 内扩散因素分析及本征动力学拟合
从上节的分析中可以看出,温度较低时外扩散对表观反应过程没有影响。因此在之后的分析中,低温下可以直接忽略外扩散的效应。为了保持分析的一致性,在研究内扩散有效因子时,高温下的实验结果也用同样的方法进行了处理,在此需要指出,分析本征动力学时仅使用了低温下的实验数据。总包反应速率常数koverall表示为:
koverall=ηks,
(9)
其中,ks为本征速率常数,而η为内扩散有效因子,表示有孔扩散阻力的反应速率与无扩散阻力的反应速率的比值,当η→1时表示气固反应速率相对于气体在颗粒内孔隙扩散速率慢的多,以至于可以认为颗粒孔隙中充满了与颗粒外环境相同浓度的还原气体,因此气固反应发生在颗粒可见的所有表面上,可能表现出类似于均相反应的特征,也可能由于内部晶粒结构变化的原因而出现不同的反应机理函数;而当η→0时,表示气固反应速率较快或颗粒孔隙结构不利于气体向固体颗粒孔隙的内部扩散,因此气固反应发生在颗粒外表层并依次向内推进,出现类似于缩核模型的反应特征。
内扩散有效因子η可以从公式9及以下两个公式中循环迭代得出:
η=(1/Φ2)(3Φcoth 3Φ-1) ,
(10)

(11)


表1 内扩散有效因子随温度的变化 (体积分数15 % CO)
从表1中可以看出,在所有的实验组别下,内扩散有效因子数值都很小,说明此种氧载体实际反应发生在颗粒表层,符合缩核模型的描述。另一方面随着温度的提高,内扩散有效因子数值变小,说明反应层变薄,正是这种反应层变薄的效应(气固接触表面积减小)部分地抵消由于温度提高而带来的气固反应速率的提高,导致表观活化能比本征活化能小。以上的计算过程中也会同时得到本征反应速率常数ks。
用阿伦尼乌斯形式的动力学方程表示计算得到的本征反应速率常数:

(12)
考虑用理想固体表面的Langmuir-Hinshelwood机理表示g(YCO),假定反应物和产物的吸附和脱附速率都很快,而表面反应速率较慢,整个过程受到表面反应的控制,忽略CO2吸附的影响,并考虑到实验数据均为常压下得到,g(YCO)可表示为:

(13)
其中,a、b均为常数。将式(13)带入到式(12)中,得到本征动力学最终的表达形式:
ks=k0exp(-Ea/RT)·[YCO/(YCO+b)] ,
(14)

将相同温度下不同还原气浓度的实验数据组合,并对其拟合如图8所示。由此得到方程(14)中常数b=0.040 2。拟合过程中得到的P1(即方程(14)中的k0exp(-Ea/RT))对温度进行阿伦尼乌斯拟合:ln(P1)~1/T,以同时得到本征活化能和指前因子,如图9所示。
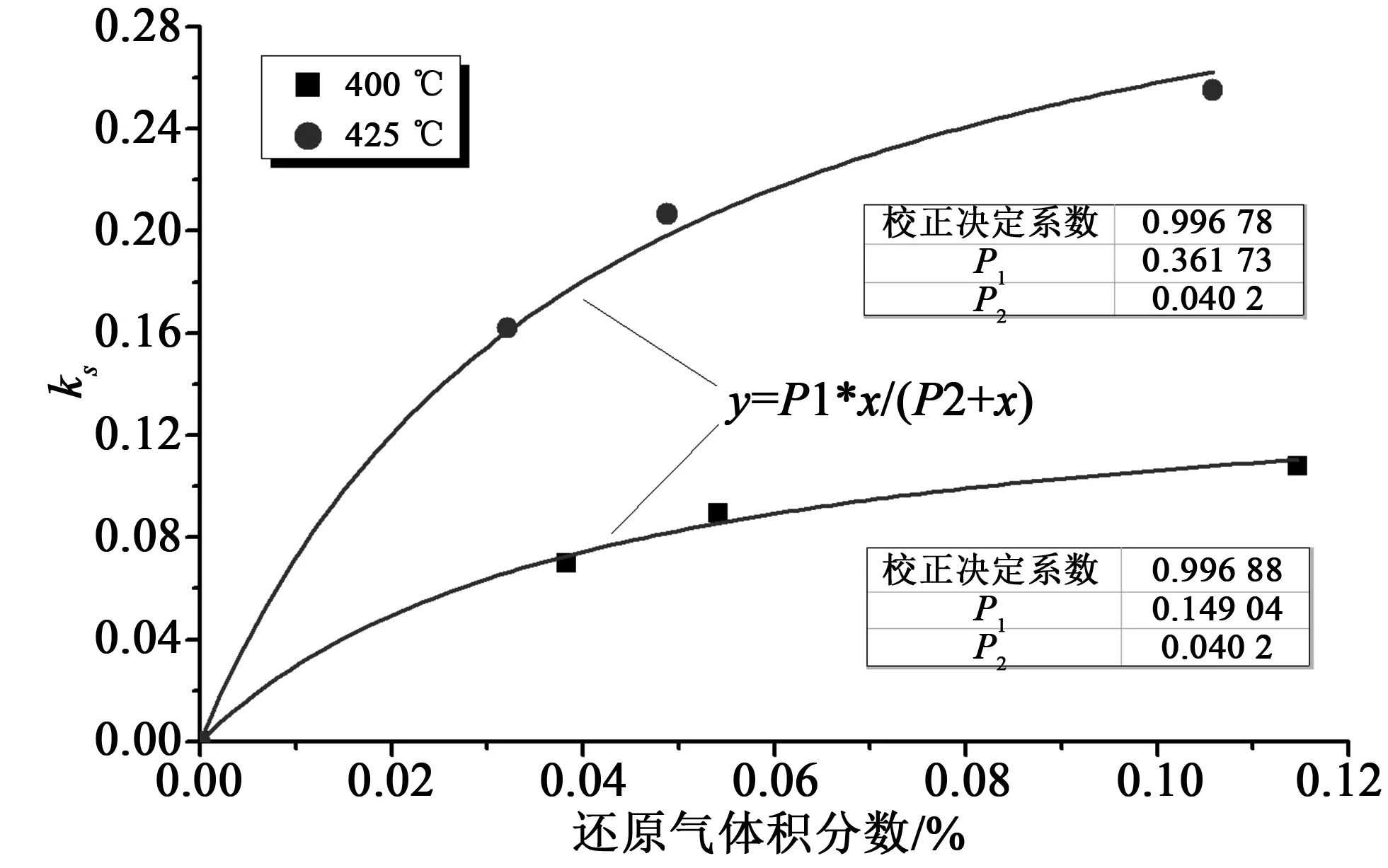
图8 Langmuir-Hinshelwood机理拟合Fig.8 Fitting forLangmuir-Hinshelwood mechanism
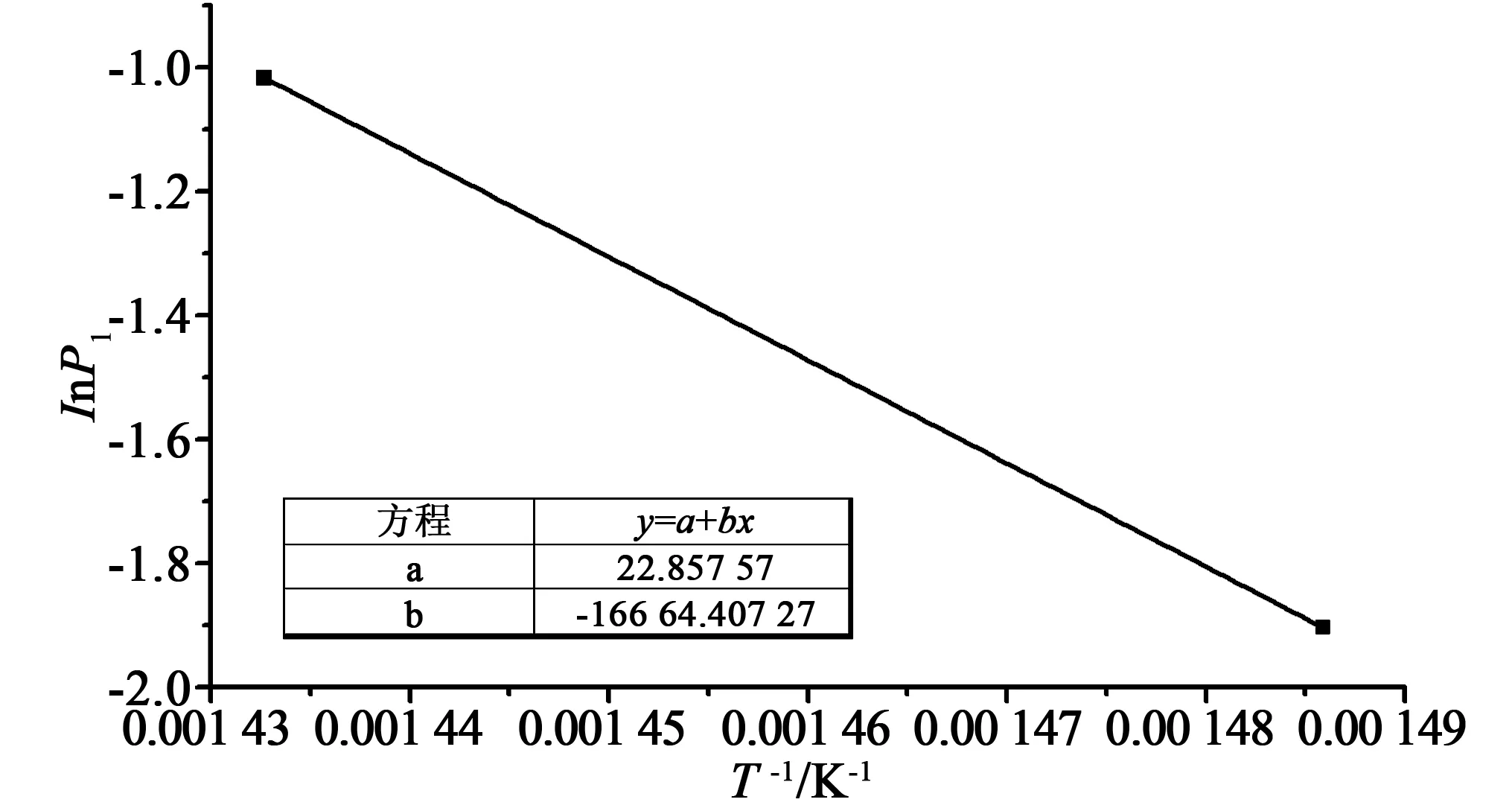
图9 阿伦尼乌斯拟合ln(P1)~1/TFig.9 Arrhenius fitting (ln(P1)~1/T)
由拟合结果可知,本征反应活化能为138.55 kJ/mol,考虑到ks与kv的关系最终得到:
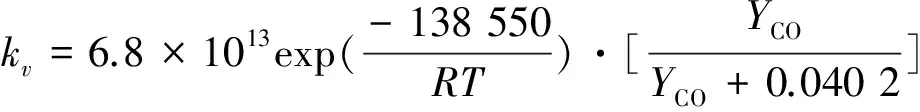
(15)
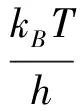
以上阿伦尼乌斯拟合中仅有两个温度点,为了证实分析的可靠性,根据2.3.1节所述,依气体进口浓度为根据,相同气体浓度的实验划分一组,直接对得到的本征反应速率进行阿伦尼乌斯拟合,如图10所示。可以看到活化能结果与以上分析结果基本一致。
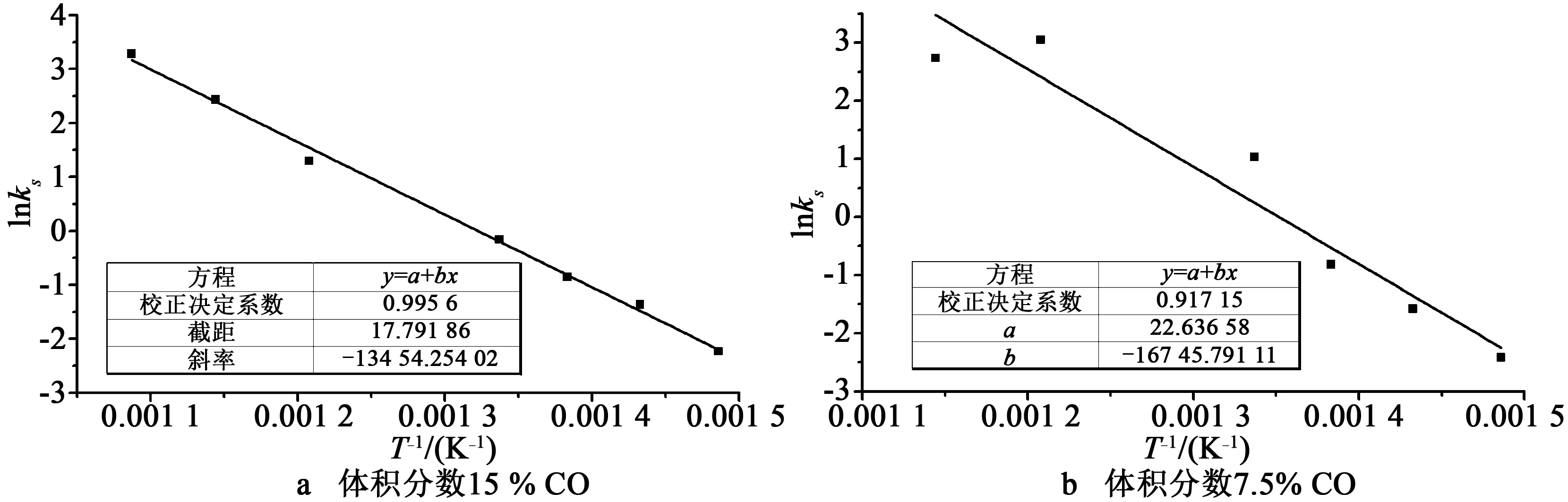
图10 同浓度气氛下直接阿伦尼乌斯拟合ln(P1)~1/TFig.10 Direct Arrhenius fitting for results within the same volume fraction
2.4 样品的表征
对反应前后样品进行了XRD分析,如图11所示。从图中可以看出,样品中SiO2的成分非常明显,这是由于在批次流化床测试实验中样品并非单独放入反应器内,而是与一定量的石英砂混合之后加入到反应器之中,这样可以使样品损失质量相对于总样品质量较小,保证实验的精确,但是由此导致从反应器取出的无论是氧化态还是还原态的样品都很难做到与石英砂完全分离。由图中可以看出石英砂的部分峰强发生了变化,这可能是由于石英砂在整体还原过程中主晶相发生变化导致的。氧化态的样品其主要成分为Fe2O3,而还原态的样品其主要成分为Fe3O4,说明我们实验中所测得的本征动力学参数确实反映了此赤铁矿氧载体的第一还原阶段的特征。

图11 反应前后样品的XRD谱图Fig.11 XRD pattern of the samples within oxidation and reduction state
3 讨论
本工作确认此种赤铁矿氧载体具有较小的孔隙率,在反应过程中表现为还原气体难以渗透进入颗粒内部;反应温度较低时,氧载体第一还原阶段表现为本征反应动力学控制,因而能够通过实验确认反应本征动力学参数;在较高温度条件下,反应趋向于外扩散控制。
本文关于氧载体反应性的论述与前人的相关研究结论是相容的,而且可以对之前的结论进行较为系统的解释。对于收缩核模型的结论,在本文中可以看出,由于天然铁矿石氧载体表面的致密性,导致即使在较低温度下还原气体也很难通过表面的孔隙结构扩散到氧载体的内部从而进行反应,更不用说在高温下颗粒整体处于表面边界层的扩散控制之下,颗粒更加表现为由外到内的分层反应,这样的图景与收缩核模型是一致的。同样,本文通过对外扩散的分析认为,前人关于赤铁矿氧载体在高温下的第一还原阶段表现为外扩散控制是合理的。随着温度的升高,外扩散的效应逐渐显现,导致实测表观活化能减小;另一方面,通过内扩散的分析,我们认为随着颗粒反应温度的升高,颗粒内扩散有效因子减小,意味着气体深入颗粒的深度减小,参与气固反应的实际固体表面积减小,这种表面积的减小体现在对宏观反应速度的影响上,即为在一定程度上抵消了因温度升高而导致本征反应活性增加所带来的宏观反应速度的增加,因此即使在分析中排除了外扩散的影响,也会由于此种原因导致表观活化能实测值较小。
在本文中虽然得到了赤铁矿氧载体与CO反应的本征动力学参数,但是其精细反应机理并不十分清楚,而且分析的过程中有一些假设依赖于对反应机理的理解。虽然已有一些文献从量子化学密度泛函(DFT)计算角度阐述了Fe2O3或Fe2O3/负载与CO反应的机理,但考虑到反应路径的复杂性和DFT计算的固有缺点,文献中的这些机理并不完备也还没有得到确切的验证。本文通过对内外扩散的分析,已经较为清晰地指明了此种赤铁矿氧载体的宏观反应特性,下一步的工作应该综合考虑本征反应、反应作用表面因素、内外传质等因素从而得到更为精确的和适用范围较大的CFD模拟适用的气固反应模型。
[1]FAN L-S, LI F. Chemical looping technology and its fossil energy conversion applications [J]. Industrial & Engineering Chemistry Research, 2010, 49(21): 10200-10211.
[2]ZHAO H B, LIU L M, WANG B W, et al. Sol-gel-derived NiO/NiAl2O4oxygen carriers for chemical-looping combustion by coal char [J]. Enery& Fuel, 2008, 22(2): 898-905.
[3]金红光, 洪慧, 王宝群, 等. 化学能与物理能综合梯级利用原理 [J]. 中国科学E辑工程科学材料科学, 2005, 35(3): 299-313.
[4]El-GEASSY A A, SHEHATA K A, EZZ S Y. Mechanism of iron-oxide reduction with hydrogen-carbon monoxide mixtures [J]. Transactions of the iron and steel institute of Japan, 1977, 17(11): 629-635.
[5]ET-TABIROU M, DUPRE B, GLEITZER C. Hematite single crystal reduction into magnetite with CO-CO2[J]. Metallurgical transactions B, 1988, 19(2): 311-317.
[6]WANG B W, LV H S, ZHAO H B, et al. Experimental and simulated investigation of chemical looping combustion of coal with Fe2O3based oxygen carrier [J]. Procedia Engineering, 2011, 16: 390-395.
[7]ZAFAR Q, MATTISSON T, GEVERT B. Redox investigation of some oxides of transition-state metals Ni, Cu, Fe, and Mn supported on SiO2and MgAl2O4[J]. Energy & Fuels, 2006, 20(1): 34-44.
[8]GARCIA-LABIANO F, de DIEGO L F, ADNEZ J, et al. Reduction and oxidation kinetics of a copper-based oxygen carrier prepared by impregnation for chemical-looping combustion [J]. Industrial & Engineering Chemistry Research, 2004, 43(26): 8168-8177.
[9]GARCIA-LABIANO F, ADNEZ J, de DIEGO L F, et al. Effect of pressure on the behavior of copper-, iron-, and nickel-based oxygen carriers for chemical-looping combustion [J]. Energy & Fuels, 2006, 20(1): 26-33.
[10]CHEN H S, ZHENG Z, SHI W Y. Investigation on the kinetics of iron ore fines reduction by CO in a micro-fluidized bed [J]. Procedia Engineering, 2015, 102: 1726-1735.
[11]MONAZAM E R, BREAULT R W, SIRIWARDANE R, et al. Kinetics of the reduction of hematite (Fe2O3) by methane (CH4) during chemical looping combustion: A global mechanism [J]. Chemical Engineering Journal, 2013, 232: 478-487.
[12]ABAD A, GARCIA-LABIANO F, de DIEGO L F, et al. Reduction kinetics of Cu-, Ni-, and Fe-based oxygen carriers using syngas (CO + H2) for chemical-looping combustion [J]. Energy & Fuels, 2007, 21(4): 1843-1853.
[13]GO K S, SON S R, KIM S D. Reaction kinetics of reduction and oxidation of metal oxides for hydrogen production [J]. International Journal of Hydrogen Energy, 2008, 33(21): 5986-5995.
[14]PIOTROWSKI K, MONDAL K, LORETHOVA H, et al. Effect of gas composition on the kinetics of iron oxide reduction in a hydrogen production process [J]. International Journal of Hydrogen Energy, 2005, 30(15): 1543-1554.
[15]PIOTROWSKI K, MONDAL K, WILTOWSKI T, et al. Topochemical approach of kinetics of the reduction of hematite to wüstite [J]. Chemical Engineering Journal, 2007, 131(1/2/3): 73-82.
[16]PINEAU A, KANARI N, GABALLAH I. Kinetics of reduction of iron oxides by H2: Part I: Low temperature reduction of hematite [J]. ThermochimicaActa, 2006, 447(1): 89-100.
[17]SU M Z, MA J C, TIAN X, et al. Reduction kinetics of hematite as oxygen carrier in chemical looping combustion [J]. Fuel Processing Technology, 2017, 155:160-167.
[18]CHUANG S Y, DENNIS J S, HAYHURST A N, et al. Kinetics of the chemical looping oxidation of CO by a co-precipitated mixture of CuO and Al2O3[J]. Proceedings of the Combustion Institute, 2009, 32(2): 2633-2640.
[19]DONG C Q, SHENG S H, QIN W, et al. Density functional theory study on activity of α-Fe2O3in chemical-looping combustion system [J]. Applied Surface Science, 2011, 257(20): 8647-8652.
[20]ZHANG X L, DONG C Q, ZHANG J J, et al. The reaction path of CO and Fe2O3in a chemical-looping combustion system [M]// International Conference on Sustainable Power Generation and Supply.[S.l.]:IEEE, 2009.
[21]DONG C Q, LIU X L QIN W, et al. Deep reduction behavior of iron oxide and its effect on direct CO oxidation [J]. Applied Surface Science, 2012, 258(7): 2562-2569.
[22]TAN Q L, QIN W, CHEN Q L, et al. Synergetic effect of ZrO2on the oxidation-reduction reaction of Fe2O3during chemical looping combustion [J]. Applied Surface Science, 2012, 258(24): 10022-10027.
[23]QIN W, CHEN Q L, WANG Y, et al. Theoretical study of oxidation-reduction reaction of Fe2O3supported on MgO during chemical looping combustion [J]. Applied Surface Science, 2013, 266: 350-354.
[24]QIN W, WANG Y, DONG C Q, et al. The synergetic effect of metal oxide support on Fe2O3for chemical looping combustion: A theoretical study [J]. Applied Surface Science, 2013, 282: 718-723.
[25]MA J C, ZHAO H B, TIAN X, et al. Chemical looping combustion of coal in a 5kWthinterconnected fluidized bed reactor using hematite as oxygen carrier [J]. Applied Energy, 2015, 157: 304-313.
[26]MA J C, ZHAO H B, TIAN X, et al. Continuous operation of interconnected fluidized bed reactor for chemical looping combustion of CH4using hematite as oxygen carrier [J]. Energy & Fuels, 2015, 29(5): 3257-3267.
Experimental investigation for the intrinsic reduction kinetics of a hematite as oxygen carrier in chemical looping combustion
SU Ming-ze1, ZHAO Hai-bo2, DU Bao-zhou1,ZHANG Peng-fei1, LIU Zhi-gang1
(1. Key Laboratory for Flow &Enhanced Heat Transfer of Shandong Academy of Sciences, Jinan 250014, China;2. State Key Laboratory of Coal Combustion, Huazhong University of Science and Technology, Wuhan 430074, China)
∶ In this work, the intrinsic kinetics of the first reduction stage of a hematite as oxygen carrier (OC) reduced by carbon monoxide (CO) has been investigated. For the intrinsic kinetics analysis, the BET surface area and the pore size distribution tests showed that the porosity of this kind of OC was 0.031, which revealed that the OC had dense structure with undeveloped pore structure. The temperature programmed reduction experiments were conducted in the thermo gravimetric analyzer, which showed that the reduction of OC was conducted in stages, and the appropriate experimental temperature range for testing the intrinsic kinetics of the first reduction stage was 400~650 °C. Furthermore, a series of formal experiments were conducted in a batch fluidized bed system with different temperatures and different CO concentrations. The intrinsic activation energy and the pre-exponential factor were determined as 138.55 kJ/mol and 6.8×1013s-1respectively, after the internal and external diffusion factor been eliminated. The analysis to the internal and external diffusion factors deepened the acknowledgement to the reaction properties of this kind of hematite OC reduced by CO. The researching results of this paper had good compatibility with many previous research conclusions such as shrinking core model, external diffusion control and smaller apparent activation energy.
∶chemical looping combustion; intrinsic reduction kinetics; hematite oxygen carrier
2016-09-28
国家重点研发计划项目(2016YFB0600801,2016YFB0601300);国家自然科学基金(51406110);山东省优秀中青年科学家科研奖励基金(BS2014NJ013);山东省科学院基础基金(科基合字(2015)第8号);山东省科学院青年基金(2014QN014)
苏明泽(1989—),男,硕士,研究方向为化学链燃烧。
TK16
A
1002-4026(2017)02-0041-011
10.3976/j.issn.1002-4026.2017.01.008
