氮磷添加对亚热带常绿阔叶林土壤微生物群落特征的影响
2017-03-09王晶晶许崇华王泽夫徐小牛
王晶晶, 樊 伟, 崔 珺, 许崇华, 王泽夫, 徐小牛
安徽农业大学林学与园林学院,合肥 230036
土壤微生物是土壤中的活力成分,是土壤养分循环的推动力,土壤中一系列的过程都是以碳、氮循环为中心,其物质的流动和能量的循环都是在不同微生物的协同下完成,土壤微生物一直在挖掘有机物中C-N键的能量,调控土壤中有机化合物的转化和养分的释放[1]。微生物量是土壤养分的源和库,也是指示土壤肥力的敏感指标[2]。长期不同的施肥措施不仅影响着土壤的理化性质,也影响着适宜各种微生物生长发育所需要的养分、水分、空气、酸碱度、渗透压和温度等条件,因此土壤微生物的特性也随之发生改变[3]。土壤微生物群落功能多样性反映了土壤微生物群落的生态特征,近几年来,土壤微生物生态的研究已经成为生态学研究的热点之一[4]。
氮、磷均是植物生长所必需的大量营养元素,在植物生长、发育和繁殖等过程中有着重要的作用,自然状态下,很多生态系统生产力都表现为氮限制、磷限制或者氮磷共限制[5]。自然条件下,氮进入陆地生态系统的主要途径是固氮生物对大气中氮气的固定,而磷则主要通过原生矿物的风化作用进入生态系统,因此一般认为生态系统在演替早期主要表现为氮限制,在演替后期则主要为磷限制;控制氮可利用性的反应主要为生物反应,而控制磷可利用性的反应则主要是地球化学反应[6]。氮素也是土壤中较为活跃的营养元素,以有机氮和无机氮两种形态存在于土壤中,氮素的转化主要有氨化作用、硝化作用、反硝化作用和生物固定,其中硝化和氨化作用是氮素有效化的过程,有利于植物的吸收。近些年来,人类大量施用无机肥料来增加土壤中的有效养分,促进植物的生长,氮、磷、钾作为“肥料三要素”,被植物真正吸收利用的仅仅是其中的小部分,大部分不能被植物所吸收利用的肥料,在土壤中会发生挥发、淋溶和固定等[7],人类大量使用氮肥来增加土壤可利用性氮素的水平,促进植物的生长,但是氮素的过量使用会对森林生态系统的结构和功能产生重要影响,土壤微生物对氮增加的响应有多样性的特点[8],因此合理的添加氮磷对森林生态系统可持续发展具有重要实践和理论意义。
亚热带常绿阔叶林生物多样性丰富、群落结构复杂、生物量及生产力高、植物群落和生态系统的稳定性强,生态效益良好,在我国分布广泛,具有涵养水源、保持水土和维持生物多样性等重要作用[9]。氮素添加对常绿阔叶林土壤生态系统氮循环的影响有一些相关报道,而氮、磷添加对不同土层土壤微生物的影响还鲜为报道。为此,本研究在黄山西脉仙寓山风景区境内设置样地,连续五年开展了氮、磷添加试验,探究不同施肥梯度下土壤微生物量碳氮的变化,采用Biolog-ECO微平板法分析不同施肥措施对土壤微生物群落功能多样性的影响,可为森林土壤中碳氮转化、碳库存储、土壤肥力监测以及建立提高森林生产力的施肥模式提供有力支撑。
1 研究地区与研究方法
1.1 研究地区概况
试验样地设在安徽石台县仙寓山景区,地理位置30°1′47.44″ N、117°21′23.33″ E,属于亚热带湿润气候,春季温凉多雨,年平均气温为16℃,海拔为375 m,年降水量为1620 mm以上。土壤类型为黄棕壤,质地轻粘,呈酸性反应。调查区植被丰富,森林覆盖率达85%,地带性森林植被类型在海拔600 m以下多为亚热带常绿阔叶林,也分布着大面积的杉木(Cunninghamialanceolata)人工林,在海拔600 m以上分布有常绿落叶阔叶混交林、落叶阔叶林及马尾松(Pinusmassoniana)林等。根据王氏家谱记载试验区森林为风水林,面积近20 hm2,近100多年来没有人为经营活动,如间伐、采伐等。试验林为甜槠(Castanopsiseyrei)老龄林分,其林龄在200年生左右,该林分以甜槠为优势种群,树种丰富度较高,基于本底调查结果,试验样地林分组成结构相似,立木密度590—680株/hm2(DBH ≥ 5.0 cm),共出现乔灌木树种52种,主要伴生乔木有青冈(Cyclobalanopsisglauca)、香桂(Cinnamomumsubavenium)、山杜英(Elaeocarpussylvestris)、枫香(Liquidambarformosana)、蓝果树(Nyssasinensis)、树参(Dendropanaxdentiger)等;主要伴生灌木有山矾(Symplocossumuntia)、冬青(Ilexspp.)、老鼠矢(Symplocosstellaris)、豹皮樟(Litseacoreanavar.sinensis)、尖连蕊茶(Camelliacuspidata)等;主要伴生草本有油点草(Tricyrtismacropoda)、蛇根草(Ophiorrhizajaponica)、蕨类等,丰富度较高。
1.2 试验设计
本试验设计4个处理:不施肥(CK,0 kg N/hm2)、低氮(LN,50 kg N/hm2)、高氮(HN,100 kg N/hm2)、高氮+磷(HN+P,100 kg N/hm2+50 kg P/hm2)。氮肥为硝酸铵(NH4NO3)、磷肥为过磷酸钙(Ca(H2PO4)2),其中每种施肥处理各设有个重复。施肥方式为喷雾器湿洒法,将肥料溶于20 L水中充分溶解,每月喷施一次,自2011年已连续施肥5年。
1.3 样品采集与分析
1.3.1 土样采集
试验区设置12个面积均为20 m×20 m的固定样地(其中3、7、8号为CK,1、6、10号为LN,0、5、11号为HN,2、4、9号为HN+P样地),每个样地之间设有8—10 m的隔离带,以防不同处理间相互干扰影响。2015年12月在各样地分别取0—10、10—20、20—30 cm 3个土层,X型布点各采集5钻,过筛去除凋落物、细根及石砾等,混合均匀后放入4℃下冷藏保存。其中一部分用于测定土壤理化性质,另一部分过2 mm筛后装入无菌袋,用于土壤微生物群落功能多样性的测定。
1.3.2 土壤理化性质及土壤微生物量的测定
土壤含水率采用烘干法测定;土壤溶液pH按水土比2.5∶1的充分混合,稍加静置后使用pH计测定;全磷和速效磷使用流动注射分析仪(FIAstar 5000, FOSS, Denmark)测定,可溶性有机碳使用TOC分析仪(Multi C/N 3100, Jena Analytik, Germany)测定,全碳和全氮使用元素分析仪(EA 3000, Vector, Italy)测定。微生物生物量碳(MBC)、氮(MBN)则使用氯仿熏蒸法,TOC分析仪测定。林地土壤本底情况如(表1)所示。
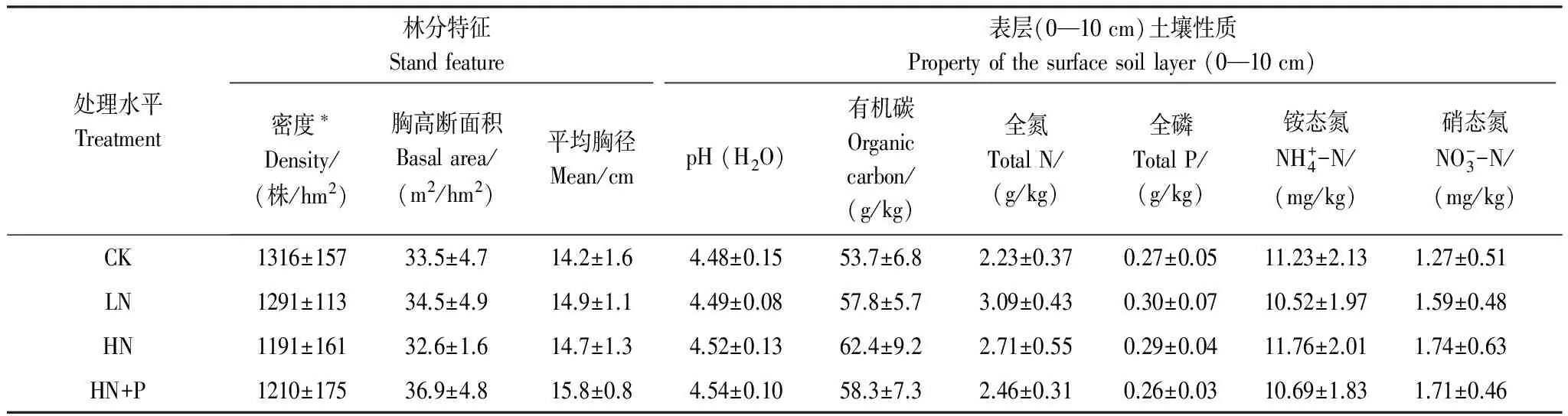
表1 试验林分结构及表层土壤特性
*DBH≥5 cm; CK:对照Control; LN:低氮处理Low N treatment; HN:高氮处理High N treatment; P:磷Phosphorus
1.3.3 土壤微生物群落功能多样性的测定
采用Biolog-ECO微平板法: 称约10 g新鲜土样放入250 mL的三角瓶中,加入100 mL已灭菌0.85% NaCl溶液,摇床震荡30 min (转速170 r/min), 将溶液稀释103倍,稀释后的溶液放置4℃冰箱内静置2—3 min, 取上清液倒入无菌培养皿,使用八通道移液枪(每孔150 μL)移入ECO微平板内,最后将已加溶液的ECO板放入28℃生化培养箱中培养7 d,每隔24 h用Biolog自动读取仪读取一次数据。
1.4 数据处理
Biolog-ECO平板测定的每孔颜色平均变化率(average well color development,AWCD)值,用来表示微生物群落利用单一碳源的能力即微生物的整体代谢活性[10]:
AWCD=∑(Ci-R)/31
式中:Ci为第i个孔590—750 nm的吸光度值,R为对照孔吸光值,若Ci-R小于0,其吸光度值均计为0。
土壤微生物功能多样性指数[11]:
Shannon指数:
H=-∑PilnPi
Simpson指数:
D=1-∑Pi2
式中:Pi=(Ci-R)/∑(Ci-R)表示第i孔的相对光密度值与整个微板相对光密度值总和的比值,ni表示第i孔的相对吸光度(Ci-R)。
数据采用SPSS 17.0软件进行单因素方差分析,应用R 3.3.1进行双因素、聚类分析和主成分分析。
2 结果与分析
2.1 不同施肥处理对不同土层土壤理化性质的影响
长期施加氮磷对土壤性质,如pH、全氮、全磷、速效磷、铵态氮和硝态氮都有着显著的影响。在不同土层间pH、全氮、全磷、铵态氮均表现出了极显著的差异(表2)。
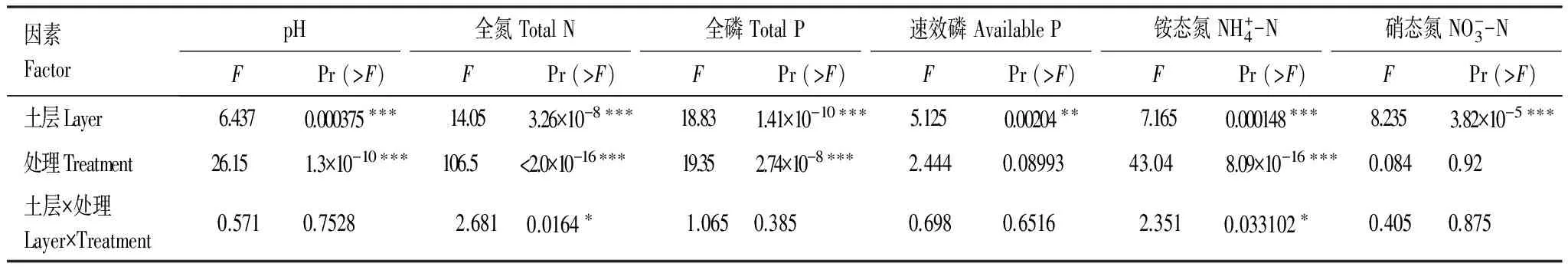
表2 不同土层和不同施肥处理土壤理化性质的双因素方差分析结果
显著水平/Significant levels: ***,P< 0.001; **,P< 0.01; *,P< 0.05
HN+P处理的土壤pH值在0—20 cm显著低于CK与HN,20—30 cm土层,LN和HN+P处理的土壤pH值也表现出低于CK与HN(表3)。全氮、全磷的含量随施肥处理方式的不同存在着显著的差异,0—10 cm土层,全氮含量表现为,CK明显低于各种处理,全磷含量表现为CK与HN+P处理高于其他处理。10—30 cm土壤中,CK的全磷含量显著高于氮磷添加处理。0—20 cm土层中HN+P处理的速效磷明显高于HN。不同土层中铵态氮与硝态氮的含量,CK都显著低于各种处理,而LN处理与HN处理之间并没有明显的差异,HN+P处理的铵态氮、硝态氮含量在各土层中低于LN、HN处理。
2.2 不同处理对土壤微生物量碳、微生物量氮的影响
土壤微生物量碳、氮与微生物量碳氮比,在不同土层之间均表现为极显著性差异,土壤微生物量碳在不同施肥处理间的差异性也极其显著,而土壤微生物量氮差异性却不明显,土层和处理间交互作用并没有差异(表4)。
MBC、MBN含量均随土层的加深而降低,不同施肥处理下MBC的变化(图1),在表层0—10 cm为HN>CK>HN+P>LN, 10—20 cm为HN>CK>LN>HN+P,20—30 cm为HN>CK>HN+P>LN;而MBN的变化则表现为:表层0—10 cm为HN>LN>CK>HN+P,10—20 cm为HN>LN>HN+P>CK,20—30 cm为HN>LN>HN+P>CK。
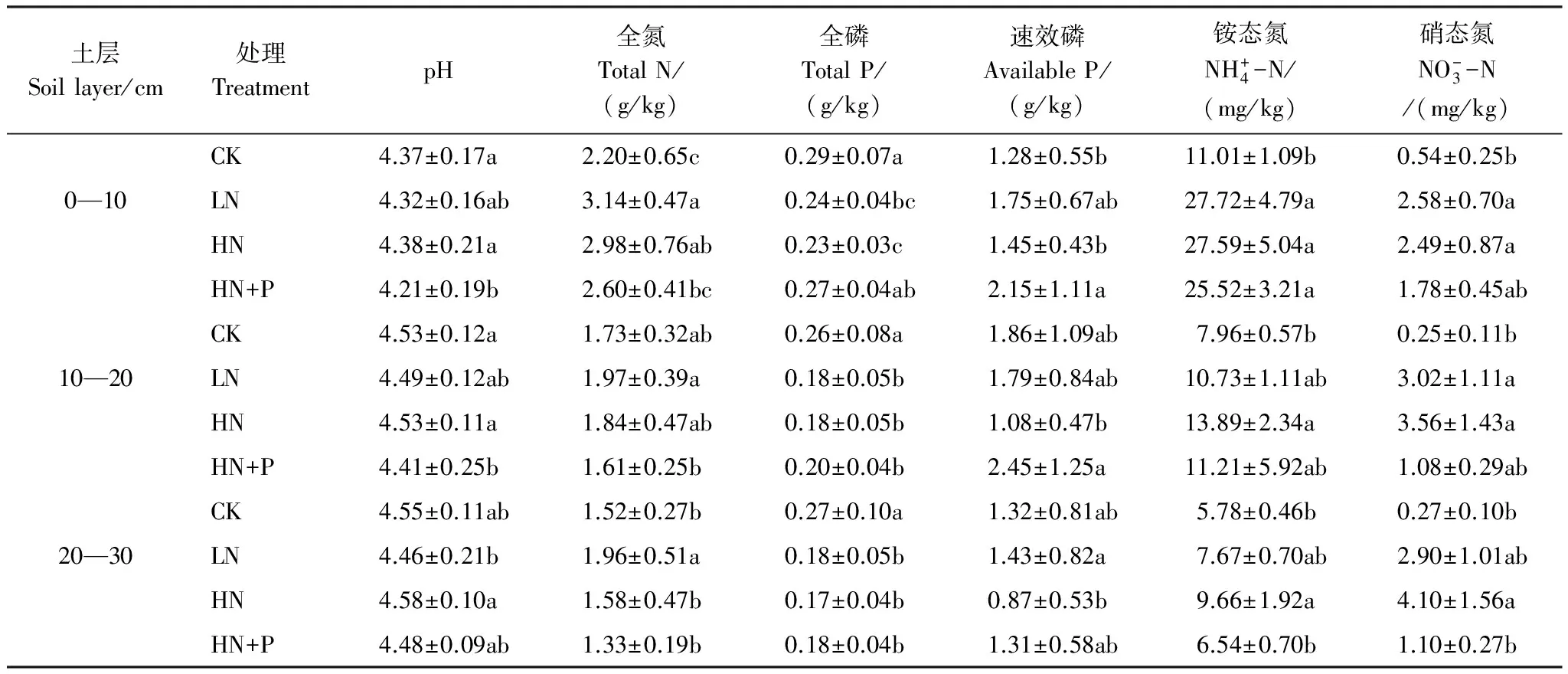
表3 不同的氮磷添加条件下不同土层的土壤理化性质
同列不同字母表示差异显著(P<0.05)

表4 不同土层和不同施肥处理土壤微生物量碳氮的双因素方差分析结果
显著水平/Significant levels: ***,P< 0.001; **,P< 0.01; *,P< 0.05;MBC:微生物量碳Microbial biomass carbon; MBN:微生物量氮Microbial biomass nitrogen
不同土层间的MBC,HN和LN处理均呈现了显著性差异,在10—30 cm土层,HN与HN+P的差异也比较明显;MBN在不同施肥处理下均没有表现出差异性;0—10 cm和20—30 cm土层土壤微生物量碳氮比(MBC/MBN)在HN和LN处理上存在着差异。
CK处理的MBC、MBN和MBC/MBN在不同土层间均表现出显著性差异,LN与HN处理的MBC含量0—10 cm明显高于20—30 cm土层,HN与HN+P施肥水平下,表层土的MBC含量显著高于底层土。MBN含量在不同施肥条件下,均表现出表层土0—10 cm显著高于10—30 cm。
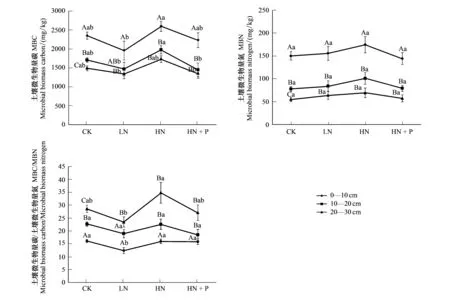
图1 不同水平氮磷添加条件下不同土层土壤微生物量C、N的变化Fig.1 Changes of soil microbial biomass carbon and nitrogen in different soil layers under different nitrogen and phosphorus additions
2.3 不同施肥处理对土壤微生物群落碳源利用的动力学特征的影响
随着培养时间的延长,土壤微生物群落AWCD值逐渐增加,从培养24 h开始进入对数增长期,AWCD值快速增长到72 h时变化速率最快,此时微生物代谢活性最为旺盛,大量碳源被利用,随后缓慢增长直至趋向平稳(图2)。
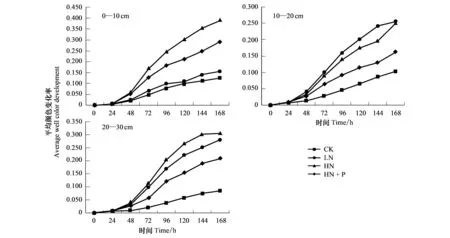
图2 不同水平氮磷添加条件下不同土层间AWCD值的变化Fig.2 Changes of AWCD of soil microorganism in different soil layers under different nitrogen and phosphorus additionsAWCD:平均颜色变化率Average well color development
表层土的整体吸光度值都大于其他土层,不同施肥处理土壤中微生物对单一碳源利用程度存在着差异,差异性并不是很显著(表5)。表层0—10 cm的AWCD值大小为HN>HN+P>LN>CK, 10—20 cm的AWCD值为LN>HN>HN+P>CK, 20—30 cm的AWCD值为HN>LN>HN+P>CK。
由(图2)所示的AWCD值可知,不同土层的土壤微生物代谢活性,CK表现为:0—10 cm>10—20 cm>20—30 cm;LN处理表现为:10—30 cm>0—10 cm;HN与HN+P处理表现为:0—10 cm>20—30 cm>10—20 cm。
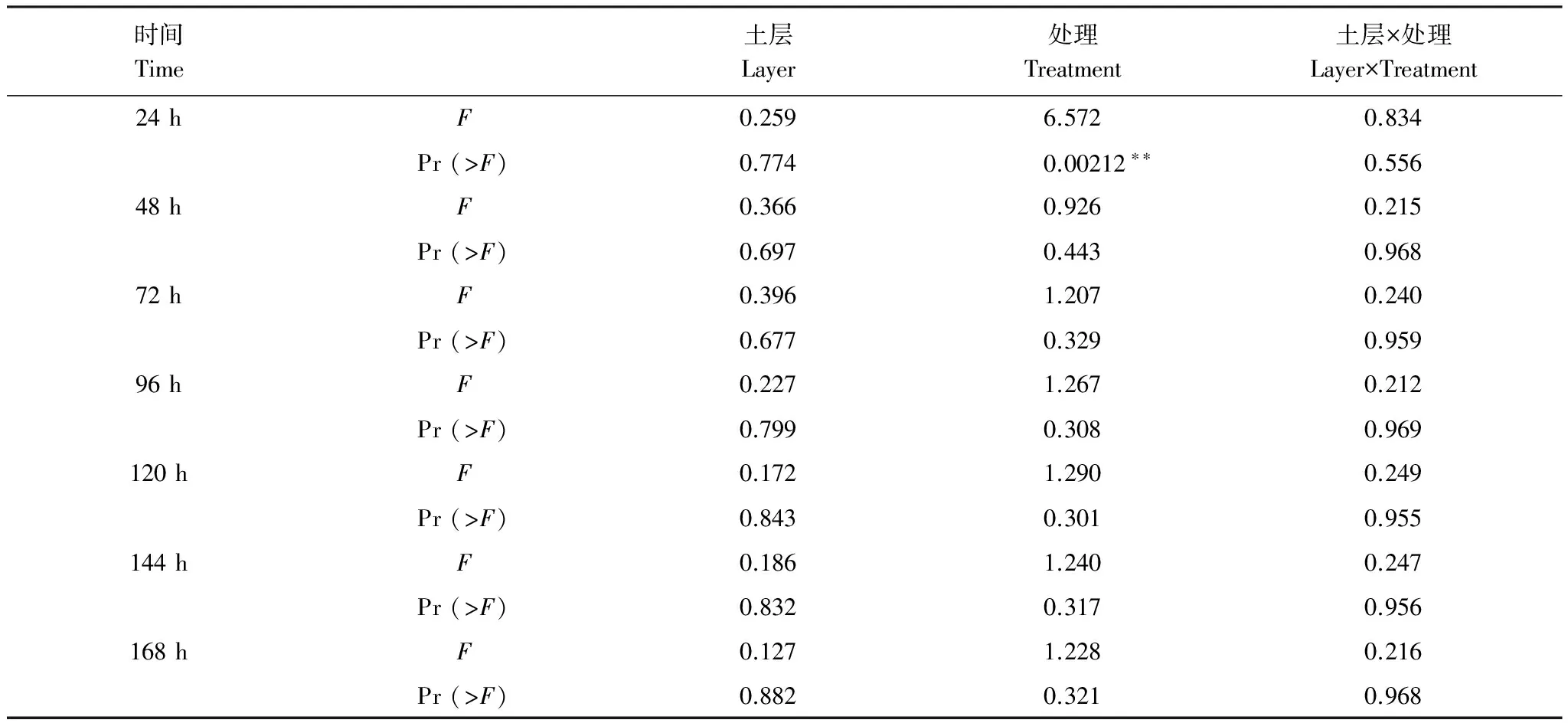
表5 不同土层和不同施肥处理AWCD值的双因素方差分析结果
显著水平/Significant levels: ***,P< 0.001; **,P< 0.01; *,P< 0.05
2.4 不同施肥处理对土壤微生物群落多样性指数的影响
对土壤微生物培养72 h的AWCD值进行McIntosh、Shannon和Simpson多样性指数分析,可在土壤微生物对不同碳源利用的数量特征上,反应土壤微生物群落物种的组成和分布情况。由表6可知,0—10 cm土层中,不同施肥处理的土壤微生物3个多样性指数的差异性均达到了显著水平,其中McIntosh指数,HN、HN+P与LN、CK呈现出显著性差异,HN处理的土壤微生物Shannon指数与其他处理呈现出显著差异,CK的土壤微生物Simpson指数与HN、HN+P也表现出显著差异性;10—30 cm土层中,CK的土壤微生物3个多样性指数与其他处理的均呈现显著差异性。

表6 土壤微生物群落多样性指数
同列不同字母表示差异显著(P<0.05)
由三个土层不同施肥处理的土壤微生物功能多样性指数聚类分析(图3)可知,0—10 cm土层HN与HN+P聚为一类,CK与LN聚为一类;10—20 cm土层CK为一类,HN、LN和HN+P聚为一类,20—30 cm土层则HN与LN聚为一类,CK与HN+P聚为一类。
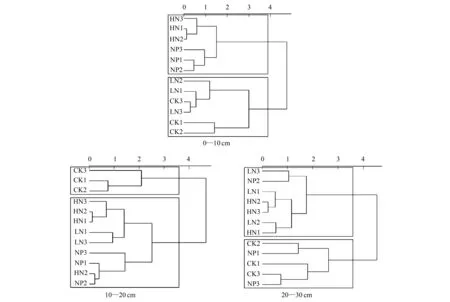
图3 不同氮磷添加条件下不同土层微生物群落多样性指数的聚类分析Fig.3 Cluster analysis of diversity index of microbial communities in different soil layers under different nitrogen and phosphorus additions
2.5 不同施肥处理对土壤微生物群落碳源利用率的影响
Biolog-ECO板31种碳源可以分为六大类,其中糖类/碳水类(10种)、氨基酸类(6种)、羧酸类(7种)、多聚物(4种)、多酚类(2种)、多胺类(2种)[12]。不同土层土壤微生物的碳源利用模式基本相同(图4),0—10 cm土层中,CK、LN、HN处理的土壤微生物对碳源利用率大小顺序均为:羧酸类>碳水类>氨基酸类>多聚物类>多酚类>多胺类,而HN+P处理,碳水类利用率高于羧酸类;10—20 cm土层中,CK的土壤微生物碳源利用率大小顺序为:羧酸类>碳水类>氨基酸类>多酚类>多聚物类>多胺类,而LN、HN与HN+P处理表现为多聚物类>多酚类, HN+P处理的碳水类>羧酸类;20—30 cm土层中,CK的土壤微生物碳源利用率大小顺序为羧酸类>碳水类>氨基酸类>多聚物类>多酚类>多胺类,而LN与HN为碳水类>羧酸类,HN+P为胺类>多酚类。
CK的土壤微生物在各土层上都表现出对羧酸类碳源的偏好,且与其他处理相比,羧酸类碳源利用率最高。LN处理的土壤微生物对多聚物类和羧酸类的利用率在土层上的变化比较明显,HN与HN+P表层土壤微生物对碳源利用率并没有明显区别,而对多酚类碳源的利用率随土层加深而降低。土壤微生物整体表现出对羧酸类、碳水类和氨基酸类的利用率较高,其次是多聚物类,对多胺类和多酚类碳源利用率最低。
2.6 土壤微生物群落对碳源利用的主成分分析
对培养72 h的各土层不同处理的AWCD值,进行群落功能多样性主成分分析(PCA),0—10 cm的第一主成分(PC1)和第二主成分(PC2)的方差贡献率分别是76.47%和6.65%,累计方差贡献率83.12%;10—20 cm的第一主成分(PC1)和第二主成分(PC2)的方差贡献率分别是44.54%和7.71%,累计方差贡献率52.25%;20—30 cm的第一主成分(PC1)和第二主成分(PC2)的方差贡献率分别是54.92%和10.86%,累计方差贡献率65.87%。PC1与PC2是微生物群落碳源利用变异的主要成分,可以解释变异的大部分信息。不同土层间施肥处理的土壤微生物群落在碳源利用上有明显的空间变异性(图5),0—10 cm土层,CK与LN处理均分布在PC1轴的负方向上,HN处理分布在PC1轴的正方向,HN+P处理分布在PC2轴的正方向。10—20 cm土层,CK分布在PC1轴的负方向,LN分布在PC2轴的负方向,HN分布在PC1轴的正方向,HN+P分布在PC2轴的正方向。20—30 cm土层,CK处理分布在PC1轴的负方向,LN与HN+P分布在PC2轴的正方向,HN分布在PC2轴的负方向。整体来看,不同N、P添加对0—10 cm土层的土壤微生物群落稳定性影响较大,空间分异性明显,而10—30 cm土层的土壤微生物群落在碳源利用上的变异性并不是很明显。
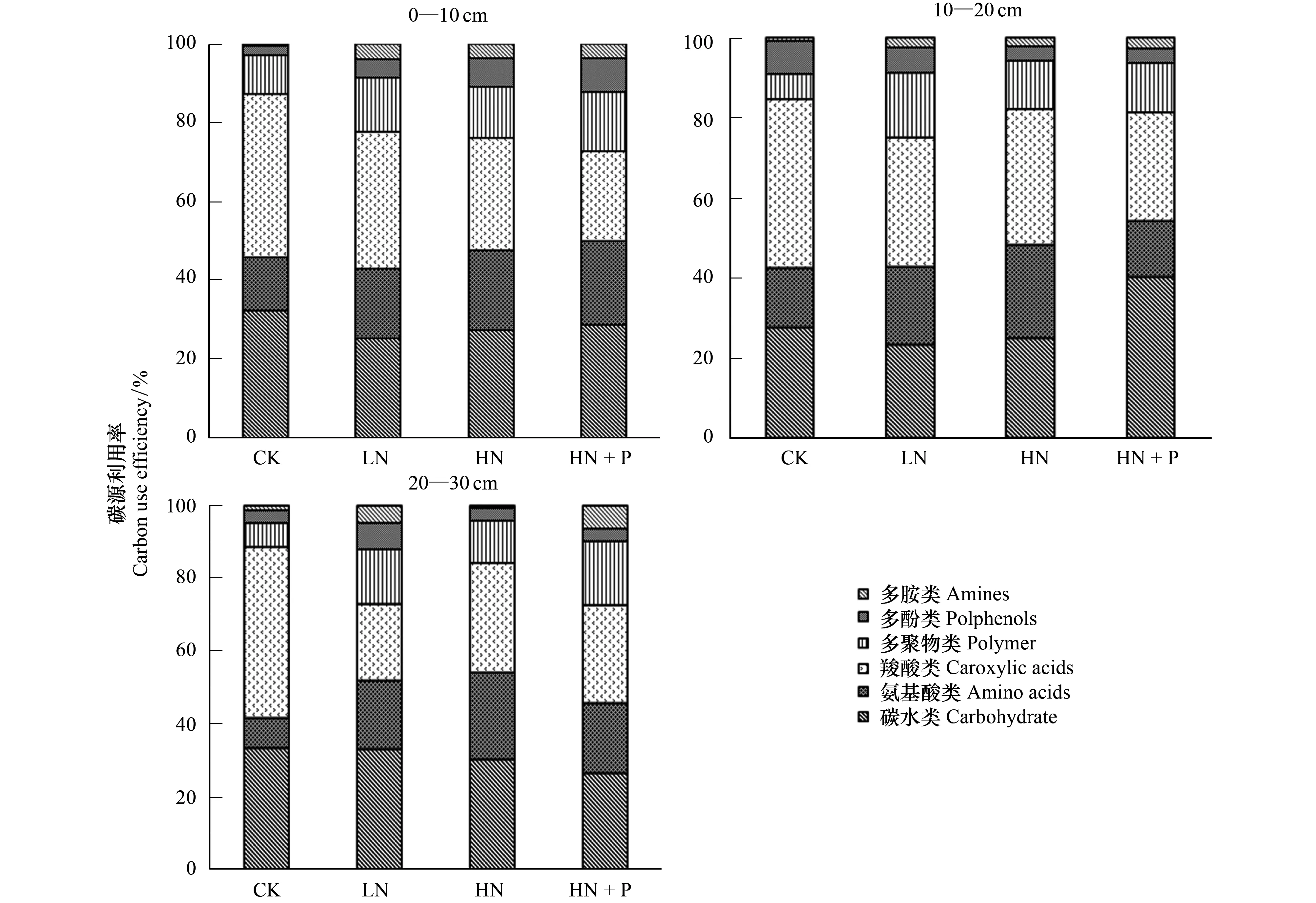
图4 不同土层土壤微生物群落对不同碳源的利用率Fig.4 Use efficiency of carbon sources by soil microbial communities in different soil layers
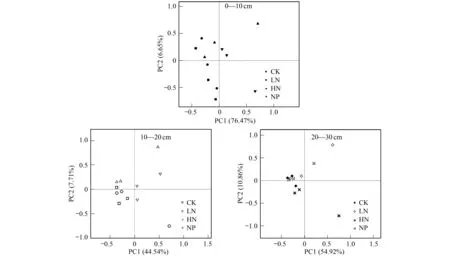
图5 不同土层土壤微生物群落功能多样性的主成分分析Fig.5 Principal component analysis of soil microbial community functional diversity in different soil layers
不同土层的31种碳源在2个主成分上的载荷值(表7),反映主成分与碳源利用的相关系数,其值越高表示该碳源对主成分的影响越大。0—10 cm土层中,氨基酸类、碳水类、羧酸类与PC1的相关性较高,羧酸类、碳水类、多聚物类与PC2的相关性较高,因此,0—10 cm土层的土壤微生物群落代谢特征,引起分异作用的主要碳源是碳水类与羧酸类,尤其碳水类碳源影响最大。10—20 cm土层中,羧酸类、碳水类、氨基酸类与PC1相关性较高,羧酸类、碳水类、氨基酸类与PC2相关性较高;20—30 cm土层中,碳水类、羧酸类、氨基酸类与PC1相关性较高,羧酸类、碳水类、多胺类与PC2相关性较高。综上所述,不同土层土壤微生物功能多样性在不同氮磷添加处理上的差异,主要体现在碳水类和羧酸类碳源的利用上。
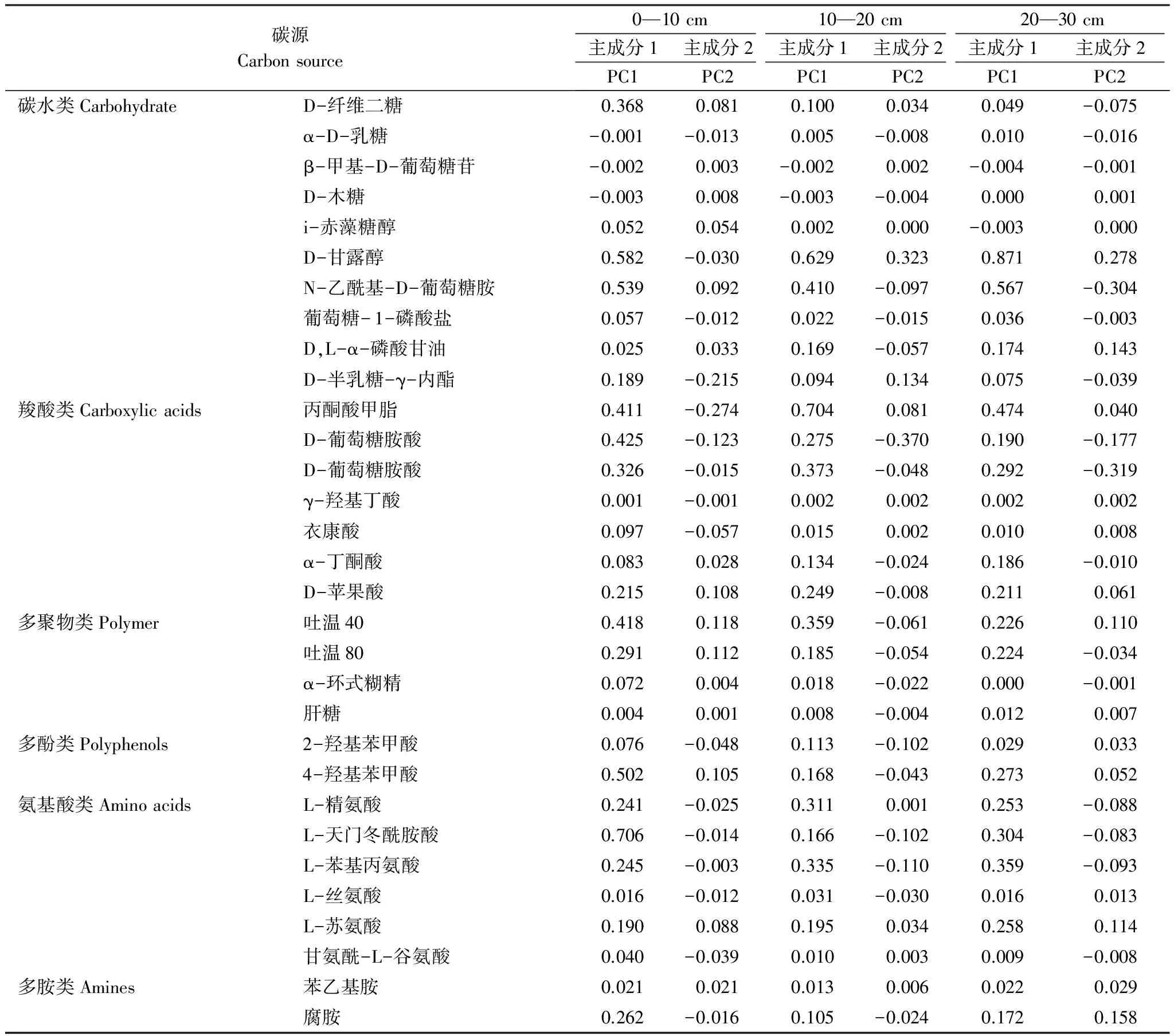
表7 31种碳源与主成分1、2的相关系数
2.7 土壤微生物多样性指数与土壤理化性质的相关性
从(表8)可以看出,全氮、铵态氮与土壤微生物群落多样性指数呈正相关,土壤微生物群落多样性指数之间均呈显著正相关,速效磷与土壤微生物群落多样性指数呈显著负相关。土壤pH与土壤理化性质的其他指标及土壤微生物群落多样性均呈现负相关关系。
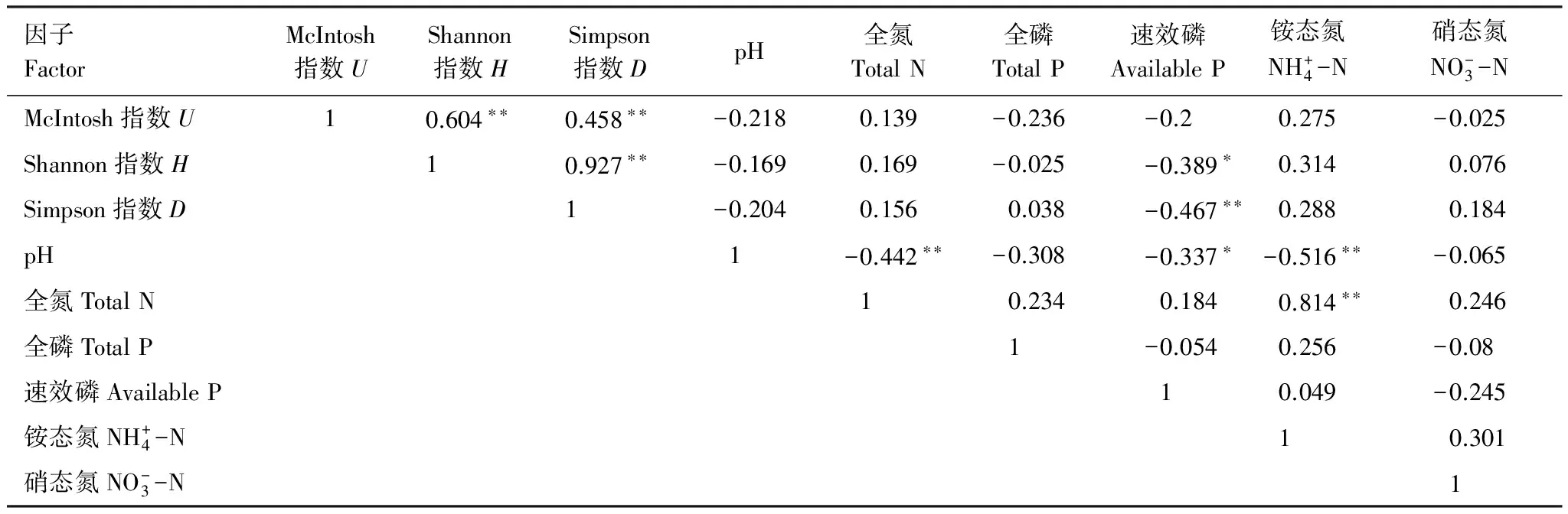
表8 土壤微生物群落多样性指数与土壤化学性质的相关系数
*P<0.05; **P<0.01
3 讨论
土壤微生物生物量碳、氮虽然在土壤中的含量较低,由于土壤微生物的繁殖速度快、周转时间短且速率快,因此MBC、MBN在森林生态系统中很大程度上控制着养分的循环和能量的转化[13]。本研究表明,MBC、MBN随土层的加深而降低,而且表土层的AWCD值明显高于其他土层,表明表土层的微生物群落的代谢活性最为活跃。有研究表明MBC含量与土壤有机质含量、土壤有机质活性、易矿化程度有关[14]。与对照相比,HN处理的土壤MBC、MBN明显高于其他处理水平,可能是这一水平的氮添加,并没有破坏土壤团聚体减弱微生物的活性,反而为微生物提供足够的氮源,利于微生物的生长繁殖,从而促进土壤微生物量N的合成,同时高氮添加也增加了植物生物量和凋落物产量,增加了微生物可利用碳源的量。张彦东等[15]研究施氮肥对金沙江干热河谷退化草地土壤微生物的影响,发现高氮施肥使微生物的数量和生物量有明显的增加,这与我们的研究结果一致。土壤MBC/MBN比可反映微生物群落结构信息[16],HN处理MBC/MBN变化显著,预示着高氮处理的土壤微生物群落结构变化是其微生物生物量较高的主要原因。
本研究表明,随着土壤深度的增加土壤微生物对碳源底物的利用不断降低。微生物对不同碳源的利用能力很大程度上取决于微生物的种类和固有性质,利用微平板法测定微生物对不同单一碳源的利用能力,可以比较分析不同微生物群落,得出其群落水平多样性[17]。McIntosh多样性指数反映土壤微生物种类数的不同,并能区分不同利用程度;Shannon多样性指数反映土壤微生物群落利用碳源程度的变化度和差异度,Simpson多样性指数可反映土壤微生物群落对常见碳源的利用程度[18]。不同氮、磷添加的表层土壤微生物群落多样性指数均表现出显著性差异,说明表层土壤微生物群落在利用常见碳源的程度、碳源种类的均匀度、丰富度及不同种碳源的利用程度上,氮、磷添加对其影响明显。CK与LN处理的表层0—10 cm土壤多样性指数聚为一类,CK在10—20 cm的土层多样性指数单为一类,CK与HN+P处理的20—30 cm聚为一类,表明不同氮、磷添加,不同土层多样性指数差异性较为一致。
Bach等[19]认为,凋落物和根系分泌物是土壤微生物的主要碳源,天然阔叶林群落物种多样,结构更为复杂,具有较高的根系生物量和根系分泌物,为土壤微生物提供了丰富的碳源,其土壤微生物的结构和功能也相应增加[20]。刘秉儒等指出地上植物多样性会通过凋落物的差异对土壤微生物功能代谢产生重要影响[21]。不同氮、磷添加,影响着表土层微生物对碳底物的利用能力,随着氮添加剂量的增加,土壤微生物对酚类碳源的利用能力明显提高(表7和图4)。酚类物质影响土壤微生物的自然平衡,降低土壤中酚类物质的积累,可在一定程度上抑制有害微生物的繁殖。因此,高氮处理有助于土壤中酚类物质的消耗。氨基酸是土壤有机氮的重要组成部分,微生物在生长代谢过程中可利用氨基酸作为其氮源合成植物生长调节剂,促进其生长[22]。氨基酸类物质对土壤中有机质有正激发效应[23],HN与HN+P处理土壤微生物对氨基酸类碳源利用率提高,说明高剂量的氮添加可促进土壤有机质的分解。
主成分空间分布的不同反映了土壤微生物利用碳源的种类和程度的差异[24],不同处理对表土层碳源利用的离散程度较大,而10—30 cm土层的分布相对集中,因此表土层土壤微生物群落功能稳定性较差,即不同水平的氮、磷添加对表层土壤微生物碳源利用的空间分布有着显著影响。土壤微生物功能多样性在主成分分离中起主要贡献作用的是碳水类和羧酸类碳源。
总之,天然阔叶林的表层土富集着大量的凋落物,养分充足,且具有较高的根系活动和细根周转,利于提高土壤微生物量与微生物活性,下层土壤生境条件逐渐变差,土壤微生物代谢活性变弱[25]。土壤微生物群落多样性也随土层深度的增加而递减[26]。不同氮磷添加,微生物生物量碳、氮和功能多样的变化取决于土壤深度和施肥量[27]。较高剂量的氮、磷添加可改善土壤的理化性质,增加植物生物量和凋落物的产量,并且促进土壤微生物的代谢活性,提高土壤微生物生物量碳、氮含量,对土壤微生物功能多样性及土壤微生物的物种多样性都有显著影响。
[1] 孙凤霞, 张伟华, 徐明岗, 张文菊, 李兆强, 张敬业. 长期施肥对红壤微生物生物量碳氮和微生物碳源利用的影响. 应用生态学报, 2010, 21(11): 2792- 2798.
[2] 逄好胜, 张会慧, 李鑫, 丁伟鹏, 胡举伟, 林晗婧, 敖红, 孙广玉. 大兴安岭林区森林退化对土壤微生物群落功能的影响. 森林工程, 2015, 31(3): 25- 30.
[3] 田雅楠, 王红旗. Biolog法在环境微生物功能多样性研究中的应用. 环境科学与技术, 2011, 34(3): 50- 57.
[4] 张海芳, 李刚, 宋晓龙, 刘红梅, 张静妮, 杨殿林, 赵树兰, 多立安. 内蒙古贝加尔针茅草原不同利用方式土壤微生物功能多样性. 生态学杂志, 2012, 31(5): 1143- 1149.
[5] Elser J J, Bracken M E S, Cleland E E, Gruner D S, Harpole W S, Hillebrand H, Ngai J T, Seabloom E W, Shurin J B, Smith J E. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater, marine and terrestrial ecosystems. Ecology Letters, 2007, 10(12): 1135- 1142.
[6] 杨晓霞, 任飞, 周华坤, 贺金生. 青藏高原高寒草甸植物群落生物量对氮、磷添加的响应. 植物生态学报, 2014, 38(2): 159- 166.
[7] 王志勇. 测土配方施肥理论与实践. 郑州: 黄河水利出版社, 2010: 5- 10.
[8] 郁培义, 朱凡, 宿少锋, 王志勇, 闫文德. 氮素添加对樟树林红壤微生物的影响. 环境科学, 2013, 34(8): 3231- 3237.
[9] 陈超凡, 吴水荣, 覃林, 范垚城, 谭玲, 郭文福. 南亚热带典型乡土阔叶人工林土壤微生物碳源利用及功能多样性. 生态学杂志, 2016, 35(5): 1132- 1139.
[10] Gomez E, Ferreras L, Toresani S. Soil bacterial functional diversity as influenced by organic amendment application. Bioresource Technology, 2006, 97(13): 1484- 1489.
[11] 杨永华, 姚健, 华晓梅. 农药污染对土壤微生物群落功能多样性的影响. 微生物学杂志, 2000, 20(2): 23- 25.
[12] 韩冬雪, 王宁, 王楠楠, 孙雪, 冯富娟. 不同海拔红松林土壤微生物功能多样性. 应用生态学报, 2015, 26(12): 3649- 3656.
[13] 吴家森, 钱进芳, 童志鹏, 黄坚钦, 赵科理. 山核桃林集约经营过程中土壤有机碳和微生物功能多样性的变化. 应用生态学报, 2014, 25(9): 2486- 2492.
[14] 隋跃宇, 焦晓光, 高崇生, 程伟, 张兴义, 刘晓冰. 土壤有机质含量与土壤微生物量及土壤酶活性关系的研究. 土壤通报, 2009, 40(5): 1036- 1039.
[15] 张彦东, 孙志虎, 沈有信. 施肥对金沙江干热河谷退化草地土壤微生物的影响. 水土保持学报, 2005, 19(2): 88- 91.
[16] 李娟, 赵秉强, 李秀英, Bo H. B . 长期有机无机肥料配施对土壤微生物学特性及土壤肥力的影响. 中国农业科学, 2008, 41(1): 144- 152.
[17] 鲁顺保, 张艳杰, 陈成榕, 徐志红, 郭晓敏. 基于BIOLOG指纹解析三种不同森林类型土壤细菌群落功能差异. 土壤学报, 2013, 50(3): 618- 623.
[18] 陈志芳. 戴云山不同森林类型土壤微生物群落多样性特征的研究[D]. 福州: 福建农林大学, 2014.
[19] Bach L H, Grytnes J A, Halvorsen R, Ohlson M. Tree influence on soil microbial community structure. Soil Biology and Biochemistry, 2010, 42(11): 1934- 1943.
[20] 韩世忠, 高人, 李爱萍, 马红亮, 尹云锋, 司友涛, 陈仕东, 郑群瑞. 中亚热带地区两种森林植被类型土壤微生物群落结构. 应用生态学报, 2015, 26(7): 2151- 2158.
[21] 刘秉儒, 张秀珍, 胡天华, 李文金. 贺兰山不同海拔典型植被带土壤微生物多样性. 生态学报, 2013, 33(22): 7211- 7220.
[22] 宋贤冲, 杨中宁, 曹继钊, 张照远, 项东云. 萌芽更新对桉树根际土壤微生物群落功能多样性的影响. 桉树科技, 2014, 31(3): 36- 40.
[23] 宋春雨, 张兴义, 刘晓冰, 高崇升. 土壤有机质对土壤肥力与作物生产力的影响. 土壤与作物, 2008, 24(3): 357- 362.
[24] 李娟, 赵秉强, 李秀英, 姜瑞波, Bo H. B. 长期不同施肥制度下几种土壤微生物学特征变化. 植物生态学报, 2008, 32(4): 891- 899.
[25] 吴则焰, 林文雄, 陈志芳, 方长旬, 张志兴, 吴林坤, 周明明, 陈婷. 中亚热带森林土壤微生物群落多样性随海拔梯度的变化. 植物生态学报, 2013, 37(5): 397- 406.
[26] 董立国, 蒋齐, 蔡进军, 张源润, 许浩, 李生宝. 基于Biolog-ECO技术不同退耕年限苜蓿地土壤微生物功能多样性分析. 干旱区研究, 2011, 28(4): 630- 637.
[27] Li F L, Liu M, Li Z P, Jiang C Y, Han F X, Che Y P. Changes in soil microbial biomass and functional diversity with a nitrogen gradient in soil columns. Applied Soil Ecology, 2013, 64: 1- 6.
