烟草抗PVY的EMS突变体pvyr1筛选与抗性遗传初步分析
2017-03-09
(1.云南省烟草农业科学研究院,烟草行业烟草生物技术育种重点实验室,国家烟草基因工程研究中心,昆明 650021;2.中国农业科学院烟草研究所,青岛 266101)
烟草抗PVY的EMS突变体pvyr1筛选与抗性遗传初步分析
刘勇1,黄昌军1,宋中邦1,李文正1,于海芹1,刘贯山2
(1.云南省烟草农业科学研究院,烟草行业烟草生物技术育种重点实验室,国家烟草基因工程研究中心,昆明 650021;2.中国农业科学院烟草研究所,青岛 266101)
为了从烟草EMS突变体库中筛选抗马铃薯Y病毒(Potato virus Y,PVY)突变体,采用苗期人工接种初筛M2抗病单株,对M3、M4和M5株系连续接种鉴定PVY抗性。采用eIF4E1基因特异分子标记检测和cDNA全长测序,分析突变体PVY抗性是否与eIF4E1突变有关。配制F1群体初步分析抗性遗传特性。苗期人工接种从1800份M2种子中筛选到1份抗PVY的烤烟突变体。冬季无加温措施塑料大棚内苗期人工接种PVY坏死株系MN分离物,接种后35 d未诱变对照品种发病率为100%,E9119-1Z/M3株系的发病率为56.3%,无症状单株ELISA检测PVY均为阴性,表明E9119-1Z/M3株系对PVY中抗。E9119-1Z的M4株系和M5株系在光照培养室内苗期人工接种对PVY坏死株系MN分离物和ZT-5分离物表现为中抗。E9119-1Z-R14-2/M5株系为抗性稳定的突变体,命名为pvyr1。pvyr1采用eIF4E1基因特异分子标记检测为阳性,cDNA测序表明eIF4E1基因无突变。pvyr1与未诱变对照品种(感PVY)、va位点抗PVY品种NC55的杂交F1代抗性鉴定结果初步表明,pvyr1突变体对PVY的抗性符合孟德尔隐性遗传,且与NC55的va位点不等位。表明pvyr1为一个与eIF4E1基因突变不同的抗PVY新资源。
烟草;马铃薯Y病毒;EMS突变体
马铃薯Y病毒(Potato virus Y,PVY)是重要的植物病毒之一,广泛分布于在世界各地,主要为害茄科(Solanaceae)作物,包括马铃薯、烟草、辣椒和番茄等。是世界烟草的重要病害之一,在中国北方烟区和黄淮烟区为害严重,曾造成大面积减产,目前在云南、贵州等烟区为害呈上升趋势[1]。
甲基磺酸乙酯(Ethyl methyl sulfonate, EMS)是广泛使用的诱变剂,具有诱变频率高的优点,主要为G/C碱基点突变为A/T,EMS还可以使遗传物质发生糖-磷酸骨架断裂,产生染色体缺失等[2]。利用 EMS诱变构建了拟南芥和水稻等多种作物的突变体库[3-4]。从烟草EMS突变体中筛选到低去甲基烟碱的突变体[5]。我国利用EMS创制了烟草突变体库,并开展了大规模的抗病虫害、耐低钾等突变体筛选[6-8]。烟草抗PVY基因位点va,来源于Virgin A Mutant(VAM,种质编号TI1406),VAM为 X-射线处理获得的烟草突变体[9]。国内外已鉴定出多个抗PVY的种质,如VAM(TI1406)、V.SCR等,大部分PVY抗源的抗性表现为隐性基因位点(va)控制,利用va位点育成烤烟品种NC55和NC102等,VAM的隐性基因位点(va)与eIF4E1基因缺失有关[10]。烟草种质资源中存在隐性抗PVY资源,辣椒和番茄等茄科作物中筛选到抗 PVY或同属病毒的 EMS突变体[11-12]。因此,从我国创制的烟草EMS突变体库中,有望筛选到抗PVY的突变体。筛选和鉴定新的抗PVY突变体,对丰富抗PVY资源具有重要意义。本文采用苗期人工接种抗性鉴定方法,对烟草EMS突变体库进行了抗PVY突变体筛选。并对获得的一个抗性稳定的突变体进行了抗性遗传特性的初步鉴定。
1 材料与方法
1.1 材料
烤烟品种中烟100,EMS处理M2种子共1800份,由中国农业科学院烟草研究所提供。抗PVY对照烤烟品种NC55、NC102由云南省烟草农业科学研究院保存。
1.2 病毒株系、接种方法与ELISA检测
PVY坏死株系ZT-5分离物、PVY-MN分离物由云南省烟草农业研究院保存。ZT-5分离物为云南省烟草流行株系。在接种前30 d左右在白肋烟或枯斑三生烟(N.tobacumvar Samsun NN)上繁殖备用。待接种时用免疫检测试纸条检测验证毒源繁殖成功且未被TMV、CMV等其他病毒污染。摩擦接种方法:采集经免疫检测试纸检测为 PVY的新鲜病叶,用PVY接种缓冲液(0.01 mol/L pH 7.0 磷酸盐缓冲液+0.4% 亚硫酸钠)研磨,双层40目尼龙网过滤。接种浓度为1:40或1:100(重量体积比)。接种前在病毒汁液中加入1% 200目化学纯二氧化硅,高压喷枪喷射压力为98 kPa。喷口距接种物20 cm,每株喷射接种时间约为0.5 s。接种后立即用喷壶喷少量自来水,提高接种效率。PVY的ELISA检测采用Agdia公司试剂盒[13]。
1.3 M2无症状单株筛选
2012年 4月至6月在云南省烟草农业科学院研和实验基地塑料大棚内进行。采用32孔盘,按常规方法漂浮育苗。烟苗5~6片叶时,剪叶1次使烟苗大小较为整齐。在育苗池内接种 PVY坏死株系MN分离物,接种后每7 d左右调查发病情况,第 3次调查时拔除发病株,挑选无症状单株移栽。在现蕾、开花和收种时,分别淘汰表现症状株,最后无症状单株收种,获得M3种子。
1.4 M3抗病株系筛选与组合配制
2013年冬季在研和实验基地塑料大棚内进行。记录试验期间当地天气预报的每天最低气温和最高气温,计算出实验期间的日平均最低气温和日平均最高气温。中选M3株系,按常规方法漂浮育苗,5~6片叶时,每个株系盆栽64株。成活后接种PVY坏死株系MN分离物,接种后7、14和21 d调查发病情况,对无症状的株系,挑选单株移栽,并一直持续观察至开花。挑选长势较好且杈枝幼叶ELISA检测为PVY阴性的单株,自交留种。挑选M3单株,取花粉分别与感PVY的中烟100、抗PVY的NC55配制F1组合。
1.5 抗病突变材料的抗性分析
2014年6—9月和2015年4—7月在光照培养室分别鉴定中选的M4株系、M5株系的PVY抗性。2015年12月至2016年3月在研和基地塑料大棚鉴定F1杂交组合抗性。5~6片叶时每个株系盆栽,分别接种PVY坏死株系ZT-5分离物、PVY-MN分离物。接种后定期调查发病率。为了验证发病情况,挑选部分无症状的单株的幼嫩叶片,采用ELISA检测PVY。抗性划分标准为:发病率0~20%为高抗;发病率20.1%~40%为抗病,发病率40.1%~60%为中抗,发病率60.1%~80%为感病,发病率80.1%~100%为高感。根据发病率数据划分的抗性数据,分析抗性遗传特性[14-15]。
1.6eIF4E1基因特异分子标记检测与cDNA序列测定
pvyr1突变体叶片采用QIAGENE试剂盒提取DNA和RNA,RNA反转录成cDNA并进行PCR扩增。根据文献检测eIF4E1[16]。扩增eIF4E1基因DNA 部分序列的特异引物对为 CF2:5′-TTTGGTTTGATAATCCTATGGCT-3′,GR11:5′-GAAGGCAAGATATTCAGGAGCT-3′;扩增片段大小为446 bp,退火温度51 ℃。扩增eIF4E1基因cDNA全长序列的引物对为CF3:5′-TAAAATCTA TAACTAAGTACATA-3′,CR3:5′- CCATTGTAG CAAGAAAACTAT-3′,扩增片段大小为715 bp,退火温度48 ℃。
PCR反应体系总体积均为20 μL,其中30~50 ng/μL DNA 样品 2.5 μL、10×PCR buffer 2.0 μL,dNTPs 1.2 μL,引物各1.5 μL,rTaq DNA酶0.3 μL,ddH2O 12.6 μL。所用试剂购自宝生物公司。PCR反应在Ependorff梯度扩增仪上(Master Cycler)上进行。扩增的程序为:94 ℃预变性5 min;94 ℃变性30,退火温度30,72 ℃延伸1 min,共28个循环,72 ℃延伸10 min,4 ℃保存;采用2%的琼脂糖凝胶进行检测。cDNA采用PCR产物直接测序,采用MEGA6比对序列。
2 结 果
2.1 无症状M2单株获得
2012年4月至6月在防虫塑料大棚内,共鉴定1800份M2株系,每份M2挑选16株假植在32孔苗盘中。4~5片叶时高压喷枪接种 PVY坏死株系MN分离物病叶汁液40倍稀释液。接种后14 d和接种后28 d分别拔除发病株。挑选300株无症状单株塑料大棚内移栽。移栽后继续淘汰发病株,最终挑选无症状且 ELISA检测阴性的单株套袋,获得216份M3种子。其中M2株系E9119苗期叶片形状存在分离,将苗期叶片畸形单株收获的M3种子编号为E9119-1Z、将苗期叶片正常单株收获的M3种子的编号为E9119-1。
2.2 M3抗病株系筛选
对M3株系的苗期接种抗性鉴定表明,E9119-1Z冬季低温下对PVY坏死株系MN分离物表现出较好抗性,接种后35 d的发病率为56.3%。接种后28 d无症状单株ELISA检测均为PVY阴性。感病的E1020株系和对照中烟100接种后14 d发病率达到100%(表1,图1)。挑选接种后35 d无症状的单株移栽,对收种时无症状的单株自交留种获得M4株系。
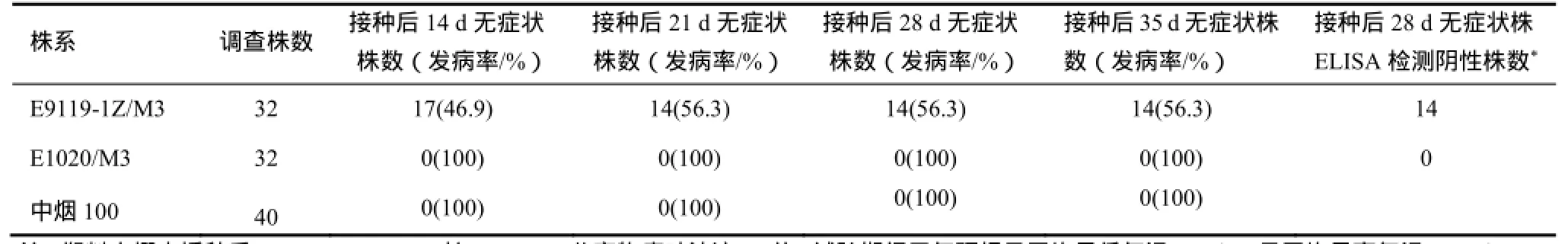
表1 M3株系冬季塑料大棚内对PVY分离物MN的抗病性Table 1 The M3 lines resistant to PVY isolate MN in plastic tunnel in winter

图1 M3株系的PVY抗性鉴定Fig. 1 The PVY resistance evaluation of M3 lines
2.3 抗病M4突变材料的抗性验证
光照培养室苗期接种后14和23 d症状调查结果和ELISA检测结果表明(表2),E9119-1Z-R14和E9119-1Z-R5 M4株系对PVY坏死株系MN分离物或ZT-5分离物中抗。E9119-1Z-R5 M4株系接种后23 d的无症状单株,ELISA检测验证部分单株为PVY阴性。抗MN的单株移栽后,现蕾时无症状单株自交留种,获得E9119-1Z-R14-1,E9119-1ZR14-2等M5株系。
2.4 M5的抗性验证与抗性遗传特性初步分析
光照培养室苗期接种后 21 d症状调查结果和ELISA检测结果表明,E9119-1Z-R14-2 M5株系中抗 PVY ZT-5分离物、抗性低于 NC102(表3)。E9119-1Z-R14的M3姊妹单株R8与携带va位点抗PVY的种质NC55的杂交1代(F1)表现为高感,表明E9119-1Z-R8的抗性基因与va位点不等位(表3)。E9119-1Z-R14的M3姊妹单株R2与高感PVY的品种云烟87的杂交1代(F1)表现为高感,表明E9119-1Z-R2的抗性为隐性遗传。
为了验证E9119-1Z-R14-2/M5株系对应的M3单株 E9119-1Z-R14的抗性,重新配制该单株与抗感品种的F1组合,并鉴定PVY抗性。2015年12月冬季低温下(试验期间天气预报日平均最低气温5.4 ℃,日平均最高气温16.7 ℃)苗期接种后14、21、28 d症状调查结果表明,E9119-1Z/M3单株R14与感PVY的品种中烟100的杂交1代(F1)表现为高感,表明其抗性为隐性遗传(表 4)。E9119-1Z/M3单株R14与携带va位点抗PVY的种质NC55的杂交 1代(F1)表现为中抗,在低温下 E9119-1Z/M3单株R14与NC55的杂交1代(F1)的抗性明显低于NC55,表明其抗性基因与va位点不等位。将E9119-1Z-R14-2/M5突变体命名为pvyr1。
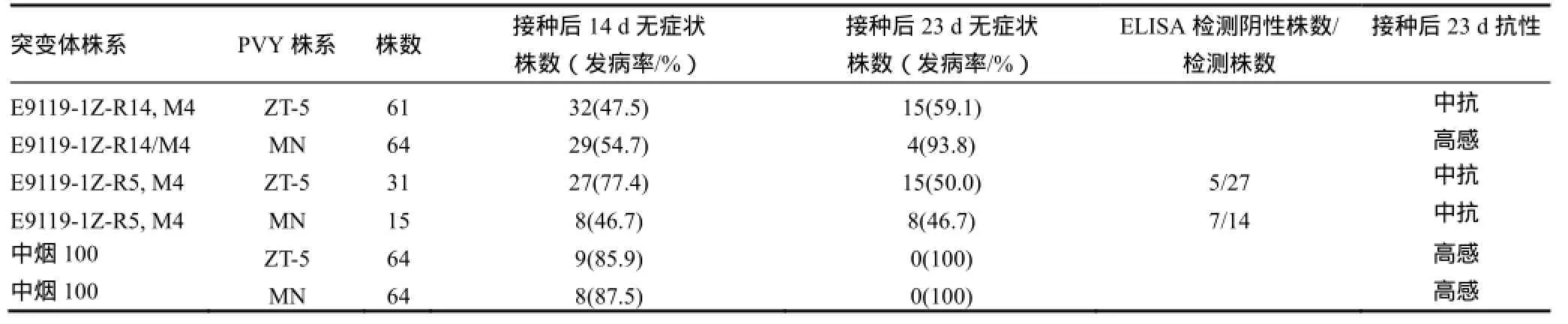
表2 M4株系对PVY分离物MN和ZT-5的抗病性Table 2 The M4 lines resistant to PVY isolate ZT-5
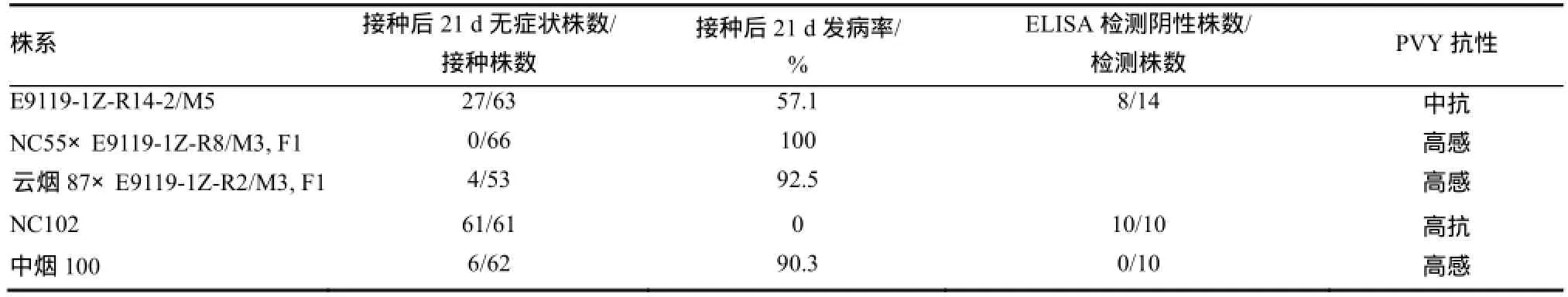
表3 M5株系对PVY分离物ZT-5的抗病性Table 3 The M5 lines resistant to PVY isolate ZT-5
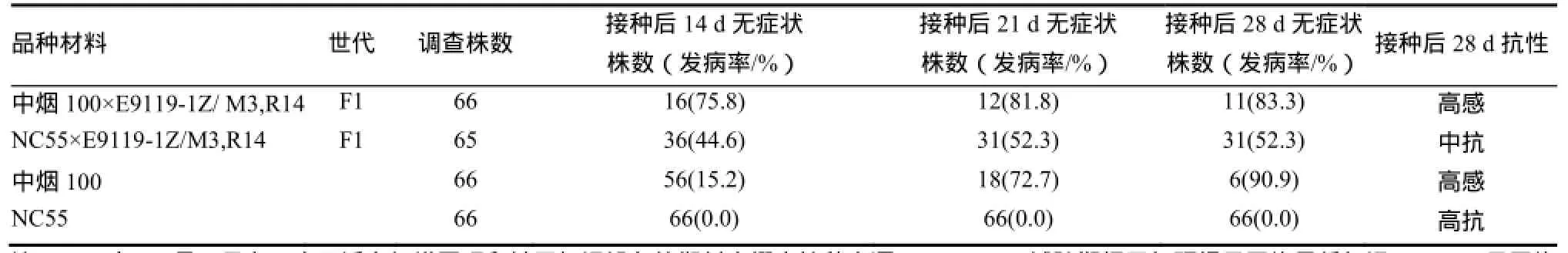
表4 冬季低温下pvyr1与出发材料和va抗病品种的F1组合抗性表现Table 4 The hybrid F1 of pvyr1 with WT control andvaresistant cultivar
2.5eIF4E1基因特异分子标记检测与cDNA序列测定
采用eIF4E1基因的特异分子标记CF2GR11检测pvyr1是否缺失eIF4E1基因。cDNA扩增测序分析pvyr1的eIF4E1编码序列是否存在突变。结果表明,pvyr1和诱变出发材料中烟 100都能扩增出CF2GR11的特异条带(图2)。pvyr1和诱变出发材料中烟100的cDNA核苷酸序列和推导的氨基酸序列一致率为100%(未列出数据)。表明pvyr1的PVY抗性与eIF4E1基因缺失或者编码区域的突变无关。
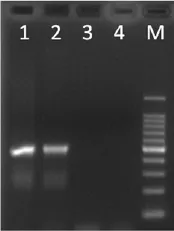
图2 eIF4E1基因的特异分子标记CF2GR11检测Fig. 2 The test ofeIF4E1gene specific marker CF2GR11
3 讨 论
3.1 抗PVY突变体筛选与鉴定
在中烟100的M2突变体库中筛选抗PVY单株,M2苗期接种PVY后7 d开始发病,一直到收种时,不断有单株表现PVY症状。本文从约1800份M2中挑选出接种后28 d无PVY症状单株移栽,收种时再挑选杈枝叶片无PVY症状的单株收种。最终获得216份M3种子。对216份M3的苗期接种后28 d调查,有17个M3株系的PVY无症状株数为4株以上(接种18株),多数M3株系PVY无症状株数为0(未列出数据)。表明M2中有较多的不能遗传的抗PVY单株。
PVY存在普通株系(PVYO)、坏死株系(PVYN)和重组株系(PVYN:O),我国烟草上的主要株系为坏死株系。其中携带va位点的烟草抗源如NC55,对PVY坏死株系ZT-5分离物的抗性高[16]。本文先接种PVY坏死株系MN分离物筛选无症状的M2单株,再接种ZT-5分离物验证M3的抗性,分别接种MN分离物和ZT-5分离物再次验证的M4和M5的抗病性。最终获得中抗PVY坏死株系的EMS突变体,命名为pvyr1。名称中的“r”取抗病英文resistance首字母。
3.2 pvyr1的抗性遗传特性
pvyr1与抗感PVY的烟草杂交F1代的抗性鉴定结果初步表明,pvyr1突变体对PVY的抗性为隐性遗传,且与NC55的va位点不等位。采用eIF4E1基因的分子标记检测与序列测定表明,pvyr1突变体与eIF4E1的编码序列突变或缺失无关。表明pvyr1为一个不同于eIF4E1基因缺失或突变的新抗PVY抗源,在烟草抗病育种和抗PVY机理研究上具有较大价值。pvyr1的抗性位点与育种利用价值,有待深入研究。
[1] 刘勇,莫笑晗,余清,等. 云南、福建、湖南烟区烟草花叶病主要病毒种类检测及黄瓜花叶病毒亚组鉴定[J].植物病理学报,2006,36(4):310-313.
[2] 安学丽,蔡一林,王久光,等. 化学诱变及其在农作物育种上应用[J]. 核农学报,2003,17(3):239-242.
[3] WU J L, WU C, LEI C, et al. Chemical and irradiation induced mutants of Indica Rice IR64 for forward and reverse genetics[J]. Plant Mol Biol, 2005, 59: 85-97.
[4] MARTIN B, RAMIRO M, MARTINEZ-ZAPATER J M. A high density collection of EMS-induced mutations for TILLING in Landsberg erecta genetic background ofArabidopsis[J]. BMC Plant Biol, 2009, 9: 147.
[5] JULIO E, LAPORTE F, REIS S, et al. Reducing the content of nornicotine in tobacco via targeted mutation breeding[J]. Mol Breed, 2008, 21: 369-381.
[6] 王军伟. 烟草突变体库创建及筛选体系建立[D]. 北京:中国农业科学院,2011.
[7] 刘贯山. 烟草突变体创制、筛选与鉴定[J]. 中国烟草科学,2013,34(2):113-114.
[8] 申莉莉. 烟草抗主要病虫害突变体的筛选与鉴定[J].中国烟草科学,2012,33(2):102-104.
[9] KOELLE G. Genetic analyse einer Y-virus (Rippen braune) resistenten mutante der tabaksorte Virgin A[J]. Zuchter, 1961, 31: 71-71.
[10] JULIO E, COTUCHEAU J, DECORPS C, et al. A Eukaryotic Translation Initiation Factor 4E (eIF4E) is Responsible for the “va” Tobacco Recessive Resistance to Potyviruses[J]. Plant Mol. Biol. Rep, 2015, 33: 609-623.
[11] RUFFEL S, DUSSAULT M, PALLOIX A, et al. A natural recessive resistance gene against potato virus Y in pepper corresponds to the eukaryotic initiation factor 4E (eIF4E) [J]. Plant J, 2002, 32:1067-1075.
[12] RUFFEL S, GALLOIS J, LESAGE M, et al. The recessive potyvirus resistance genepot-1is the tomato orthologue of the pepperpvr2-eIF4Egene[J]. Mol Gen and Genomics, 2005, 274: 346-353.
[13] 刘勇,李应金. 云南省烟草漂浮苗主要病毒种类的检测[J]. 烟草科技,2006(11):58-61.
[14] 向珣朝,李季航,张楷正,等. 一个水稻抗纹枯病突变体的遗传分析及其基因的初步定位[J]. 西南科技大学学报,2007,22(2):76-81.
[15] 尹静,王广金,张宏纪,等. 小麦突变体D51抗秆锈病遗传分析及其抗性基因 SSR标记[J]. 作物学报,2007,33(8)1262-1266.
[16] 刘勇,宋中邦,童治军,等. 烟草PVY隐性抗病基因的分子标记及其适用性[J]. 中国烟草学报,2015,21(1):76-81.
Identification and Genetic Analysis of Tobacco PVY-resistant EMS Mutant pvyr1
LIU Yong1, HUANG Changjun1, SONG Zhongbang1, LI Wengzheng1, YU Haiqin1, LIU Guanshan2
(1. Yunnan Academy of Tobacco Agricultural Sciences, Key Laboratory of Tobacco Biotechnological Breeding, National Tobacco Genetic Engineering Research Center, Kunming 650021, China; 2. Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, China)
In order to screen forPotato virus Y(PVY) resistant mutant of tobacco among EMS mutant library, seedling inoculation was used to screen for M2 PVY-resistant plants, and continuous inoculation was conducted to identify M3, and M4 and M5 lines with resistance to PVY. TheeIF4E1molecular marker test and full length cDNA sequencing were applied to analyze whether the PVY-resistant mutations were associated with theeIF4E1mutation or not. F1 populations were used for preliminary analysis of the genetic characteristics of the resistance. After artificial inoculation of 1800 M2 lines at the seedling stage, a flue-cured tobacco mutant resistant to PVY necrotic strains was obtained. Seedlings were inoculated with PVY MN isolates and PVY ZT-5 isolates. After 35 days post inoculated (dpi), the disease incidence of E9119-1Z M3 line was 56.3% while that of the WT control was 100%. The symptomless M3 plantlets were PVY negative when tested by ELISA. These primary results indicated that the E9119-1Z /M3 line had medium resistance to PVY. In the green house inoculation test the M4 and M5 lines descendent of E9119-1Z showed stable medium resistance to PVY necrotic strains MN isolate and ZT-5 isolate. The E9119-1Z-R14/M5 was named pvyr1. Analysis of pvyr1 hybrid F1 with WT control and with thevalocus PVY-resistant NC55 line showed that the PVY resistance ofpvyr1was in accord with Mendelian model of recessive gene and is not allelic to the NC55valocus. TheeIF4E1gene specific molecular markers tests and cDNA sequencing results indicated that the pvyr1 mutation is not related to theeIF4E1mutation. Mutant pvyr1 can be used as a new PVY-resistant tobacco germplasm.
tobacco; Potato virus Y; EMS mutant
S435.72
1007-5119(2017)01-0059-05
10.13496/j.issn.1007-5119.2017.01.010
中国烟草总公司科技项目“烟草高香气、抗青枯病、抗TMV突变体鉴定及中烟100、翠碧一号品种定向改良”(110201301005);中国烟草总公司云南省公司科技项目“烟草PVY抗性基因的研究与应用”(2012YN02)
刘 勇(1970-),男,博士,副研究员,主要从事烟草抗病基因资源挖掘与抗病育种研究。E-mail:yliu@yntsti.com
2016-04-12
2016-08-10
