新黄酮类化合物的脱甲基反应及其抗氧化活性
2017-03-08王晓静李慧娟
李 娜,王晓静,孙 捷,王 兵,李慧娟
(1.济南大学 山东省医学科学院,医学与生命科学学院,山东 济南 250200;2.山东省医学科学院 药物研究所,山东 济南 250062;3.国家卫生部生物技术药物重点实验室,山东 济南 250062;4.山东省罕见病重点实验室,山东 济南 250062)
新黄酮类化合物的脱甲基反应及其抗氧化活性
李 娜1,2,3,4,王晓静2,3,4*,孙 捷2,3,4,王 兵1,2,3,4,李慧娟1,2,3,4
(1.济南大学 山东省医学科学院,医学与生命科学学院,山东 济南 250200;2.山东省医学科学院 药物研究所,山东 济南 250062;3.国家卫生部生物技术药物重点实验室,山东 济南 250062;4.山东省罕见病重点实验室,山东 济南 250062)
以3,4-二甲氧基苯甲醛(1)为起始原料,使用文献已报道的三氟乙酸法合成了3个含两个甲氧基取代基的新黄酮类化合物4a-4c,在新制碘化铝的催化下发生脱甲基反应,合成了3个含多个羟基取代基的新黄酮类化合物5a-5c,产率均高于90%.所有目标化合物均经过IR,1H NMR,ESI-MS 对其进行了结构确认.通过测定羟基自由基和DPPH自由基清除活性两个方面评价其抗氧化活性,结果发现,脱甲基后产物活性均增强.
新黄酮类化合物;脱甲基;碘化铝;抗氧化
新黄酮(又名4-芳基香豆素)是指具有C6-C3-C6骨架且在4位上具有一个芳基结构的一类化合物.经研究,新黄酮类化合物具有多种药理活性,如抗氧化[1]、抗糖尿病[2]、抗肿瘤[3]、抗原生动物[4]、抗菌[5]、抗真菌[6]、和抗炎[7]等,具有重要的研究价值和应用潜力[8].
目前,合成 新黄酮类化合物的方法主要有:1)以香豆素衍生物为原料的 Suzuki 等交叉偶联反应[9,10],2)3,4-二氢 -4-芳基香豆素类化合物的氧化脱氢反应[11],3)以苯酚衍生物及苯丙炔酸衍生物为原料的闭环缩合反应,其催化剂有三氟乙酸或三氯化硼乙醚等[12].其中原料最便宜且操作简单的为第3个方法,但该类方法在合成含有多个羟基基团的新黄酮类化合物时需要用到羟基的保护及脱保护反应[13],操作繁琐,且产率较低.本课题组参照孙捷等制备4-芳基香豆素类化合物的方法[12]合成了一系列含有多个甲氧基基团的新黄酮类化合物,再以新制碘化铝为催化剂,发生完全脱甲基反应制备含多个羟基基团的新黄酮类化合物.
1 实验部分
1.1 仪器与试剂
DF101S型集热式恒温加热磁力搅拌器、低温恒温搅拌反应浴,郑州长城科工贸有限公司;旋转蒸发仪,上海申升科技有限公司;真空干燥箱,上海一恒科学仪器有限公司;循环水式多用真空泵,郑州长城科工贸有限公司;Nexus 670型傅立叶红外光谱仪,美国尼高力仪器公司(Thermo-Nicolet);德国Bruker AM-600核磁共振仪;日本日立(Hitachi) U-3000 紫外-可见光分光光度计.
3,4-二甲氧基苯甲醛(质量分数97%),间苯三酚(质量分数97%),邻苯三酚(质量分数97%),双氧水,国药集团化学试剂有限公司;DPPH(2,2-联苯基-1-苦基肼基),麦克林试剂;硫酸亚铁,水杨酸,乙醇,溴,氯化亚砜,氢氧化钾,盐酸,三氟乙酸,吡啶,哌啶,碘,铝粉,乙腈,乙酸乙酯,二氯甲烷,甲醇均为市售分析纯试剂.
1.2 步骤
目标化合物的合成路线如图1所示:
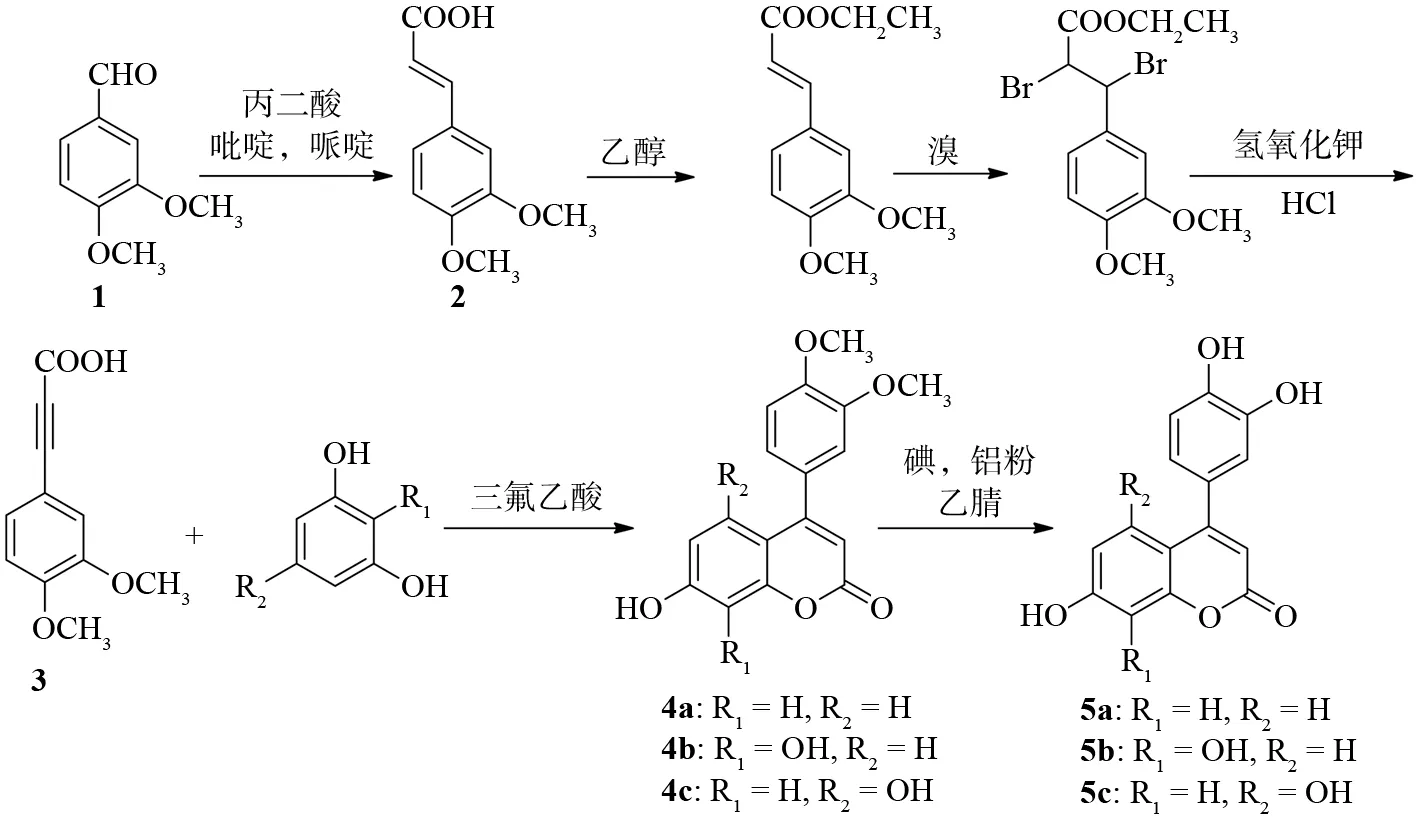
图1 化合物4a-4c与5a-5c的合成路线Fig.1 Synthetic route of 4a-4c and 5a-5c
以3,4-二甲氧基苯甲醛1为起始原料,与丙二酸生成3,4-二甲氧基苯基丙烯酸2;2经过加成、消除等反应后再进行溴代、消除反应合成3,4-二甲氧基苯丙炔酸3;以三氟乙酸为催化剂,3与酚类化合物反应生成4-芳基香豆素类化合物4a-4c,在乙腈溶液中,新制碘化铝催化4a-4c脱甲基合成5a-5c.
1.2.1 3,4-二甲氧基苯基丙烯酸(2)的合成
在100 mL的三口反应瓶中加入25 g(240 mmol) 丙二酸,33.2 g(200 mmol)3,4-二甲氧基苯甲醛1,40 mL(496 mmol) 吡啶,2 mL(20.4 mmol) 哌啶,加热至75 ℃后回流5 h,反应完毕,冷却10 min,加入150 mL 3 mol/L冰盐酸溶液,放置一夜,抽滤,用1 000 mL 水洗涤沉淀,得到白色粗品.粗品用无水乙醇重结晶,得白色纯品3,4-二甲氧基苯基丙烯酸37.0 g,收率88.9%.Ms:m/z:209.1[M+1]+.
1.2.2 中间体3,4-二甲氧基苯丙炔酸(3)的合成
在250 mL三口反应瓶中加入8.32 g(40 mmol) 3,4-二甲氧基苯基丙烯酸,100 mL(1 717 mmol)无水乙醇,滴加4.4 mL(60 mmol)氯化亚砜,加热至82 ℃,回流反应2 h,直至原料点完全消失,停止反应冷却10 min,浓缩反应液,加50 mL冰水,4 ℃冰箱中冷却析出淡红色固体,抽滤,得3,4-二甲氧基苯基丙烯酸乙酯粗品,直接用于下一步反应.
在250 mL圆底烧瓶中加入3,4-二甲氧基苯基丙烯酸乙酯粗品,倒入80 mL(1 247 mmol)二氯甲烷溶液将其完全溶解,冰盐浴条件下,用恒压滴液漏斗滴加2.1 mL(41 mmol)溴(用10 mL二氯甲烷稀释),30 min滴完,直至溴滴下反应液不褪色,继续搅拌1 h,以10%亚硫酸钠溶液洗涤反应液除去多余的溴,水洗一遍,二氯甲烷层蒸干得2,3-二溴-3,4-二甲氧基苯基丙酸乙酯粗品,直接用于下一步反应.
在250 mL三口反应瓶中加入2,3-二溴-3,4-二甲氧基苯基丙酸乙酯粗品,6.8 g(121 mmol)氢氧化钾,100 mL无水乙醇,加热至82 ℃,回流反应10 h,直至原料点消失,停止反应冷却10 min,加20 mL水溶解反应生成的盐,用浓盐酸调节至强酸性,二氯甲烷萃取反应液(35 mL×3),蒸干二氯甲烷萃取液得3,4-二甲氧基苯丙炔酸5.6 g,产率70%.Ms:m/z:206.9[M+1]+.
1.2.3 目标化合物4的合成
在100 mL的三口反应瓶中,加入2.06 g(10 mmol)3,4-二甲氧基苯基丙炔酸,11 mmol间苯二酚、邻苯三酚或间苯三酚,10 mL三氟乙酸,室温搅拌反应,TLC监测反应进程(展开剂体积比:二氯甲烷∶甲醇=10∶1),5 h后反应完毕,将反应液倒入50 mL冰水中,有固体析出,抽滤,得粗品,用甲醇重结晶,抽滤,真空干燥箱中干燥.
4-(3′,4′-二甲氧基苯基)-7-羟基香豆素(4a):白色固体,产率57.6%;IR(cm-1):3 355(OH); 1 732(C=O); 3 069,1 622,1 558,1 519,1 450,1 139,1 014,860,820 (苯环);1 253,1 178(C-O); 2 843(-OCH3).1H NMR (600 MHz,DMSO-d6)δ:3.83 (d,J= 12.1 Hz,6H),6.16 (s,1H),6.79 (dd,J= 6.3,2.3 Hz,2H),7.09 (ddd,J= 11.2,10.1,5.1 Hz,3H),7.41~7.47 (m,1H),10.62 (s,1H).Ms:m/z:299.0[M+1]+.
4-(3′,4′-二甲氧基苯基)-7,8-二羟基香豆素(4b):淡红色固体,产率63.2%;IR(cm-1):3 322(OH); 1 700(C=O); 2 954,1 604,1 519,1 505,1 440,1 020,817 (苯环); 1 257,1 142(C-O); 2 834(-OCH3).1H NMR (600 MHz,DMSO-d6)δ:3.82 (s,3H),3.84 (s,3H),6.15 (s,1H),6.80 (d,J= 8.7 Hz,1H),6.93 (d,J= 8.7 Hz,1H),7.06 (d,J= 8.2 Hz,1H),7.10 (dd,J= 8.8,4.8 Hz,2H),9.38 (s,1H),10.17 (s,1H).Ms:m/z:314.9[M+1]+.
4-(3′,4′-二甲氧基苯基)-5,7-二羟基香豆素(4c):淡红色固体,产率66.9%;IR(cm-1):3 468(OH); 1 675(C=O); 3 051,1 595,1 549,1 515,1 459,1 079,840 (苯环); 1 246,1 140 (C-O); 2 967(-OCH3).1H NMR (600 MHz,DMSO-d6)δ:3.75 (s,3H),3.79 (s,3H),5.79 (s,1H),6.19 (d,J= 2.3 Hz,1H),6.26 (d,J= 2.3 Hz,1H),6.88 (dd,J= 8.2,2.0 Hz,1H),6.95 (dd,J= 5.1,3.1 Hz,2H),10.14 (s,1H),10.42 (s,1H).Ms:m/z:315.0[M+1]+.
1.2.4 目标产物5的合成
在250 mL三口反应瓶中加入150 mL乙腈溶液,将9.6 g(37.6 mmol)碘与1.0 g(37 mmol)铝粉,回流反应3 h,冷却至室温,加入1.59 mmol化合物4,升温回流反应,TLC监测反应进程(展开剂体积比:二氯甲烷∶甲醇=6∶1),直至原料完全消失.浓缩反应液,5%亚硫酸氢钠洗涤浓缩液除去多余碘,盐酸酸化后乙酸乙酯萃取水液,浓缩蒸干有机层.
4-(3′,4′-二羟基苯基)-7-羟基香豆素(5a):浅黄色固体,产率93.4%;IR(cm-1):3 249(OH); 1 667(C=O); 1 609,1 513,1 444,1 383,1 116,839(苯环); 1 224,1 007(C-O).1H NMR (600 MHz,DMSO-d6)δ:6.04 (s,1H),6.81 (dt,J= 10.3,1.9 Hz,3H),6.90 (dd,J= 5.1,2.9 Hz,2H),7.46 (d,J= 8.5 Hz,1H),9.37 (s,1H),9.52 (s,1H),10.66 (s,1H).Ms:m/z:270.9[M+1]+.
4-(3′,4′-二羟基苯基)-7,8-二羟基香豆素(5b):浅黄色固体,产率91.7%;IR(cm-1):3 265(OH); 1 666(C=O); 2 918,1 597,1 531,1 449,1 343,1 043,847(苯环); 1 243,1 043(C-O).1H NMR (600 MHz,DMSO-d6)δ:6.01 (s,1H),6.84~6.78 (m,2H),6.91~6.86 (m,2H),6.94 (d,J= 8.8 Hz,1H),9.40 (s,3H),10.15 (s,1H).Ms:m/z:286.9[M+1]+,240.8,152.6.
4-(3′,4′-二羟基苯基)-5,7-二羟基香豆素(5c):浅黄色固体,产率90.2%;IR(cm-1):3 305(OH); 1 698(C=O); 1 597,1 522,1 442,1 348,1 083,845(苯环); 1 234,1 033(C-O).1H NMR (600 MHz,DMSO-d6)δ:5.69 (s,1H),6.18 (d,J= 2.4 Hz,1H),6.25 (d,J= 2.3 Hz,1H),6.62 (dd,J= 8.1,2.1 Hz,1H),6.75~6.69 (m,2H),9.01 (s,1H),9.11 (s,1H),10.11 (s,1H),10.40 (s,1H).Ms:m/z:286.9[M+1]+.
1.3 体外抗氧化活性测定
1.3.1 清除羟基自由基(·OH)能力的测定[14]
H2O2与Fe2+反应产生·OH,在体系中加入水杨酸捕捉并产生有色物质,该物质在510 nm下有最大吸收.分别取0.3% H2O2,1.0 mmol/L FeSO4(用10 mmol/L H2SO4溶液配置),1.0 mmol/L水杨酸(用无水乙醇配置)1.0 mL于10.0 mL试管中,再加入不同浓度的样品溶液各1.0 mL.最后以1 mL 0.3% H2O2启动反应,在37 ℃水浴中反应30 min,以蒸馏水作空白对照,在510 nm下测定反应液的吸光值,重复3次试验.计算IC50值.
·OH清除率=[A0-(A1-A2)]/A0×100%
式中,A0:1.0 mL 蒸馏水 +1.0 mL H2O2+1 mL FeSO4+1 mL 水杨酸+1.0 mL H2O2的吸光值;A1:1.0 mL 新黄酮类化合物或Vc+1.0 mL H2O2+ 1.0 mL FeSO4+1.0 mL 水杨酸 +1.0 mL H2O2的吸光值;A2:1.0 mL新黄酮类化合物或Vc +1.0 mL H2O2+1.0 mL FeSO4+1.0 mL 无水乙醇 +1.0 mL H2O2;IC50:清除率达到50%时,所需抗氧化剂的浓度(g/L).
1.3.2 清除DPPH自由基能力的测定[15]
准确称取10 mg DPPH于50 mL 容量瓶中,用无水乙醇溶解定容,避光保存,使用前稀释成0.04 g/L使用.取2.0 mL 不同浓度的样品溶液于10.0 mL 试管中,加入2.0 mL 上述的DPPH 溶液,摇匀,避光室温保存30 min,用紫外-可见分光光度计于517 nm 测吸光值,以无水乙醇作空白,重复3次试验.计算IC50值.
DPPH 自由基的清除率=[A0-(A1-A2)]/A0×100%
式中,A1:2.0 mL DPPH 溶液+2.0 mL新黄酮类化合物或Vc的吸光值;A2:2.0 mL 新黄酮类化合物或Vc+2.0 mL无水乙醇的吸光值;A0:2.0 mL DPPH 溶液+2.0 mL 无水乙醇的吸光值;IC50:清除率达到50%时,所需抗氧化剂的浓度(g/L).
2 结果与讨论
2.1 合成方法
本路线以孙捷课题组报道的氟乙酸法[12]合成了3个含有多个甲氧基基团的新黄酮类化合物4a-4c,然后选取新制碘化铝为催化剂进行这3个化合物的脱甲基反应,分别得到5a-5c3个新黄酮类化合物.该反应过程无需氮气保护,反应时间短,条件温和,各步反应操作简单,而且产物无需经过柱层析、重结晶等纯化过程,产率均在90%以上,具有较好的经济性和实用性.
2.2 脱甲基前后抗氧化活性的比较
分别通过测定新黄酮类化合物4a-4c和5a-5c对羟基自由基和DPPH自由基的清除作用来评价其抗氧化活性,分析脱甲基前后活性强弱变化,结果如表1所示.
由表1可知无论是清除羟基自由基还是DPPH自由基,脱甲基后的产物活性均增强,说明4a-4c的C3′,C4′上的甲氧基变成羟基有助于该类化合物抗氧化活性的增强.在清除羟基自由基方面,化合物5a、4b、5b和5c的IC50值均小于相对照药品维生素C,分析其结构发现有一个共同的特点:均具有邻二羟基结构.在清除DPPH自由基方面,除化合物4a以外,均具有中等到较强的活性,其中化合物5a、5b和5c的活性均强于Vc.由此说明多羟基结构与抗氧化活性具有一定关系.

表1 化合物4a-4c和5a-5c的抗氧化活性Table 1 In vitro antioxidant activities of compounds 4a-4c and 5a-5c
3 结论
本文在考虑了已有文献报道的脱甲基的方法,选用价廉易得的新制碘化铝为催化剂,在没有氮气保护的条件下进行新黄酮类化合物的脱甲基反应.不仅成本较低,而且产率均高于90%,初步研究对该类化合物具有广泛的应用,适合市场大规模生产,这也为进一步研究新黄酮类化合物,寻找药物先导化合物提供了新方法,具有重要的应用价值.抗氧化试验表明,部分多羟基结构的新黄酮类化合物具有强于Vc的抗氧化活性,具有进一步研究的价值.
[1] ZHANG K Y,DING W X,SUN J,et al.Antioxidant and antitumor activities of 4-arylcoumarins and 4-aryl-3,4-dihydrocoumarins [J].Biochimie,2014,107(B):203-210.
[2] GUERRERO-ANALCO J,MEDINA-CAMPOS O,BRINDIS F,et al.Antidiabetic properties of selected Mexican copalchis of the Rubiaceae family [J].Phytochemistry,2007,68(15):2087-2095.
[3] COMBES S,BARBIER P,DOUILLARD S,et al.Synthesis and biological evaluation of 4-arylcoumarin analogues of combretastatins.Part 2 [J].Journal of Medicinal Chemistry,2011,54(9):3153-3162.
[5] KONG Y,FU Y J,ZU Y G,et al.Cajanuslactone,a new coumarin with anti-bacterial activity from pigeon pea [Cajanuscajan(L.) Millsp.] leaves [J].Food Chemistry,2010,121(4):1150-1155.
[6] TAECHOWISAN T,LU C H,SHEN Y M,et al.Secondary metabolites from endophyticStreptomycesaureofaciensCMUAc130 and their antifungal activity [J].Microbiology,2005,151(5):1691-1695.
[7] WU S F,CHANG F R,WANG S Y,et al.Anti-inflammatory and cytotoxic neoflavonoids and benzofurans from Pterocarpus santalinus [J].Journal of Natural Products,2011,74(5):989-996.
[8] 李娜,孙捷,孙敬勇,等.4-芳基香豆素类化合物的活性及合成方法研究进展[J].中国医药工业杂志,2015,46(12):1352-1365.
LI N,SUN J,SUN J Y,et al.Progress in bioactivities and synthetic methods of 4-arylcoumarins [J].Chinese Journal of Pharmaceuticals,2015,46(12):1352-1365.
[9] RAJALE T,SHARMA S,STROUD D A,et al.An efficient synthesis of 4-substituted coumarin derivatives via a palladium-catalyzed Suzuki cross-coupling reaction [J].Tetrahe-dron Letters,2014,55(49):6627-6630.
[10] KHADDOUR Z,AKRAWI O A,SULEIMAN A S,et al.Regioselective Suzuki-Miyaura cross-coupling reactions of the bis(triflate) of 4,7-dihydroxycoumarin [J].Tetrahe-dron Letters,2014,55(32):4421-4423.
[11] 孙捷.4-芳基香豆素及去甲斑蝥酰亚胺类化合物的合成及初步生物活性[D].北京:中国科学院研究生院,2011:10-11.
SUN J.Synthesis and preliminary biological studies on 4-arylcoumarin and norcantharimide analogues [D].Beijing:Graduate University of Chinese Academy of Sciences,2011:10-11.
[12] GOZUM V P,MEBANE R C.Solvent-free and atom efficient conversion of aldehydes into nitriles [J].Green Chemistry Letters and Reviews,2013,6(2):149-150.
[13] LEE J M,TSENG T H,LEE Y J.An efficient synthesis of neoflavonoid antioxidants based on montmorillonite K-10 catalysis [J].Synthesis,2001,15:2247-2254.
[14] 朱璐,董福,冯叙桥,等.浸提法、超声波法和微波法提取紫薯花色苷的抗氧化性比较研究[J].食品科学,2015,36(19):83-88.
ZHU L,DONG F,FENG S Q,et al.Antioxidant activities of anthocyanins extracted by organic solvent,ultrasonic assisted or microwave assisted method from purple sweet potato or microwave assisted method from purple sweet potato [J].Food Science,2015,36(19):83-88.
[15] 南海娟,莫海珍,颜振敏,等.槲树叶黄酮的抗氧化特性研究[J].中国食品添加剂,2013(2):83-87.
NAN H J,MO H Z,YAN Z M,et al.Study on antioxidant activity of flavonoids from the leaves of quercus dentate [J].China Food Additives,2013(2):83-87.
[责任编辑:张普玉]
Demethylation of neoflavonoids and their antioxidant activity
LI Na1,2,3,4,WANG Xiaojing2,3,4*,SUN Jie2,3,4,WANG Bing1,2,3,4,LI Huijuan1,2,3,4
(1.SchoolofMedicineandLifeSciences,UniversityofJinan-ShandongAcademyofMedicalSciences,Jinan250200,Shandong,China; 2.InstituteofMateriaMedica,ShandongAcademyofMedicalSciences,Jinan250062,Shandong,China; 3.KeyLaboratoryforBiotech-DrugsMinistryofHealth,Jinan250062,Shandong,China; 4.KeyLaboratoryforRare&UncommonDiseasesofShandongProvince,Jinan250062,Shandong,China)
Neoflavonoids 4a-4c were prepared according to the literatures using 3,4-dimethoxybenzaldehyde (1) as the starting material in the presence of trifluoroacetic acid.The compounds 4a-4c bea-ring two methoxy group at the aryl in C4 could be easily converted to neoflavonoids 5a-5c bearing se-veral hydroxyl groups under the catalysis of aluminium iodide at reflux in acetonitrile.Notably,the yield of this demethylating reaction was >90% without complex purification.The structure was confirmed by1H NMR and ESI-MS. The antioxidant activity of these 6 compounds were evaluated by means of sca-venging 2,2-diphenyl-1-picrylhydrazyl (DPPH) and hydroxyl radical.It was found that its antioxidant activity did increased after the reaction of demethylation.
neoflavonoids; demethylation; aluminium iodide; antioxidant activity
2016-10-17.
山东省医学科学院医药卫生科技创新工程,山东省自然科学基金(ZR2015YL041).
李 娜(1990-),女,硕士生,研究方向为药物化学.*
,E-mail:307801198@qq.com.
O625
A
1008-1011(2017)01-0051-05
