七氟醚麻醉对子代大鼠海马神经元自噬的影响
2017-03-07卫晓丰谭秀华梁建军
卫晓丰,谭秀华,梁建军,詹 鸿
七氟醚麻醉对子代大鼠海马神经元自噬的影响
卫晓丰1,谭秀华1,梁建军2*,詹 鸿1
目的 探讨七氟醚麻醉对子代大鼠海马神经元自噬的影响。方法 孕5~7 d的SD雌鼠18只,采用随机数字表法将其分为3组(n=6):对照组(C组)、七氟醚组(S组)、七氟醚+自噬抑制剂wortmannin组(SW组)。C 组母鼠仅置于麻醉箱内,通入相同流量氧气暴露4 h,S组和SW组母鼠给予2.8%七氟醚吸入麻醉4 h。SW组子代大鼠于出生后1~3 d腹腔注射0.5 mg/kg自噬抑制剂wortmannin,C组和S组于相同时点腹腔注射等量的生理盐水对照。于出生后 22 d,对各组子代大鼠进行水迷宫实验,测定其学习记忆功能,出生后28 d,完成水迷宫测试后处死子代大鼠,并取其海马组织。采用TUNEL染色测定子代大鼠海马组织内神经元的凋亡率,采用Western blot法检测子代大鼠海马组织内微管相关蛋白l轻链3(LC3)Ⅱ/LC3Ⅰ比值作为自噬活性的指标。结果 S组、C组子代大鼠逃避潜伏期较C组,穿越平台次数比较差异无统计学意义(P>0.05),SW组子代大鼠逃避潜伏期较C组延长,穿越平台次数较C组减少(P<0.05)。与C组比较,S组和SW组子代大鼠海马神经元的凋亡率和LC3Ⅱ/LC3Ⅰ比值均升高(P<0.05);与S组比较,SW组子代大鼠海马神经元的LC3Ⅱ/LC3Ⅰ比值降低(P<0.05)。结论 大鼠孕期七氟醚麻醉对子代学习记忆功能无影响,其机制与激活生理性自噬对抗神经元凋亡有关。
七氟醚;麻醉;神经元;自噬;凋亡;海马
0 引言
临床上孕妇在妊娠期间行非产科手术常采用全身麻醉,并且常应用具有循环稳定特点的七氟醚[1]。有研究表明,七氟醚麻醉可促进幼龄大鼠海马神经元凋亡,从而导致认知功能障碍[2]。但也有研究证实,七氟醚麻醉对子代大鼠认知功能无影响[3-4],其机制尚不明确。自噬是细胞清除体内错误蛋白质和损害的细胞器,具有维持内环境稳定的作用[5]。生理性自噬增强对改善认知障碍、减缓神经退行性疾病发展具有积极意义[6],然而自噬是否影响七氟醚麻醉后子代大鼠的学习记忆能力鲜有报道。因此,本研究旨在探讨七氟醚麻醉对子代大鼠海马神经元自噬的影响,为临床研究提供参考。
1 材料与方法
1.1 动物与分组 健康孕5~7 d SD雌鼠18只,体重250~280 g,由广州医科大学医学动物实验中心提供。于室温25 ℃、湿度55%~65%的环境中饲养,单笼饲养,自由摄食和饮水。采用随机数字表法将其分为3组(n=6):对照组(C组)、七氟醚组(S组)、七氟醚+自噬抑制剂wortmannin组(SW组)。C组母鼠仅置于麻醉箱内,通入相同流量氧气暴露4 h,S组和SW组母鼠接受2.8%七氟醚吸入麻醉4 h。SW组子代大鼠于出生后1~3 d腹腔注射0.5 mg/kg自噬抑制剂wortmannin (货号:IPA1003-0001MG,上海前尘生物科技有限公司),C组和S组于相同时点腹腔注射等体积的二甲基亚砜(DMSO)对照。
1.2 七氟醚麻醉处理 参考相关文献[3]对孕鼠进行七氟醚麻醉处理,将S组和SW组孕鼠置于自制麻醉箱(50 cm×30 cm×30 cm)中,接受2.8%七氟醚吸入麻醉4 h。箱底铺钠石灰,麻醉箱放于37 ℃恒温水浴箱内,以排除CO2及温度对实验的干扰。麻醉箱有2个通气孔,上孔连接麻醉机,用于通入七氟醚,氧流量2 L/min,氧浓度50%,下孔位于对侧,连接Ohmeda麻醉气体监测仪(Datex-Ohmeda公司,芬兰)监测MAC值,维持麻醉。C组仅置于麻醉箱内对照,不进行七氟醚麻醉。采用便携式血氧仪监测麻醉期间孕鼠的脉搏血氧饱和度及心率。剔除脉搏血氧饱和度低于95%或心率下降幅度超过基础值30%的大鼠。
1.3 行为学测定 水迷宫法测定子代大鼠学习记忆功能,于出生后22 d取各组母鼠的子鼠,采用ZH0065型Morris水迷宫系统(京硕林苑科技有限公司)测定认知功能,持续7 d,第22~27天进行定位航行实验,第28天进行空间探索实验,实验均于上午9∶00开始,维持水温23 ℃。将子代大鼠从一个固定入水点面向池壁置入水中,记录150 s内寻找平台的时间为逃避潜伏期,并使其在平台上停留30 s。若150 s内未能找到平台,则将其引上平台,停留30 s。随后撤去隐匿于水中的平台,将子代大鼠从固定处放入水中,记录150 s内子代大鼠游过前期放置平台所在象限(第Ⅱ象限)的次数为穿越平台次数。
1.4 神经元凋亡检测 完成空间探索实验后,子代大鼠快速断头处死,快速开颅,分离出双侧海马,取3只孕鼠子代大鼠的海马,在Bonin′s液中固定24 h,组织块经常规脱水、透明、浸蜡、包埋成蜡块,延垂直脊髓长轴方向连续切片,片厚5 μm,制备切片分别用于TUNEL染色。切片常规二甲苯脱腊梯度酒精脱水后蒸馏水冲洗。3% H2O2室温处理10 min,蒸馏水冲洗3 min×3次。标本片加TBS 1∶200新鲜稀释ProteinaseK 37 ℃消化15 min,TBS洗1 min×3次。标本片加标记缓冲液(Labeling,buffer),20 μL/片,以保持切片湿润,并置样品于湿盒中,37 ℃标记2 h,TBS洗3 min×3次。用1%的TBS稀释SABC,均匀后50 μL/片加至切片,37 ℃反应60 min,TBS洗5 min。DAB显色10 min,蒸馏水冲洗5 min。苏木素复染1 min。TBS洗,蒸馏水洗。梯度酒精脱水、二甲苯透明、中性树脂封片。应用Image-pro plus 6.0医学图像分析系统分析处理,高倍视野下计算子代大鼠海马神经元的凋亡率,凋亡率=凋亡细胞数/总细胞数×100 %。
1.5 神经元自噬检测 将其余3只孕鼠子代大鼠海马用冰冷生理盐水冲洗,经12%分离胶、5%浓缩胶SDS-聚丙烯酰胺凝胶电泳后,通过电转膜仪100 mA恒流转膜2 h,转印蛋白至硝酸纤维素膜,用含5%脱脂奶粉的洗脱缓冲液室温封闭1 h,加入兔抗大鼠LC3抗体(1∶5 000,Santa Cruz公司,美国),4 ℃孵育过夜,洗后加过氧化物酶标记的山羊抗兔Ⅱ抗(1∶3 000,Santa Cruz公司,美国),37 ℃孵育l h;洗后再移入显色液中,曝光后显影、定影,最后扫描并图像分析。
2 结果
2.1 子代大鼠水迷宫行为学的变化 与C组比较,SW组子代大鼠逃避潜伏期延长,穿越平台次数较C组减少(P<0.05)。见表1。
2.2 子代大鼠海马神经元凋亡和自噬的变化 与C组比较,S组和SW组子代大鼠海马神经元的凋亡率和LC3Ⅱ/LC3 Ⅰ比值均升高(P<0.05);与S组比较,SW组子代大鼠海马神经元的LC3Ⅱ/LC3 Ⅰ比值降低(P<0.05)。见表2。

表1 各组子代大鼠水迷宫行为学变化比较(n=6)
注:与C组比较,*P<0.05
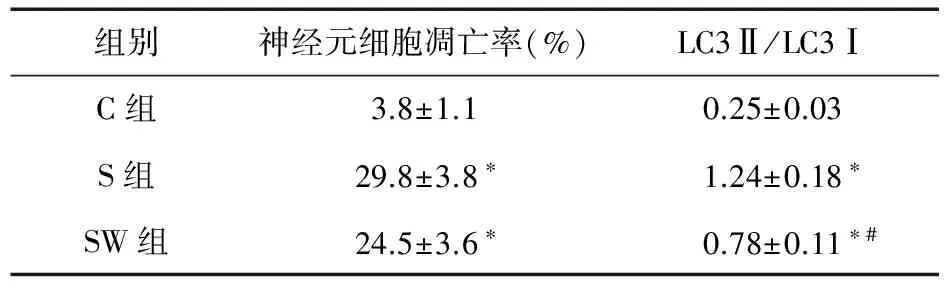
表2 各组子代大鼠海马神经元细胞凋亡率和LC3Ⅱ/LC3Ⅰ比较(n=3)
注:与C组比较,*P<0.05;与S组比较,#P<0.05
3 讨论
本研究采用孕早期母鼠作为麻醉处理对象,选择其子代大鼠为研究对象,从而探讨孕鼠七氟醚麻醉对子代神经发育的影响。本实验采用李梦圆等[3]应用的七氟醚浓度与时点,建立动物模型,同时,麻醉期间各组孕鼠的生理指标均在正常范围内,排除了生理性干扰对其子代大鼠的影响。本研究结果表明,S组子代大鼠行为学与C组无显著差异,与文献[3]一致,提示模型制备成功。
七氟醚作为目前最常用的吸入麻醉剂[7-8]被广泛应用于孕妇的手术。研究表明,所有吸入麻醉药均可通过胎盘作用于胎儿,若浓度大,血药浓度高,则会对胎儿产生抑制作用[9-10]。进一步研究指出,七氟醚既可增加新生大鼠脑细胞凋亡[11],又可抑制突触后膜乙酰胆碱传递,进而抑制突触可塑性[12]。神经元凋亡和突触可塑性障碍均可导致学习认知功能障碍。但也有大量研究证实,不同孕期接受不同浓度的七氟醚麻醉,对子代大鼠的学习认知功能均无影响,提示新生神经元被七氟醚麻醉造成损伤的同时,将启动自身保护系统。本研究证实了这种自身保护系统可能与海马内自噬有关。
自噬是保持细胞正常代谢及功能必不可少的生理过程,其在神经损伤和修复过程中发挥双重作用。自噬可以降解胞质大分子和细胞器,为蛋白质合成提供能量和氨基酸,同时能降解异常蛋白质,防止其在神经元内积聚;但是自噬的过度活跃会形成自噬应激,可能对细胞有毒性作用,并参与神经变性疾病的致病过程[13]。自噬增强时,胞质内LC3Ⅰ在泛素样反应酶作用下,与磷脂酰乙醇胺偶联生成LC3Ⅱ,并与新生成的自噬体膜结合,因此,LC3Ⅱ/LC3Ⅰ可准确地反映细胞的自噬水平[14]。自噬可能通过清除破损线粒体延迟凋亡和对抗凋亡,自噬体吞噬去极化的线粒体,抑制细胞色素C释放至胞浆,抑制caspase家族激活,从而减少细胞凋亡[15-16]。本研究证实,孕早期七氟醚麻醉造成子代大鼠海马神经元凋亡增强,然而,在后天学习记忆过程中,生理性自噬也随之增加,对抗凋亡,使得子代大鼠并未表现出学习认知障碍,但在使用自噬抑制剂wortmannin打破上述平衡后,子代大鼠将表现为学习认知能力障碍。
综上所述,孕期七氟醚麻醉对子代大鼠的学习记忆功能无影响,其机制与激活生理性自噬对抗神经元凋亡有关。
[1]Zand F,Hadavi SM,Chohedri A,et al.Survey on the adequacy of depth of anaesthesia with bispectral index and isolated forearm technique in elective Caesarean section under general anaesthesia with sevoflurane[J].Br J Anaesth,2014,112(5):871-878.
[2]Satomoto M,Satoh Y,Terui K,et al.Neonatal exposure to sevoflurane induces abnormal social behaviors and deficits in fear conditioning in mice[J].Anesthesiology,2009,110(3):628-637.
[3]李梦圆,赵为禄,汤洋,等.孕早期七氟醚麻醉对子代大鼠认知功能的影响[J].中华麻醉学杂志,2011,31(12):1431-1433.
[4]潘永英,赵柏松,汪自欣,等.孕晚期七氟醚麻醉对子代大鼠认知功能和海马神经元树突棘发育的影响[J].国际麻醉学与复苏杂志,2016,37(2):117-121.
[5]Levine B,Kroemer G.Autophagy in the pathogenesis of disease[J].Cell,2008,132(1):27-42.
[6]Son JH,Shim JH,Kim KH,et al.Neuronal autophagy and neurodegenerative diseases[J].Exp Mol Med,2012,44(2):89-98.
[7]肖春龙,赵婷,张应平.第三代喉罩七氟醚吸入麻醉在小儿骨科手术中的应用观察[J].沈阳医学院学报,2015,17(1):16-18.
[8]汪芳俊,胡建华,万勇,等.经喉罩自主吸入七氟醚用于小儿短小手术麻醉的可行性研究[J].中国小儿急救医学,2015,22(5):332-336.
[9]Li Y,Liu C,Zhao Y,et al.Sevoflurane induces short-term changes in proteins in the cerebral cortices of developing rats[J].Acta Anaesthesiol Scand,2013,57(3):380-390.
[10]Feng X,Liu JJ,Zhou X,et al.Single sevofIurane exposure decreases neuronal nitric oxide synthase levels in the hippocampus of developing rats[J].Br J Anaesth,2012,109(2):225-233.
[11]Pellegrini L,Bennis Y,Velly L,et al.Erythropoietin protects newborn rat against sevoflurane induced neurotoxicity[J].Paediatr Anaesth,2014,24(7):749-759.
[12]Zheng H,Dong Y,Xu Z,et al.Sevoflurane anesthesia in pregnant mice induces neurotoxicity in fetal and offspring mice[J].Anesthesiology,2013,118(3):516-526.
[13]Puleston DJ,Simon AK.Autophagy in the immune system[J].Immunology,2014,141(1):1-8.
[14]王丽萍,陈国忠,邓小明.自噬在低氧预处理BMSC在大鼠脊髓缺血再灌注损伤组织中存活的作用:离体和在体实验[J].中华麻醉学杂志,2015,35(11):1370-1376.
[15]Hildeman D,Jorgensen T,Kappler J,et al.Apoptosis and the homeostatic control of immune responses[J].Curr Opin Immunol,2007,19(5):516-521.
[16]Zhou F,Yang Y,Xing D.Bcl-2 and Bcl-xL play important roles in the crosstalk between autophagy and apoptosis[J].FEBS J,2011,278(3):403-413.
Influence of sevoflurane anesthesia on hippocampal neuron autophagy in offspring rats
WEI Xiao-feng1,TAN Xiu-hua1,LIANG Jian-jun2*,ZHAN Hong1
(1.Department of Anesthesiology,the Third Affiliated Hospital of Guangzhou Medical University,Guangzhou 510150,China;2.Department of Anesthesiology,Sun Yat-Sen Memorial Hospital,Sun Yat-Sen University,Guangzhou 510280,China)
Objective To explore the influence of sevoflurane anesthesia on hippocampal neuron autophagy in offspring rats.Methods A total of 18 female SD rats with 5~7 d pregnancy were randomly divided into 3 groups (n=6):control group (group C),sevoflurane group (group S) and sevoflurane+wortmannin (autophagy inhibitory agent) group (group SW).Maternal rats in group C were exposed to the same flow of oxygen for 4 h in the anesthesia box,while maternal rats in group S and group SW were given inhalation anesthesia with 2.8% sevoflurane for 4 h.Offspring rats in group SW were given 0.5 mg/kg wortmannin via intraperitoneal injection at 1~3 d after birth,while offspring rats in group C and group S were given the same amount of saline at the same time point via intraperitoneal injection.Water maze test was carried out to determine the learning and memory function of offspring rats in each group at 22 d after birth.The offspring rats were sacrificed at 28 d after birth after the completion of water maze test,then the hippocampus were taken.The apoptosis rate of hippocampus neuron in offspring rats was measured by TUNEL staining.As the indicator for autophagy activity,the ratio of microtubule associated protein 1 light chain 3 (LC3)Ⅱ/LC3Ⅰ in hippocampus neuron of offspring rat was detected by using Western bolt.Results There was no significant difference in escape latency or the number of times the offspring rats crossed the platform between group S and group C (P>0.05),and the latency in group SW was shorter than that of group C with less number of times the offspring rats crossed the platform (P<0.05).The apoptosis rate of hippocampal neurons and the LC3Ⅱ/LC3Ⅰratio of offspring rats in group S and group SW was higher than those of group C (P<0.05),while the LC3Ⅱ/LC3Ⅰratio in offspring rats in group SW was lower than that of group S (P<0.05).Conclusion Sevoflurane anesthesia at early pregnancy has no effect on learning and memory function of offspring rats,the mechanism by which it activates physiologic autophagy is associated with anti-apoptosis of neurons.
Sevoflurane;Anesthesia;Neuron;Autophagy;Apoptosis;Hippocampus
2016-07-15
1.广州医科大学附属第三医院麻醉科,广州 510150;2.中山大学附属孙逸仙纪念医院麻醉科,广州 510280
*通信作者
10.14053/j.cnki.ppcr.201702004
