ADC值及Ktrans值与前列腺癌Gleason评分的相关性研究
2017-03-06安徽省马鞍山市人民医院影像科安徽马鞍山243000
安徽省马鞍山市人民医院影像科(安徽 马鞍山 243000)
何永胜 戚 轩 张 敏杨宏楷
ADC值及Ktrans值与前列腺癌Gleason评分的相关性研究
安徽省马鞍山市人民医院影像科(安徽 马鞍山 243000)
何永胜 戚 轩 张 敏杨宏楷
目的探讨前列腺癌表观弥散系数(ADC)值及容积转换常数(Ktrans)与前列腺癌病理分级(Gleason评分)的相关性,并对两者进行比较。方法回顾性分析病理证实的前列腺癌患者30例,根据病理结果中的Gleason评分将患者分为高分化、中分化及低分化组,比较组间ADC值及Ktrans值的差异,并分析ADC值、Ktrans值及Gleason评分间的相关性。结果三组前列腺癌ADC值及Ktrans值组间整体差异均具有统计学意义(P<0.01)。ADC值与Gleason评分、Ktrans值呈负相关(r=-0.633,P<0.01,r=-0.609,P<0.01),Ktrans与Gleason评分呈正相关(r=0.579,P<0.01)。高分化组与中低分化组之间的ADC值及Ktrans值差异均具有显著统计学意义(P<0.01),利用ROC曲线分析显示ADC值与Ktrans值的曲线下面积分别为0.861、0.838,区分高分化组与中低分化组的敏感性和特异性分别为83.3%、88.9%,75.0%、77.8%。结论前列腺癌的ADC值及Ktrans值与Gleason评分之间具有相关性,且ADC值与Gleason评分之间的相关性较Ktrans值高,它们能够在一定程度上帮助预测前列腺癌的分化程度。
表观弥散系数;容积转换常数;前列腺癌;Gleason评分
前列腺癌(Prostate Cancer,PCa)是老年男性常见的恶性肿瘤之一,肿瘤的分期及分级直接影响着临床治疗方案的选择和对预后的判断,而前列腺穿刺活检术是一种有创的检查方法,会带来一些严重的并发症,其发生率为2%~4%[1]。因此,寻找一种安全、无创的检查方法用以预测前列腺癌的分期及分级尤为重要。常规MRI是目前诊断前列腺疾病常用的影像学检查,但仅限于形态学诊断,准确性欠佳[2],随着扩散加权成像(diffusion weighted imaging,DWI)和动态增强扫描(dynamic contrast-enhanced MRI,DCE-MRI)等定量影像检查技术的发展,已逐渐开始应用在前列腺癌的诊断中。本研究旨在探讨ADC值及Ktrans值与前列腺癌Gleason评分的相关性。
1 材料与方法
1.1 研究对象 收集2015年5月至2016年7月在我院就诊的30例前列腺癌患者资料,均行前列腺常规MRI,DWI及定量DCE-MRI扫描。前列腺特异性抗原(PSA)值:3.6~100ng/ml,年龄50~84岁,平均年龄73.33岁。患者检查前均未穿刺活检和治疗,且于检查后2周内经手术或穿刺活检病理证实。
1.2 使用设备及参数 采用1.5T超导磁共振扫描仪(GE,Signa HDxt),8通道体部相控阵线圈。(1)DWI:TR=4600ms、TE=76.5ms、矩阵=128×156,层厚=5mm,层间隔=1mm。扩散梯度因子(b)值:800s/ mm2。(2)DCE-MRI:采用3D LAVA序列,扫面范围为精囊腺至前列腺基底部。TR=3.6ms、TE=1.7ms、矩阵256×170,层厚=4.2mm,层数40层,先行多翻转角扫描(2o,6o,8o,10o,15o),以15o翻转角进行连续40组(7s/组)扫描,第2组结束以2.5 ml/s的速度按0.2ml/kg注入对比剂(欧乃影,GE),再注入10ml 0.9%生理盐水注射液冲洗。
1.3 图像处理及数据测定由两名主治以上医师同时根据前列腺常规MRI、DWI及DCE-MRI图像进行诊断,意见不符时,两者讨论得出一致结论。对照穿刺或手术病理结果,结合MRI图像确定感兴趣区(ROI),尽量保证ROI大小、范围一致,若遇到尿道、出血、坏死、囊变及血管等区域时应避开,连续测量3次取平均值。DCE-MRI定量分析采用Omni Kinetics软件(GE,Healthcare),获得感兴趣区的定量参数Ktrans值。在ADW4.5后处理工作站测量病灶的ADC值(b=800s/ mm2)。
1.4 肿瘤病理分级 以病理结果为“金标准”,采用Gleason评分系统(5级10分制)对肿瘤进行分级,参考国际公认前列腺癌评分系统[3],将前列腺癌患者按Gleason评分分为高分化组(≤6分)、中分化组(=7分)、低分化组(≥8分)。
1.5 统计学处理 采用SPSS 19.0统计学软件分析数据,对三组间的参数先进行方差齐性检验,然后再采用单因素方差分析(One-factor Analysis of Variance,one-way ANOVA),并进行组间两两比较。对两组间比较采用独立样本t检验,并进行受试者工作特征(receiver operating characteristic,ROC)曲线分析,获得其相应的曲线下面积、诊断阈值、敏感性及特异性。采用Pearson相关分析检验ADC值、Ktrans值及Gleason评分之间的相关性,P<0.05表示差异有统计学意义。
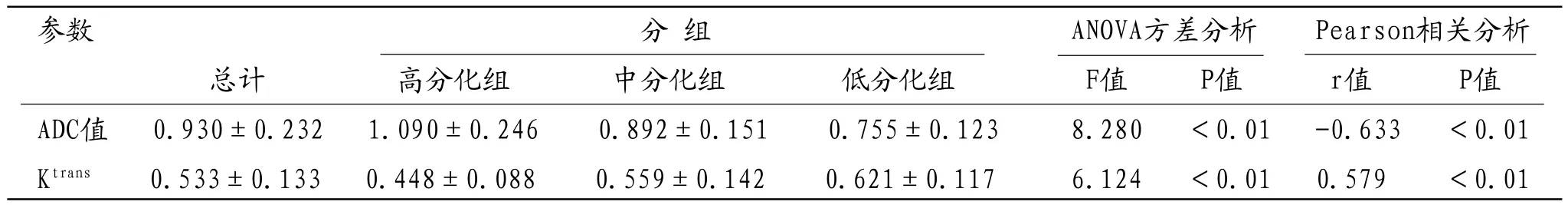
表1 前列腺癌的ADC值及Ktrans值方差分析及与Gleason评分之间的相关分析
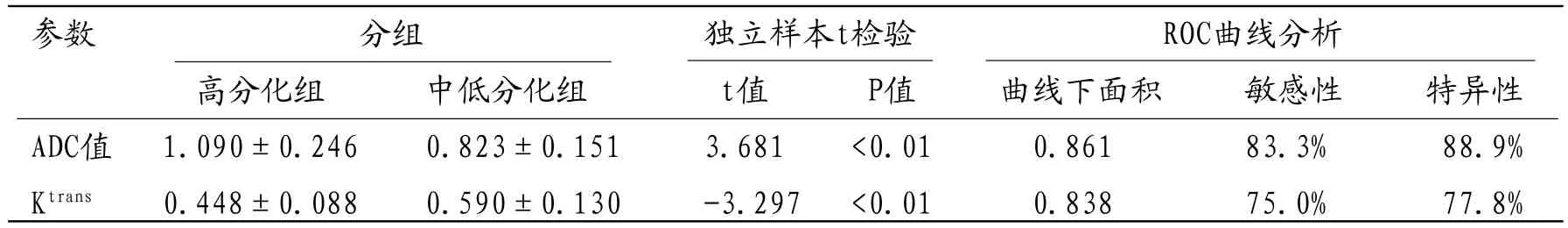
表2 高分化组及中低分化组前列腺癌的ADC值及Ktrans值比较
2 结 果
2.1 病理结果 30例前列腺癌患者中Gleason评分≤6分的12例,占40%。Gleason评分=7分的9例(图1-4),≥8分的9例,两者各占30%。
2.2 前列腺癌不同分组间的ADC值及Ktrans值比较
2.2.1 不同分组间的ADC值比较:三组患者之间的平均ADC值由大到小的顺序为:高分化组、中分化组、低分化组(图5),经单因素方差分析,结果显示三组间的ADC值差异具有显著统计学意义(F=8.28,P<0.01)(表1)。组间两两比较分析显示高、低分化组之间及高、中分化组之间的的ADC值差异有统计学意义(P<0.01,P<0.05),而中、低分化组之间的ADC值差异无统计学意义(P=0.137)。高分化组与中低分化组ADC值的差异具有显著统计学意义(t=3.681,P<0.01),AUCROC为0.861(图7),最佳诊断界值为0.961×10-3mm2/s,诊断敏感性和特异性分别为83.3%、88.9%(表2)。
2.2.2 不同分组间的Ktrans值比较:三组患者之间的平均Ktrans值由大到小的顺序为:低分化组、中分化组、高分化组(图6),Ktrans在三组之间的整体差异具有显著统计学意义(F=6.124,P<0.01)(表1)。组间两两比较分析显示高、低分化组之间及高、中分化组之间的Ktrans值差异有统计学意义(P<0.01,P<0.05),中、低分化组之间的Ktrans值没有统计学意义(P=0.269)。高分化组与中低分化组Ktrans值的差异具有显著统计学意义(t=-3.297,P<0.01),AUCROC为0.838(图7),最佳诊断界值为0.498min-1,诊断敏感性和特异性分别为75.0%、77.8%(表2)。
2.3 前列腺癌的ADC值、Ktrans值及Gleason评分相关性 采用Pearson相关性分析PCa的ADC值、Ktrans值及Gleason评分之间相关性,结果显示,ADC值与Gleason评分呈负相关(r=-0.633,P<0.01),Ktrans值与Gleason评分呈正相关(r=0.579,P<0.01)(表1),随着Gleason评分的增加,ADC值呈下降趋势,Ktrans值呈上升趋势,ADC值与Ktrans值呈负相关(r=-0.609,P<0.01) (图8-10)。

图1-4 男性,66岁,图1 T2WI-FS;图2 ADC图;图3 Ktrans伪彩图;图4 术后病理结果:前列腺癌,Gleason评分:4+3=7(HE×100)。图5-6 不同分组间ADC值及Ktrans值的差异。图7 ADC值及Ktrans值对高分化组与中低分化组的诊断效能,AUCROC分别为0.861、0.838。图8-10 ADC、Ktrans、Gleason评分之间的相关性。
3 讨 论
不同病理分级的前列腺癌生物学特性有显著差异,这种差异直接影响临床治疗方案的选择、以及对疗效和预后的评估。前列腺癌的Gleason分级系统可以反映前列腺癌组织形态、结构特征与生物学行为,是目前已得到广泛认可的评估前列腺癌恶性程度的病理学标准,且被认为是评估预后最有意义的指标[4]。Gleason评分由主要结构和次要结构分级两部分组成,两种结构均分为5级(1级预后最好,5级预后最差),不同分级与肿瘤细胞组织排列方式、腺体分化程度、周边浸润状况等相关[5]。因此评分越高说明肿瘤分化程度越低,侵袭性越大,预后越差,复发的可能性越大。
恶性肿瘤的细胞内核质比高,细胞生长速度快,密度高,细胞外间隙减小,所以细胞内及细胞外组织间隙水分子运动情况也能够反映恶性肿瘤的分化程度。DWI是目前唯一能够在活体组织中监测水分子扩散运动的状态,从而可以提供组织细胞成分、密度等信息,在颅内应用较多,而在前列腺癌中应用的报道相对较少[6-7]。以ADC值作为量化指标,ADC 值越低,表示水分子扩散运动越受限。本研究结果显示高分化、中分化及低分化前列腺癌三组间的ADC值整体差异有显著统计学意义(P<0.01),但是中、低分化组之间的ADC值无统计学意义。Woodfield C A等[8]对51名患者81个病理为前列腺癌的活检区研究也显示ADC值在中分化组与低分化组之间差异无统计学意义(P=0.157)。原因可能与Gleason评分为7分的前列腺癌中,主评分为4的肿瘤恶性倾向明显高于主评分为3的肿瘤[9],卢艳丽等[10]研究也表明Gleason评分为4+3的前列腺癌组的平均rADC值低于Gleaon评分为3+4的前列腺癌组,本研究中Gleason评分为4+3的前列腺癌患者有6例,Gleason评分3+4的有3例,使中分化组中肿瘤的恶性程度相对偏高,导致中分化组与低分化组之间的ADC值无明显统计学意义,本文将患者分为高分化组和中低分化两组,结果ADC值差异具有显著统计学意义(P<0.01),与王卓楠[11]等研究一致。此外本研究显示前列腺癌的ADC值与对应的Gleason评分之间存在显著的负相关性(r=-0.633,P<0.01),与张刚等[12-13]研究结果相一致,表明ADC值随着前列腺癌Gleason评分的升高呈下降的趋势,能够对前列腺癌的分级有着很好的预测价值。
DCE-MRI的定量参数Ktrans主要用以评价组织灌注、新生血管的生成及血管壁的渗透性,它在前列腺疾病研究中的应用日益增多,但前列腺癌的诊断与鉴别诊断是目前关注的焦点,各定量参数与前列腺癌Gleason评分之间的相关性研究并不多。前列腺癌的生长速度与肿瘤能够诱导生成新生血管的多少有密切关联,因此理论上Ktrans参数能够提供前列腺癌分化程度相关信息。本研究结果显示高、中、低分化组之间的Ktrans值整体差异有统计学意义(P<0.01),Ktrans值与Gleason评分也呈正相关(r=0.579,P<0.01),结果高于朱海滨等[14]对78例前列腺癌的两者相关性统计学结果(r=0.351,P<0.05)。Bigler S A等[15]研究显示前列腺癌的平均微血管密度与Gleason评分、肿瘤的分期和预后相关。随着Gleason评分的增加,Ktrans值呈上升趋势,这可能是因为随着Gleason评分的增加,肿瘤组织分化程度减低,组织细胞异型性增加,细胞代谢及增殖加快、新生的毛细血管增多,使平均微血管密度增加,同时伴有血管内皮生长因子的过度表达,导致组织灌注及毛细血管通透性升高,Ktrans值增加。目前,对DCE-MRI定量参数与前列腺癌Gleason评分相关性研究还没得出一致结论[16],可能是因为DCE-MEI定量参数的研究方法尚未成熟,各研究所使用的机器、后处理软件及药代动力学模型不同,因此统计出来的结果不完全相同。
本研究结果表明,ADC值及Ktrans值与Gleason评分之间均有相关性,ADC值相关性略高,它们都可以较好的为预测前列腺癌的分化程度提供帮助,评价肿瘤的侵袭性,为临床治疗方案的制定及对预后的判断提供相应的有效的影像学依据。然而,本研究也还存在一些不足,如样本量不大,且样本的病理结果部分来自于穿刺活检,会给Gleason评分的数值及统计学结果造成一定的影响。
[1] Tiong H Y, Liew L C, Samuel M, et al. A meta-analysis of local anesthesia for transrectal ultrasound-guided biopsy of the prostate[J]. Prostate Cancer Prostatic Dis,2007,10(2):127-136.
[2]李勇,梁碧玲,傅加平,等.MRI动态增强扫描在前列腺癌诊断及鉴别诊断中的价值[J].实用放射学杂志, 2002,18(7):598-601.
[3]Bostwick D G, Foster C S. Predictive factors in prostate cancer: current concepts from the 1999 College of American Pathologists Conference on Solid Tumor Prognostic Factors and the 1999 World Health Organization Second International Consultation on Prostate Cancer[J].Semin Urol Oncol,1999,17(4):222-272.
[4]Buhmeida A, Pyrhonen S, Laato M,et al.Prognostic factors in prostate cancer[J]. Diagn Pathol,2006,1:4.
[5] Harnden P, Shelley M D, Coles B, et al. Should the Gleason grading system for prostate cancer be modified to account for high-grade tertiary components? A systematic review and meta-analysis[J].Lancet Oncol,2007,8(5):411-419.
[6]Manenti G, Squillaci E, Di Roma M, et al. In vivo measurement of the apparent diffusion coefficient in normal and malignant prostatic tissue using thin-slice echoplanar imaging[J].Radiol Med, 2006,111(8):1124-1133.
[7]王丽霞,高晋军,齐志民,等.T2WI结合弥散加权成像对前列腺癌危险分级的应用[J].中国CT和MRI杂志, 2015,13(3):78-82.
[8]Woodfield C A, Tung G A, Grand D J, et al. Diffusionweighted MRI of peripheral zone prostate cancer: comparison of tumor apparent diffusion coefficient with Gleason score and percentage of tumor on core biopsy[J]. AJR Am J Roentgenol, 2010,194(4):W316-W322.
[9] Makarov D V, Sanderson H, Partin A W, et al. Gleason score 7 prostate cancer on needle biopsy: is the prognostic difference in Gleason scores 4 + 3 and 3 + 4 independent of the number of involved cores[J].J Urol, 2002,167(6):2440-2442.
[10]卢艳丽,杨毅,赵文露,等.中央腺前列腺癌表观扩散系数与Gleason评分的相关性[J].临床放射学杂志, 2012,31(5):677-680.
[11]王卓楠,罗天友,陈莉,等.ADC值在前列腺中央腺体癌中的诊断价值及与Gleason评分的相关性研究[J].重庆医科大学学报,2015,40(6):885-889.
[12]张刚,林骅.MR扩散加权成像诊断前列腺癌的临床研究[J].中国CT和MRI杂志,2016,14(10):99-101.
[13]Peng Y, Jiang Y, Antic T, et al. Validation of quantitative analysis of multiparametric prostate MR images for prostate cancer detection and aggressiveness assessment: a cross-imager study[J]. Radiology,2014,271(2):461-471.
[14]朱海滨,刘婧,蔡文超,等.前列腺癌M R I动态增强定量参数Ktrans值与Gleason评分的相关性研究[J].中国医学影像学杂志,2012,20(7):481-484.
[15]Bigler S A, Deering R E, Brawer M K. Comparison of microscopic vascularity in benign and malignant prostate tissue[J]. Hum Pathol,1993,24(2):220-226.
[16]Rosenkrantz A B, Sabach A, Babb J S, et al. Prostate cancer: comparison of dynamic contrastenhanced MRI techniques for localization of peripheral zone tumor[J]. AJR Am J Roentgenol, 2013,201(3):W471-W478.
(本文编辑: 张嘉瑜)
Correlative Study of ADC Value, Ktrans Value and Gleason Score of Prostate Cancer
HE Yong-sheng, QI Xuan, ZHANG Min, et al.,
Department of Radiology, Maanshan People' s Hospital, Maanshan 243000, Anhui Province, China
ObjectiveTo evaluate the correlation among ADC value, Ktransvalue and pathology grade(Gleason score) of prostate cancer.MethodsA retrospective analysis was carried with 30 patients with prostate cancer confirmed by pathology, According to the gleason score, we divided the patients into three groups, high grade, medium grade and slow grade, Then comparing the variation between the value of ADC and Ktrans, and analyzing the correlation between ADC, Ktransand gleason score.ResultsThere were statistical difference in ADC and Ktransamong these three groups(P<0.01). The value of ADC in prostate cancer showed negative correlation with Gleason score and Ktransvalue(r=-0.633, P<0.01, r=-0.609, P<0.01), Ktransvalue showed positive correlation with Gleason score (r=0.579, P<0.01), there were statistical differences between highgrade and medium, slow grade group in ADC and Ktransvalue (P<0.01). ROC curves showed that the area under the ROC curve of ADC and Ktranswere 0.861, 0.838, the sensitivity, specificity of ADC, Ktranswere83.3%, 88.9% and 75.0%, 77.8% respectively.ConclusionThere were significant correlation between ADC value, Ktransvalue and Gleason scores of prostate cancer, and the correlation between ADC value and Gleason score were higher than Ktrans, they could help to predict the differentiation degree of prostate cancer.
Apparent Diffusion Coefficient; Volume Transfer Coefficient; Prostate Cancer; Gleason Score
R737.25
A
10.3969/j.issn.1672-5131.2017.02.021
2017-01-04
何永胜