鲤鱼肝原代细胞的分离与培养方法
2017-03-04蒋丽辉李意捷傅志伟
蒋丽辉,李意捷,傅志伟,崔 倩,杨 明
(上海大学环境与化学工程学院,上海 200444)
鲤鱼肝原代细胞的分离与培养方法
蒋丽辉,李意捷,傅志伟,崔 倩,杨 明*
(上海大学环境与化学工程学院,上海 200444)
本研究在酶消化法的基础上,通过比较不同的肝组织分离和培养条件,获得鲤鱼肝原代细胞培养的最佳培养方法和条件。首先,结合细胞数量和台盼蓝染色所得的细胞存活率,比较了胰蛋白酶消化鲤鱼肝组织的不同反应温度和时间,结果表明:肝组织用0.25%(m/V)胰蛋白酶在25℃消化40 min时细胞分离效果最好。其次,经酶消化得到的肝原代细胞粗制液,设置4种不同的细胞纯化和培养条件:1)将细胞直接重悬于含10%胚牛血清(FBS)的L-15/DMEM培养基中培养;2)以10%鲤鱼血清取代培养基中的胚牛血清重悬细胞并培养;3)将细胞经Percoll液密度梯度离心纯化后,重悬于含10%胚牛血清的L-15/DMEM培养基中培养;4)细胞经Percoll纯化后,重悬于含10%鲤鱼血清的L-15/DMEM培养基中培养。利用光学显微镜观察肝细胞的形态,进而通过HE染色法检测,结果表明经Percoll纯化后,肝细胞纯度显著提高;采用MTS/PMS法检测肝细胞的增殖情况,结果表明鲤鱼血清代替胚牛血清培养细胞,肝细胞活力显著提高。本研究将为建立稳定的毒理学肝原代细胞实验模型奠定基础。
鲤鱼;肝原代细胞;Percoll密度梯度离心;鱼血清
肝脏在动物机体物质和能量代谢过程中起重要的作用,通过肝脏的代谢,许多外源化学物质转化为无毒、低毒或者毒性更大的代谢产物[1],因此肝脏是目前毒理学和药理学研究的主要对象之一[2]。肝细胞适于研究外界毒物的毒性、毒理及细胞对毒物的应答和解毒机理[3],且有研究表明体外与体内的肝毒性实验结果有很好的正相关关系[4],故体外培养肝细胞可作为肝组织的替代模型应用于药理及环境毒理学等研究[5]。目前,鱼类已经建立了150多种细胞系[6],这些细胞系可标准化,管理更方便,在毒理药理试验中减少大量的劳动力[7]。但是细胞系分化程度低,失去了原有的遗传和生化特性,而原代细胞可以保持大部分组织的生理生化特性[8]。此外,与细胞系相比,原代细胞更敏感,具有更高的代谢能力[9]。因此,肝原代细胞可作为更优的细胞模型应用于药理以及环境毒理学领域。
动物肝原代细胞的培养在大小鼠、豚鼠、绵羊等陆生动物[10-14]中较多。肝细胞的分离始于20世纪60年代,Fry等[15]用机械和酶法相结合的技术首先从大鼠肝脏中分离得到肝细胞,Seglen[16]对其进一步完善发展得到了沿用至今的两步胶原酶灌注技术法。相较于哺乳动物细胞,鱼类细胞具有可在室温下培养、可直接暴露在不同渗透压的环境样品中等优点[17]。鱼类肝细胞的分离自Birnbaum等[18]运用胶原酶灌注法分离肝细胞开始得到逐渐发展,但是灌注法操作步骤复杂,耗费大量的胶原酶,并需要恒流灌注装置[19]。目前有很多研究用胰蛋白酶法成功地分离了大鼠[20]、斜带石斑鱼[21]、草鱼肝细胞[22]。因此,本实验以红鲤鱼(Cyprinuscarpio)为研究对象,在酶消化法的基础上对肝细胞培养条件进行探索,寻找其最佳培养方法和条件,以期为建立稳定的毒理学和药理学等实验模型奠定基础。
1 材料和方法
1.1 材料
1.1.1 实验材料
实验用红鲤鱼购买于上海花鸟市场,体重500~600 g,体格健壮,体表无创伤。实验前在水箱中去氯水(25℃)养殖两周,24 h充气时不间断充气。光照周期(h)为光照∶黑暗=14∶10,每天喂食。
1.1.2 实验试剂及仪器
无酚红L-15培养基(L-15)、DMEM培养基、无酚红无Ca2+Mg2+HBSS(1×)、无酚红无Ca2+Mg2+HBSS(10×)、新生胚牛血清(FBS)均购自Thermo Fisher公司(美国);链霉素/青霉素(streptomycin/penicillin,Invitrogen,美国);0.25%胰蛋白酶[生工生物工程(上海)有限公司];Hepes(Solarbio,中国);鱼用麻醉剂MS-222(Sigma,美国);0.5%台盼蓝染液(Sigma,美国);MTS(promega,美国);PMS(Sigma,美国);鲤鱼血清自制。
培养基配方:L-15(68%),DMEM(20%),HEPES(1%),双抗(青霉素/链霉素,1%),血清(10%)。
3111型CO2培养箱(Heraeus,德国);F50型光吸收酶标仪(TECAN,瑞士);CK-40F200倒置显微镜(OLYMPUS,日本);SW-CJ-1F型超净工作台(苏州净化设备厂);TU-1901型双光束紫外可见分光光度计(普析通用仪器有限公司,北京);光学显微镜(OLYMPUS,日本);血球计数板(中国上海);96孔细胞培养板(Corning,美国)。
1.2 实验方法
1.2.1 鲤鱼血清的制备
用麻醉剂MS-222将红鲤鱼麻醉5 min后用无菌注射器从尾静脉抽血,并转移至不含抗凝剂的试管内,室温下自然凝集30~40 min,密封试管,于4℃下3 000 rpm离心10 min,吸取上层血清于无菌离心管中,于-20℃保存备用。
1.2.2 胰蛋白酶消化法
红鲤鱼经麻醉后,用75%医用酒精消毒鱼体,采血后于无菌条件下剪开腹部取出肝组织,用无菌的冷HBSS(1×)清洗3次,除去血细胞和其他组织,用无菌剪刀剪至1~3 mm大小组织块,再用HBSS(1×)清洗1次;加入10倍体积的0.25%胰蛋白酶分别在25℃和37℃进行消化,消化时间分别为30 min和40 min,消化期间不断转动组织,并加入与胰蛋白酶同体积的培养基停止消化。组织消化液经100 μm筛网过滤,得到细胞悬液。将细胞悬液2次离心重悬后弃上清液,向管中加入细胞培养基,轻柔吹打,得到较纯净的细胞悬液。取在25℃、消化40 min得到的细胞悬液分为4组,第一组细胞重悬于含10%胚牛血清(FBS)的培养基中(实验组1),第二组细胞重悬于含鲤鱼血清的培养基中(实验组2),剩余两组待用。
1.2.3 Percoll工作液的配制
Percoll分离液的配制:90 mL Percoll原液与10 mL HBSS(10×)混合,制成渗透压为335 mOsm(1 kPa=38 178 mOsm)的缓冲型Percoll工作液;取35 mL Percoll工作液与15 mL HBSS(1×)混合,在1 000 rpm,离心3 min[23]即可获得浓度为70%的Percoll梯度分离液,其密度为1.06~1.07 g/mL。
1.2.4 鲤鱼肝细胞的纯化
将剩余两组细胞悬液分别缓慢地加入70%的Percoll分离液上方,Percoll分离液和细胞悬液的体积比为7∶3,于1 000 rpm、4℃下离心10 min。离心后管内从上到下分4层:1)培养基;2)死细胞、碎片和杂细胞;3)分离液;4)肝实质。取第四层细胞沉淀,其中一组用含胚牛血清(FBS)的培养基1 000 rpm、5 min离心洗涤1次细胞,弃上清液,向管中加入含胚牛血清的细胞培养液,轻柔吹打,得到细胞悬液(实验组3)。另一组用含鲤鱼血清培养基1 000 rpm、5 min离心洗涤1次细胞,弃上清液,向管中加入含鲤鱼血清的细胞培养液,轻柔吹打,得到细胞悬液(实验组4)。
1.2.5 肝细胞的培养
将上述4组细胞悬液(实验组1、2、3和4)稀释至1×106cell/mL的密度,接种于96孔培养板中,置于27℃无菌培养箱中培养。
1.3 肝细胞数量、纯度、存活率和活力的测定
1.3.1 细胞数量和纯度测定
将细胞悬液稀释10倍,滴于血球计数板上,并在光学显微镜下计数,结果以每g肝重分离的细胞个数表示。用爬片法分别将4个实验组的细胞均匀地涂在载玻片上,用4%多聚甲醛固定20 min,室温下晾干,苏木素染液染色15 min,超纯水洗涤,伊红染色30 s,超纯水洗涤,自然晾干后中性树胶封片。在倒置显微镜下分别对肝细胞与肝非实质细胞进行计数,计算肝细胞的纯度。用肝实质细胞占细胞总数的百分比表示细胞的纯度。
1.3.2 细胞存活率和活力测定
细胞悬液与0.4%台盼蓝染液按1∶10体积比混合,1 min后在血球计数板上计数,活细胞圆形透明,死细胞被染成蓝色。用活细胞占计数细胞中的百分比表示细胞存活率。
采用MTS/PMS[24]法检测实验组中肝细胞的增殖能力。提取红鲤鱼肝细胞后,以1×106cell /mL的浓度接种于96孔细胞培养板中,每孔200 μL,在分别培养24、48、72和96 h后测定各组光吸收值。测定方法为:每孔吸出50 μL培养基,加入50 μL MTS/PMS试剂,27℃,孵育2 h。在酶标仪490 nm波长下检测各孔光吸收值,每组各8个重复孔。
1.3.3 数据处理
用SPSS软件进行数据处理,所有数据用mean±SD表示。用独立样本t检验法分析组别间的差异显著性。当P<0.05时表明具有显著性差异。
2 结果与分析
2.1 胰蛋白酶消化法对鲤鱼肝细胞数量和存活率的影响
如表1所示,红鲤鱼肝组织在37℃时,经胰蛋白酶消化40 min获得的细胞数量最多,37℃消化30 min所得细胞数量次之,第三为25℃消化40 min,而在25℃消化30 min所得的细胞最少。此外,经台盼蓝染色后所得到的细胞存活率结果发现:在25℃下胰蛋白酶消化获得的肝细胞存活率均高于37℃胰蛋白酶消化收集的细胞。25℃时,细胞活率均大于90%,而37℃时消化收集的肝细胞存活率小于90%;其中在37℃消化40 min后,细胞存活率仅为74.6%。综合肝细胞数量和存活率的结果表明:肝组织用0.25%胰蛋白酶在25℃消化40 min时分离效果最好。

表1 不同胰蛋白酶消化条件对鲤鱼肝细胞数量和存活率影响Tab.1 The effects of different treatment conditions for trypsin digestion on the cell number and viability ofCyprinus carpio hepatocytes
2.2 Percoll分离纯化对鲤鱼肝细胞纯度的影响
在倒置显微镜下观察,新鲜分离的肝细胞呈圆形透亮且具有立体感。未经Percoll分离的实验组1的肝细胞中可见一定数量的非实质细胞,如血细胞、细胞碎片以及死细胞(图1A),而实验组3(经Percoll分离纯化)中的肝细胞(图1B)纯度较高,非实质细胞数量明显减少。
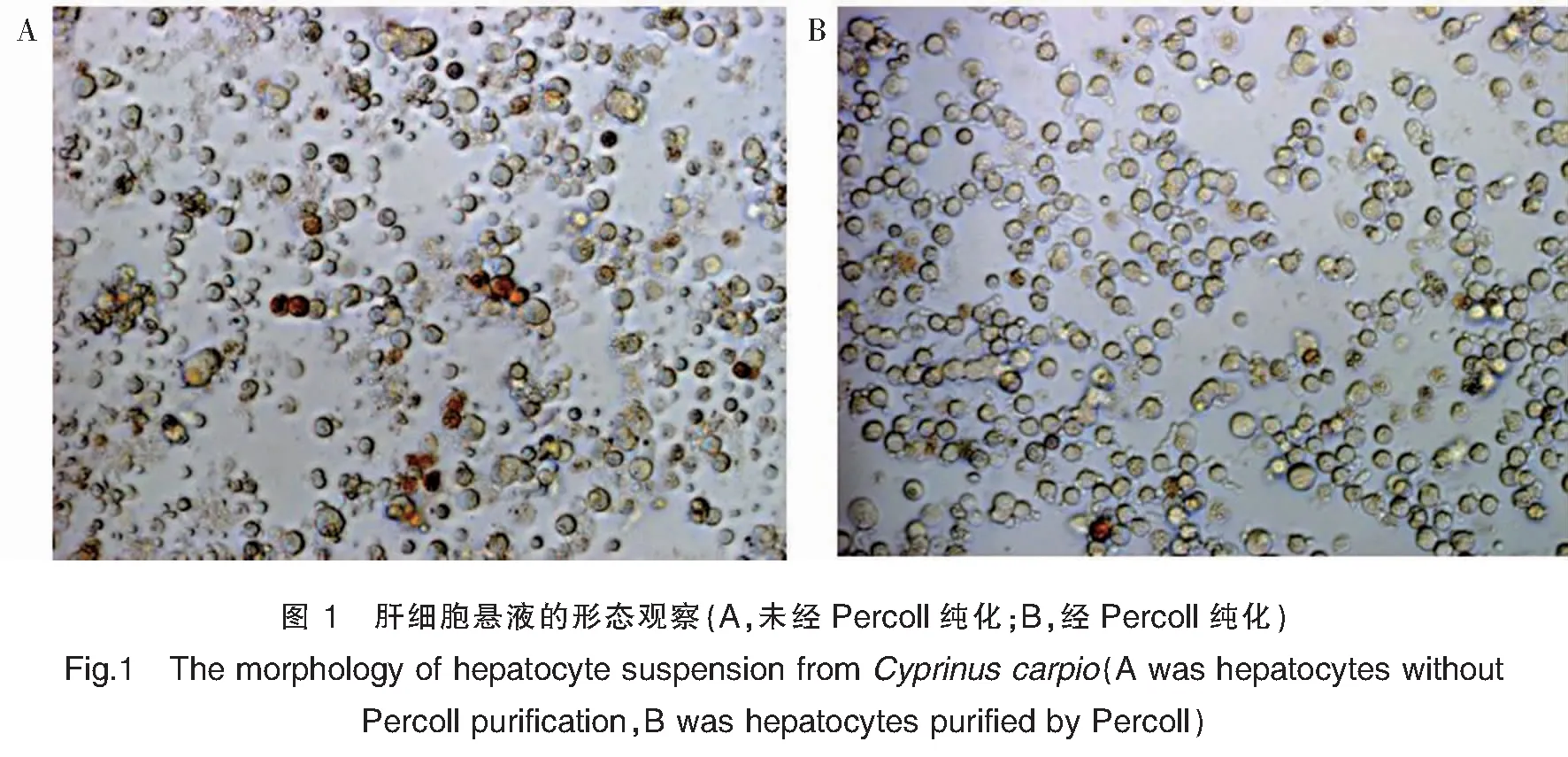
红鲤鱼肝细胞经HE染色后可见细胞质呈橙色,细胞核呈蓝色,清晰可见,也可见部分双核肝细胞。非肝细胞不具有上述特性,由此可计算出肝实质细胞的纯度。不同培养条件对肝细胞纯度的影响见表2。从表2可以看出,经Percoll分离纯化的实验组3和实验组4中的肝细胞纯度分别达到95.3%和96.8%,显著高于未分离纯化的实验组1(78.5%)和实验组2(82.7%)。可见,经Percoll法分离纯化的肝细胞纯度明显增加。

表2 不同分离方法对鲤鱼肝细胞纯度的影响Tab.2 The effects of different isolation methods on purity of Cyprinus carpio hepatocytes
2.3 不同血清对鲤鱼肝细胞活力的影响
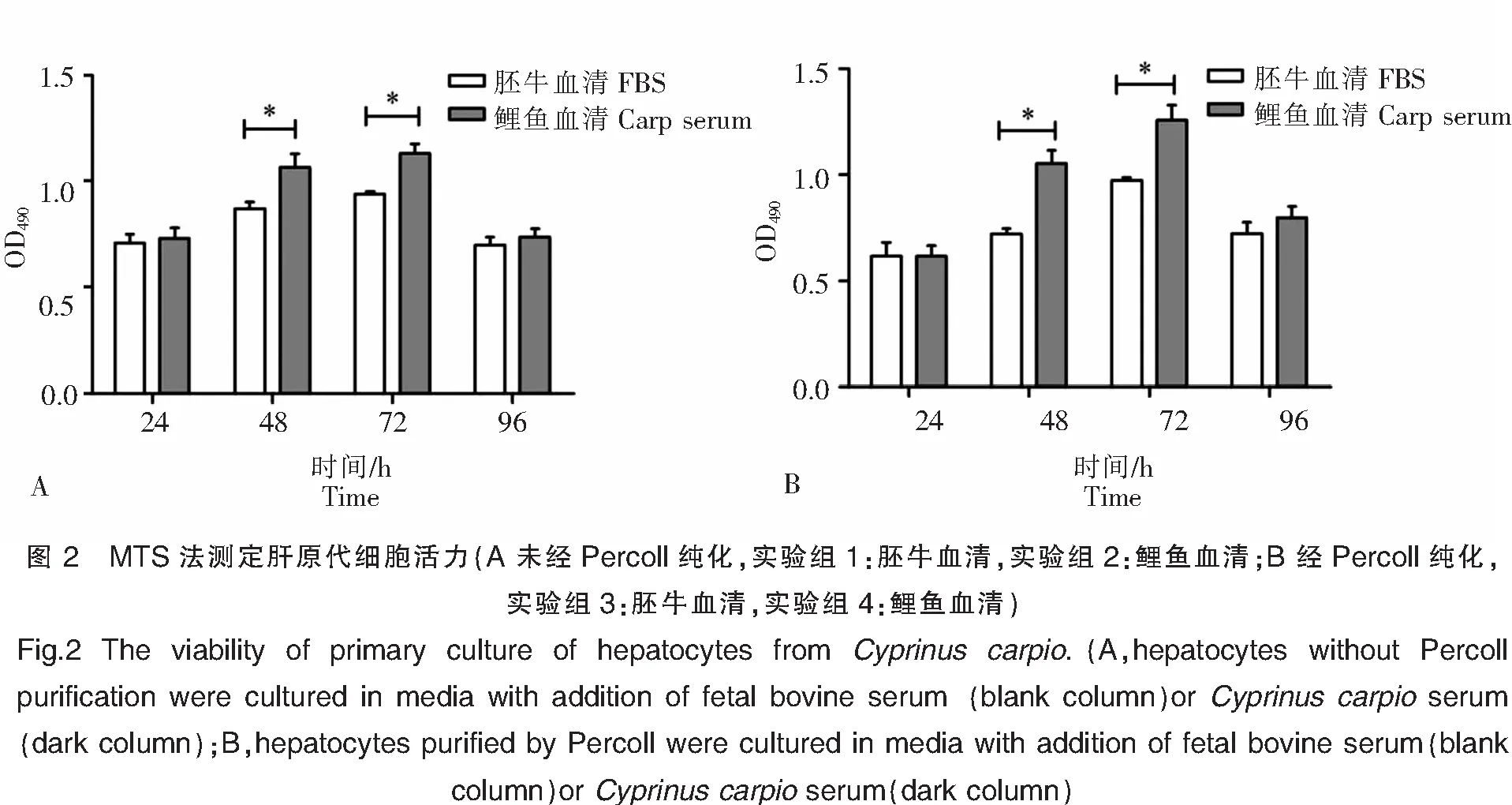
根据肝活细胞的数量占总计数细胞的数量,绘制鲤鱼肝细胞活力的变化图。从图2可以看出,实验组2肝细胞培养24 h后,OD值增加到(0.73±0.15);培养72 h后OD值达最高,为(1.13±0.14),96 h后肝细胞增殖率明显降低。实验组1肝细胞培养24 h后,OD值增加到(0.71±0.13);培养72 h后OD值达最高,为(0.94±0.04),96 h后肝细胞增殖率明显降低。实验组4的OD值在24 h为(0.69±0.15),实验组3在相同时间的OD值为(0.61±0.21),实验组4在72 h也达到最高值(1.26±0.24),在图中可明显看出其OD值高于实验组3。四组实验的肝细胞活力随培养时间的延长先增长而后下降,其原因可能是由于随着培养时间的延长,培养基中的营养物质被快速消耗,细胞由于营养的缺失导致增殖变慢;通过比较添加胚牛血清和添加鲤鱼血清两种培养基对细胞增殖的影响,结果表明,添加鲤鱼血清的培养基更有利于鲤鱼肝细胞的增殖。
3 讨论
Walton[25]将二步灌流法应用于鱼类肝细胞的分离,并分离得到了虹鳟鱼肝细胞。胶原酶灌注法获得的细胞数量虽多于胰酶消化法,但胰酶消化法的细胞活力优于胶原酶灌注法[26]。而且,胶原酶灌注法操作步骤多、耗费大量的胶原酶、技术要求高、所花费时间长、易污染[27]。综合考虑,本实验采用胰蛋白酶消化法。胰蛋白酶细胞的活性与其浓度、温度和时间有关,且胰酶溶液在37℃的作用力最强,但是肝细胞存活的最佳温度是26℃。因此,本实验采用0.25%的胰蛋白酶液,通过设置不同的消化时间和消化温度,确定原代肝细胞在消化温度为25℃、消化时间为40 min时,其数量和存活率较好。同时,由于血清和蛋白质中的Ca2+、Mg2+的存在降低了胰酶的活性,故应选用不含Ca2+、Mg2+的盐溶液配置胰酶溶液。
Percoll是一种密度梯度离心剂,由聚乙酰胺吡咯烷酮的硅胶颗粒组成,离心后可形成一定的密度梯度,不同密度的细胞会分布于不同的密度层内,由此可将肝实质细胞与非实质细胞分离[23]。实验研究表明,经过Percoll梯度离心后,肝细胞的纯度达95%以上;而不经过Percoll液纯化处理,肝细胞的纯度仅有约80%。这是因为实验用Percoll梯度液的密度为1.06~1.07 g/mL,而富含活力的肝实质细胞的密度在1.07~1.10 g/mL之间,肝脏杂质细胞、肝细胞碎片及受损肝细胞的密度均在1.04 g/mL以下[28]。故通过Percoll梯度液纯化分离的肝细胞,可进一步提高肝实质细胞纯度。
细胞的生长受血清、培养基和其他添加物的影响,由于培养基添加的血清中含有各种生长因子、营养物质等有助于细胞生长的物质,所以血清的浓度会影响细胞的贴壁和生长[6]。细胞培养大多使用FBS作为培养基中的营养物质,也有研究以鱼血清作为营养物质。Kocal等[29]研究发现在培养基中添加自制虹鳟鱼血清增加肝细胞的贴壁率,且能形成单层细胞。而胚牛血清对其肝细胞贴壁率影响不大。而在本实验中采用鲤鱼血清代替胚牛血清,研究结果表明,鲤鱼血清组肝细胞活力明显高于胚牛血清组。
4 结论
通过Percoll梯度液纯化胰蛋白酶消化法分离的肝细胞,可显著提高肝实质细胞的活力与纯度;用鲤鱼血清替代传统培养基中的胚牛血清,肝细胞的生长效果明显更好。本论文从消化方法、分离纯化方法和培养方法等方面对红鲤鱼的原代肝细胞的获得进行了初步探讨,并成功得到一种较优的提取流程,从而为环境毒理学、分子生物学、遗传学、免疫学、肿瘤学、细胞工程等领域的深入研究提供了模型细胞。
[1]王珊.原代小鼠肝细胞培养方法的比较[J].癌变·畸变·突变,2016,28(2):125-130.
[2]Ferraris M,Radice S,Catalani P,et al.Early oxidative damage in primary cultured trout hepatocytes:a time course study[J].Aquatic Toxicology,2002,59(3-4):283-296.
[3]Fent K.Fish cell lines as versatile tools in ecotoxicology:assessment of cytotoxicity,cytochrome P4501A induction potential and estrogenic activity of chemicals and environmental samples[J].Toxicology in Vitro,2001,15(4-5):477-488.
[4]Fardel O,Ratanasavanh D,Loyer P,et al.Overexpression of the multidrug resistance gene product in adult rat hepatocytes during primary culture[J].European journal of biochemistry / FEBS,1992,205(2):847-852.
[5]Jia R,Cao L,Xu P,et al.In vitro and in vivo hepatoprotective and antioxidant effects of Astragalus polysaccharides against carbon tetrachloride-induced hepatocyte damage in common carp(Cyprinuscarpio)[J].Fish Physiology and Biochemistry,2012,38(3):871-881.
[6]左文功.淡水鱼类细胞培养方法[J].淡水渔业,1991,(2):37-40.
[7]贾睿,曹丽萍,丁炜东,等.鲫鱼肝细胞分离与原代肝细胞培养方法的优化[J].华北农学报,2011,26(B12):206-212.
[8]于淼,管华诗,郭华荣,等.鱼类细胞培养及其应用[J].Marine Sciencdes,2003,27(3):4-8.
[9]Chen J J,Chen G S,Bunce N J.Inhibition of GYP 1A2-dependent MROD activity in rat liver microsomes:An explanation of the hepatic sequestration of a limited subset of halogenated aromatic hydrocarbons[J].Environmental Toxicology,2003,18(2):115-119.
[10]Liu W,Hou Y,Chen H,et al.Sample preparation method for isolation of single-cell types from mouse liver for proteomic studies[J].Proteomics,2011,11(17):3556-3564.
[11]Sarkar N K.Amino acid incorporating activity of cell-free preparations from chicken liver and the factors that control the process[J].Currents in modern biology,1972,5(1):30-37.
[12]Berry M N,Friend D S.High-yield preparation of isolated rat liver parenchymal cells:a biochemical and fine structural study[J].The Journal of cell biology,1969,43(3):506-520.
[13]Ash R,Pogson C I.Preparation and biochemical characterisation of isolated parenchymal cells from adult sheep liver[J].Biochimica et biophysica acta,1977,496(2):475-483.
[14]Elliott K R,Pogson C I.Preparation and characterization of isolated parenchymal cells from guinea pig liver[J].Molecular and cellular biochemistry,1977,16(1):23-29.
[15]Fry J R.Preparation of mammalian hepatocytes[J].Methods in enzymology,1981,77(77):130-137.
[16]Seglen P O.Preparation of isolated rat liver cells[J].Methods in cell biology,1976,13(13):29-83.
[17]Yanhong F,Chenghua H,Guofang L,et al.Optimization of the isolation and cultivation ofCyprinuscarpioprimary hepatocytes[J].Cytotechnology,2008,58(2):85-92.
[18]Birnbaum M J,Schultz J,Fain J N.Hormone-stimulated glycogenolysis in isolated goldfish hepatocytes[J].The American journal of physiology,1976,231(1):191-197.
[19]叶娟.原代大鼠肝细胞分离及培养鉴定[J].实用儿科临床杂志,2012,27(7):531-533.
[20]裔传卉,汪纪仓,刘宗平.大鼠原代肝细胞分离培养方法的改良[J].江苏农业科学,2009,(5):201-203.
[21]洛源.斜带石斑鱼肝细胞分离及原代培养方法的建立[J].水产学报,2016,40(4):558-565.
[22]秦洁.草鱼肝细胞的分离与原代培养[J].中国实验动物学报,2012,20(3):33-39.
[23]Zhang G F,Guo T,Wei H,et al.Isolation and purification ofCarassiusauratushepatocytes by the method of Percoll [J].Journal of Fishery Sciences of China,2007,14(2):208-214.
[24]Buttke T M,McCubrey J A,Owen T C.Use of an aqueous soluble tetrazolium/formazan assay to measure viability and proliferation of lymphokine-dependent cell lines[J].Immunol Methods,1993,157(1-2):233-240.
[25]Walton M J,Cowey C B.Gluconeogenesis by isolated hepatocytes from rainbow trout(Salmogairdneri)[J].Comparative Biochemistry and Physiology,1979,62(1):75 -79.
[26]贾珍容.比较两种消化酶对分离大鼠肝细胞的影响[J].中国药师,2006,9(7):590-592.
[27]陈慧梅.肝细胞培养方法研究进展[J].细胞生物学杂志,2002,24(3):163-166.
[28]Mommsen T P,Walsh P J.Metabolic and enzymatic heterogeneity in the liver of the ureogenic teleost Opsanus beta[J].The Journal of experimental biology,1991,156(1):407-418.
[29]Kocal T,Quinn B A,Smith I R,et al.Use of trout serum to prepare primary attached monolayer cultures of hepatocytes from rainbow trout[J].In Vitro Cellular & Developmental Biology,1988,24(4):304-308.
Isolation and culture of primary hepatocytes fromCyprinuscarpio
JIANG Lihui,LI Yijie,FU Zhiwei,CUI Qian,YANG Ming*
(School of Environmental and Chemical Engineering,Shanghai University,Shanghai 200444,China)
In the present study,the optimal conditions for isolation and culture of the primary hepatocytes from liver ofCyprinuscarpiowere explored.The condition for digestion reaction with trypsin was optimized first and the results from trypan blue staining indicated that the mortality of primary hepatocytes was the highest after treatment of fish liver tissue with trypsin at 25oC for 40 min.Four different purification and culture conditions were then set up with crude liver cell suspension after trypsin digestion:1.Cells were directly incubatedin L-15/DMEM medium containing 10% fetal bovine serum(FBS);2.Cells were incubated with L-15/DMEM medium containing 10% carp serum;3.Cells were purified using Percoll density gradient centrifugation and then cultured in L-15/DMEM medium containing 10% fetal bovine serum;4.Cells were purified with Percoll and then cultured with L-15/DMEM medium containing 10% carp serum.The results from the morphology by HE staining revealed that the purification by Percoll significantly improved the purity of hepatocytes.In addition,the replacement of bovine serum by carp serum significantly increased the cell proliferation based on the MTS/PMS results.This study will lay the foundation for the establishment of a stable primary hepatocyte model for further toxicological research.
Cyprinuscarpio;primary hepatocytes;Percoll density gradient centrifugation;fish serum
2016-10-12
国家自然科学基金(No.31470554);上海市教委创新项目(No.14YZ001).
蒋丽辉(1994-),女,硕士研究生,研究方向为抗抑郁药在水体环境的毒性.E-mail:759786441@qq.com
杨 明(1979-),女,副研究员,主要研究方向为水生生态毒理学.E-mail:mingyang@shu.edu.cn
S961.6
A
1006-5601(2017)01-0001-07
蒋丽辉,李意捷,傅志伟,等.鲤鱼肝原代细胞的分离与培养方法[J].渔业研究,2017,39(1):1-7.
