生长激素定量标记免疫分析试剂盒行业标准的验证
2017-03-03曲守方
于 婷 曲守方 黄 杰*
生长激素定量标记免疫分析试剂盒行业标准的验证
于 婷①曲守方①黄 杰①*
目的:制订生长激素(GH)定量标记免疫分析试剂盒行业标准,并采用该标准适用的化学发光标记、时间分辨荧光标记方法进行验证。方法:选择GH磁微粒化学发光法、电化学发光法、化学发光法和时间分辨荧光分析法试剂盒,按照拟定的行业标准规定,对空白限、线性、准确度、精密度、特异性和稳定性项目进行验证。结果:除部分试剂盒的准确度结果不能满足预期要求的±10%外,其余验证结果均能满足拟定行业标准中的要求。结论:根据验证情况,将准确度要求调整至±15%,其余项目要求不变,最终确定GH定量标记免疫分析试剂盒行业标准。该标准的制定,有助于统一GH定量标记免疫分析试剂盒的质量标准,为该类产品的研制、检验及上市后的监督管理提供依据。
生长激素;试剂盒;行业标准; 化学发光;验证
[First-author’s address]Division of In Vitro Diagnostics for Non-Infectious Diseases, National Institutes for Food and Drug Control; Key Laboratory of Method and Standardization for Quality Control of Biotechnical Products, MOH, Beijing 100050,China.commissioning:multiple institution planning and dosimetry comparisons,a report from AAPM task group 119[J].Med Phys,2009,36(11):5371-5372.
人体生长激素(growth hormone,GH)是脑垂体前叶含有嗜酸性粒细胞所分泌的肽类激素,由191个氨基酸残基所构成,分子量为22×103D左右[1-2]。GH的基本功能是刺激机体组织的发育,促进人体的骨骼、软骨和组织的生长,GH对中间代谢及能量代谢也有影响[3-5]。临床研究结果显示,人体GH缺乏可导致巨人症和肢端肥大症等疾病,故GH水平是诊断GH缺乏症等疾病的重要指标之一[6-10]。
截至2016年3月,国家食品药品监督管理总局网站显示,我国现有市售且具有医疗器械注册证的国产和进口GH检测试剂盒有近20余家,因无统一的国家标准或行业标准,由企业自行编制GH产品技术要求,其结果形成不同厂商的产品技术要求不统一,造成不同临床实验室的检验结果往往缺乏可比性。为规范GH试剂盒技术要求,促进产品质量提高,按照国家食品药品监督管理总局2016年医疗器械标准制修订计划,中国食品药品检定研究院提出了制定GH定量标记免疫分析试剂盒标准的项目提案。本研究在参考相关资料和广泛征求意见的基础上,制定定量测定GH的标记免疫分析试剂盒行业标准,并对该标准适用的化学发光标记、时间分辨荧光标记方法进行验证。
1 资料与方法
1.1 仪器和试剂
(1)AutoLumo A2000全自动化学发光检测仪(郑州安图生物工程股份有限公司);DR6608时间分辨荧光免疫分析仪(广州市达瑞抗体工程技术有限公司);Access 2全自动免疫分析仪[贝克曼库尔特商贸(中国)有限公司];Elecsys 2010全自动免疫分析仪[罗氏诊断产品(上海)有限公司];Liaison Analyzer化学发光分析仪[索灵诊断医疗设备(上海)有限公司];Immulite2000全自动化学发光测定仪[西门子医学诊断产品(上海)有限公司]。
(2)试剂盒。A试剂盒,人GH检测试剂盒(磁微粒化学发光法)(郑州安图生物工程股份有限公司);B试剂盒,人GH定量测定试剂盒(时间分辨免疫荧光法) (广州市达瑞生物技术股份有限公司);C试剂盒,人GH测定试剂盒(化学发光法)[贝克曼库尔特商贸(中国)有限公司];D试剂盒,人GH检测试剂盒(电化学发光法)[罗氏诊断产品(上海)有限公司];E试剂盒,人GH定量测定试剂盒(化学发光法)[索灵诊断医疗设备(上海)有限公司];F试剂盒,GH测定试剂盒(化学发光法)[西门子医学诊断产品(上海)有限公司]。上述试剂盒均为取得医疗器械产品注册证的试剂盒。以上各公司试剂盒与该公司检测仪器配套使用。
(3)标准品及质控品。①GH国家标准品,批号:150534-9604,1.22 mIU/0.61μg/支,冻干品由中国食品药品检定研究院提供;②GH国际标准品,NIBSC批号:98/574,3IU/支,冻干品,由中国食品药品检定研究院提供;③GH质控品,批号:1807-0503,3支/套,冻干品,由中国食品药品检定研究院提供。
1.2 验证方法
1.2.1 空白限
采用企业零浓度校准品进行检测,重复检测20次,计算信号值的平均值(M)和标准差(standard deviation,SD),根据零浓度校准品和相邻校准品之间的浓度-信号值进行两点直线回归拟合,得到一次方程,将(M+2SD)的信号值带入上述方程中,求出对应的浓度值即为空白限,要求空白限应≤0.5 ng/ ml。
1.2.2 线性
要求制造商给定的线性区间,下限应≤1 ng/ ml,上限应≥30 ng/ml,相关系数(r)应≥0.9900。将接近线性区间上限的高值样本按一定比例稀释至少5个不同浓度的样本,其中最低值浓度的样本应接近线性区间的下限。每个浓度样本至少重复测定2次,将测定浓度的均值与理论浓度或稀释比例用最小二乘法直线拟合,以计算线性的相关系数(r)。
1.2.3 准确度
(1)试剂盒校准品与相应浓度的GH国家(或国际)标准品同时进行分析,用双对数或其他适当的数学模型拟合,要求两条剂量-反应曲线不显著偏离平行,采用t检验分析。以GH国家(或国际)标准曲线计算,试剂盒校准品的实测值与标示值的效价比应在0.900~1.100之间。采用各试剂盒专用缓冲体系将GH国家(或国际)标准品配制成与试剂盒校准品相应的浓度点(≥5个浓度点),每个浓度平行测定≥2次,用双对数或其他适当的数学模型拟合,计算两条剂量-反应曲线的斜率,要求两条曲线不显著偏离平行(t检验);以GH国家(或国际)标准曲线为对照,计算试剂盒校准品实测值与标示值的效价比,应符合相应要求。
(2)在各试剂盒要求的线性区间范围内测定GH国家(或国际)标准品,其结果的相对偏差应在±10.0%范围内。将GH国家(或国际)标准品配制成高、低浓度样品(至少2个)后进行测定,每个浓度至少重复2次,取均值后计算相对偏差,结果应符合相应要求。
1.2.4 精密度
分为批内精密度和批间精密度。前者是在试剂盒剂量-反应曲线范围内,测定2~3个不同浓度的质控品,每个浓度重复10次,要求手工操作试剂盒测定结果的变异系数应≤10.0%,全自动仪器操作试剂盒测定结果的变异系数应≤8.0%;后者采用3个批次试剂盒,在试剂盒剂量-反应曲线范围内,测定2~3个不同浓度的质控品,测定结果的变异系数(coefficient variation,CV)应≤15.0%。
1.2.5 特异性
特异性用于分析在被测物中若存在与GH结构类似物是否对其检测有影响的项目。选择浓度≥2000 mIU/L的泌乳素样本,平行测定2次,其测定结果应≤0.5 ng/ml。
1.2.6 稳定性
稳定性分为效期末稳定性和热稳定性两种。效期末稳定性是将试剂盒在规定条件下保存至有效期末;热稳定性是将试剂盒在37 ℃条件下放置一定时间后进行检测,其放置时间由各试剂盒设置的效期来决定,各项性能指标是否满足相应要求,但批间精密度和特异性指标不做要求。
2 结果
定量测定GH的标记免疫分析试剂盒验证空白限、线性、准确度、精密度、特异性及稳定性结果。
(1)对A、B、C、D和E共5家试剂盒的验证结果显示,空白限均小于拟定行业标准的要求(0.5 ng/ ml);剂量-反应曲线相关系数(r)也均大于拟定行业标准的要求(0.9900),表明在试剂盒线性范围内,量效关系反应良好;批内和批间精密度项目中,除进口试剂盒短期内无法提供3批次试剂未做验证外,其余结果均符合要求,包括手工法试剂盒,变异系数均<10.0%,表明各试剂盒测定同一样本的重现性较好。在特异性项目中,所有试剂盒在测定浓度水平为2000 mIU/L的泌乳素(prolactin,PRL)时,测定结果均低于拟定行业标准的要求(0.5 ng/ml),表明该浓度下的PRL不影响GH的测定,见表1。
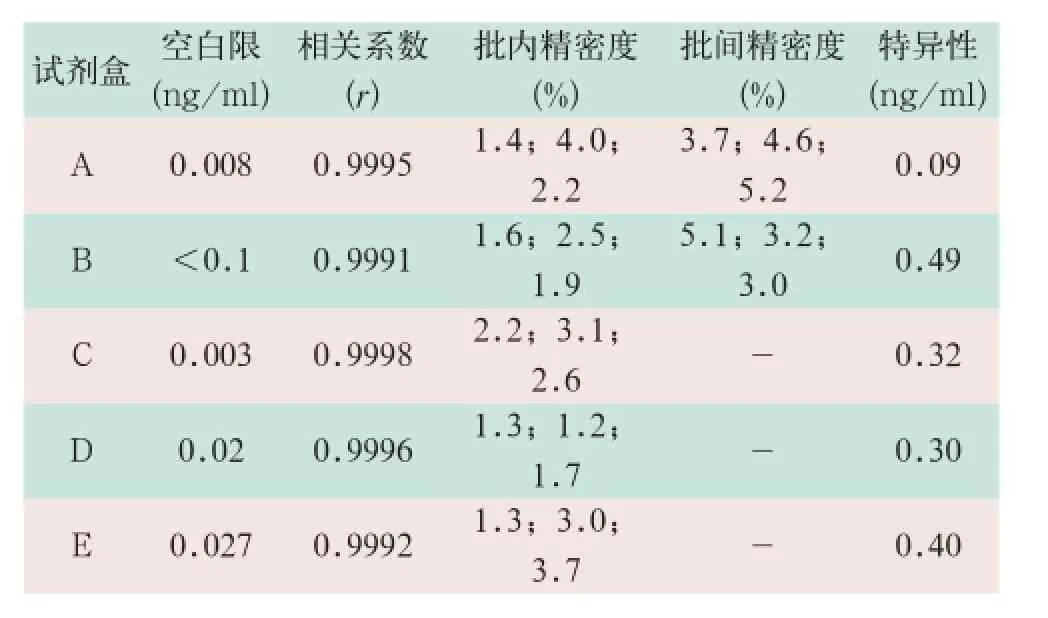
表1 GH定量标记免疫分析试剂盒3个浓度水平的验证结果
(2)对于具有注册证,为我国GH主流且销售量较大的进口和国产试剂盒,不限于参与本次行业标准验证的试剂盒。验证数据显示,除1个国产试剂盒下限不满足要求外,其余试剂盒均能满足拟定行业标准线性范围(下限应≤1 ng/ml,上限应≥30 ng/ml)的要求,见表2。
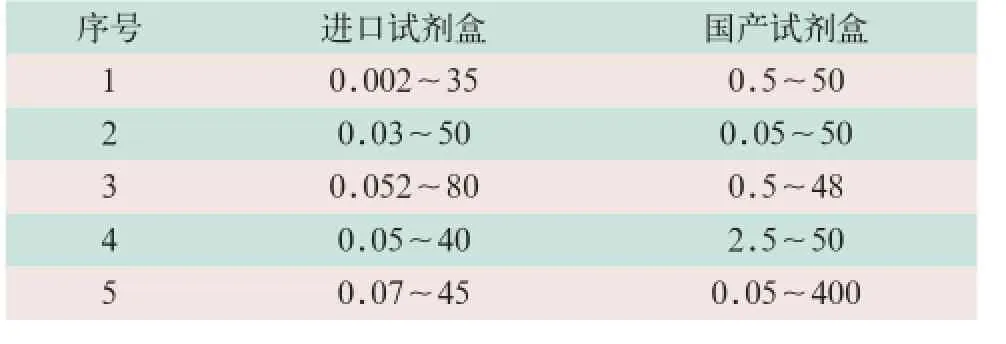
表2 部分试剂盒的线性范围(ng/ml)
(3)在稳定性实验中,选择2家国产试剂盒分别进行了热稳定性和效期末稳定性的检测,空白限、相关系数和批内精密度也均满足拟定行业标准的要求,其结果见表3。
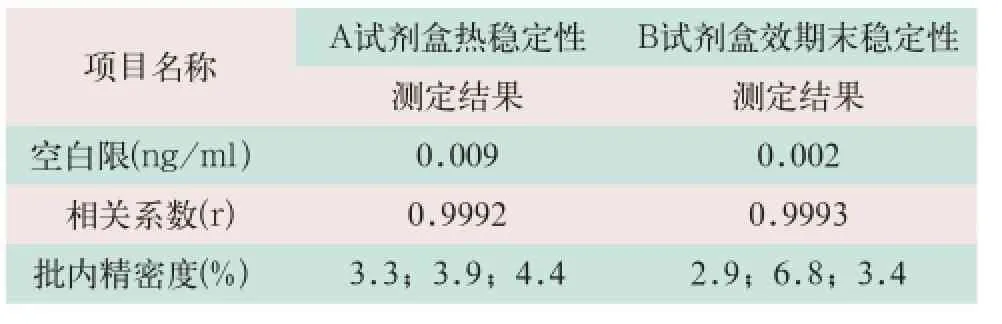
表3 GH试剂盒稳定性验证结果
(4)准确性项目是GH行业标准中关键性指标之一。行业标准中提供了两种验证方法,国产试剂盒多采用前者方法,进口试剂盒多采用后者方法。验证结果表明,国产试剂盒结果令人满意。平行性检验中,t值均<t0.05,P>0.05,两条剂量-反应曲线不显著偏离平行;以GH国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比均在拟定行业标准要求的0.900~1.100范围内,表明量值传递基本准确;而进口试剂盒结果差强人意,参加验证的4个进口试剂盒均不能满足相对偏差应在±10.0%范围内的要求。国产试剂准确性结果见表4,进口试剂准确性结果见表5。
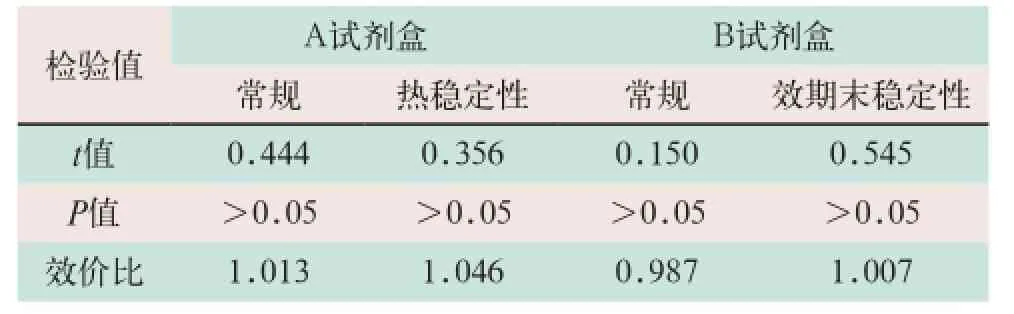
表4 国产试剂准确性检验结果
3 讨论
生长激素定量标记免疫分析试剂盒行业标准中规定的线性,反映了试剂盒规定范围内的量效关系,良好的剂量-反应曲线线性是建立定量标记免疫分析的基础。批内和批间精密度是考察试剂盒对同一样本重复测定时能否得到相同结果的指标。特异性反映了试剂盒对于结构类似物抗干扰的能力。稳定性对产品效期末稳定性和热稳定性的性能都做了明确规定[11-12]。本验证试验中,选择了电化学发光法、化学发光法、磁微粒化学发光法以及时间分辨荧光法等多种不同标记方法,且具有代表性的国产或进口试剂盒进行验证。验证项目包括:空白限、线性、准确度、精密度、特异性及稳定性。参与验证的试剂盒均通过了除准确度项目外的技术指标。
准确度项目是行业标准关键技术指标之一。本研究验证采用了不同来源的国家和(或)国际标准品。一项来源为垂体源国家标准品(150534-9604,1.22 mIU/0.61 μg/支),可溯源至人体GH国际标准品(66/217),但该国际标准品已被GH国际垂体源标准品(80/505,4.4IU/1.735 mg/支)所取代,这两种标准品单位换算关系为:国家标准品中1 ng=2 μIU,现行国际垂体源标准品中1 ng=2.6 μIU;另一项来源为重组国际标准品(98/574,1.95 mg/5.8 IU/支),单位换算关系为:1 ng=3 μIU。由于不同的质量单位与国际单位之间的转换因子不一致,因此国家标准品和国际垂体源标准品之间,或者两个国际标准品之间,单位无法进行统一。即此单位“ng、 IU”并非是统一的“ng、IU”。
国产试剂多溯源至国家标准品,而绝大部分试剂尤其是进口试剂,均溯源至重组GH国际标准品。因此对于此项目的验证,必须分别采用相对应的标准品来进行分析才有意义。然而,即便考虑了溯源性的不一致情况,除2个国产试剂准确度结果满足要求外,进口试剂均不满足要求,在7次实验中仅有4次满足相对偏差在±15.0%范围内,其余3次均在±20.0%范围内。考虑到以上实际检测结果,若按照原定要求准确度定为±10.0%,则大部分试剂无法满足要求,致使其技术指标无可操作性,因此考虑将准确度指标范围放宽至±15.0%,将促使进口企业积极找出偏差原因,改进产品质量,最终将有助于促进各结果的可比性。

表5 进口试剂准确性检验结果
GH现行国家标准品即将面临换批,新批次国家标准品将溯源至重组国际标准品98/574,是根据NIBSC的建议而制定。为了促进GH分析的结果一致化,NIBSC建议均以98/574对各免疫分析系统进行校正,并以μg/L作为单位[13-14]。因此,换批之后的国家标准品上市后,国产试剂需要重新校准溯源系统,这需要一定时间转换,期间可能会出现一些问题,因此准确度技术指标定为±15.0%范围内,更具有合理性和实际操作性。GH定量标记免疫分析行业标准中各项技术指标制定科学合理、易于操作。该标准的制定,将有助于统一GH定量标记免疫分析试剂盒的技术要求,为该类产品的研制、检验及上市后的监管工作提供依据。
4 结语
近年来,我国体外诊断试剂发展势头迅猛,在疾病检测、预防及疗效监测等领域的作用越来越大,对诊断试剂行业标准的需求越来越多。国家食品药品监督管理总局有关部门正在加紧进行相关标准的制修订工作,在监管、审评及检验等各部门及各企业的共同努力下,必将促进体外诊断试剂行业更加健康和规范地发展,为人民用械安全提供更好的保障[15]。
[1]Goeddel DV,Heyneker HL,Hozumi T,et al. Direct expression in Escherichia coli of a DNA sequence coding for human growth hormone[J]. Nature,1979,281(5732):544-548.
[2]刘景会,刘玉林,刘晨,等.重组人生长激素的分离纯化及其结构确证[J].中国生物制品学杂志,2015,28 (11):1153-1156.
[3]李雨萌,洪盼,兰海楠,等.生长激素促进细胞增殖机理的研究进展[J].中国畜牧兽医,2015,42(1):147-152.
[4]Waters MJ,Brooks AJ.Growth hormone and cell growth[J].Endocr DEV,2012,23:86-95.
[5]Baronio F,Mazzanti L,Girtler Y,et al.The-Influence of Growth Hormone Treatment on Glucose Homeostasis in Growth-Hormone-Deficient Children:A Six-Year Follow-Up Study[J].Horm Res Paediatr,2016,86(3):196-200.
[6]孙文鑫,顾盘仙,陈风生.生长激素缺乏症远期随访:附30例报告[J].临床儿科杂志,1997,15(5):294-295.
[7]覃舒文,史轶萦,王德芬,等.重组人生长激素治疗青春期生长激素缺乏症的临床观察[J].中华内分泌代谢杂志,1999,15(1):8-11.
[8]牛庆玲,夏宏伟.重组人GH对GH缺乏症儿童生长及骨代谢的影响[J].中国妇幼保健,2016,31(8):1638-1640.
[9]Richmond E,Rogol AD.Treatment of growth hormone deficiency in children,adolescents and at the transitional age[J].Best Pract Res Clin Endocrinol Metab,2016,30(6):749-755.
[10]Clemmons DR.Accurate diagnosis of growth hormone deficiency in adults:the ongoing challenge[J].Endocr Pract,2016,22(12):1462-1464.
[11]黄颖.标记免疫分析的质量控制和标准化(一)[J].标记免疫分析与临床,2006,13(3):171-174.
[12]黄颖.标记免疫分析的质量控制和标准化(二)[J].标记免疫分析与临床,2006,13(4):240-243.
[13]Müller A,Scholz M,Blankenstein O,Binder G,et al.Harmonization of growth hormone measurements with different immunoassays by data adjustment[J].Clin Chem Lab Med,2011,49(7):1135-42.
[14]Bidlingmaier M.Problems with GH assays and strategies toward standardization[J].Eur J Endo crinol,2008,159(S1):S41-S44.
[15]郭世富,黄颖,母瑞红,等.体外诊断试剂质量控制标准研究[J].中国医学装备,2016,13(1):28-31.
The verification of industry standard for growth hormone quantitative labeling immunoassay kit/
YU Ting, QU Shou-fang, HUANG Jie//China Medical Equipment,2017,14(2):18-22.
Objective:To establish the industry standard for growth hormone quantitative labelling immunoassay kit, and to validate it by chemiluminescence labeling and time-resolved fluorescence labeling method which are suitable for the standard.Methods:Different assay method kits, including magnetic particle chemiluminescent assay, electrochemiluminescence assay, chemiluminescence assay and time-resolved fluorescent assay, were used to verified the blank limitation, linearity, accuracy, precision, specificity and stability in accordance with protocol industry standard.Results:Other verification results could meet requirements of the protocol industry standard besides accuracy in part of kits couldn't achieve to anticipative remand (relative deviation couldn't be more than ±10%).Conclusion:According to the verification results, the accuracy requirements was adjusted to ±15%. The other items of industry standard were maintained. The industry standard for growth hormone quantitative labeling immunoassay kit is ultimately established. The standard would contribute to unity quality standard of growth hormone quantitative labeling immunoassay kit, and provide the basis for the supervision and administration of its production, examination, circulation, clinical application and other areas.
Growth hormone; Reagent kit; Industry standard; Chemiluminescence; Verification
1672-8270(2017)02-0018-05
R446.62
A
10.3969/J.ISSN.1672-8270.2017.02.006

2016-10-12
①中国食品药品检定研究院非传染病诊断试剂室 卫生部生物技术产品检定方法及其标准化重点实验室 北京 100050
*通讯作者:jhuang5522@126.com
于婷,女,(1978- ),博士,副研究员。中国食品药品检定研究院非传染病诊断试剂室、卫生部生物技术产品检定方法及其标准化重点实验室,从事体外诊断试剂的检定、行业标准制修订及标准物质研制工作。
