一测多评法同时测定北青龙衣药材中胡桃醌和胡桃酮的含量Δ
2017-03-03霍金海张海燕王伟明黑龙江省中医药科学院中药研究所哈尔滨50036黑龙江省林下经济资源研发与利用协同创新中心哈尔滨50040
霍金海,张海燕,王伟明,2#(.黑龙江省中医药科学院中药研究所,哈尔滨 50036;2.黑龙江省林下经济资源研发与利用协同创新中心,哈尔滨 50040)
一测多评法同时测定北青龙衣药材中胡桃醌和胡桃酮的含量Δ
霍金海1*,张海燕1,王伟明1,2#(1.黑龙江省中医药科学院中药研究所,哈尔滨 150036;2.黑龙江省林下经济资源研发与利用协同创新中心,哈尔滨 150040)
目的:建立同时测定北青龙衣药材中胡桃醌、胡桃酮含量的方法。方法:采用高效液相色谱法,以胡桃醌为内参物,计算其对胡桃酮的相对校正因子(RCF),通过RCF计算北青龙衣药材中胡桃酮的含量;以外标法测定的胡桃酮含量作实测值,采用夹角余弦法比较一测多评法的计算值与实测值的差异。结果:胡桃醌、胡桃酮检测质量浓度线性范围分别为7.6~76.0 μg/mL(r=0.999 0)、8.2~82.0 μg/mL(r=0.999 4);精密度、稳定性、重复性试验的RSD<3.0%;加样回收率分别为95.37%~97.94%(RSD=1.04%,n=6)、99.13%~100.10%(RSD=0.33%,n=6)。计算值与实测值之间的夹角余弦值为0.999 84,两者差异无统计学意义(P>0.05)。结论:该方法操作简便,精密度、稳定性、重复性好,可用于北青龙衣药材中胡桃醌、胡桃酮含量的同时测定。
北青龙衣;一测多评;高效液相色谱法;校正因子;胡桃醌;胡桃酮;含量
北青龙衣为胡桃科胡桃属植物核桃楸Juglans mandshurica Maxim.的未成熟外果皮,主产于东北三省,以黑龙江省资源蕴藏量最大。萘醌类为公认的北青龙衣抗肿瘤主要成分,文献表明从胡桃属植物中已分离获得60多种萘醌类化合物[1],其中以胡桃醌、胡桃酮为主要活性成分。目前国内外学者多集中于胡桃醌的含量测定方法研究,但胡桃醌化学性质不稳定,致使测定结果不理想。笔者前期研究发现,北青龙衣鲜品中胡桃醌含量较高,在干燥、贮存过程中能够转化成胡桃酮,二者总和相对稳定。因此,同时测定北青龙衣药材中胡桃醌、胡桃酮的总量,对于北青龙衣药材质量控制及品质评价具有实际意义。
目前,胡桃醌有化学合成对照品,而胡桃酮仅有少数植物化学家从胡桃属植物中分离获得,难以商品化,笔者也未见其含量测定方法的报道。近年来,一测多评技术采用一个对照品实现对多个成分的同步测定,对于一些制备困难或价格昂贵的对照品具有实际应用价值。该方法在白芍[2]、木香[3]等药材中得到发展和验证,黄连的一测多评标准已被2010年版《中国药典》(一部)采纳[4]。2015年版《中国药典》(一部)继续收录了丹参等品种的一测多评含量测定方法[5]。本试验针对北青龙衣药材中主要指标成分胡桃醌、胡桃酮建立一测多评方法,解决了难以获得胡桃酮对照品的困扰,为北青龙衣药材的质量控制及采收期的确定奠定基础。
1 材料
1.1 仪器
1100型高效液相色谱(HPLC)仪,包括G1315B DAD二级管阵列检测器(美国Agilent公司);2010型HPLC仪,包括紫外双波长检测器(日本Shimadzu公司);KQ-300DB型数控超声仪(昆山市超声仪器有限公司,功率:300 W,频率:40 kHz);BP211D型电子分析天平、BSA224S-CW型电子分析天平(德国Sartorius公司)。
1.2 试剂
胡桃醌对照品(成都瑞芬思生物科技有限公司,批号:H-075-131230,纯度:>99%);胡桃酮对照品(笔者自制,经氢谱、碳谱检测结构,HPLC面积归一化法测定纯度:>98%);磷酸、甲醇为色谱纯,其余试剂均为分析纯,水为超纯水。
1.3 药材
北青龙衣药材于2014年7—8月采自黑龙江省不同产地(见表1),经黑龙江省中医药科学院初东君主任药师鉴定为真品。剥取外果皮,通风处阴干,7 d后用于样品制备(含水量均符合小于10%的要求)。

表1 北青龙衣药材来源Tab 1 Source of J.mandshurica
2 方法与结果
2.1 原理
在一定线性范围,成分的量(质量或浓度)与检测器响应值成正比。在多指标(s,a,b,…,i,…)质量评价时,以药材/成药中某一典型有效成分作内参物(s),建立内参物对其他待测成分(a,b,…,i,…)间的相对校正因子(RCF),按下式计算:

式中,As为内参物对照品s峰面积,cs为内参物对照品s浓度,Ai为待测成分对照品i峰面积,ci为待测成分对照品i浓度。
在方法学建立时,主要是求出内参物与各待测成分间的RCF,并将其作为一个常数用于含量测定中。
应用RCF(fsa,fsb,fsc,…),结合内参物(s)实测值cs,计算待测成分(a,b,…,i,…)的浓度:

2.2 色谱条件与系统适用性试验
色谱柱:Diamonsil C18(250 mm×4.6 mm,5 μm);流动相:甲醇-水(45∶55,V/V);流速:1.0 mL/min;检测波长:265 nm;柱温:30℃;进样量:10µL。在上述色谱条件下,理论板数以胡桃酮、胡桃醌峰计均>3 000;各成分基线分离良好,分离度>1.5,详见图1。
2.3 溶液的制备
2.3.1 混合对照品溶液 取待测成分对照品适量,精密称定,置于10 mL量瓶中,加甲醇溶解并定容,制成胡桃醌、胡桃酮质量浓度分别为0.076、0.082 mg/mL的混合对照品溶液。

图1 高效液相色谱图Fig 1 HPLC chromatograms
2.3.2 供试品溶液 取样品粉末(过60目筛)1 g,精密称定,加甲醇25 mL,称定质量,超声处理30 min,放冷,再次称定质量,加甲醇补足减失的质量,摇匀,经微孔滤膜滤过,取续滤液,即得。
2.4 线性关系考察
分别精密量取“2.3.1”项下混合对照品溶液1、2、3、5、10 mL,分别置于10 mL量瓶中,加流动相定容,制成系列混合对照品溶液。精密量取上述系列混合对照品溶液各10 μL,按“2.2”项下色谱条件进样测定,记录峰面积。以待测成分质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,得胡桃醌、胡桃酮回归方程分别为y=32.22x+79.04(r=0.999 0)、y=33.04x+ 111.3(r=0.999 4)。结果表明,胡桃醌、胡桃酮检测质量浓度线性范围分别为7.6~76.0、8.2~82.0 μg/mL。
2.5 精密度试验
取“2.3.1”项下混合对照品溶液适量,按“2.2”项下色谱条件连续进样测定6次,记录峰面积。结果,胡桃醌、胡桃酮峰面积的RSD分别为0.98%、0.95%(n=6),表明仪器精密度良好。
2.6 稳定性试验
取“2.3.2”项下供试品溶液(编号:1)适量,分别于室温下放置0、2、4、6、8、10、12 h时按“2.2”项下色谱条件进样测定,记录峰面积。结果,胡桃醌、胡桃酮峰面积的RSD分别为0.51%、2.85%(n=7),表明供试品溶液在室温放置12 h内基本稳定。
2.7 重复性试验
精密称取同一批样品(编号:1)适量,按“2.3.2”项下方法制备供试品溶液,共6份,再按“2.2”项下色谱条件进样测定,记录峰面积并计算含量。结果,胡桃醌、胡桃酮平均含量分别为0.462 6、1.956 1 mg/g,RSD分别为2.91%、2.55%(n=6),表明本方法重复性良好。
2.8 加样回收率试验
取已知含量样品(编号:1)适量,共6份,分别加入一定质量的待测成分对照品,按“2.3.2”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。

表2 加样回收率试验(n=6)Tab 2 Results of recovery test(n=6)
2.9 RCF的计算
以胡桃醌为内参物,按“2.1”项下公式(1)计算,结合“2.4”项下系列混合对照品溶液所得峰面积数据,计算胡桃醌对胡桃酮的RCF。结果,胡桃醌对胡桃酮的RCF为1.131。
2.10 RCF耐用性考察
2.1 0.1 色谱条件考察 取“2.3.1”项下混合对照品溶液,分别考察不同流动相[甲醇-0.2%磷酸溶液(55∶45,V/V)、甲醇-水(45∶55,V/V)]、不同流动相比例[甲醇-水(45∶55,V/V)、(50∶50,V/V)]、不同柱温(20、30、40℃ )、不同流速(0.8、1.0、1.2 mL/min)对RCF的影响,详见表3~表6。

表3 不同流动相对RCF的影响(n=6)Tab 3 Effect of different mobile phases on RCF(n=6)

表4 不同流动相比例对RCF的影响(n=6)Tab 4 Effect of different mobile phase ratios on RCF(n=6)
2.1 0.2 色谱柱和HPLC仪考察 取“2.3.1”项下混合对照品溶液,分别考察不同HPLC仪(安捷伦1100、岛津2010)和不同色谱柱[Diamonsil C18(250 mm×4.6 mm,5 μm)、Kromasil 100-5C18(250 mm×4.6 mm,5 μm)、Agilent Extend C18(250 mm×4.6 mm,5 μm)3种色谱柱,详见表7。
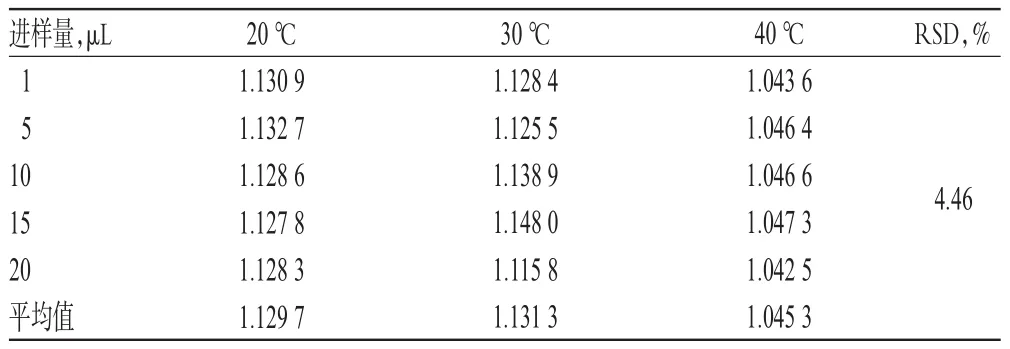
表5 不同柱温对RCF的影响(n=6)Tab 5 Effect of different column temperature on RCF(n=6)
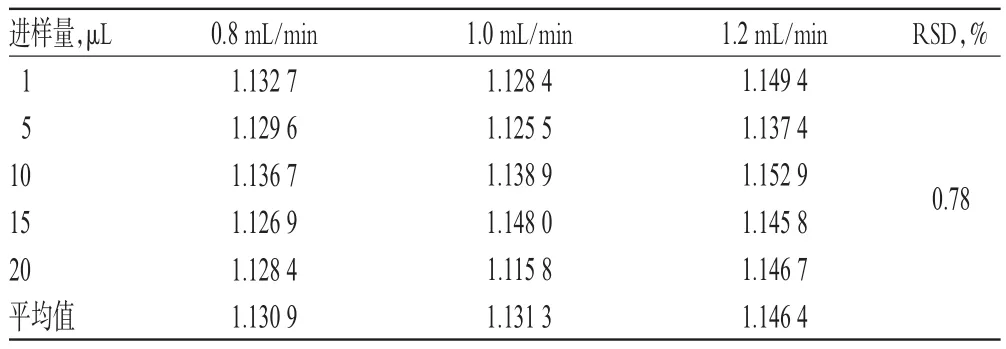
表6 不同流速对RCF的影响(n=6)Tab 6 Effect of different velocities on RCF(n=6)
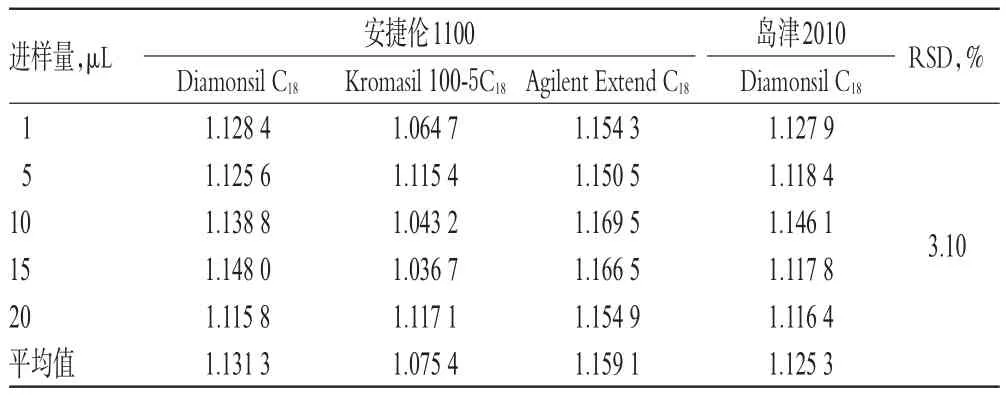
表7 不同仪器和色谱柱对RCF的影响(n=6)Tab 7 Effect of different instruments and chromatographic columns on RCF(n=6)
2.1 0.3 实验室考察 取“2.3.1”项下混合对照品溶液考察3个不同实验室对RCF的影响,详见表8。
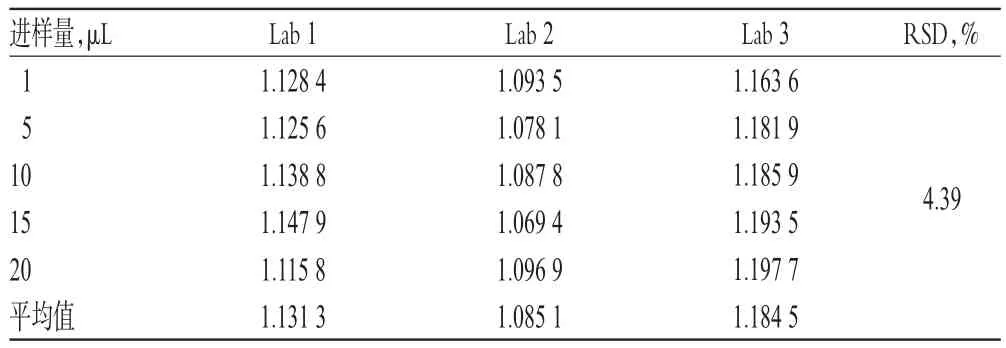
表8 不同实验室对RCF的影响(n=6)Tab 8 Effect of different laboratories on RCF(n=6)
以上研究表明,该一测多评方法在流动相组成及比例、柱温、流速发生小幅度变化,以及更换色谱柱、HPLC色谱仪、实验室等条件下均具有较好耐用性,RSD均小于5%。
2.11 样品含量测定
取表1中的样品各适量,分别按“2.3.2”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,记录峰面积并计算样品含量,见表9。采用一测多评法和外标法测得的胡桃酮的计算值和实测值之间的夹角余弦值为0.999 84,表明两种方法所得含量差异无统计学意义(P>0.05)。
3 讨论

表9 样品含量测定结果(n=6)Tab 9 Results of contents determination of samples(n=6)
笔者对不同流动相pH、流动相组成比例、柱温、流速和检测波长等因素进行了考察,结果RCF均无较大偏离(RSD<5%);通过方法学、方法的耐用性、系统适用性考察对一测多评法进行验证,结果一测多评法计算值与外标法实测值差异无统计学意义(P>0.05),表明试验建立的RCF准确可信。
预试验中还检测了北青龙衣鲜、干品中胡桃醌和胡桃酮含量,发现鲜品中无胡桃酮,且胡桃醌含量较高;然而鲜品中胡桃醌含量与干品中胡桃醌、胡桃酮含量之和相当;可见北青龙衣鲜、干品中胡桃醌、胡桃酮含量总和相对稳定。而单一测定胡桃醌的含量,受干燥方法和贮存时间的限制,难以准确反映北青龙衣药材真实质量。
综上所述,一测多评方法不仅能够准确计算胡桃酮成分含量,并且实现了在对照品短缺的情况下,多指标成分的含量测定,为北青龙衣药材的质量控制研究提供了更加科学准确的研究方法。
[1] Sun JX,Zhao XY,Fu XF,et al.Three new naphthalenyl glycosides from the root bark of Juglans cathayensis[J]. Chem Pharm Bull:Tokyo,2012,60(6):785-789.
[2] 黄山君,杨琪伟,石燕红,等.一测多评法测定白芍中芍药苷与芍药内脂苷的含量[J].中国中药杂志,2011,36(6):780-783.
[3] 杨宪,刘筱琴,张雪,等.HPLC一测多评法用于木香及3种含木香中药复方制剂的质量评价[J].中国药房,2014,25(11):1030-1034.
[4] 国家药典委员会.中华人民共和国药典:一部[S].2010年版.北京:中国医药科技出版社,2010:285.
[5] 国家药典委员会.中华人民共和国药典:一部[S].2015年
版.北京:中国医药科技出版社,2015:76.
Simultaneous Determination of Contents of Juglone and Regiolone in Juglans mandshurica by Quantitative Analysis of Multi-components by Single-maker
HUO Jinhai1,ZHANG Haiyan1,WANG Weiming1,2(1.Institute of Chinese Medicine,Heilongjiang Academy of Traditional Chinese Medicine,Harbin 150036,China;2.Heilongjiang Forest Economy Collaborative R&D and Innovation Center Resource Utilization,Harbin 150040,China)
OBJECTIVE:To establish a method for the simultaneous determination of juglone and regiolone in Juglans mandshurica.METHODS:HPLC was used and regiolone was used as internal reference,the relative correction factor(RCF)of regiolone and juglone wascalculated,then calculated the content of juglone based on RCF;the juglone content was used as measured value,which was determined by external standard method,angle cosine method was used to compared the difference of calculated value in quantitative analysis of multi-components by single-maker and measured value in external standard method.RESULTS:The lin-ear range was 7.6-76.0 μg/mL for juglone(r=0.999 0)and 8.2-82.0 μg/mL for regiolone(r=0.999 4);RSDs of precision,stability and reproducubility tests were lower than 3.0%;recoveries were 95.37%-97.94%(RSD=1.04%,n=6)and 99.13%-100.10%(RSD=0.33%,n=6).The cosine of the included angle between the calculated and measured values was 0.999 84,and there was no significant difference(P>0.05).CONCLUSIONS:The method is simple with good precision,stability and reproducibility,and can be used for the simultaneous determination of juglone and regiolone in J.mandshurica.
Juglans mandshurica;Quantitative analysis of multi-components by single-maker;HPLC;Correction factor;Juglone;Regiolone;Content
R284.1
A
1001-0408(2017)03-0380-04
2016-02-06
2016-05-16)
(编辑:张 静)
国家自然科学基金资助项目(No.81503348);国家“重大新药创制”科技重大专项课题(No.2009ZX09102-138)
*副研究员。研究方向:中药品质评价及药效物质基础。电话:0451-55653086。E-mail:jinhaihuo@126.com
#通信作者:研究员。研究方向:中药新药研发。电话:0451-55665478。E-mail:zyyjy@163.com
DOI10.6039/j.issn.1001-0408.2017.03.26
