氨磷汀预防化疗致周围神经毒性疗效与安全性的系统评价Δ
2017-03-03魏晓晨朱立勤王春革天津市第一中心医院天津3009天津市第四医院天津300
魏晓晨,王 慧,朱立勤,王春革,邓 琦,李 新(.天津市第一中心医院,天津 3009;.天津市第四医院,天津 300)
氨磷汀预防化疗致周围神经毒性疗效与安全性的系统评价Δ
魏晓晨1*,王 慧2,朱立勤1#,王春革1,邓 琦1,李 新1(1.天津市第一中心医院,天津 300192;2.天津市第四医院,天津 300222)
目的:系统评价氨磷汀预防化疗致周围神经毒性(CIPN)的疗效和安全性,为临床提供循证参考。方法:计算机检索PubMed、EMBase、Cochrane图书馆、中国期刊全文数据库、万方数据库和中文科技期刊数据库,收集氨磷汀联合化疗(试验组)对比单纯化疗(对照组)用于肿瘤患者的随机对照试验(RCT),资料提取并采用改良的Jadad评分量表评价质量后,采用Rev Man 5.3统计软件进行Meta分析。结果:共纳入20项RCT,合计1 552例患者。Meta分析结果显示,试验组患者CIPN总发生率[RR=0.57,95%CI(0.45,0.72),P<0.001]、严重CIPN发生率[RR=0.47,95%CI(0.32,0.69),P<0.001]显著低于对照组,恶心发生率[RR=1.31,95%CI(1.03,1.67),P=0.03]、呕吐发生率[RR=2.28,95%CI(1.14,4.54),P=0.02]及低血压发生率[RR=28.29,95% CI(10.53,76.04),P<0.001]显著高于对照组,差异均有统计学意义;两组患者客观缓解率比较,差异无统计学意义[RR=1.08,95% CI(0.98,1.19),P=0.14]。结论:氨磷汀能有效预防肿瘤患者化疗致CIPN的发生,且不影响化疗疗效,但会加重患者化疗后恶心、呕吐的发生,并易诱发低血压。
氨磷汀;化疗;预防;神经毒性;系统评价;疗效;安全性
化疗致周围神经毒性(Chemotherapy-induced peripheral neurotoxicity,CIPN)是目前化疗最常见且有可能造成永久性损害的不良反应,其发生率仅次于血液毒性[1]。20%~40%肿瘤患者在使用具有神经毒性的化疗药物后会出现不同程度的CIPN[2]。CIPN的出现会导致化疗强度降低、化疗时间推迟、甚至终止化疗,而这将直接影响化疗效果,降低肿瘤患者的生存质量,增加病死率[3]。此外,CIPN一旦出现,由于目前临床缺乏有效的治疗手段,因此预防CIPN的发生显得尤为重要。氨磷汀为广谱细胞保护剂,临床对其在化疗中的肾保护、骨髓保护作用研究较多,而在周围神经系统方面报道较少,且相关报道结论不一,仍有争议[4-5]。因此,本研究对国内外报道的氨磷汀预防CIPN的随机对照试验(RCT)进行系统评价,以期为临床提供循证依据。
1 资料和方法
1.1 纳入标准
1.1.1 研究类型 国内外公开发表的RCT,语种限定为中文和英文。
1.1.2 研究对象 接受化疗的肿瘤患者。肿瘤类型不限,患者年龄、性别不限。
1.1.3 干预措施 对照组患者给予单纯化疗;试验组患者在化疗前给予氨磷汀,剂量和疗程不限。所有化疗方案中均包含导致神经毒性发生的药物,具体为紫杉醇+卡铂(TC方案)、环磷酰胺+阿霉素+长春新碱+强的松(CHOP方案)、紫杉醇+卡铂+表柔比星(TEC方案)、环磷酰胺+顺铂(CP方案)、顺铂(DDP方案)、卡铂+依托泊苷+噻替哌(CET方案)、紫杉醇+异环磷酰胺+顺铂(TIP方案)、奥沙利铂+氟尿嘧啶+亚叶酸钙(FOLFOX方案)、紫杉醇+顺铂(TP方案)、长春瑞滨+顺铂(NP方案)、伊立替康+氟尿嘧啶+亚叶酸钙(FOLFIRI方案)、卡培他滨+奥沙利铂(XELOX方案)、多西他赛+顺铂(DP方案)。
1.1.4 结局指标 疗效指标:①CIPN总发生率;②严重CIPN发生率(≥Ⅱ级)[2];③客观缓解率。安全性指标:④不良反应(ADR)发生率。
1.2 排除标准
1)非RCT;2)试验组患者联合使用了其他营养神经的药物;3)原有神经系统疾病者;4)正在接受其他可能引起神经系统症状的药物;5)结局指标无CIPN发生率的研究;6)无法提取结局指标的研究。
1.3 检索
计算机检索PubMed、EMBase、Cochrane图书馆、中国期刊全文数据库、万方数据库和中文科技期刊数据库。同时,手工检索相关专业杂志并追溯纳入文献的参考文献,检索时限均从各数据库建库起至2015年9月。中文检索词:“化疗”“周围神经毒性”“预防”“氨磷汀”“奥沙利铂”“顺铂”“紫杉醇”“多西他赛”“长春瑞滨”“长春新碱”等;英文检索词:“Chemotherapy”“Peripheral neurotoxicity”“Peripheral neuropathy”“Prophylaxis”“Prevent”“Amifostine”“Oxaliplatin”“Cisplatin”“Paclitaxel”“Docetaxel”“Vinorelbine”“Vincristine”。
1.4 资料提取及质量评价
两位研究者根据纳入与排除标准分别阅读题目及摘要初筛,进一步阅读全文复筛,若意见不同,由第三位研究者协助解决。根据改良的Jadad量表评价纳入文献的方法学质量,包括随机方法、分配方案、盲法、退出及失访的例数和原因等几个方面。总分最高为7分,其中1~3分为低质量研究,4~7分为高质量研究[6]。
1.5 统计学方法
采用Rev Man 5.3统计软件进行数据处理和分析。纳入研究间异质性采用χ2检验,当P>0.1,I2<50%时,采用固定效应模型分析;反之,采用随机效应模型分析。计数资料采用比值比(OR)或相对危险度(RR)及其95%置信区间(CI)表示效应量;计量资料采用标准差(MD)及其95%CI表示效应量。此外,采用倒漏斗图来识别发表偏倚。
2 结果
2.1 文献检索结果
计算机和手工初检共获得相关文献822篇,排除重复文献,阅读摘要和全文,排除不符合纳入标准的文献后,最终纳入20篇(项)研究[7-26],其中7篇英文文献[7-13],13篇中文文献[14-26]。
2.2 纳入研究基本信息
共纳入20项研究,合计1 552例患者。20项研究比较了两组患者CIPN总发生率[7-26];14项研究比较了两组患者严重CIPN发生率[7,9-11,13,15,17-18,20-21,23-26];11项研究比较了两组患者客观缓解率[7-8,10-14,17-18,20,25];10项研究比较了两组患者ADR发生率[7-12,16,18-19,26];10项研究采用美国国立癌症研究所(NCI-CTC)不良反应评定标准[7-15,23];7项研究采用世界卫生组织(WHO)抗癌药物周围神经毒性分级标准评定[16-18,21-22,25-26];1项研究采用Levi(奥沙利铂专用)周围神经毒性分级标准评定[20];2项研究未提及具体评定标准[19,24]。纳入研究基本信息见表1。
2.3 纳入研究质量评价结果
纳入的20项研究均为RCT。3项研究描述了具体随机方法[7,12,22],其中2项采用分层随机化[7,12],1项采用随机数字表[22],其余均未描述;1项研究采用双盲[9],1项研究未采用盲法[8],其余均未描述;所有研究均未报道分配隐藏;4项研究报道了失访/退出[7,11-13],其中3项解释了具体原因[7,11-12]。5项研究为高质量研究[7,9,11-12,22],其中2项评分为5分[7,12],3项评分为4分[9,11,22];其中13项评分为3分[10,14-21,23-26],2项评分为2分[8,13]。
2.4 Meta分析结果
2.4.1 CIPN总发生率 20项研究报道了CIPN总发生率[7-26],各研究间有统计学异质性(P<0.001,I2=74%),采用随机效应模型分析,详见图1。Meta分析结果显示,试验组患者CIPN总发生率显著低于对照组,差异有统 计学意义[RR=0.57,95%CI(0.45,0.72),P<0.001]。

表1 纳入研究基本信息Tab 1 General information of the included studies
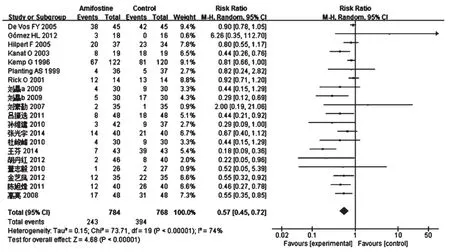
图1 两组患者CIPN总发生率的Meta分析森林图Fig 1 Forest plot of Meta-analysis of the total incidence of CIPN in 2 groups

图2 两组患者严重CIPN发生率的Meta分析森林图Fig 2 Forest plot of Meta-analysis of serious CIPN in 2 groups
2.4.2 严重CIPN发生率 14项研究报道了严重CIPN发生率[7,9-11,13,15,17-18,20-21,23-26],各研究间无统计学异质性(P=0.98,I2=0),采用固定效应模型分析,详见图2。Meta分析结果显示,试验组患者严重CIPN发生率显著低于对照组,差异有统计学意义[RR=0.47,95%CI(0.32,0.69),P<0.001]。
2.4.3 客观缓解率 共有11项研究报道了客观缓解率[7-8,10-14,17-18,20,25],各研究间无统计学异质性(P=0.90,I2=0),采用固定效应模型分析,详见图3。Meta分析结果显示,两组患者客观缓解率比较差异无统计学意义[RR=1.08,95%CI(0.98,1.19),P=0.14]。
2.4.4 ADR发生率 根据纳入研究中报道氨磷汀致ADR的不同类型分别进行Meta分析,结果见表2。

图3 两组患者客观缓解率的Meta分析森林图Fig 3 Meta-analysis of objective response rate in 2 groups

表2 两组患者ADR发生率的Meta分析结果Tab 2 Meta-analysis results of the incidence of ADR in 2 groups
2.4.5 亚组分析 由于纳入研究涉及众多化疗方案,为了进一步评价氨磷汀对不同化疗药物的预防效果,本研究以CIPN总发生率为指标进一步行亚组分析,结果见表3。

表3 不同化疗药物CIPN总发生率的Meta分析结果Tab 3 Results of Meta-analysis of the tolal incide-nce of CIPN induced by different chemotherapy drugs
2.5 发表偏倚分析
以CIPN总发生率为指标绘制倒漏斗图,详见图4。由图4所示,对称性较差,表明可能存在发表偏倚。

图4 CIPN总发生率的倒漏斗图Fig 4 Inverted funnel plot of the total incidence of CIPN
3 讨论
CIPN是肿瘤患者治疗过程中相对常见且严重的不良反应,通常表现为感觉异常、日常活动受限、甚至致残[3,27]。CIPN的发生机制目前仍不清楚,可能是由于神经递质缺乏和能量代谢衰竭导致的背根神经节损伤及轴突神经病变。由于缺少有效预防或缓解CIPN的方法,因此目前对于CIPN的防治仍然是十分棘手的难题[28]。氨磷汀为广谱选择性细胞保护剂,在体内可被细胞膜结合的碱性磷酸酶水解为WR-1605、WR-33278等产物。WR-1065的自由巯基在正常组织中浓度高于肿瘤组织中,可直接与化疗药物结合而减轻其毒副作用,并可清除化疗中产生的氧自由基;WR-33278可松解拓扑异构酶引起的DNA超螺旋结构。WR-1065或WR-33278与DNA核蛋白结合后,改变了染色质核小体间结构使其不易被降解,故可明显减少化疗引起的正常组织细胞凋亡[4,11]。
本次系统评价表明,氨磷汀能有效减少肿瘤患者CIPN的总发生率,较对照组减少了43%,且对化疗后患者的客观缓解率没有影响,但会增加患者恶心、呕吐的发生率并容易诱发低血压(一般在5~15 min内缓解)。目前,临床用于评定CIPN的分级标准主要包括WHO、Levi及NCI-CTC,但无论采用哪种分级标准,当患者出现≥Ⅱ级CIPN时,临床通常会根据患者病情及耐受情况选择降低化疗强度或停止化疗。因此,本研究进一步评价了氨磷汀对严重CIPN(≥Ⅱ级)的预防作用。结果显示,氨磷汀能有效减少严重CIPN发生率,较对照组减少了53%。这表明氨磷汀能使53%患者避免化疗强度降低或停止化疗,从而保证化疗效果。这提示,化疗前使用氨磷汀是一种预防CIPN的有效方法,且不影响化疗药物的抗肿瘤效果,但使用期间应密切关注恶心、呕吐和低血压等不良反应的发生,并及时处理。
临床上常用的具有神经毒性的化疗药物主要包括顺铂、奥沙利铂、紫杉醇等[1],因此本研究根据不同的化疗药物进行亚组分析。结果表明,氨磷汀能有效降低顺铂或奥沙利铂致CIPN总发生率,分别减少了24%及63%,但对紫杉醇致CIPN总发生率没有影响,因此提示氨磷汀在预防铂类引起的CIPN方面具有优势。
本研究的局限性:(1)部分研究质量偏低;(2)部分RCT样本量较小;(3)部分指标存在异质性,可能是由于纳入研究间临床特征(如化疗方案、化疗周期等)的不同造成的;(4)可能存在发表偏倚。因此,所得结论尚需更多高质量、大样本、随机双盲对照试验来加以验证。
综上所述,氨磷汀能有效预防肿瘤患者CIPN的发生,且不影响化疗疗效,但会加重化疗后恶心、呕吐的发生,并易诱发低血压。
[1] Grisold W,Cavaletti G,Windebank AJ.Peripheral neuropathies from chemotherapeutics and targeted agents:diagnosis,treatment,and prevention[J].Neuro Oncol,2012,14(Suppl 4):iv45-54.
[2] Smith EM,Pang H,Cirrincione C,et al.Effect of duloxetine on pain,function,and quality of life among patients with chemotherapy-induced painful peripheral neuropathy:a randomized clinical trial[J].JAMA,2013,309(13):1359-1367.
[3] Beijers AJ,Jongen JL,Vreugdenhil G.Chemotherapy-induced neurotoxicity:the value of neuroprotective strategies[J].Neth J Med,2012,70(1):18-25.
[4] 王蜀梅.氨磷汀在肿瘤治疗中的应用与不良反应[J].中国药物与临床,2012,12(10):1313-1314.
[5] Hershman DL,Lacchetti C,Dworkin RH,et al.Prevention and management of chemotherapy-induced peripheral neuropathy in survivors of adult cancers:American soci-ety of clinical oncology clinical practice guideline[J].J Clin Oncol,2014,32(18):1941-1947.
[6] 梁万年.医学科研方法学[M].北京:人民卫生出版社,2002:451-486.
[7] De Vos FY,Bos AM,Schaapveld M,et al.A randomized phaseⅡstudy of paclitaxel with carboplatin+/—amifostine as first line treatment in advanced ovarian carcinoma [J].Gynecol Oncol,2005,97(1):60-67.
[8] Gómez HL,Samanéz C,Campana F,et al.Addition of amifostine to the CHOP regimen in elderly patients with aggressive non-hodgkin lymphoma:a phaseⅡtrial showing reduction in toxicity without altering long-term survival[J].Hematol Oncol Stem Cell Ther,2012,5(3):152-157.
[9] Hilpert F,Stähle A,Tomé O,et al.Neuroprotection with amifostine in the first-line treatment of advanced ovarian cancer with carboplatin/paclitaxel-based chemotherapy-a double-blind,placebo-controlled,randomized phaseⅡstudy from the arbeitsgemeinschaft gynäkologische onkologie(AGO)ovarian cancer study group[J].Support Care Cancer,2005,13(10):797-805.
[10] Kanat O,Evrensel T,Baran I,et al.Protective effect of amifostine against toxicity of paclitaxel and carboplatin in non-small cell lung cancer[J].Med Oncol,2003,20(3):237-245.
[11] Kemp G,Rose P,Lurain J,et al.Amifostine pretreatment for protection against cyclophosphamide-induced and cisplatin-induced toxicities:results of a randomized control trial in patients with advanced ovarian cancer[J]. J Clin Oncol,1996,14(7):2101-2112.
[12] Planting AS,Catime G,de Mulder PH,et al.Randomized study of a short course of weekly cisplatin with or without amifostine in advanced head and neck cancer[J]. Ann Onco,1999,10(6):693-700.
[13] Rick O,Beyer J,Schwella N,et al.Assessment of amifostine as protection from chemotherapy-induced toxicities after conventional-dose and high-dose chemotherapy in patients with germ cell tumor[J].Ann Oncol,2001,12(8):1151-1155.
[14] 刘晶,靳彩玲,牛红蕊,等.氨磷汀配合FOLFOX方案治疗晚期胃癌的临床观察[J].中国医药指南,2009,7(18):17-18.
[15] 刘晶,靳彩玲,牛红蕊,等.氨磷汀对肺癌TP方案化疗的周围神经保护作用观察[J].中国中医药现代远程教育,2009,7(10):125-126.
[16] 刘素勤,班丽英,张洁,等.阿米福汀在晚期非小细胞肺癌NP方案化疗中的保护作用观察[J].中国医师进修杂志,2007,30(11):26-26.
[17] 吕振选.氨磷汀联合方案治疗晚期非小细胞肺癌的临床观察[D].郑州:郑州大学,2011.
[18]孙维建,卢明东,李丕宏,等.阿米福汀联合FOLFOX4化疗治疗晚期胃癌的临床观察[J].浙江医学,2010,32(9):1322-1324.
[19] 张光宇,虞晓林,蒙荣钦,等.氨磷汀联合术后FOLFIRI方案治疗中晚期直肠癌临床分析[J].中国现代医学杂志,2014,24(16):85-87.
[20] 王芬,王树滨,申东兰,等.氨磷汀对奥沙利铂所致周围神经毒性的改善作用的病例对照研究[J].癌症进展,2014,12(6):571-575.
[21]胡丹红,刘俏,石小姑.XELOX化疗联合阿米福汀治疗Ⅲ期结直肠癌的临床观察和护理[J].浙江实用医学,2012,17(4):309-312.
[22] 董志毅,韩明权,苏晋梅.阿米福汀联合TP方案在晚期非小细胞肺癌的应用[J].临床肺科杂志,2010,15(7):1032-1033.
[23] 陈旭烽,王永辉,楼建.氨磷汀防治奥沙利铂神经毒性的临床研究[J].中国药业,2011,20(7):76-77.
[24] 高亮,王永向,卢丽琴,等.氨磷汀对胃肠道肿瘤L-OHP联合CF/5-FU方案化疗患者重要脏器保护作用的临床观察[J].实用肿瘤杂志,2008,23(4):363-365.
[25] 金艺凤,王莹,刘东华,等.氨磷汀配合含铂方案治疗晚期肺癌的疗效观察[J].安徽医药,2012,16(7):1006-1007.
[26]杜峻峰,李世拥,于波,等.氨磷汀联合术后FOLFOX4方案治疗中晚期直肠癌临床分析[J].中国误诊学杂志,2010,10(10):2335-2336.
[27] Carozzi VA,Canta A,Chiorazzi A.Chemotherapy-induced peripheral neuropathy:what do we know about mechanisms?[J].Neurosci Lett,2015,596(2):90-107.
[28] Argyriou AA,Bruna J,Marmiroli P,et al.Chemotherapy-induced peripheral neurotoxicity(CIPN):an update[J]. Crit Rev Oncol Hematol,2012,82(1):51-77.
Efficacy and Safety of Amifostine in Preventing Chemotherapy-induced Peripheral Neurotoxicity:A Systematic Review
WEI Xiaochen1,WANG Hui2,ZHU Liqin1,WANG Chunge1,DENG Qi1,LI Xin1(1.Tianjin First Central Hospital,Tianjin 300192,China;2.Tianjin Fourth Hospital,Tianjin 300222,China)
OBJECTIVE:To systematically review the efficacy and safety of amifostine in preventing chemotherapy-induced peripheral neurotoxicity(CIPN),and provide evidence-based reference for clinical treatment.METHODS:Retrieved from PubMed,EMBase,Cochrane Library,CJFD,Wanfang and VIP Database,randomized controlled trials(RCT)about amifostine combined with chemotherapy(test group)versus chemotherapy alone(control group)in preventing CIPN were collected.Meta-analysis was performed by using Rev Man 5.3 software after data extraction and quality evaluation by modified Jadad score.RESULTS:Totally 20 RCTs were included,involving 1 552 patients.Results of Meta-analysis showed,the total incidence of CIPN[RR=0.57,95%CI(0.45,0.72),P<0.001]and incidence of serious CIPN[RR=0.47,95%CI(0.32,0.69),P<0.001]in test group were significantly lower than control group,the incidences of nausea[RR=1.31,95%CI(1.03,1.67),P=0.03],vomiting[RR=2.28,95%CI(1.14,4.54),P=0.02]and hypotension[RR=28.29,95%CI(10.53,76.04),P<0.001]were significantly higher than control group,with statistic significance;and there was no significant difference in objective response rate[RR=1.08,95%CI(0.98,1.19),P=0.14]. CONCLUSIONS:Amifostine can effectively prevent the incidence of CIN and does not affect chemotherapy efficacy,whereas can increase the incidence of nausea and vomiting and easily induce hypotension.
Amifostine;Chemotherapy;Prevention;Neurotoxicity;Systematic evaluation;Efficacy;Safety
R96
A
1001-0408(2017)03-0364-05
2016-01-15
2016-11-29)
(编辑:申琳琳)
天津市卫生局科技基金项目(No.2014KY09)
*主管药师,硕士。研究方向:临床药学。电话:022-23626417。E-mail:onlyxiao23@163.com
#通信作者:主任药师,研究生导师,博士。研究方向:临床药学。电话:022-23626417。E-mail:zlq0713@aliyun.com
DOI10.6039/j.issn.1001-0408.2017.03.22
