LC—MS/MS 法测定乌苯美司及甲氨蝶呤在临床药物相互作用中的应用
2017-03-02刘磊佟学丰徐鑫张馨月刘志浩孟强
刘磊 佟学丰 徐鑫 张馨月 刘志浩 孟强 王长远


[摘要] 目的 建立灵敏、高效、专属性强的高效液相色谱质谱联用法用于测定生物样品中乌苯美司和甲氨蝶呤的浓度。 方法 两种LC-MS/MS法均采用乙腈沉淀蛋白法处理生物样品,应用Hypersil ODS-C18色谱柱分离,通过电喷雾电离源串联质谱,以多反应监测方式进行负离子检测,测定生物样品中乌苯美司和甲氨蝶呤的浓度。其中,m/z 309.10 →m/z 120.30,m/z 455.20→m/z 308.20和m/z 370.40→m/z 288.10分别作为乌苯美司、甲氨蝶呤和西洛他唑(内标)定量分析时监测的离子对,色谱分离的流动相为乙腈-0.1%甲酸水(60∶40,=v/v),流速为0.4 mL/min。结果 苯美司、甲氨蝶呤在2.00~2000.00 ng/mL的范围内线性关系良好(r2=0.9976)。 结论 所建的LC-MS/MS法快速、灵敏、专属性强,适用于乌苯美司和甲氨蝶呤临床药代动力学研究。
[关键词] 乌苯美司;甲氨蝶呤;药物相互作用;液相色谱质谱联用
[中图分类号] R927.2;R961 [文献标识码] B [文章编号] 1673-9701(2016)30-0144-05
肿瘤是一类严重危害人类健康的多发病、常见病。化疗在癌症综合治疗中处于不可缺少的重要地位,为了提高化疗的疗效,医学工作者开展了多方面的研究,如开发新的高效低毒的药物,更科学合理联合用药以协同增效等。其中,联合用药是临床上长期使用且合理有效的治疗手段,所以药物相互作用(drug-drug-interaction,DDI)是长期困扰临床治疗的问题之一[1]。P-糖蛋白(P-gp)影响药物代谢动力学及口服生物利用度,临床上许多的癌症化疗药物是P-糖蛋白的底物,都被它所外排[2,3]。有机阴离子转运体(organic anion transporter,OATs)将血液中的有机阴离子转运至肾小管上皮细胞内,OATs能够转运一些内源性阴离子代谢物及某些有机阴离子药物[4-6]。甲氨蝶呤(MTX)是治疗肿瘤和一些自身免疫性疾病的有效的抗癌药物。近些年来有报告指出,甲氨蝶呤的多药耐药与药物相互作用常與P-gp和OATs有关[7-9]。乌苯美司(bestatin)是临床上常用的一种免疫增强剂,用于配合其它化疗药物的治疗。当甲氨蝶呤与乌苯美司合用时,这些转运体是否影响二者体内动态和临床疗效也不明确[10-12]。因此,本实验目的是建立灵敏、高效的LC-MS/MS检测方法阐明甲氨蝶呤和乌苯美司相互作用分子药代学机制。
1 仪器与试剂
1.1 仪器
Agilent HP1200 液相色谱系统(美国Agilent公司)API 3200 型三重四级杆质谱仪(美国Applied Biosystems公司);FCR 2002-UF型纯水机(德国FLOM公司);HSC-24B型氮气吹干仪(中国天津恒奥科技有限公司);ST-16R型高速离心机(德国Thermo公司);AL104万分之一电子天平(梅特勒仪托利多公司)。
1.2 试剂
乌苯美司对照品(深圳万乐药业有限公司,批号:H2006 7632,纯度>99.0%);甲氨蝶呤对照品(美国sigma公司,批号:119H1449,纯度>99.0%);西洛他唑原料药(IS, 浙江金立源药业有限公司,批号:H20083045,纯度>99.0%);甲醇为色谱纯(美国Tedia公司),其他试剂均为分析纯。
1.3 研究对象
健康幼年雄性Wistar大鼠,体重220~250 g由大连医科大学SPF实验动物中心提供,洁净级,许可证号:SCXK(辽)2008-0002。OAT1和OAT3细胞由中科院上海药物所宫丽琨教授友情提供。MDR1-MDCK细胞由浙江大学曾苏教授友情提供。K562、K562/ADR细胞购自凯基生物。
2 方法与结果
2.1主要溶液的配制
2.1.1 对照品溶液的配制 分别精密称取乌苯美司和甲氨蝶呤标准品10.1 mg,用甲醇∶水(50∶50,v/v)溶液精确定容于10 mL容量瓶中得到1.00 mg/mL的储备液I及2.00、5.00、20.00、50.00、200.00、500.00和2000.00 ng/mL标准系列浓度的标准品溶液;配制出低、中、高三个不同浓度的质量控制样品(其QC浓度分别为4.00、50.00和1000.00 ng/mL)。储备液I以及标准系列溶液均置于4℃保存,并于使用前放置至室温。
2.1.2 西洛他唑内标溶液的配制 精密称取西洛他唑标准品10.1 mg,用甲醇∶水(50∶50,v/v)溶液精确定容于10 mL容量瓶中得到1.00 mg/mL的储备液I;精密移取9 μL内标储备液I,置于50 mL容量瓶中,用甲醇稀释并定容至刻度,摇匀。获得浓度约为180 ng/mL的西洛他唑内标溶液。
2.2 检测条件
2.2.1 色谱条件的选择 流动相条件为:0.1%甲酸水溶液-乙腈溶液(60∶40,v/v);流速为0.4 mL/min;色谱柱为Hypersil ODS-C18柱(100×2.1 mm,I.D. 5 μm,中国大连伊力特公司);柱温为室温,进样量10 μL。
2.2.2 质谱条件的选择 电喷雾电离源(ESI),采用正离子模式扫描;离子喷射电压为4700 V;温度为570℃;扫描方式为多反应监测(MRM),乌苯美司 m/z 309.10→m/z 120.30、甲氨蝶呤m/z 455.20→m/z 308.20和内标m/z 370.40→m/z 288.10(各化合物的结构及产物离子见图1);碰撞能量(CE)为32 eV(乌苯美司)、27 eV(甲氨蝶呤)和20 eV(内标IS);扫描时间为150 ms。
2.3 血浆样品处理
实验前大鼠禁食过夜(不禁水)。实验时,先将大鼠麻醉,通过颈静脉注射给药后在不同时间点进行颈静脉取血。取血浆50 μL,加入50 μL甲醇和50 μL内标溶液(180 ng/mL),200 μL乙腈,涡旋混匀1 min;离心(16 099×g)10 min,取上清液于另一EP管中,37℃氮气流下吹干,残留物加入200 μL流动相复溶,15 000 r/min 离心10 min,取上清于进样小瓶中,10 μL进样分析。
2.4 方法专属性实验
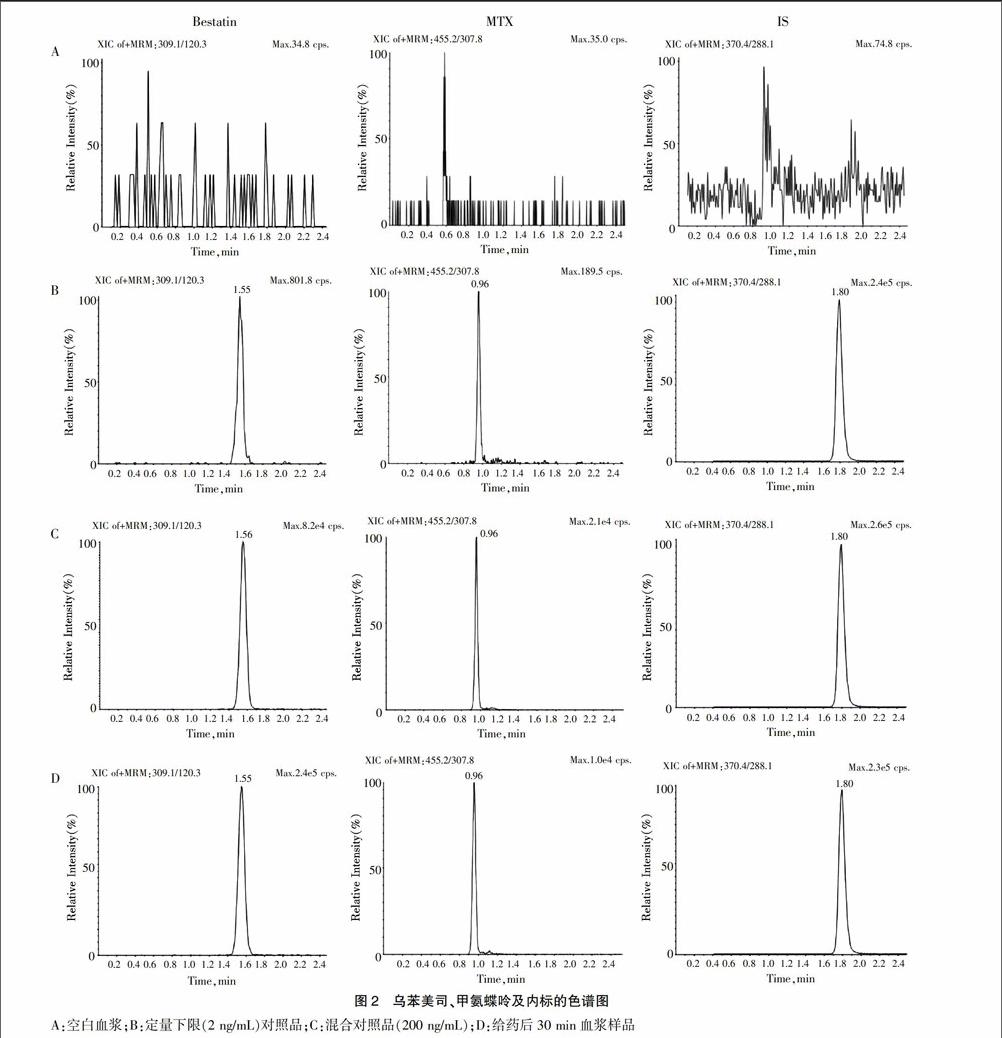
取空白血浆50 μL加入100 μL甲醇,按“2.3”项下方法操作,得空白血浆样品色谱图(图2A)。取血浆50 μL,加入50 μL对照品溶液和50 μL内标溶液配制成相当于血浆浓度200 ng/mL的血浆样品,按“2.3”项下方法操作,得对照品色谱图(图2C)。给药30 min后的血浆处理进样得色谱图(图2D)。结果表明在选定色谱、质谱条件下,血浆内源性杂质对待测物无干扰,乌苯美司、甲氨蝶呤及内标物峰形良好,分离完全,保留时间分别为1.55 min、0.96 min和1.80 min。
2.5 标准曲线和定量下限的考察
取空白血浆50 μL,加入乌苯美司和甲氨蝶呤标准系列溶液50 μL,加入内标溶液50 μL,配制成相当于血浆浓度为2.00、5.00、20.00、50.00、200.00、500.00、2000.00 ng/mL的血浆样品,按“血浆样品处理”项下操作,每一浓度进行三样本分析,取10 μL进样分析。以待测物浓度为横坐标,待测物与内标的峰面积比值为纵坐标,用加权(w=1/x2)最小二乘法进行回归运算,求得的回归方程分别为Y1=0.00109c2+0.00173(r=0.9981)、Y2=0.00116c3+0.00378(r=0.9978)。结果表明,乌苯美司和甲氨蝶呤在2.00~2000.00 ng/mL范围内线性关系良好。取空白血浆50 μL,加入4.00 ng/mL 乌苯美司标准溶液50 μL,配制成相当于血浆浓度为2.00 ng/mL,在方法确证首天对该样品进行6样本分析,求出乌苯美司和甲氨蝶呤的日内精密度(RSD)为3.24和1.97,准确度(RE)为-2.5和-2.0。乌苯美司和甲氨蝶呤的定量下限是2.00 ng/ mL(见图2B)。
2.6精密度与准确度的考察
取大鼠空白血浆50 μL,配制低、中、高三个浓度(乌苯美司和甲氨蝶呤血浆浓度为4.00,50.00和1000.00 ng/mL)的质量控制(QC)样品,进行6样本分析,连续3 d测定,根据当天所配置的标准曲线,计算质量控制样品浓度,并进行方差分析,得出准确度和精密度(表1)。以上结果表明,对于检测生物樣品中乌苯美司和甲氨蝶呤的方法均精密、准确,符合有关国际规范的要求。
2.7 提取回收率与基质效应的考察
乌苯美司和甲氨蝶呤质控样品按“2.3”项下方法操作。进样得峰面积 A1;50 μL空白血浆加入 50 μL甲醇和200 μL乙腈沉淀蛋白,涡旋,14 000 r/min离心 10 min,取上清,氮气吹干,加入流动相配制的乌苯美司和甲氨蝶呤浓度为4.00、50.00和1000.00 ng/mL 的对照品溶液,混匀离心后取上清进样,得峰面积 A2;流动相配制的乌苯美司和甲氨蝶呤浓度为4.00,50.00和1000.00 ng/mL 的对照品溶液,进样得峰面积 A3。每个浓度平行做平行6样本分析。以A1/A2×100%计算得乌苯美司和甲氨蝶呤的提取回收率,以A2/A3×100%计算得到基质效应。低、中、高浓度质控样品的提取回收率均>94.53%,基质效应在 93.45% ~ 97.27%范围内,符合生物样品的分析要求(表 2)。
2.8 样品的稳定性考察
将乌苯美司和甲氨蝶呤的大鼠血浆样品置于室温2 h,处理后的乌苯美司和甲氨蝶呤的血浆样品置于室温24 h,经历3次冷冻-解冻循环以及血浆样品-20℃冷冻15 d,考察其稳定性。稳定性考察时,取大鼠空白血浆50 μL,按“2.3”项配制出乌苯美司和甲氨蝶呤的血浆样品,包含低、高两个浓度(血浆浓度分别为4.00和1000.00 ng/mL),每一种浓度水平的每一种稳定性考察进行三样本分析,采用LC-MS/MS法测定。结果表明乌苯美司和甲氨蝶呤的血浆样品室温放置2 h稳定(RSD<4.3);处理后样品室温放置24 h稳定(RSD<6.2);经历3次冷冻-解冻循环稳定(RSD<8.4);血液样品-20℃冷冻15 d稳定(RSD<6.8)。
2.9 乌苯美司和甲氨蝶呤的大鼠体内胃肠道吸收的相互作用
实验前大鼠禁食过夜(不禁水)。戊巴比妥麻醉后,分别用大鼠灌胃器灌胃给药,然后在规定时间内进行颈静脉取血。实验分组及给药剂量如下:(1)乌苯美司(4 mg/kg,对照组);(2)甲氨蝶呤(5 mg/kg,对照组);(3)乌苯美司(4 mg/kg)+甲氨蝶呤(5 mg/kg)。在特定时间时测定乌苯美司和甲氨蝶呤的大鼠血药浓度-时间曲线(图3A、B)与药代动力学参数(表 3)。
3讨论
本实验采用LC-MS/MS法测定,其灵敏度好,准确度高;用MRM扫描方式,专属性强;采用氮气挥干的方法,不仅有效的将干扰组分排除,还是样品浓缩,大大增强乌苯美司和甲氨蝶呤痕量分析物的检出能力。本实验建立了快速、灵敏、高效的LC-MS/MS分析法,同时测定生物样品中的乌苯美司和甲氨蝶呤。此分析方法的定量下限均可达2.00 ng/mL,并根据大鼠灌胃给药后两药的的血药浓度变化分析药物相互作用。
临床上当同为P-gp和OATs底物的抗癌药物甲氨蝶呤和乌苯美司合用时,是否会发生由药物转运体所介导的药物相互作用有待研究[13-15]。基于这一构想,开展了本次实验研究。对药代动力学参数进行分析发现,甲氨蝶呤和乌苯美司同时灌胃给药与单独给药组相比,二者的血药浓度均升高,AUC分别由(38.40±0.70) min·μg/mL增加到(213.00±28.00) min·μg/mL(甲氨蝶呤)和(820.00±60.00)min·μg/mL增加到(1170.00±110.00) min·μg/mL(乌苯美司),二者的血浆清除率均显著下降(图 3A、B,表 3),提示同时给药后,二者在肠道吸收过程中存在相互影响,导致彼此进入血中的药物浓度增加,证明了二者在胃肠道存在相互作用的靶点,为药物转运体介导药物代谢与排泄的临床合理用药提供参考。
[參考文献]
[1] Giles TD,Materson BJ,Cohn JN,et al. Definition and classification of hypertension:An update[J]. J Clin Hyperten,2009,11(11):611-614.
[2] Suzuki H,Sugiyama Y. Role of metabolic enzymes and efflux transporters in the absorption of drugs from the small intestine[J]. Eur J Pharm Sci,2000,12(1):3-12.
[3] Robey RW,Polgar O,Deeken J,et al. ABCG2:Determining its relevance in clinical drug resistance[J]. Cancer Metastasis Rev,2007,26(1):39-57.
[4] Hagenbuch B. Drug uptake systems in liver and kidney:A historic perspective[J]. Clin Pharmacol Ther,2010,87:39-47.
[5] Anzai N,Jutabha P,Endou H. Renal solute transporters and their relevance to serum urate disorder[J]. Current Hypertension Reviews,2010,6(3):148-154.
[6] Zhu Y,Meng Q,Wang C,et al. Organic anion transporters involved in the excretion of bestatin in the kidney[J]. Peptides,2012,33(33):265-271.
[7] Jackson RC. Biological effects of folic acid antagonists with antineoplastic activity[J]. Pharmacol Ther,1984,25(1):61-82.
[8] Takeda M,Khamdang S,Narikawa S,et al. Characterization of methotrexate transport and its drug interactions with human organic anion transporters[J]. J Pharmacol Exp Ther,2002,302(2):666-671.
[9] Yokooji T,Murakami T,Yumoto R,et al. Role of intestinal efflux transporters in the intestinal absorption of methotrexate in rats[J]. J Pharm Pharmacol,2007,59(9):1263-1270.
[10] Lkhagvaa B,Tani K,Sato K,et al. Bestatin,an inhibitor for aminopeptidases,modulates the production of cytokines and chemokines by activated monocytes and macrophages[J]. Cytokine,2008,44(3):386-391.
[11] YU SX,MA HF. Clinical p ractice of ubenimex in solid tumors[J]. Foreign M ed Sci(Cancer Sect),2002,29(2):15321551.
[12] Deguchi T,Kusuhara H,Takadate A,et al. Characterization of uremic toxin transport by organic anion transporters in the kidney[J]. Kidney In,2004,65(1):162-174.
[13] Miao Q,Liu Q,Wang C,et al. Inhibitory effect of zinc on the absorption of JBP485 via the gastrointestinal oligopeptide transporter(PEPT1) in rats[J]. Drug Metab Pharmacokinet,2011,26(5):494-502.
[14] Zhang J,Wang C,Liu Q,et al. Pharmacokinetic interaction between JBP485 and cephalexin in rats[J]. Drug Metab Dispos,2010,38(6):930-938.
[15] Sun BT,Zheng LH,Bao Yl,et al. Reversal effect of Dioscin on multidrug resistance in human hepatoma HepG2/adriamycin cells[J]. Eur J Pharmacol,2011,654(2):129-134.
(收稿日期:2016-08-28)
