饵料中添加胶红酵母对刺参性能的影响
2017-03-02刘金凤张春晓王际辉
张 坤, 刘金凤, 董 琦, 张春晓, 肖 珊, 王 晗, 王际辉
(大连工业大学生物工程学院,辽宁大连 116034)
饵料中添加胶红酵母对刺参性能的影响
张 坤, 刘金凤, 董 琦, 张春晓, 肖 珊, 王 晗, 王际辉
(大连工业大学生物工程学院,辽宁大连 116034)
分别研究了饵料中添加不同水平的胶红酵母对刺参生长性能、免疫力和抗病能力的影响。胶红酵母的添加量分别为106、107和108CFU/g。结果表明,饵料中添加不同浓度的胶红酵母能够显著提高刺参的特定生长率(P<0.05),其中,添加107CFU/g胶红酵母效果最好,对比空白对照组,终末体质量和特定生长率分别提高了15.40%和35.09%;酚氧化酶、总一氧化氮合酶和碱性磷酸酶活性显著增加(P<0.05),分别较对照组提高了76.13%、49.17%和47.64%。但是饵料中添加不同浓度的胶红酵母对总体腔细胞数、超氧化物歧化酶、酸性磷酸酶和过氧化氢酶活性没有显著的影响。攻毒实验结果表明,对比未添加组,饵料中添加107CFU/g胶红酵母能够减少刺参的累积死亡率55.59%。
刺参;胶红酵母;生长性能;免疫;抗病能力
0 引 言
近年来,刺参养殖业已经成为中国北方海水养殖的重要产业。但随着养殖规模的扩大和养殖密度的提高,出现了海参免疫力下降、生长缓慢、成活率低等一系列问题[1]。为了解决以上问题,抗生素开始在海参养殖中应用,但是长期使用抗生素,不仅会导致动物机体的免疫力下降,而且还会因药物残留而危害食用者的健康。微生态制剂是采用有益微生物经特殊工艺制成的活菌制剂[2],是一种绿色环保的纯生物制剂,研究表明微生态制剂可以起到净化水质,对受到污染的水体进行生态修复,并且可以提高养殖对象的免疫力和生长率的作用[3]。
胶红酵母由于可产虾青素,是一种极具利用价值的微生态制剂。虾青素(3,3-二羟基-β-胡萝卜素-4,4-二酮)是一种重要的类胡萝卜素,因其具有优良的色素沉积作用并能促进动物发育,在水产业、饲料业有着重要应用,而且由于其超强的抗氧化活性及较强抗肿瘤活性而日益受到研究者的关注。胶红酵母在刺参养殖中的应用研究尚少,本实验旨在探讨胶红酵母对刺参的生长性能、免疫力及抗病能力的影响,以期为胶红酵母在刺参健康养殖中的应用提供理论依据。
1 材料与方法
1.1 材 料
胶红酵母菌种筛自海泥,实验室保存,于YPD液体发酵培养基,27℃培养至稳定前期,菌体浓度达到4×108CFU/g。
实验用幼刺参由大连宝发海珍品有限公司提供,大小一致,体质量为(0.714±0.009)g。
基础饵料的成分主要大叶菜(81.9%)、海虹干(8.2%)、蛎壳粉(8.2%)、酵母粉(1.7%)、海泥等,饵料与海泥的比为1∶1.5。用粉碎机粉碎、匀浆、加热,粉碎完温度降至40℃即可进行饲喂。
1.2 方 法
1.2.1 饲养实验
分别在基础饵料中添加胶红酵母106、107和108CFU/g,即饵料中菌液的添加量分别为2.5、25和250 m L/kg。设一个空白对照,每个实验组设3个平行,整个养殖实验时间为8周。
将幼刺参在水温约14℃的条件下预饲2周。将300 kg健康幼参随机分配到12个装有50 m3砂滤海水的养殖池中,每个实验组3个池子,每个养殖池15 kg幼参。每日投饵2次,分别为早上7:00(投喂量为体质量的2%)和下午16:00(投喂量为体质量的5%)。实验期间每15 d倒池一次,水温保持在14~16℃,p H 7.8~8.2,盐度2.8%~3.0%。用增氧泵间隔充氧,间歇10 min,充氧20 min,使溶氧量保持在6~7 mg/L。
1.2.2 样品采集
取样前24 h停止投喂饵料,使刺参肠道内容物排空。每组随机选取15头刺参,与等量抗凝剂混合(0.02 mol/L EGTA,0.48 mol/L NaCl, 0.019 mol/L KCl,0.068 mol/L Tris-HCl,p H 8.0),得抗凝体腔液。将每组刺参体腔液混合后,一部分用于体腔细胞总数及吞噬活性的测定,剩下的置于液氮中冷冻保存。实验前将体腔液样品先置于4℃冰箱解冻后,离心10 min(3 000g, 4℃),用移液器取上清,分装于离心管中,液氮速冻,后转-20℃贮存。
1.2.3 免疫活性测定
1.2.3.1 体腔细胞总数
采用血球计数板在400倍的光学显微镜下直接计数,然后计算每毫升体腔液中体腔细胞总数。
1.2.3.2 细胞吞噬率测定
采用Barracco等[4]的方法处理刺参体腔细胞,略有改动。采用Silva等[5]的方法计算吞噬率:
吞噬率(Phagocytic capacity)=吞噬酵母细胞的吞噬细胞数/被计数的吞噬细胞总数×100%。
1.2.3.3 各种酶活性的测定
溶菌酶(LSZ)活性采用溶菌酶裂解溶壁微球菌(Micrococcus lysodeikticus)原理,利用分光光度计进行测定。
酚氧化酶(PO)活性测定采用Smith等[6]使用的方法,略加修改,用酶标仪测定。酶活力定义:在实验条件下每秒OD490增加0.001作为一个酶活力单位(U)。
SOD活性的测定基于黄嘌呤氧化酶法,采用南京建成生物工程研究所的检测试剂盒测定。SOD活力定义为每毫升反应液中SOD抑制率达50%时所对应的酶量为一个活力单位(U)。样品及试剂的加样量为标准步骤的1/10。
总一氧化氮合酶(T-NOS)的测定,采用南京建成生物工程研究所的检测试剂盒测定。T-NOS活力定义为每毫升体腔液每分钟生成1 nmol NO为一个活力单位(U)。
酸性磷酸酶(ACP)和碱性磷酸酶(AKP)两种酶的活性均采用酶标仪测定,采用南京建成生物工程研究所的检测试剂盒测定。ACP活力定义:100 m L体腔液在37℃与基质作用30 min产生1 mg酚为一个金氏单位。AKP活力定义: 100 m L体腔液在37℃与基质作用15 min产生1 mg酚为一个金氏单位。
1.2.4 攻毒实验
60 d养殖实验结束后,每组随机取10头刺参,采用灿烂弧菌(Vibrio splendidus)对刺参进行攻毒实验。灿烂弧菌用胰蛋白胨大豆肉汤培养基(TSB)在28℃下培养24 h,然后用无菌生理盐水冲洗菌落,并调整浓度为109CFU/g。攻毒浓度109CFU/g,注射剂量为0.1 m L/头,同时再从每组随机抽取1只刺参,注射等量的无菌生理盐水作为对照组。继续投喂基础饲料,连续观察7 d,统计累积死亡率。累积死亡率计算公式:
累积死亡率=Dt/D0×100%
式中:D0和Dt分别为攻毒过程中海参初始头数和累积死亡头数。
1.3 数据分析
本方案包括GSM移动通信模块,AT89S52单片机模块,红外传感器模块,烟雾传感器模块,温度传感器模块,遥控、撤防模块,电源模块等。通过各大传感器对家居实时情况进行检测,当传感器采集可能有人进入,或者发生有毒气体泄漏的时候,相应的传感器会将相应的情况进行采集,然后将信息传送到单片机中,单片机通过对实时情况的分析后,将信息传送到GSM短信模块,GSM短信模块组成的报警系统将具体情况通过短信发送到用户手机上,当相应的情况得到解决后,警报会自动解除。另外,当用户回到家中,想解除相应的安防报警系统的时候,可通过手机的遥控撤防模块撤销启动状态,回到相应的不撤防状态,系统结构如图1所示。
采用统计软件SPSS 20.0进行单因素方差分析,不同处理之间采用Ducan’s多重比较。
2 结 果
2.1 生长性能
由表1可知,与对照组相比,刺参饵料中添加不同浓度的胶红酵母能够提高刺参的终末体质量和特定生长率(P<0.05)。其中107CFU/g胶红酵母组对海参的生长性能促进作用最为显著,对比空白对照组,终末体质量和特定生长率(SGR)分别提高了15.40%和35.09%。
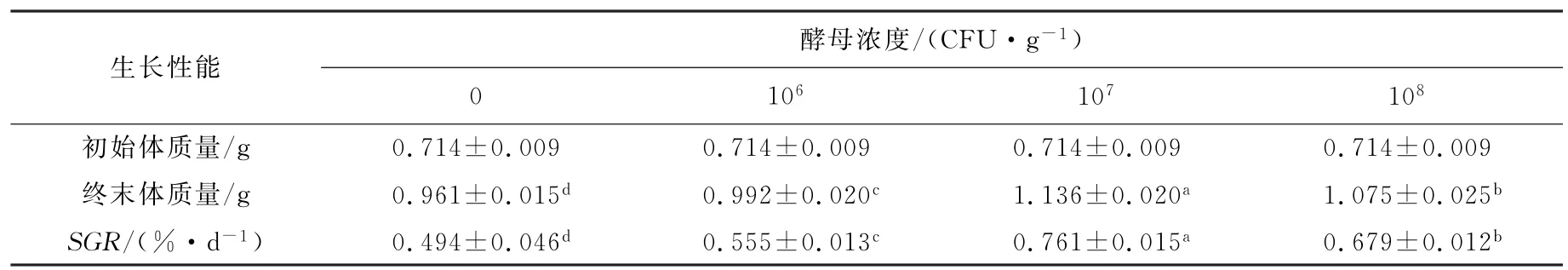
表1 胶红酵母对刺参生长性能的影响Tab.1 Effects of Rhodotorula mucilaginosa on growth performance of Apostichopus japonicus
胶红酵母添加组的刺参生长性能都显著高于对照组(P<0.05)。这可能是由于胶红酵母定植在刺参肠道后,能够产生一系列的生长因子、氨基酸和维生素,并能增强刺参的消化和吸收率。同时,胶红酵母本身就含有丰富的营养物质,如蛋白质、多糖、维生素、生长因子和其他生理活性物质。而中剂量组的特定生长率最好,可能是因为高剂量的酵母浓度太大,定植在刺参肠道后,影响了刺参自身的肠道菌群平衡,从而导致生长率有所下降,结果与AN[6]的研究结果一致。
2.2 免疫活性
饵料中添加不同浓度的胶红酵母对刺参免疫活性的影响如表2所示。结果表明,低剂量组的总体腔细胞数显著高于对照组(P<0.05)。各处理组的CAT活性与对照组没有显著性差异。中剂量组的PO活性显著高于对照组(P<0.05),并且在3个添加组中活性最高,较空白对照组提高了76.13%,而低剂量组和高剂量组与对照组没有显著性差异。SOD活性与对照组都没有显著的差异。
吞噬作用是海参免疫反应的重要环节[8],棘皮动物吞噬细胞能够通过溶菌酶、ACP和AKP的活性完全消除这些外源性物质[9]。本实验中,与对照组相比,低剂量组的刺参溶菌酶活性显著增加(P<0.05),中剂量组和高剂量组的吞噬活性显著增加(P<0.05),中剂量组的AKP活性显著增加(P<0.05),较对照组提高47.64%。这说明刺参摄入胶红酵母后可以在一定程度上提高海参的免疫力。高剂量组溶菌酶、ACP和AKP活性下降的原因可能是刺参产生了免疫疲劳。而低剂量组的溶菌酶活性最高的原因还不清楚,需要进一步研究。
近些年,大量的研究已经报道一氧化氮合酶在无脊椎动物中扮演重要的角色[10]。在本实验中,对比空白对照组,低剂量组和中剂量组的T-NOS活性显著高于对照组(P<0.05),且中剂量组活性最高(P<0.05),较对照组提高了49.17%。原因可能是高浓度的胶红酵母会产生有害的代谢产物,对刺参的生长不利。
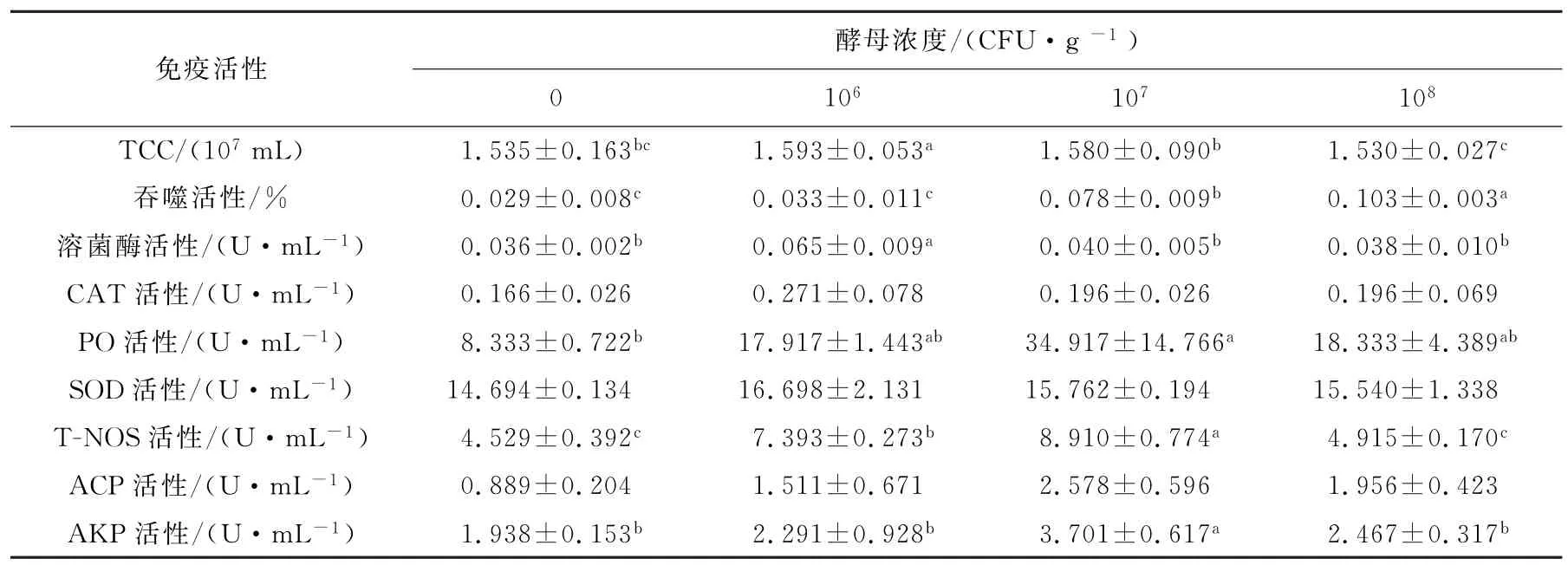
表2 胶红酵母对刺参免疫力的影响Tab.2 Effects of Rhodotorula mucilaginosa on immunity of Apostichopus japonicus
2.3 攻毒实验
如表3所示,饲喂了胶红酵母的3个处理组刺参死亡率显著低于对照组(P<0.05),其中,中剂量组表现出最低的累积死亡率,对比空白对照组,降低了55.99%。

表3 胶红酵母对刺参累积死亡率的影响Tab.3 Effects of Rhodotorula mucilaginosa on the cumulative mortality of Apostichopus japonicus
灿烂弧菌是引起刺参腐皮综合征的主要致病原。饵料中添加胶红酵母增强了刺参的抗病能力,可能是由于刺参免疫力增强的原因。所以,可以在刺参腐皮综合征爆发时在饵料中添加胶红酵母,以提高刺参成活率。
3 结 论
在饵料中添加不同浓度的胶红酵母能够在一定程度上提高刺参生长性能、免疫活性和抗病能力。其中,中剂量组(107CFU/g)表现出更好的效果。
[1]隋锡林,邓欢.刺参池塘养殖的病害及防治对策[J].水产科学,2004,23(6):22-24.
[2]于莲,马丽娜,杜妍,等.微生态制剂研究进展[J].中国微生态学杂志,2012(1):84-86.
[3]许振英,张子仪.动物营养研究进展[M].北京:中国农业出版社,1994.
[4]BARRACCO M A,MEDEIROS I D,MOREIRA F M.Some haemato-immunological parameters in the mussel Perna perna[J].Fish and Shellfish Immunology,1999,9(5):387-404.
[5]SILVA J R M C,PECK L.Induced in vitro phagocytosis of the Antarctic starfish Odontaster validus (Koehler 1906)at 0℃[J].Polar Biology,2000,23 (4):225-230.
[6]SMITH V J,SÖDERHÄLL K.A comparison of phenoloxidase activity in the blood of marine invertebrates[J].Developmental Comparative Immunology, 1991,15(4):251-261.
[7]AN G H,SCHUMAN D B,JOHNSON E A.Isolation of Phaffia rhodozyma mutants with increased astaxanthin content[J].Applied Environmental Microbiology,1989,55(1):116-124.
[8]ORDDS M C,ORDDS A,BELOSO C,et al.Immune parameters in carpet shell clams naturally infected with Perkinsus atlanticus[J].Fish and Shellfish Immunology,2000,10(2):597-609.
[9]CANICATTI C.Lysosomal enzyme pattern in Holothuria polii coelomocytes[J].Journal of Invertebrate Pathology,1990,56(1):70-74.
Effects of dietary addition of Rhodotorula mucilaginosa on performance of Apostichopus japonicus
ZHANG Kun, LIU Jinfeng, DONG Qi, ZHANG Chunxiao, XIAO Shan, WANG Han, WANG Jihui
(School of Biological Engineering,Dalian Polytechnic University,Dalian 116034,China)
The effects of dietary addition of Rhodotorula mucilaginosa on the growth performance, immunity and disease resistance of A.japonicus were investigated.The dietary addition of Rhodotorula mucilaginosa were 106,107and 108CFU/g,respectively.The result showed that dietary addition of Rhodotorula mucilaginosa could increase the specific growth rate of A.japonicus significantly(P<0.05).The group of 107CFU/g showed better effects,of which the specific growth rate and terminal weight increased by 15.40%and 35.09%.Compared with the control group,the activity of phenoloxidase,total nitric oxide synthase and alkaline phosphatase increased by 76.13%, 49.17%and 47.64%,respectively(P<0.05).There were no significant effects on total coelomocyte counts,SOD activity,ACP activity and CAT activity of A.Japonicus.adding Rhodotorula mucilaginosa to diet at different levels.It was observed that the group of 107CFU/g could significantly decrease the cumulative mortality of A.japonicus by 55.59%.
Apostichopus japonicus;growth performance;immune;disease resistance
TS254.2
A
1674-1404(2017)01-0006-04
2015-07-15.
国家星火计划项目(2015GA651002);国家海洋公益性行业科研专项项目(201405003);辽宁省农业领域青年科技创新人才培养计划项目(2015004);辽宁省教育厅创新团队项目(LT2014010).
张坤(1991-),男,硕士研究生;通信作者:王际辉(1970-),男,教授.
张坤,刘金凤,董琦,张春晓,肖珊,王晗,王际辉.饵料中添加胶红酵母对刺参性能的影响[J].大连工业大学学报,2017, 36(1):6-9.
ZHANG Kun,LIU Jinfeng,DONG Qi,ZHANG Chunxiao,XIAO Shan,WANG Han,WANG Jihui.Effects of dietary addition of Rhodotorula mucilaginosa on performance of Apostichopus japonicus[J].Journal of Dalian Polytechnic University,2017,36(1):6-9.
