广西陆川某猪场猪伪狂犬病病毒的分离鉴定及gE基因的分析
2017-03-02张民秀谢芝勋谢志勤刘加波谢丽基邓显文罗思思黄娇玲
张民秀,谢芝勋,谢志勤,刘加波,谢丽基,邓显文,罗思思,黄娇玲,黄 莉
(广西壮族自治区兽医研究所广西兽医生物技术重点实验室,广西南宁 530001)
广西陆川某猪场猪伪狂犬病病毒的分离鉴定及gE基因的分析
张民秀,谢芝勋*,谢志勤,刘加波,谢丽基,邓显文,罗思思,黄娇玲,黄 莉
(广西壮族自治区兽医研究所广西兽医生物技术重点实验室,广西南宁 530001)
为了确诊猪伪狂犬病病毒(PRV)的感染,探讨目前广西猪群中流行的PRVgE基因的变异特征,为更好地防控猪伪狂犬病(PR)提供参考依据,本研究采集了广西陆川某猪场保育猪群发生呼吸道症状的肺脏组织,并用Vero细胞进行病毒分离,应用PCR方法对分离株的gE基因进行克隆和测序,根据测序结果证实分离到1个PRV毒株,命名为GXLC1。分离株在Vero细胞上增殖,细胞出现典型的病变;GXLC1株gE基因与GenBank上20株国内外具有代表性参考毒株的核苷酸序列同源性为97.1%~99.4%,氨基酸同源性为94.3%~99.6%;gE基因的遗传进化分析显示,GXLC1株与2012年的国内流行毒株亲缘关系较近,与欧美分离株亲缘关系较远;氨基酸序列分析显示,GXLC1株gE蛋白主要抗原表位区较之国内经典强毒株有3个氨基酸位点的变异,可能导致gE抗原性发生改变。本研究将分离到的1个PRV毒株进行了gE基因的分析,发现GXLC1株为近年来流行的变异株,gE蛋白在抗原表位区上有3个氨基酸位点的变异,这是否会影响GXLC1株毒力和抗原性的变化,还有待进一步研究;对gE基因变异特征的分析和病毒的分离为进一步丰富广西PRV的分子流行病学和疫苗的研制提供参考依据和重要材料。
伪狂犬病病毒;分离鉴定;gE基因;序列分析
伪狂犬病(Pseudorabies,PR)是由伪狂犬病病毒(Pseudorabies virus,PRV)感染多种动物(猪、绵羊、狗、牛、猫、兔、鼠等35种动物)而引起的一种以发热、奇痒(猪除外)和脑脊髓炎为主要症状的重要传染病[1]。PRV在世界范围内的流行,给世界养殖业带来严重的经济损失。不同日龄猪对PRV的感染表现出不同的临床症状:15日龄以内的哺乳仔猪感染PRV后,病死率高达100%,临床上出现体温突然升高(41℃~42℃),有呕吐或腹泻的发生,精神沉郁,个别仔猪会出现转圈和四肢划动等神经症状,此病程不超过72 h即死亡;感染PRV的断奶仔猪出现与哺乳仔猪相似的症状,病死率(50%左右)低于哺乳仔猪,临床症状还表现出呼吸障碍等症状,如呼吸困难、咳嗽、流鼻涕等,仔猪会出现生长障碍;成年猪感染PRV后一般不发生死亡,仅表现轻微的体温升高或无临床症状;母猪感染PRV表现明显的繁殖障碍;公猪会出现精液品质下降,睾丸肿胀。
目前,免疫接种是防控PR的有效手段,基因缺失疫苗的应用使PR得到了有效的控制,但自2011年以来,国内部分常规PRV疫苗株(Barth-K61)免疫猪场不时发生PR疫情,国内学者将这些PR疫情中分离到的流行毒株定义为变异株,变异株在病原性上发生了新的变化[2-7]。宋宏晓等[8]于2010年10月~2012年3月检测了河南地区84份临床样品,发现PRV的阳性率高达75%;张显浩[9]等于2012年-2013年对国内不同地区PRV的野毒感染情况进行了调查,总阳性率为34.1%,并且2013年PRV的感染率比2012年的高;基于以上数据显示我国猪群受到PRV野毒感染日趋严重。因此,对目前PRV流行毒株进行收集,并对PRV野毒株与毒力相关基因进行分析,以期获得更多的数据来研究PRV流行毒株的变异情况和开发出有效抵抗PRV野毒感染的新型疫苗。2014年4月从广西陆川某猪场保育猪群出现呼吸道症状的发病猪中采集了肺脏组织,为了确保对该疾病确诊,本研究用RT-PCR和PCR对猪流感病毒(Swine influenza virus,SIV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)和猪伪狂犬病病毒(PRV)进行了检测,根据检测结果用Vero细胞进行了伪狂犬病病毒的分离与鉴定,分离得到1株疑似PRV的病毒,命名为GXLC1株,并对其进行了gE基因的扩增和序列分析,以期获得广西流行毒株PRV分子变异趋势,为进一步丰富广西PRV的分子流行病学和疫苗的研制提供参考依据和病原材料。
1 材料与方法
1.1 材料
1.1.1 病料及细胞 2014年4月采集的广西陆川某猪场保育猪群出现呼吸道症状病猪的肺脏组织5份;肺脏研磨后,用磷酸缓冲(PBS)溶液按照(病料:PBS)1∶5稀释混成匀浆,将匀浆吸入到EP管中,反复冻融3次,3 000 r/min离心20 min,取上清液用0.22 μm微孔滤膜过滤,-70℃保存备用;非洲绿猴肾细胞(Vero)由广西壮族自治区兽医研究所保存。
1.1.2 菌种、载体和试剂 大肠埃希菌DH5α感受态细胞,分子克隆所需试剂盒(DNA/RNA共提试剂盒和胶回收试剂盒)、EasyPure Viral DNA/RNA 共提试剂盒,北京全式金生物技术有限公司产品;M-MLV酶、RNasin、dNTPs、DNA Marker、LATaq®with GC buffer和ExTaq,TaKaRa公司产品;DMEM培养基、胎牛血清,Gibco公司产品。
1.1.3 引物 猪流感病毒(SIV)RT-PCR检测引物,PRRSV和PCR检测引物分别参考文献[10-12]中的引物,PRV gE基因扩增引物参考文献[4]中的引物。
1.2 方法
1.2.1 病料及细胞培养物DNA/RNA的提取 取病料上清液或细胞培养物200 μL按照EasyPure Viral DNA/RNA共提试剂盒的操作说明书提取病料和细胞培养物的DNA和RNA,提取好的DNA和RNA于-70℃保存备用。
1.2.2 SIV、PRRSV和PRV RT-PCR/PCR检测 参照M-MLV反转录酶的操作说明,将1.2.1中从病料上清液提取好的RNA进行反转录成cDNA,将cDNA和1.2.1 中的DNA作为模板按照TaKaRa ExTaq操作说明使用材料中1.1.3中的引物进行单重PCR鉴定。
1.2.3 病毒分离与鉴定 取1.1.1中过滤除菌后的病料上清液接种于单层Vero细胞,于37℃,体积分数为5% CO2细胞培养箱中作用2 h,每隔30 min摇晃一次,作用完毕后,弃去接种的病料上清,使用PBS洗涤细胞3次,加入含有20 mL/L胎牛血清的DMEM细胞维持液,置于37℃、体积分数为5% CO2细胞培养箱培养至72 h,收集第1代病毒培养物,将病毒培养物反复冻融后3 000 r/min离心10 min,得到细胞上清液,将细胞上清液接种Vero细胞,盲传至第3代。收获第1代至第3代的病毒培养物,按照1.2.1和1.2.2提取PRVDNA并PCR鉴定病毒培养物中的PRV。
1.2.4 分离病毒株的gE基因的扩增及序列分析 按照EasyPure Viral DNA/RNA 共提试剂盒中的说明书提取PRV DNA。参照TaKaRa LATaq○Rwith GC Buffer Tran Star操作说明进行gE基因的扩增。PCR产物进行电泳纯化后按照常规操作进行基因克隆,挑取阳性克隆菌液送上海立菲生物技术公司进行测序。从GenBank上获得20条PRV序列(表1),利用Laser Gene7.1和Molecular Evolutionary Genetics Analysis 4.1(MEGA4.1)对gE基因的核苷酸、氨基酸进行同源性分析和构建遗传进化树。

表1 PRV毒株名称及来源
注:“*”表示信息未知。
Note:“*”means unknown information.
2 结果
2.1 SIV、PRRSV和PRV的RT-PCR/PCR检测
提取病料中的DNA和RNA,用针对SIV、PRRSV和PRV的检测引物进行单重RT-PCR和单重PCR鉴定,琼脂糖电泳显示,SIV和PRV为阳性,大小分别为244 bp和227 bp,PRRSV为阴性(图1)。
2.2 PRV的分离和鉴定
将过滤除菌后的病料上清液接种于Vero细胞,72 h后收集第1代病毒培养物,将第1代细胞培养物反复冻融后的细胞上清液再次接种Vero细胞并传至第3代。结果显示,第1代至第3代的Vero细胞均于36 h开始出现明显的细胞病变,细胞出现圆缩,脱落和细胞空洞(图2B),对照细胞无细胞病变。用PRV的检测引物对第1代至第3代病毒培养物的病毒DNA均进行PCR鉴定,第1代至第3代细胞的病毒培养物均为PRV阳性。因此,将该PRV分离株初步命名为GXLC1。
2.3 GXLC1株gE基因的扩增及测序
GXLC1株的gE基因扩增出预期大小的目的片段,约为1 778 bp(图3)。经测序确定GXLC1株的gE基因开放阅读框(ORF)为1 740 bp,编码580个氨基酸。
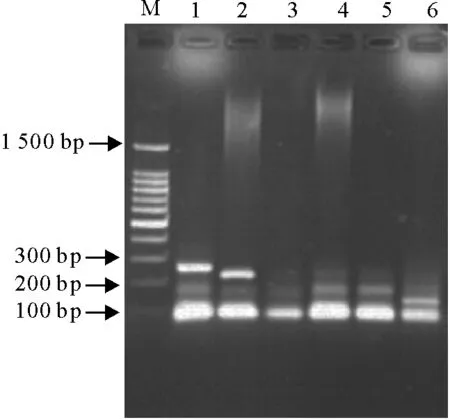
M.DNA标准100 bp;1.猪流感病毒;2.猪伪狂犬病病毒;3.猪繁殖与呼吸综合征病毒;4~6.阴性对照M.DNA Marker 100 bp; 1.SIV; 2.PRV; 3.PRRSV; 4-6.Negative control图1 SIV、PRRSV和PRV的RT-PCR/PCR检测结果Fig.1 The detection of SIV,PRRSV and PRV by RT-PCR/PCR

A.对照Vero细胞;B.PRV 接种Vero细胞36 h的细胞病变

M.DNA标准DL 2 000;1~2.gE基因的扩增
2.4 GXLC1株gE基因的同源性比较和进化树
GXLC1株gE基因与GenBank上的20条参考序列进行同源性分析结果显示GXLC1株gE基因与20条参考序列的核苷酸同源性为97.1%~99.4%,氨基酸同源性为94.3%~99.6%。GXLC1株gE基因与经典强毒Min-A、Rice和SC的核苷酸同源性分别为98.7%、97.2%和99.0%;氨基酸同源性分别为97.2%、94.3%和97.8%。将GXLC1株gE基因推导的氨基酸与经典强毒株Min-A株、Rice株、SC和2012年国内流行毒株(GY、LGX、M5和JY分离株)进行比对,发现GXLC1株gE基因与近期国内流行毒株(GY、LGX、M5和JY分离株)在第48和496位氨基酸均有1个天冬氨酸(Asp)的插入。由于GXLC1株gE蛋白在第48氨基酸插入了1个Asp,因此与毒力相关的2个氨基酸位点(原位于第125位和第126位氨基酸)位置变化为第126位和第127位氨基酸,但位于这2个位点上的氨基酸仍为缬氨酸(Val)和半胱氨酸(Cys)。将GXLC1株gE蛋白与国内经典分离株Ea、SC的主要抗原表位区A、B、C和E进行比较,GXLC1株gE蛋白在上述区域有3个位点的变异,分别是第54Gly→Asp,第98Asp→Val和第175Ser→Pro。
基于gE基因的遗传进化分析显示(图4),本研究所用国内外的PRV分离株可分2个群,GXLC1株、2012年国内流行毒株(GY、LGX、M5和JY分离株)和早期国内的分离株(Ea、SC、LA、SH和Fa分离株)位于基因Ⅰ群上,并且GXLC1株与2012年的国内流行毒株亲缘关系较近,Becker、Rice和NiA等欧美分离株位于基因Ⅱ群上。
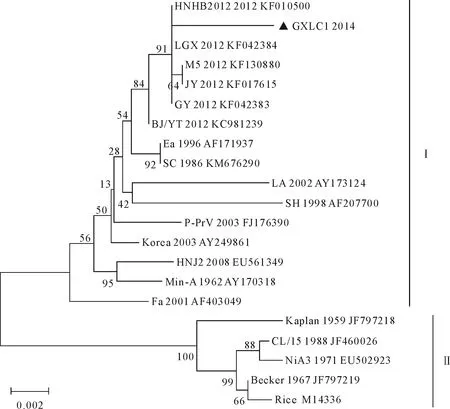
图4 基于gE基因的遗传进化树
3 讨论
根据发病猪组织病料的PCR鉴定和病毒分离结果,结合分离株的gE基因测序鉴定和基因分析,证实分离出的病毒为PRV。本分离株是从已经过PRV疫苗株(Barth-K61)免疫的猪体内分离得到,说明目前疫苗株使用不能完全抵御野毒株的感染,PRV野毒株在猪群的感染依然存在。有研究表明PRV疫苗株(Barth-K61)能够对PRV经典株起到100%的保护,而对近年在国内流行的野毒株则不能提供完全的保护,该研究将这些野毒株称为变异株[13]。本次的PRV GXLC1株的gE基因与2012年国内的流行毒株即变异株的核苷酸同源性较高,达到99.3%以上,并且相对于国内经典毒株Ea和SC、GXLC1株与这些变异株的亲缘关系更近。国内许多研究也显示,自2011年后PRV野毒株在免疫猪群中的流行均归结为变异株的流行[2,14-15]。因此,本试验PRV分离株GXLC1应为变异株。
gE基因在PRV基因组中编码病毒的囊膜糖蛋白,该蛋白可以促进细胞间的融合,介导病毒在细胞之间传播和扩散,促进病毒向神经系统扩散,该蛋白是PRV侵入中枢神经组织所必需的蛋白[5,16]。GXLC1株中gE蛋白的第126位和第127位氨基酸与病毒的毒力相关,与国内外经典强毒株和2012年国内流行毒株(GY、LGX、M5和JY分离株)对比,这2个位点未发生变异,仍为Val和Cys,但GXLC1株的毒力是否与最近国内的流行毒株的毒力相当,需要进一步研究。
Jacobs L等[17-18]发现在PRV gE蛋白有6个抗原表位区(A、B、C、D、E和F抗原表位区),不同品种的动物受到相同PRV毒株的感染,机体会针对不同的抗原表位区产生相应的抗体,因此不同品种动物相同毒株的感染抗体类型可能并不相同;PRV感染猪产生的抗体,大多数是针对E抗原表位区,部分猪产生针对A、B和F区的抗体。GXLC1株gE蛋白与国内经典强毒株Ea和SC在B,C抗原和E抗原表位区进行比较,发现GXLC1株gE蛋白有3个位点氨基酸差异,分别是第54Gly(不带电荷氨基酸)→Asp(负电荷氨基酸),第98Asp(亲水性氨基酸)→Val(疏水性氨基酸),第175Ser(亲水性氨基酸)→Pro(疏水性氨基酸),这3个位点的变异可能导致GXLC1的gE抗原性发生改变,继而导致毒力增强。
综上所述,本研究分离株为变异株,GXLC1株gE蛋白中决定毒力关键位点(第126位和第127位)未发生改变,gE蛋白主要抗原表位区较之国内经典强毒株(强毒株Ea和SC)有3个氨基酸位点的变异(第54Gly→Asp、第98Asp→Val、第175Ser→Pro)、GXLC1株gE蛋白的这些分子特征是否会影响GXLC1株毒力和抗原性的变化,还有待进一步研究。因为导致PRV变异株毒力和抗原性发生变化可能是由PRV基因组内编码的多个蛋白相互作用造成的,有必要进一步进行GXLC1株的全基因测序和通过相关试验来进一步验证毒株的致病性、抗原的变异对毒力的影响,为进一步开发新疫苗及规模化猪场PRV的防控提供理论依据。
[1] Lee J Y,Wilson M R.A review of pseudorabies (Aujeszky's disease) in pigs [J].Can Vet J,1979,20(3):65-69.
[2] Yu X,Zhou Z,Hu D,et al.Pathogenic pseudorabies virus,China,2012 [J].Emerg Infect Dis,2014,20(1):102-104.
[3] 赵鸿远,彭金美,安同庆,等.猪伪狂犬病病毒变异株的分离鉴及其gE基因的分子特征[J].中国预防兽医学报,2014,36 (7):506-509.
[4] 余秋颖,常洪涛,陈文定,等.2012-2013年新流行猪伪狂犬病毒的分离鉴定及其gE、TK、gD基因序列分析[J].中国兽医学报,2014,34(10):1573-1578.
[5] 童 武,郑 浩,单同领,等.伪狂犬病毒变异株(JS-2012)对仔猪的致病性研究[J].中国动物传染病学报,2014,22(5):10-14.
[6] 覃雨阳,李雪梅,马 军,等.广西地区猪伪狂犬病病毒gE基因的序列分析[J].动物医学进展,2016,37(1):17-21.
[7] 林群群,郑小香,陈秋勇,等.猪伪狂犬病病毒NP株的分离鉴定[J].动物医学进展,2015,36(3):59-63.
[8] 宋宏晓,李葱晓,王 慧,等.河南省部分地区猪伪狂犬病病毒、猪圆环病毒和猪瘟病毒核酸检测分析[J].动物医学进展,2013,34(2):117-121.
[9] 张显浩,陈瑞爱,李 冰,等.2012年-2013年我国集约化猪场猪伪狂犬病病毒感染情况的调查[J].动物医学进展,2015,36(3):133-136.
[10] Fouchier R A,Bestebroer T M,Herfst S,et al.Detection of influenza a viruses from different species by PCR amplification of conserved sequences in the matrix gene [J].J Clin Microbiol,2000,38(11):4096-4101.
[11] Zhang M X,Xie Z X,Xie L J,et al.Simultaneous detection of eight swine reproductive and respiratory pathogens using a novel GeXP analyser-based multiplex PCR assay [J].J Virol Methods,2015,224:9-15.
[12] 罗廷荣,唐章辉,蒋小红,等.二株广西繁殖与呼吸综合征流行M基因的克隆和序列分析[J].中国预防兽医学报,2004,26(2):90-93.
[13] An T Q,Peng J M,Tian Z J,et al.Pseudorabies virus variant in Bartha-K61-vaccinated pigs,China [J].Emerg Infect Dis,2013,19 (11):1749-1755.
[14] Wu R,Bai C,Sun J,et al.Emergence of virulent pseudorabies virus infection in Northern China [J].J Vet Sci,2013,14(3):363.
[15] Wang C H,Yuan J,Qin H Y,et al.A novel gE-deleted pseudorabies virus (PRV) provides rapid and complete protection from lethal challenge with the PRV variant emerging in Bartha-K61-vaccinated swine population in China [J].Vaccine,2014,32(27):3379-3385.
[16] Tirabassi R S,Toenley R A, Eldridge M G,et al.Charaeterization of pseudorbaies virus mutants expressing eabroxy-terminal truncation of gE evidence for envelope incorporation,virulence and neurtropism domains [J].J Virol,1997,71(9):6455-6464.
[17] Jacobs L,Meloen R H,Gielkens A L,et al.Epitope analysis of glycoprotein I of pseudorabies virus [J].J Gen Virol,1990,71(Pt 4):881-887.
[18] Jacobs L,Mulder W A,Priem J,et al.Glycoprotein I of pseudorabies virus (Aujeszky's disease virus) determines virulence and facilitates penetration of the virus into the central nervous system of pigs [J].Acta Vet Hung,1994,42(2-3):289-300.
Isolation and Identification of Swine Pseudorabies Virus and Analysis of gE Gene in Luchuan, Guangxi
ZHANG Min-xiu,XIE Zhi-xun,XIE Zhi-qin,LIU Jia-bo,XIE Li-ji,DENG Xian-wen,LUO Si-si,HUANG Jiao-ling,HUANG Li
(GuangxiKeyLaboratoryofVeterinaryBiotechnology,GuangxiVeterinaryResearchInstitute,Nanning,Guangxi, 530001,China)
In order to make a definite diagnosis of the PRV infection,discuss the variation characteristics of the gE gene of PRV in Guangxi, and control and protect PRV infection in pigs,the lung tissues were collected from nursery pigs with respiratory symptoms in Luchuan of Guangxi province.One PRV isolate was incubated in Vero cells and the gE gene of this isolate was amplified,cloned and sequenced.This isolate was named as GXLC1.The results showed that the Vero cells appeared typical cytopathic effect after incubating with GXLC1.The gE gene of GXLC1 shares 97.1%-99.4% nucleotide homology and 94.3%-99.6% amino acid homology with twenty nucleotide sequences available in GenBank; Phylogenetic tree of gE genes showed that the gE gene of GXLC1 was most closely related to pandemic strains circulating in China in 2012,and had a distant relationship with foreign isolates; The amino acid analysis showed that there were three different amino acid residues in major epitopes of gE gene between GXLC1 and domestic high virulent strains,which may cause antigenic variation of the gE protein of GXLC1.The PRV strain was successfully isolated,and the GXLC1 strain was a variant strain similar to the epidemic strains circulating in recent years in China; this problem is expecting for further research whether the three amino acids mutation on the antigen epitope area of the gE protein will affect the GXLC1 virulence and antigenicity changes.The genetic characteristic of the gE gene was analyzed and the results provided a reference and important material for enriching PRV molecular epidemiology data in Guangxi and vaccine development.
Pseudorabies virus; identification and isolation; gE gene; sequence analysis
2016-05-09 基金项目:广西特聘专家专项经费(2011B020);广西科技攻关重大专项(1222003-2-4) 作者简介:张民秀(1986-),女(壮族),广西南宁人,硕士,主要从事兽医生物技术研究。*通讯作者
S852.659.1;S858.28
A
1007-5038(2017)02-0007-06
