代谢工程改造甘油代谢途径提高β-胡萝卜素产量
2017-03-02董悦胡坤乐李兴林李清艳张学礼
董悦,胡坤乐,李兴林,李清艳,张学礼
1 天津科技大学 生物工程学院,天津 300457
2 中国科学院系统微生物工程重点实验室,天津 300308
3 河南科技大学 食品与生物工程学院,河南 洛阳 471023
代谢工程改造甘油代谢途径提高β-胡萝卜素产量
董悦1,2*,胡坤乐3*,李兴林1,李清艳2,张学礼2
1 天津科技大学 生物工程学院,天津 300457
2 中国科学院系统微生物工程重点实验室,天津 300308
3 河南科技大学 食品与生物工程学院,河南 洛阳 471023
董悦, 胡坤乐, 李兴林, 等. 代谢工程改造甘油代谢途径提高β-胡萝卜素产量. 生物工程学报, 2017, 33(2): 247–260.
Dong Y, Hu KL, Li XL, et al. Improving β-carotene production inEscherichia coliby metabolic engineering of glycerol utilization pathway. Chin J Biotech, 2017, 33(2): 247–260.
甘油是生物柴油的副产物,因其价格低廉和高还原性,成为生物发酵的重要碳源。为了进一步提高工程菌对甘油的利用能力,从而提高萜类化合物的合成能力,本研究从β-胡萝卜素高产菌CAR015出发,对其甘油代谢途径的多个基因进行了调控。首先敲除了编码3-磷酸甘油抑制子的glpR基因,然后分别用M1-37、M1-46和M1-93三个不同强度的人工调控元件对glpFK、glpD和tpiA三组基因进行单基因调控和多基因组合调控。研究发现用M1-46调控glpD基因后β-胡萝卜素产量达到了64.82 mg/L,是CAR015的4.86倍,甘油消耗速率也提高了100%;调控tpiA基因后β-胡萝卜素产量略有提高;调控glpFK基因后β-胡萝卜素产量略有降低。说明GlpD是甘油代谢途径中的关键限速步骤。Q-PCR结果表明,降低甘油代谢途径的glpD和glpFK基因转录水平,增加tpiA基因转录水平,可以增加细胞生长速度、提高β-胡萝卜素产量,可能是因为减少了丙酮醛毒性所致。组合调控glpD和tpiA基因,获得β-胡萝卜素产量最高菌株Gly003,其β-胡萝卜素产量达72.45 mg/L、产率达18.65 mg/g每克干细胞,分别是出发菌株CAR015的5.23倍和1.99倍。总之,GlpD是甘油代谢途径中的关键限速步骤,适当强度调控glpD,可以有效提高重组大肠杆菌的β-胡萝卜素产量。
β-胡萝卜素,萜类化合物,甘油代谢,大肠杆菌
β-胡萝卜素是类胡萝卜素家族中的典型代表,也是生物体内合成维生素A的前体物质,具有较高的营养价值和药用价值,广泛应用于化工、化妆品、饲料、食品、保健品以及医药等行业[1-2]。目前市场上销售的β-胡萝卜素有化学合成和天然提取,化学合成法合成的产品存在有害物质残留问题,与化学合成的产品相比,天然β-胡萝卜素具有更好的生物活性且无毒副作用,随着人们生活品质的不断提高以及对绿色天然产品的倡导,天然β-胡萝卜素的市场需求将会越来越大[3]。微生物发酵生产天然β-胡萝卜素不受光照、气候、产地等条件的限制,且产品具有经济、安全等优势,因此该技术受到国内外市场的广泛青睐[4-5]。以大肠杆菌作为出发菌株,运用代谢工程手段构建产类胡萝卜素基因工程高产菌株,成为包括β-胡萝卜素在内的多种类胡萝卜素产品生产开发的新模式[4-7]。
对产β-胡萝卜素大肠杆菌的遗传改造主要集中在过表达大肠杆菌自身的2-甲基-D-赤藻糖醇-4-磷酸途径 (MEP途径) 中的关键基因和过表达外源的甲羟戊酸途径 (MVA途径)[4-5]。另外,近年来部分研究组通过代谢流分析等,研究了非代谢途径基因表达水平对萜类化合物产量的影响。Alper利用代谢流分析,验证了敲除gdhA、aceE、talB、gdhA、aceE和fdhF基因对番茄红素产量的影响,发现同时敲除gdhA、aceE和fdhF,产量提高37%[8]。Farmer等通过高表达pps,平衡PEP和P3G供应提高番茄红素产量[9]。Choi等发现高表达pfkA、pgi、fbaA、tpiA、icdA和mdh可以提高番茄红素产量,fbaA、tpiA和mdh效果最明显。gdhA和gpmB双敲除效果最好,同时高表达mdh和pps,番茄红素产量达到283 mg/L[10]。Zhao等系统研究了中央代谢途径和ATP合成途径各基因的转录水平对β-胡萝卜素产量的影响,发现高表达sucAB、sdhAB和talB基因可以有效提高β-胡萝卜素产量,产量比出发菌株高64%[11]。因此改造大肠杆菌内非MEP途径基因表达水平成为提高萜烯类化合物合成的重要手段。
甘油是脂肪酸工业和生物柴油制造工业不可避免的副产物,曾是我国比较紧缺的化工产品。近年来,随着国内外对生物柴油制造进行的研究和应用,作为生物柴油的副产物,甘油产量大大增加,价格也大幅度下降[12]。因此,利用甘油作为发酵原料制造大宗化学品具有丰富、廉价的优势,同时还可降低生物柴油制造业处理副产废物的压力[13]。此外,与葡萄糖、木糖等糖类底物相比,甘油代谢产生更高的还原力,是发酵合成还原性化合物的理想碳源[14]。Kim等比较了葡萄糖、甘露糖、麦芽糖、甘油、半乳糖和乳糖等6种碳源对类胡萝卜素合成和重组大肠杆菌生长的影响,发现使用甘油效果最好,葡萄糖效果最差[15]。Lee等也发现在LB、2×YT、TB和MR培养基中加入葡萄糖会对类胡萝卜素的产量产生显著抑制,而在这些培养基中加入甘油则会提高类胡萝卜素的产量[16]。目前报道的甘油转化产品主要有乙醇、丁醇、1,3-丙二醇和丙酸等。许多微生物都可以利用甘油生产有价值的产品。大肠杆菌遗传背景清晰、基因工程改造手段丰富、营养需求简单和生长迅速,这些特性使其成为工业化规模下利用甘油发酵生产大宗化学品的理想选择[12]。通过遗传改良对甘油代谢途径和产物合成途径进行必要的修饰和改造,有助于实现在工业化规模下高效转化甘油为其他产物[17]。
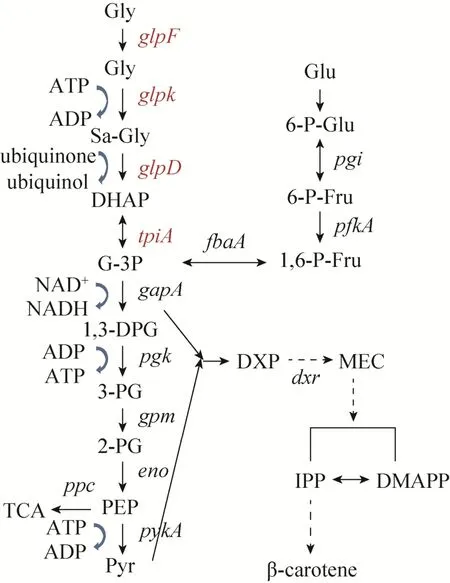
图1 大肠杆菌中经甘油到萜烯类化合物的代谢途径表示包含多步催化反应Fig. 1 Construction of terpenoid synthetic pathway inE. coliby integrating heterologous gene.
大肠杆菌中存在两条甘油代谢途径[18]。好氧条件下,环境中的甘油主要通过被动运输进入到大肠杆菌细胞中,首先通过细胞外膜上的孔道蛋白运输到细胞周质中,然后再通过细胞内膜上孔道蛋白GlpF (glpF编码) 转运到细胞胞浆 (图1)[19]。进入胞浆后的甘油首先在甘油激酶GlpK作用下以ATP作为磷酰化供体进行磷酰化,然后磷酰化的甘油在3-磷酸甘油脱氢酶GlpD (glpD编码) 的作用下氧化获得磷酸二羟丙酮 (DHAP),在此过程中醌类物质作为电子受体;DHAP在磷酸丙糖异构酶TpiA (tpiA编码)作用下发生异构化形成3-磷酸甘油醛并用于后续代谢过程[18]。3-磷酸甘油醛和丙酮酸是合成萜烯类化合物的直接前体,因此甘油到3-磷酸甘油醛途径各基因协调表达,是合成β-胡萝卜素的重要保证。可以通过改造大肠杆菌好氧条件下甘油代谢途径的相关基因来提高其对甘油的利用,促进目的产物的合成。
有氧条件下,甘油经GlpF、GlpK、GlpD和TpiA催化合成3-磷酸甘油醛,这几个蛋白分别由glpF、glpK、glpD和tpiA编码而成,glpF和glpK在同一操纵子下,更换基因组上glpF启动子,就可以同时对这两个基因进行调控。本研究从实验室构建的产β-胡萝卜素工程菌株CAR015出发[20],敲除了编码3-磷酸甘油抑制物的glpR基因,并用实验室构建的3个不同强度的调控元件M1-37、M1-46和M1-93[21]对甘油代谢途径中的glpFK、glpD和tpiA进行单基因调控和多基因组合调控,提高重组大肠杆菌合成β-胡萝卜素能力,同时为利用甘油为碳源合成其他萜烯类化合物及其他目标产物提供借鉴。
1 材料与方法
1.1 材料
1.1.1 试剂
氨苄青霉素、氯霉素,购自上海生工生物工程有限公司;质粒小量快速提取试剂盒购自美国Axygen公司;SanPrep柱式PCR产物纯化试剂盒购自生工生物工程 (上海) 有限公司;Trans 2K Plus DNA Marker、EasyTaqPCR SuperMix DNA聚合酶购自北京全式金物工程公司;RNA提取试剂盒 (RNeasy mini kit,Cat,No 74104) 购自Qiagen公司;PrimeSTARTMHS DNA聚合酶和DNase I (Recombinant DNase I,RNase-free,Cat,No 2270 A) 购自宝生物工程(大连) 有限公司;Gold View I型核酸染色剂购自北京索莱宝科技有限公司;Phusion TM超保真DNA聚合酶购自NEB公司;RevertAid Premium First Strand cDNA Synthesis Kit购自Thermo Scientific;胡萝卜素标品购自美国Sigma公司 (Cat. No. C4582);其他试剂均为分析纯。
1.1.2 仪器与设备
紫外可见分光光度计,Shimadzu UV-2550 spectrophotometer (Shimadzu,Kyoto,Japan);PCR扩增仪,Eppendorf Mastercycler gradient;全自动凝胶成像系统,AlphaImager HP;电转仪MicroPulser;台式高速离心机,Eppendorf 5415D;高速冷冻离心机,Thermo Sorvall Evolution RC;高效液相色谱,Agilent Technologies Series 1200。实时定量PCR仪,CFX connectTMReal-Time system(Bio-Rad,Hercules,USA)。
1.1.3 菌株和质粒
本研究所用菌株和质粒见表1。
1.2 方法
1.2.1 培养基及培养方法
LB培养基:1 L培养基包含10 g胰蛋白胨、5 g酵母提取物和5 g氯化钠;氨苄青霉素、氯霉素、硫酸卡那霉素终浓度分别为100、34、50 μg/mL。LB固体培养基含1.5%的琼脂。
LB+2%甘油培养基:1 L培养基包含10 g胰蛋白胨、5 g酵母提取物、5 g氯化钠和20 mL甘油。
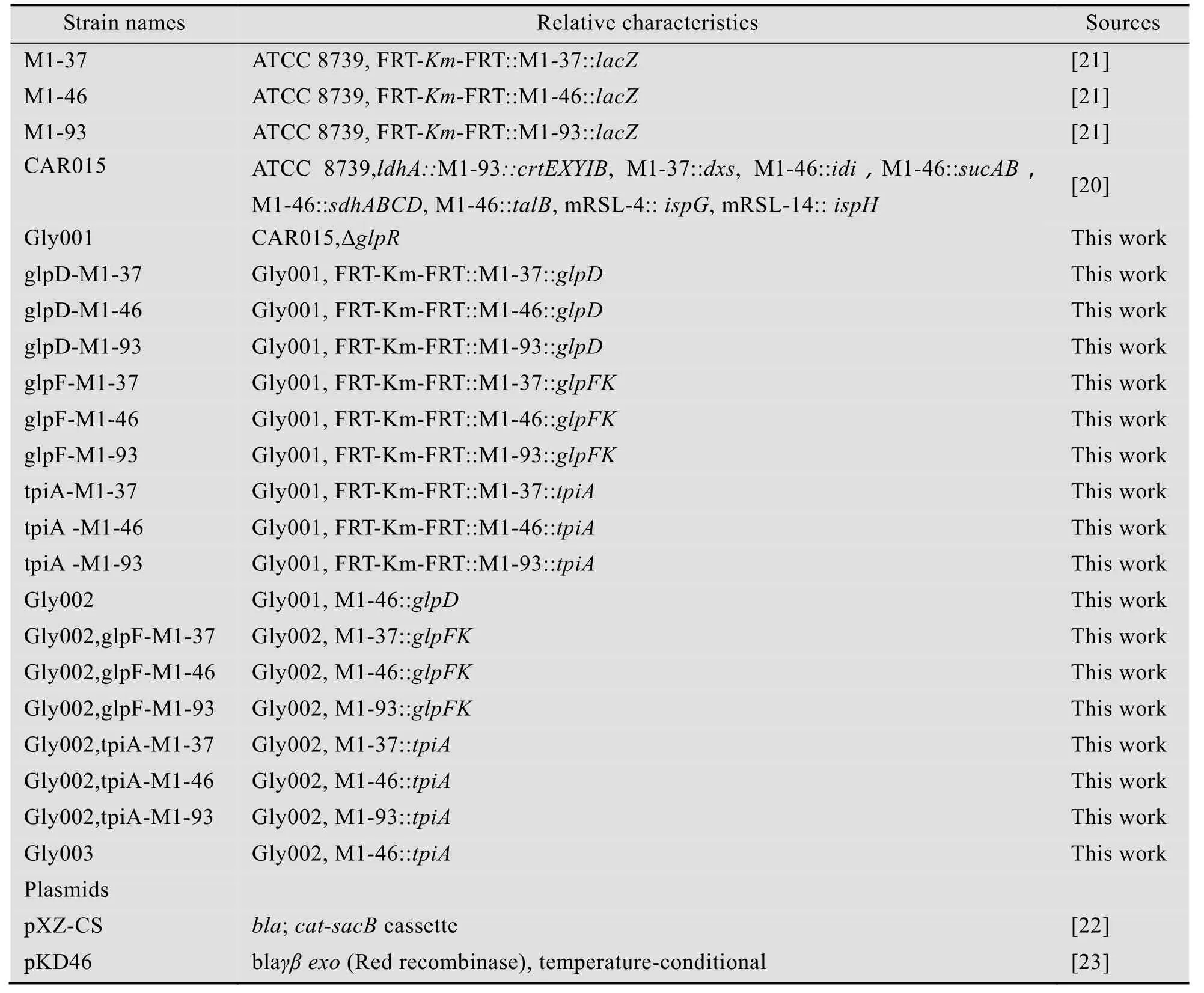
表1 本研究所用的菌株和质粒Table 1 Strains and plasmids used in this study
无盐蔗糖培养基:1 L培养基包含10 g胰蛋白胨、5 g酵母提取物和10 g蔗糖。无盐蔗糖固体培养基含1.5%的琼脂。
1.2.2 β-胡萝卜素产量和甘油残留量的检测方法
保存于−80 ℃ 的菌种在LB平板上划线活化,挑取单菌落接种到15 mm×100 mm试管 (含4 mL LB培养基) 中,37 ℃、250 r/min培养24 h,1%的接种量转接到100 mL三角瓶 (含10 mL LB+2%甘油培养基) 中,30 ℃、250 r/min 培养24 h。收集菌液用于测定β-胡萝卜素含量。
测定β-胡萝卜素产量时,先取500 μL待测菌液,13 000 r/min 离心5 min,无菌水清洗后,用1 mL 丙酮悬浮沉淀,在55 ℃ 黑暗条件下萃取15 min,然后将样品在14 000 r/min 下离心10 min,含有β-胡萝卜素的上清过滤后用于测定β-胡萝卜素产量。用高效液相色谱测定β-胡萝卜素的浓度[24]。检测条件:VWD 检测器,Symmetry C18色谱柱 (250 mm×4.6 mm,5 μm),流动相为甲醇∶乙腈∶二氯甲烷(21∶21∶8),流速1.0 mL/min,时间25 min,柱温30 ℃,检测波长450 nm。每个待测样品分别有3个平行样,实验结果取自3个平行的平均值。用购自Sigma公司的β-胡萝卜素标准品构建HPLC标准曲线。
对于甘油残留量的测定,取1 mL稀释10倍的菌液,13 000 r/min 离心5 min,上清液经滤膜过滤后用于测定甘油残留量。用高效液相色谱测定甘油的浓度[24]。检测条件:VWD检测器,HPX-87H色谱柱,流动相为5 mmol/L H2SO4,流速0.5 mL/min,时间30 min,柱温35 ℃[25]。每个待测样品分别有3个平行样,实验结果取自3个平行的平均值。
1.2.3 一步同源重组调控基因
目前往往通过质粒高表达外源或内源基因,质粒表达基因可以引起质粒不稳定、代谢负荷等弊端[26-27];同时大肠杆菌具有多个基因在同一个操纵子下调控的现象,要高表达同一操纵子下多个基因,必然需要构建较大质粒,构建质粒难度更大、质粒稳定性更低。染色体上直接用高强度启动子调控基因,避免克隆大片段基因,提高改造效率[11]。另外菌株改造时,有时候需要降低某些基因的转录水平。本研究在染色体上可以通过一步同源重组和两步同源重组的方法对基因进行调控。一步同源重组调控可以快速找出多个基因中的限速步骤[28]。两步同源重组方法在染色体上直接对基因进行调控,可以进行无痕操作,减少残留条带对后续操作的影响[11-22];采用一步同源重组的方法,用3个不同强度的启动子M1-37、M1-46、M1-93对甘油代谢途径的3个基因glpD、glpFK、tpiA分别进行单基因调控。相对于大肠杆菌中诱导后lacZ启动子,调控元件M1-46、M1-37和M1-93的强度分别是它的1.7、2.5 和5倍[11-21]。用一对引物gene-FRT-up/gene-RBS-down来扩增用于转化的条带。对于glpD基因,使用glpD-FRT-up/glpD-RBS-down引物 (表2),分别以M1-37、M1-46和M1-93的基因组DNA为模板扩增DNA片段,将片段电转入含有pKD46的菌株Gly001的感受态细胞中,在含有50 μg/mL卡那霉素的LB平板中过夜培养,挑选单克隆,用引物Kan-F/glpD-373-I-r进行PCR验证(表2)[21-28]。验证正确的克隆。采用同样的方法调控glpFK和tpiA基因,所用引物序列在表2中列出。
1.2.4 两步同源重组调控或敲除基因
两步同源重组敲除或调控基因,在改造位点不留任何不必要的序列,有利于进行后续工程改造。用两步同源重组的方法调控或敲除基因包括以下步骤,第一步同源重组,在将要敲除或调控基因位点插入一个catsacB基因片段;第二步同源重组中,将带有敲除位点两端同源臂的片段替换catsacB基因片段,完成敲除或调控。两步同源重组敲除基因流程如图2所示。首先,用电转到已经转化了pKD46的CAR015感受态细胞中,用glpR-catsacB基因片段替换glpR基因,用引物cat-up/glpR-300-O-R来验证成功转化的菌,glpR-catsacB基因片段是以pXZ-CZ质粒为模板[22],用引物glpR-cat-up/glpR-cat-down (表2) 扩增得到 (图2A)。第二步同源重组,glpR-catsacB基因片段被glpR-Deletion DNA片段取代,glpR-Deletion是以大肠杆菌ATCC 8739的基因组为模板,用引物glpR-D-up/glpR-300-O-R扩增得到,其中glpR-D-up引物包含glpR基因ATG前50 bp同源臂序列和20 bp与glpR基因TAA后20 bp同源序列,glpR-300-O-R为位于glpR基因后300 bp位置的一段反向互补序列,PCR扩增得到的第二步同源重组片段分别含glpR上游50 bp同源臂和下游300 bp同源臂序列。经第二步同源重组,可敲除掉glpR基因 (图2B)。第二步重组正确菌株在含有蔗糖的无盐LB培养基富集。在蔗糖存在的情况下,表达sacB基因的菌株因为在培养过程中积累果聚糖对细胞产生毒性而被杀死。cat-sacB基因簇被替换掉的细胞被初步富集[11,28-29]。随后,挑单菌落分别在LB和氯霉素平板上进行抗性筛选,挑选LB上生长而氯霉素上不生长的菌,用引物glpR-400-O-F/glpR-300-O-R进行PCR验证。将敲除glpR的菌命名为Gly001。
[11]所述方法两步同源重组调控基因glpF、glpD和tpiA。所用引物见表2,构建菌株及所用质粒见表1。
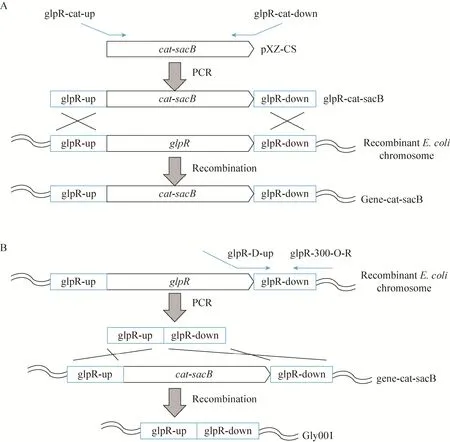
图2 基因敲除流程图 (A:第一步同源重组;B:第二步同源重组)Fig. 2 Modulation of gene deletion by the two-step recombination method. (A) The first recombination step. (B) The second recombination step.
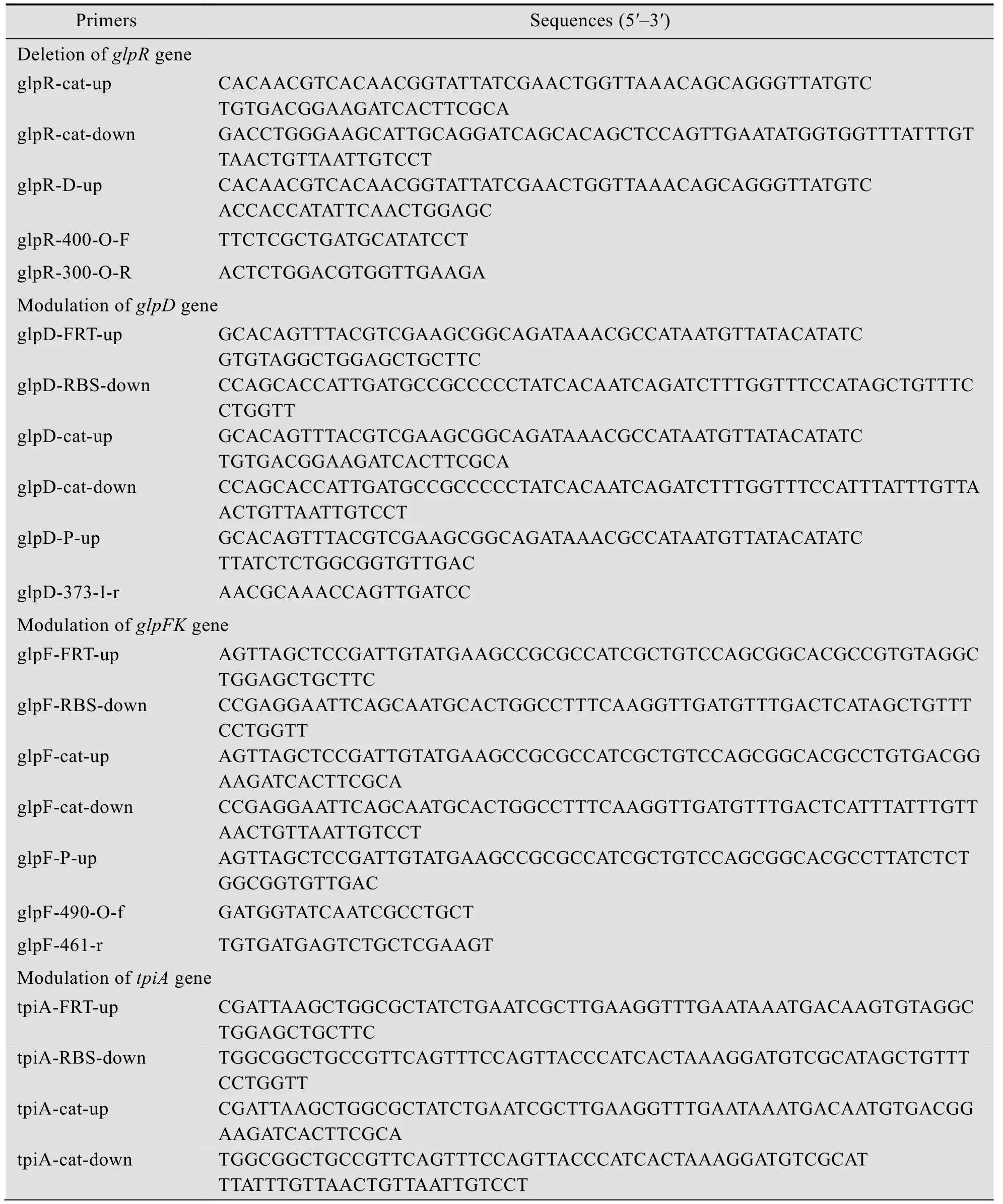
表2 本研究所用的引物Table 2 Primers used in this work

续表2
1.2.5 调控基因转录水平测定
为了确定人工调控元件调控相应基因后转录水平,我们用实时定量PCR (Q-PCR) 的方法,测定调控前后基因转录水平的改变。将待测菌取单菌落接种于含3 mL LB的试管中,培养过夜,以1%的接种量转接,30 ℃培养5 h后,按照RNA提取试剂盒要求收集一定菌体,液氮速冻后,RNA提取试剂盒提取RNA,并用DNase I去除污染的DNA,用RevertAid Premium First Strand cDNA Synthesis Kit准备cDNA,用Q-PCR仪进行Q-PCR。16S rRNA基因为内参基因,用2-ΔΔCt法计算基因的相对转录水平。Q-PCR引物见表2。
2 结果与分析
2.1glpR基因的敲除
GlpR是三磷酸甘油的阻遏蛋白,在葡萄糖存在下对大肠杆菌的甘油代谢起阻遏作用[30-33]。因此,本研究首先敲除编码GlpR的基因glpR,防止GlpR对甘油代谢的阻抑作用,同时,为重组工程菌共代谢葡萄糖和甘油做准备。
本研究用两步同源重组的方法,敲除出发菌株CAR015中的glpR,特异引物验证阳性克隆 (图3)。
结果如图3所示,用引物glpR-400-O-F/ glpR-300-O-R进行PCR验证,出发菌株CAR015为模板,扩增出1 500 bp条带,而敲除glpR后,用同样引物扩增,得到约700 bp条带,因此敲除成功,获得菌株命名为Gly001。
发酵Gly001,发现敲除glpR后,β-胡萝卜素产量比CAR015降低约8%,生长基本不受影响 (图4),可以作为出发菌株,调控甘油代谢途径各基因。
2.2 调控甘油代谢途径基因对β-胡萝卜素产量影响
采用一步同源重组方法,用M1-37、M1-46和M1-93号人工调控元件调控甘油代谢途径中的glpFK、glpD和tpiA基因。
结果表明,M1-37、M1-46和M1-93调控glpFK基因后,生长分别为Gly001的0.96、0.76和0.57倍,β-胡萝卜素产量分别为Gly001的0.96、0.76和0.54倍,甘油消耗分别为CAR015的1.16、1.13和1.12倍,说明3个固定强度调控glpFK后,对细胞生长和β-胡萝卜素产量都有一定抑制作用。TpiA调控后,生长基本不受影响(图4A),β-胡萝卜素产量略高于Gly001,分别比Gly001提高了29%、24%和17%,说明,改变tpiA的强度可以提高β-胡萝卜素产量。
M1-37和M1-93调控glpD基因后,β-胡萝卜素产量分别降低了8%和19%,而生长基本没有影响 (图4),但是,用M1-46号人工调控元件调控glpD后,生长和β-胡萝卜素产量明显升高,β-胡萝卜素产量和产率分别达64.82 mg/L和16.44 mg/g DCW,分别为CAR015的4.86倍和2.64倍。OD600达12.19,为CAR015的1.84倍,说明适当强度的人工调控元件调控glpD,可以有效提高β-胡萝卜素产量。
2.3 两基因组合调控提高β-胡萝卜素产量
因为M1-46调控glpD后,β-胡萝卜素产量明显提高,所以从glpD调控菌株出发,分别与glpFK和tpiA组合调控,观察两基因组合调控后,对细胞生长和β-胡萝卜素产量的影响。
为了便于对基因组合调控,都用两步同源重组的方法调控各基因。首先从Gly001出发,两步法用M1-46号启动子调控glpD基因,得到测序正确菌株,命名为Gly002。Gly002和glpD-M1-46相比,两者都为M1-46调控,但是在glpD-M1-46的启动子前面有一个FRT-Km-FRT片段,从β-胡萝卜素产量来看,Gly002产量为68.9 mg/L,略高于glpD-M1-46 (产量为64.82 mg/L) (图5)。
从Gly002出发,用M1-37、M1-46和M1-93人工调控元件分别调控glpFK和tpiA基因,观察两基因组合调控对β-胡萝卜素产量的影响。

图4 单基因调控后菌株β-胡萝卜素产量及生长Fig. 4 β-carotene production and cell growth after modulating single gene.

图5 双基因调控后菌株β-胡萝卜素产量及生长Fig. 5 β-carotene production and cell gowth after modulating double genes.
结果表明,单独调控tpiA基因时,M1-37号调控后,β-胡萝卜素产量最高 (图4)。在Gly002基础上调控tpiA时,M1-37号调控后,β-胡萝卜素产量反而更低,说明同样的调控元件,在不同菌株中,对目标产物的影响不同。GlpFK调控后,产量没有提高,反而下降,分别比出发菌株Gly002降低8%、13%和17%。双基因组合调控得到β-胡萝卜素产量最高菌株为Gly002,tpiA-M1-46,产量达72.45 mg/L,比Gly002提高了8%,命名为Gly003。
2.4 调控对转录水平的影响
M1-37和M1-93调控glpD后,β-胡萝卜素产量有一定降低,而生长基本没有影响 (图4),但是,用M1-46号人工调控元件调控glpD后,生长和β-胡萝卜素产量明显升高。glpFK和tpiA调控后,对细胞生长和β-胡萝卜素产量也有一定影响。本文所用的3个不同强度的启动子是组成型启动子,对不同基因可能启动强度不同;另外,所调控基因在细胞中原始转录水平不同,调控后相对转录水平是升高还是降低,结果必定不同。为了研究对基因调控后,转录水平与生长及β-胡萝卜素产量的关系,本文用Q-PCR方法,测定了基因调控菌株中,相对应基因转录水平的改变。本文以出发菌株Gly001中相对应的基因为1,来计算改造后基因的相对转录水平。

图6 调控对转录水平的影响Fig. 6 Relative expression level ofglpF,glpK,glpDandtpiAafter modulated by M1-37, M1-46 and M1-93.
由图6可知,从Gly001出发单独调控glpFK,M1-37、M1-46和M1-93调控使glpF和glpK转录水平依次升高 (图6)。调控后glpF基因的转录水平都低于对照的转录水平,但是,只有M1-37调控使glpK的转录水平低于对照,是对照的0.6倍,M1-46和M1-93调控都使glpK转录水平高于对照,分别是对照的1.2和4.6倍,因此,目前glpFK的转录水平依然高,推测进一步降低glpFK的转录水平可以提高β-胡萝卜素产量,增加细胞生长速度,建议进一步用调控元件文库调控glpFK基因,以实现提高β-胡萝卜素产量,增加细胞生长速度的目的。
M1-37和M1-93调控使glpD转录水平升高,分别是对照的1.75和5.28倍 (图6),M1-46调控使glpD转录水平降低了68%,调控菌株glpD-M1-46细胞生长和β-胡萝卜素产量明显提高,说明glpD转录水平降低,有利于细胞生长及β-胡萝卜素合成。
M1-37、M1-46和M1-93调控使tpiA转录水平依次升高,分别是对照的1.78、2.72和5.63倍 (图6),β-胡萝卜素产量都有一定提高(图4),说明提高tpiA的强度可以提高β-胡萝卜素产量。
甘油代谢包括有氧代谢和厌氧代谢两条途径。改造甘油厌氧代谢途径基因集中在提高乙醇、乳酸等产物生成[17-34];Mazumdar 等在微氧条件下过表达甘油有氧代谢中的glpK和glpD加速了甘油利用,提高了L-乳酸和D-乳酸的产量[18-35]。Applebee 在进行适应性进化研究时发现,降低glpK转录水平,可以减少丙酮醛(Methyglyoxal) 积累,降低细胞毒性,有利于细胞生长[36]。本研究发现在有氧条件下,催化甘油转化成DHAP的glpFK和glpD转录水平降低,有利于细胞生长和β-胡萝卜素合成,而分解DHAP的tpiA转录水平提高有利于细胞生长和β-胡萝卜素产量。丙酮醛主要来自甘油代谢途径的DHAP,经丙酮醛合成酶催化形成。本研究中降低glpFK和glpD转录水平,可以通过减少DHAP合成,进而减少丙酮醛积累,从而加快细胞生长和提高β-胡萝卜素产量。
3 结论
本研究在高产β-胡萝卜素的重组大肠杆菌CAR015基础上,通过用不同强度的人工调控元件调控甘油代谢途径的glpFK、glpD和tpiA基因,系统研究了甘油代谢途径各基因转录水平对β-胡萝卜素产量的影响。结果表明,降低glpD基因的转录水平可以显著提高重组大肠杆菌的生长速度和β-胡萝卜素产量;glpFK基因的转录水平与β-胡萝卜素合成能力呈反比,本研究所用固定强度启动子调控glpFK都不能使β-胡萝卜素产量提高,需要强度更低的调控元件调控glpFK基因,以期提高β-胡萝卜素产量。提高tpiA的转录水平可以适当增加β-胡萝卜素的产量;组合调控glpD和tpiA基因后,得到产量最高菌株Gly003,小摇瓶发酵24 h,β-胡萝卜素产量达72.45 mg/L、产率达18.65 mg/g DCW,是高产β-胡萝卜素重组大肠杆菌CAR015的5.23倍和1.99倍。研究结果表明,适当程度表达甘油代谢途径的glpD和tpiA基因,可以有效提高β-胡萝卜素产量及细胞生长速度,这个策略可以用于大肠杆菌生产其他萜烯类化合物。
REFERENCES
[1] Giovannucci E, Ascherio A, Rimm EB, et al. Intake of carotenoids and retinol in relation to risk of prostate-cancer. J Natl Cancer Inst, 1995, 87(23): 1767–1776.
[2] Malvy DJM, Burtschy B, Arnaud J, et al. Serum beta-carotene and antioxidant micronutrients in children with cancer. Int J Epidemiol, 1993, 22(5): 761–771.
[3] Yoon SH, Lee SH, Das A, et al. Combinatorial expression of bacterial whole mevalonate pathway for the production of β-carotene inE.coli. J Biotechnol, 2009, 140(3/4): 218−226.
[4] Yoon SH, Park HM, Kim JE, et al. Increased β-carotene production in recombinantEscherichia coliharboring an engineered isoprenoid precursor pathway with mevalonate addition. Biotechnol Prog, 2007, 23(3): 599–605.
[5] Yuan LZ, Rouvière PE, LaRossa RA, et al. Chromosomal promoter replacement of the isoprenoid pathway for enhancing carotenoid production inE.coli. Metab Eng, 2006, 8(1): 79–90.
[6] Lemuth K, Steuer K, Albermann C. Engineering of a plasmid-freeEscherichia colistrain for improvedin vivobiosynthesis of astaxanthin. Microb Cell Fact, 2011, 10: 29.
[7] Ajikumar PK, Tyo K, Carlsen S, et al. Terpenoids: opportunities for biosynthesis of natural product drugs using engineered microorganisms. Mol Pharm, 2008, 5(2): 167–190.
[8] Alper H, Jin YS, Moxley JF, et al. Identifying gene targets for the metabolic engineering of lycopene biosynthesis inEscherichia coli. Metab Eng, 2005, 7(3): 155–164.
[9] Farmer WR, Liao JC. Precursor balancing for metabolic engineering of lycopene production inEscherichia coli. Biotechnol Prog, 2001, 17(1): 57–61.
[10] Choi HS, Lee SY, Kim TY, et al.In silicoidentification of gene amplification targets for improvement of lycopene production. Appl Environ Microbiol, 2010, 76(10): 3097–3105.
[11] Zhao J, Li QY, Sun T, et al. Engineering central metabolic modules ofEscherichia colifor improving β-carotene production. Metab Eng, 2013, 17: 42–50.
[12] YazdaniSS, Gonzalez R. Anaerobic fermentation of glycerol: a path to economic viability for the biofuels industry. Curr Opin Biotech, 2007, 18(3): 213–219.
[13] Abdel-Rahman MA, Tashiro Y, Sonomoto K. Recent advances in lactic acid production by microbial fermentation processes. Biotechnol Adv, 2013, 31(6): 877–902.
[14] Clomburg JM, Gonzalez R. Biofuel production inEscherichia coli: the role of metabolic engineering and synthetic biology. Appl Microbiol Biotechnol, 2010, 86(2): 419–434.
[15] Kim J, Kong MK, Lee SY, et al. Carbon sourcesdependent carotenoid production in metabolically engineeredEscherichia coli. World J Microb Biotechnol, 2010, 26(12): 2231–2239.
[16] Lee PC, Mijts BN, Schmidt-Dannert C. Investigation of factors influencing production of the monocyclic carotenoid torulene in metabolically engineeredEscherichia coli. Appl Microbiol Biotechnol, 2004, 65(5): 538–546.
[17] Durnin G, Clomburg J, Yeates Z, et al. Understanding and harnessing the microaerobic metabolism of glycerol inEscherichia coli. Biotechnol Bioeng, 2009, 103(1): 148–161.
[18] Mazumdar S, Blankschien MD, Clomburg JM, et al. Efficient synthesis of L-lactic acid from glycerol by metabolically engineeredEscherichia coli. Microb Cell Fact, 2013, 12: 7.
[19] Heller KB, Lin ECC, Wilson TH. Substratespecificity and transportproperties of the glycerol facilitator ofEscherichia coli. J Bacteriol, 1980, 144(1): 274–278.
[20] Zhang XL, Li QY, Tang JL. Construction methods and applications of a β-carotene recombinant microorganisms: CN, 201610866681.9 (in Chinese).张学礼, 李清艳, 唐金磊. 生产β-胡萝卜素的重组微生物及构建方法和应用: 中国, 201610866681.9.
[21] Lu J, Tang JL, Liu Y, et al. Combinatorial modulation ofgalPandglkgene expression for improved alternative glucose utilization. Appl Microbiol Biotechnol, 2012, 93(6): 2455–2462.
[22] Tan ZG, Zhu XN, Chen J, et al. Activating phosphoenolpyruvate carboxylase and phosphoenolpyruvate carboxykinase in combination for improvement ofsuccinate production. Appl Environ Microbiol, 2013, 79(16): 4838–4844.
[23] Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes inEscherichia coliK-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12): 6640–6645.
[24] Yoon SH, Lee SH, Das A, et al. Combinatorial expression of bacterial whole mevalonate pathway for the production of β-carotene inE.coli. J Biotechnol, 2009, 140(3/4): 218–226.
[25] Zhang XL, Jantama K, Moore JC, et al. Metabolic evolution of energy-conserving pathways for succinate production inEscherichia coli. Proc Natl Acad Sci USA, 2009, 106(48): 20180–20185.
[26] Keasling JD. Synthetic biology for synthetic chemistry. ACS Chem Biol, 2008, 3(1): 64–76.
[27] Albermann C, Trachtmann N, Sprenger GA. A simple and reliable method to conduct and monitor expression cassette integration into theEscherichia colichromosome. Biotechnol J, 2010, 5(1): 32–38.
[28] Zhao J, Liu Y, Li QY, et al. Modulation of isoprenoid gene expression with multiple regulatory parts for improved β-carotene production. Chin J Biotech, 2013, 29(1): 41–55 (in Chinese).赵婧, 刘怡, 李清艳, 等. 多个调控元件调控萜类合成途径基因表达提高β-胡萝卜素的生产. 生物工程学报, 2013, 29(1): 41–55.
[29] Chen J, Zhu XN, Tan ZG, et al. Activating C4-dicarboxylate transportersDcuBandDcuCfor improving succinate production. Appl Microbiol Biotechnol, 2014, 98(5): 2197–2205.
[30] Yang B, Larson TJ. Action at a distance for negative control of transcription of theglpDgene encoding sn-glycerol 3-phosphate dehydrogenase ofEscherichia coliK-12. J Bacteriol, 1996, 178(24): 7090–7098.
[31] Zeng G, Ye S, Larson TJ. Repressor for the sn-glycerol 3-phosphate regulon ofEscherichia coliK-12: primary structure and identification of the DNA-binding domain. J Bacteriol, 1996, 178(24): 7080–7089.
[32] Larson TJ, Ye SZ, Weissenborn DL, et al. Purification and characterization of the repressor for the sn-glycerol 3-phosphate regulon ofEscherichia coliK12. J Biol Chem, 1987, 262(33): 15869–15874.
[33] Schweizer H, Boos W, Larson TJ. Repressor for the sn-glycerol-3-phosphate regulon ofEscherichia coliK-12: cloning of theglpRgene and identification of its product. J Bacteriol, 1985, 161(2): 563–566.
[34] Cintolesi A, Clomburg JM, Rigou V, et al. Quantitative analysis of the fermentative metabolism of glycerol inEscherichia coli. Biotechnol Bioeng, 2012, 109(1): 187–198.
[35] Mazumdar S, Clomburg JM, Gonzalez R.Escherichia colistrains engineered for homo fermentative production of D-lactic acid from glycerol. Appl Environ Microbiol, 2010, 76(13): 4327–4336.
[36] Applebee MK, Joyce AR, Conrad TM, et al. Functional and metabolic effects of adaptive glycerol kinase (GLPK) mutants inEscherichia coli. J Biol Chem, 2011, 286(26): 23150–23159.
(本文责编 陈宏宇)
Improving β-carotene production inEscherichia coliby metabolic engineering of glycerol utilization pathway
Yue Dong1,2*, Kunle Hu3*, Xinglin Li1, Qingyan Li2, and Xueli Zhang2
1College of Biotechnology,Tianjin University of Science & Technology,Tianjin300457,China
2 Key Laboratory of Systems Microbial Biotechnology, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences,Tianjin300308,China
3College of Food and Bioengineering,Henan University of Science and Techology,Luoyang471023,Henan,China
Glycerol is a byproduct during biodiesel production. It is an important feedstock for fermentation due to its low price and high reduced status. Multiple genes of the glycerol utilization pathway were modulated in a previously engineered high β-carotene producingEscherichia colistrain CAR015 to enhance glycerol utilization capability for improving isoprenoids production. TheglpRgene, encoding glycerol 3-phosphate repressor, was firstly deleted. TheglpFK,glpDandtpiAgenes were then modulated by three artificial regulatory parts, M1-37, M1-46 and M1-93, respectively. β-carotene titer reached 64.82 mg/L after modulatingglpDwith M1-46, which was 4.86 times higher than that of CAR015, and glycerol consumption rate also increased 100%. ModulatingtpiAled to a little increase of β-carotene titer, whereas modulatingglpFKled to a little decrease of β-carotene titer. This demonstrated that GlpD was a rate-limiting step in glycerol utilization pathway. Q-PCR ofglpF,glpK,glpD andtpiAresults showed that decrease the transcription level ofglpF,glpK,glpD, or decrease the transcription level oftpiAcould increase the cell growth and β-carotene production, probably for the decrease of methylglyoxal toxicity. ModulatingglpDandtpiAgenes in combination resulted in the best strain Gly003, which produced 72.45 mg/L β-carotene with a yield of 18.65 mg/g dry cell weight. The titer was 5.23 and yield 1.99 times of that of the parent strain CAR015. Our work suggested that appropriate activation ofglpDandtpiAgenes in glycerol utilization pathway could effectively improve β-carotene production. This strategy can be used for production of other terpenoids inE. coli.
β-carotene, terpenoids, glycerol metabolism,Escherichia coli
s:Xinglin Li. Tel/Fax: 86-22-60601329; Email: lxlszf@tust.edu.cn
Received:July 22, 2016;Accepted:December 6, 2016
Supported by:Natural Science Foundation of Tianjin (No. 15JCYBJC49400), Tianjin Key Technology R&D Program of Tianjin Municipal Science and Technology Commission (No. 12ZCZDSY14700).
Qingyan Li. Tel/Fax: 86-22-84861946; Email: li_qy@tib.cas.cn
*These authors contributed equally to this work.
天津市自然科学基金 (No. 15JCYBJC49400),天津市科技支撑计划重点项目 (No. 12ZCZDSY14700) 资助。
时间:2016-12-27
http://www.cnki.net/kcms/detail/11.1998.Q.20161227.1416.001.html
