增施硝态氮对Na2CO3胁迫下桑树幼苗叶片PSⅡ功能的影响
2017-03-02张会慧谷思玉朱玉伟张秀丽
许 楠,张会慧,谷思玉,李 鑫,朱玉伟,杨 艳,刘 昆,张秀丽
(1.东北林业大学生命科学学院 黑龙江 哈尔滨 150040; 2.黑龙江省科学院自然与生态研究所 黑龙江 哈尔滨 150040;3.东北农业大学资源与环境学院 黑龙江 哈尔滨 150030)
增施硝态氮对Na2CO3胁迫下桑树幼苗叶片PSⅡ功能的影响
许 楠1,2,张会慧3,谷思玉3,李 鑫3,朱玉伟3,杨 艳3,刘 昆3,张秀丽1
(1.东北林业大学生命科学学院 黑龙江 哈尔滨 150040; 2.黑龙江省科学院自然与生态研究所 黑龙江 哈尔滨 150040;3.东北农业大学资源与环境学院 黑龙江 哈尔滨 150030)
以桑树(Morusalba)为试验材料,在室内以溶液培养的方法研究了增施NO3--N(7.5 mmol·L-1增加到17.5 mmol·L-1)对Na2CO3胁迫(50 mmol·L-1)下桑树幼苗叶片PSⅡ功能的影响。结果表明,50 mmol·L-1的Na2CO3胁迫下桑树植株表现出明显的盐害症状,叶片的PSⅡ反应中心光化学活性明显降低,PSⅡ电子供体侧和受体侧均受到不同程度的影响。增施NO3--N显著提高了Na2CO3胁迫下桑树幼苗叶片的光合电子供应和传递能力,表现为PSⅡ电子供体侧放氧复合体OEC的功能增强,PSⅡ电子受体侧受体库接受电子能力增加。另外,增施NO3--N还可以相对提高桑树幼苗叶片类囊体膜结构的稳定性,促进Na2CO3胁迫下桑树幼苗叶片光能向光化学反应方向的分配,降低以无效热能形式耗散的比例。可见,增施NO3--N可显著增强Na2CO3胁迫下桑树幼苗叶片PSⅡ的功能,这为其光合作用的正常进行提供了保证。
桑树;硝态氮;Na2CO3胁迫;PSⅡ反应中心;荧光动力学曲线;电子传递;非光化学猝灭
氮是植物体内最为重要的大量元素之一[1],植物对氮素的吸收主要为根系对硝态氮(NO3--N)、铵态氮(NH4+-N)和有机态氮的吸收为主,少量伴随氨基酸形式氮的吸收[2-3],相同植物对氮的偏好也不相同,喜铵植物在单一NO3--N供应下生长会受到抑制,同样,喜硝植物在单一供应NH4+-N时还会发生铵盐毒害现象[4-5]。
盐碱胁迫是限制植物生长的重要因子之一,全世界约有20%的耕地面积受到不同程度盐碱化的影响[6-7],预计到2050年面积将会达到50%[8]。特别是以Na2CO3为主的碱性盐,是危害我国松嫩平原盐碱地最主要的盐类,并且Na2CO3胁迫对植物的影响也明显大于中性盐NaCl[9-10]。合理施用氮肥不但可以促进植物的生长[11],提高植物的光合碳代谢能力和蛋白质合成能力[12],还对增强植物的抗逆能力方面也发挥重要作用[13-16],例如增施氮肥提高芥菜(Indianmustard)[14]、大麦(Hordeumvulgare)[15]和油菜(Brassicacampestris)[16]等植物的抗逆能力方面已经得到了证实。
桑树(Morusalba)是我国栽培最早而且用途最广的栽培植物,依据桑树的用途可分为蚕桑、食用桑、果桑、饲料桑和绿化桑等。桑树叶片的营养丰富,蛋白质含量与苜蓿(Medicagosativa)相仿, 比禾本科牧草高80%~100%,桑树(Morusalba)在NO3--N供应下的生长和光合能力明显优于NH4+-N供应下,为典型的喜硝植物[17],并且增施NO3--N可以提高Na2CO3胁迫下桑树幼苗的生长,提高其光合氮同化能力[18],但是对其提高光合能力的作用机理方面的研究尚不深入。为此,本研究利用叶绿素荧光技术以及快相叶绿素荧光动力学(OJIP曲线)方法研究增施NO3--N对Na2CO3胁迫桑树幼苗叶片PSⅡ功能的影响,为揭示NO3--N提高桑树幼苗叶片光合中心对Na2CO3胁迫耐受能力的机理提供一些基础数据,为合理指导盐碱脆弱生态地植被恢复中氮素的合理运筹提供理论依据。
1 材料与方法
1.1 试验材料及处理方法
试验于2012年在东北林业大学植物生理学实验室进行。试验材料为1年龄青龙桑实生苗。幼苗水培于1/2Hoagland完全营养液不透光水培箱中,电动气泵通气,营养液每隔3 d更换一次。水培养箱规格:直径25 cm,高30 cm,体积为10 L。幼苗于温度约为25 ℃的室内,在光照强度为400 μmol·(m2·s)-1、光周期12/12 h(光/暗)人工LED白光灯架下培养。待幼苗长至约8片叶时,进行试验处理。
将长势相对一致的18株幼苗平均分为3组,即每个处理6株重复。第一组:Na2CO3胁迫处理,在1/2Hoagland营养液中加入Na2CO3使其浓度达50 mmol·L-1;第二组:增施NO3--N处理(Na2CO3胁迫+施氮),即在含有50 mmol·L-1Na2CO3的1/2Hoagland营养液中再加入Ca(NO3)2,使其NO3--N浓度达17.5 mmol·L-1(1/2Hoagland营养液中的NO3--N浓度为7.5 mmol·L-1);第三组:以1/2Hoagland营养液水培为对照(CK)。为消除增施NO3--N处理中引入Ca2+的影响,分别将CK和Na2CO3胁迫处理中加入适量CaCl2使其Ca2+浓度与Na2CO3胁迫+施氮处理一致。处理20 d后待不同处理之间表型差异明显后进行各指标的测定。
1.2 测定参数和方法
快相叶绿素荧光动力学曲线的测定:选择不同处理下桑树幼苗顶端第2片完全展开叶片,利用Mini调制式掌上叶绿素荧光仪(FluorPen FP 100 max,捷克)测定经过0.5 h暗适应后叶片的OJIP曲线,5次重复。其中OJIP曲线上O、J、I和P点的相对荧光强度(Fo、FJ、FI和Fm)对应的时间分别为0、2、30和1 000 ms,L和K点相对荧光强度(FL和FK)分别表示0.15和0.3 ms对应的时刻。为分析J、I、L和K点相对可变荧光(VJ、VI、VL和VK)的变化,分别将O-P、O-J和O-K曲线标准化,方法参照胡举伟等[19]。按照Strasser等[20]的方法对OJIP曲线进行JIP-test分析,得到PSⅡ最大光化学效率(Fv/Fm)、PSⅡ潜在光化学活性(Fv/Fo)、以吸收光能为基础的光合性能指数(PIABS)、荧光上升的初始斜率(Mo)、QA完全被还原所需要的能量(Sm)、荧光曲线与Fm所围面积(Area)、2 ms时有活性反应中心的开放程度(Ψo)、吸收光能用于QA-以后的电子传递的能量比例(φEo)和非光化学猝灭的最大量子产额(φDo)等叶绿素荧光参数。将CK的各叶绿素荧光参数定义为1,利用其它处理与CK的比值绘制叶绿素荧光参数变化的雷达图。
1.3 数据处理方法
运用Excel和DPS软件对测定数据进行统计分析。
2 结果与分析
2.1 增施硝态氮对Na2CO3胁迫下桑树幼苗的表型特征
50 mmol·L-1的NaCO3胁迫抑制了桑树幼苗的地上部生长,植株高度、冠幅明显小于CK,并且叶片面积也较CK明显降低,特别是下部叶片的盐害症状更为明显,甚至出现了盐斑,叶片边缘有卷曲现象(图1)。但是,增施硝态氮处理明显缓解了桑树幼苗的盐害症状,与NaCO3胁迫相比,植株的冠幅、叶面积均明显增加,叶片面积增大。

图1 增施硝态氮肥对Na2CO3胁迫下桑树幼苗表型特征的影响Fig. 1 Effect of NO3--N application on phenotypic characteristics of Morus alba seedlings under Na2CO3 stress
2.2 增施硝态氮对Na2CO3胁迫下桑树幼苗叶片OJIP曲线形态的影响
Na2CO3胁迫下桑树幼苗叶片OJIP曲线上O-J点的相对荧光强度与CK相比均明显上升,但到I点(30 ms)时基本与CK无明显差异,当超过I点时,CK桑树叶片上相对荧光强度上升幅度明显大于Na2CO3胁迫处理。Na2CO3胁迫+施氮处理下桑树幼苗叶片的OJIP曲线形态与Na2CO3胁迫基本相似,其中O、I和P点均无明显差异,但J点的相对荧光强度却较Na2CO3胁迫明显降低。
2.3 增施硝态氮对Na2CO3胁迫下桑树幼苗叶片标准化O-P曲线的影响
将不同处理下桑树幼苗叶片的OJIP曲线标准化后可以看出(图3),分别将O点和P点的相对可变荧光定义为0和1后,Na2CO3胁迫下桑树幼苗叶片VJ和VI较CK均明显增加,并且VJ的增加幅度明显大于VI。增施硝态氮处理后明显降低了Na2CO3胁迫下桑树幼苗叶片VJ和VI的增加幅度。将不同处理下桑树幼苗叶片的标准化O-P曲线与CK做差值可以看出(图3),Na2CO3胁迫下桑树幼苗叶片VJ较CK增加了约0.17,而Na2CO3胁迫+施氮处理仅较CK增加了仅0.1左右。不同处理下VI之间变化幅度较小,Na2CO3胁迫下较CK有小幅增加,但Na2CO3胁迫+施氮处理下VI却与CK无明显差异。
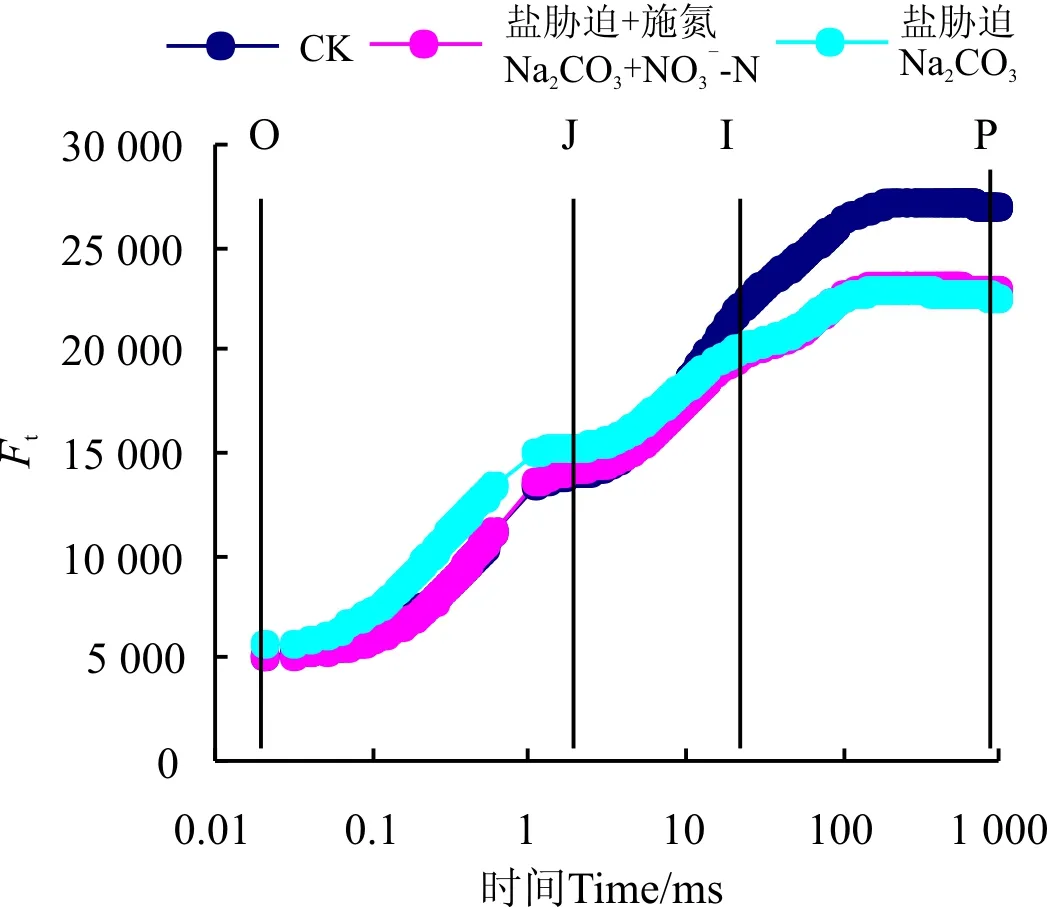
图2 增施硝态氮对Na2CO3胁迫下桑树 幼苗叶片OJIP曲线形态的影响Fig. 2 Effect of NO3--N application on the OJIP curve in leaves of Morus alba seedlings under Na2CO3 stress
2.4 增施硝态氮对Na2CO3胁迫下桑树幼苗叶片标准化O-J曲线的影响
Na2CO3胁迫下桑树幼苗叶片标准化O-J曲线上VK明显增加(图4),但是增施硝态氮处理却明显缓解了Na2CO3胁迫下桑树幼苗叶片VK的上升,并且Na2CO3胁迫+施氮处理下桑树幼苗叶片的O-J曲线基本与CK重合。另外,Na2CO3胁迫处理和Na2CO3胁迫+施氮处理O-J曲线分别与CK做差值也可以看出(图4),Na2CO3胁迫处理下以VK变化幅度最大,但Na2CO3胁迫+施氮处理却没有发生明显变化。
2.5 增施硝态氮对Na2CO3胁迫下桑树幼苗叶片标准化O-K曲线的影响
不同处理下桑树幼苗叶片标准化O-K曲线约在0.15 ms时的差异程度最大(图5),Na2CO3胁迫下桑树幼苗叶片标准化O-K曲线上Vt明显增加,但Na2CO3胁迫+施氮处理O-K曲线与CK之间的差异程度明显小于Na2CO3胁迫处理。不同处理与CK之间做差值也可以看出(图5),Na2CO3胁迫处理桑树幼苗叶片的VL与CK相比增加了0.08左右,但Na2CO3胁迫+施氮处理却仅增加了约0.02。
2.6 增施硝态氮对Na2CO3胁迫下桑树幼苗叶片标准化叶绿素荧光参数的影响
Na2CO3胁迫处理明显改变了桑树幼苗叶片的叶绿素荧光参数(图6),但是增施硝态氮处理却明显缓解了Na2CO3胁迫下桑树幼苗叶片叶绿素荧光参数的变化幅度。其中,Na2CO3胁迫下桑树幼苗叶片的Fo和FJ较CK分别增加了12.2%和9.3%,而Na2CO3胁迫+施氮处理却没有发生明显变化,Na2CO3胁迫和Na2CO3胁迫+施氮处理下桑树幼苗叶片的FI和Fm均较CK明显降低,但Na2CO3胁迫和Na2CO3胁迫+施氮处理之间无明显差异。Na2CO3胁迫+施氮处理下桑树幼苗叶片的VL、VK、VJ和VI较Na2CO3胁迫也分别降低了5.8%、45.9%、12.1%和2.4%,其中以VK和VJ的变化幅度较大。虽然不同处理之间桑树幼苗叶片的Fv/Fm降低幅度较小,但Na2CO3胁迫下桑树幼苗叶片的Fv/Fo和PIABS却较CK分别降低了31.1%和76.8%,而Na2CO3胁迫+施氮处理仅降低了16.2%和46.9%。另外,Na2CO3胁迫下桑树幼苗叶片的Area、Sm、Ψo和φEo均明显降低,而φDo则明显增加,而Na2CO3胁迫+施氮处理下桑树幼苗叶片的Area、Sm、Ψo和φEo分别高于Na2CO3胁迫处理8.6%、6.6%、7.9%和11.1%,φDo却降低了18.5%。
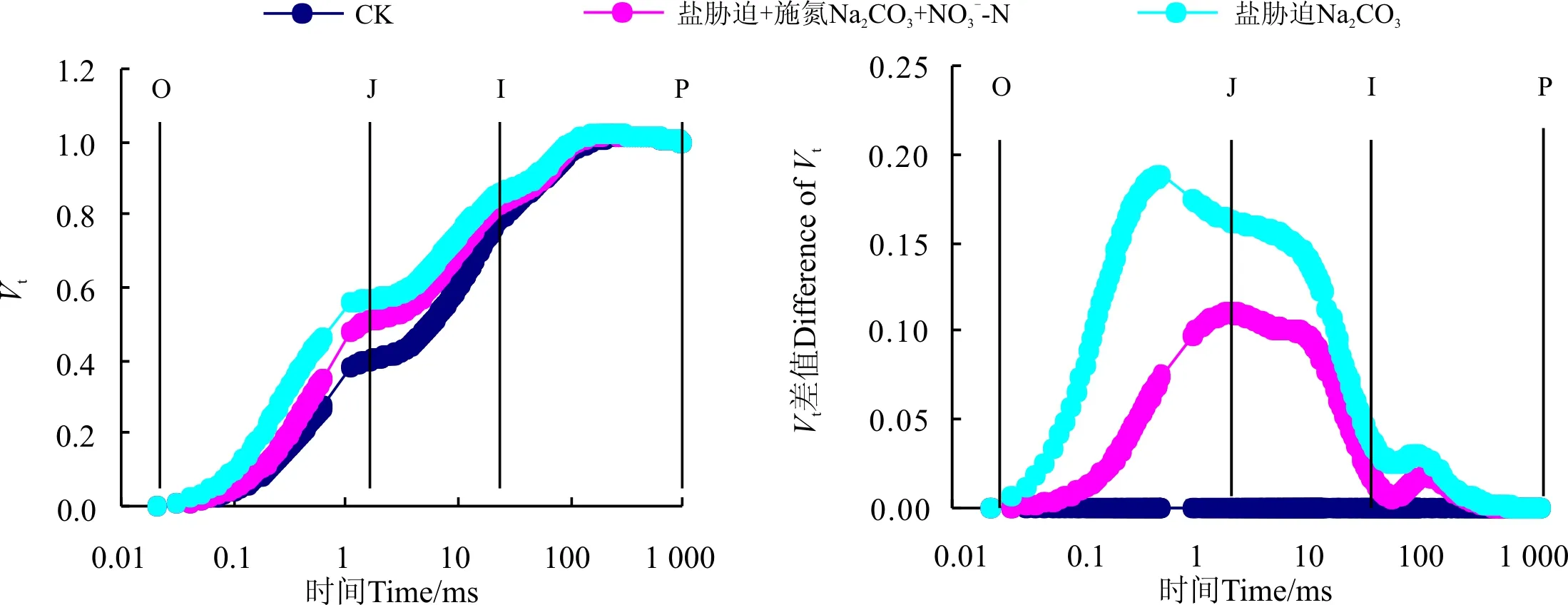
图3 增施硝态氮对Na2CO3胁迫下桑树幼苗叶片标准化O-P曲线的影响Fig. 3 Effect of NO3--N application on VO-P in leaves of Morus alba seedlings under Na2CO3 stress
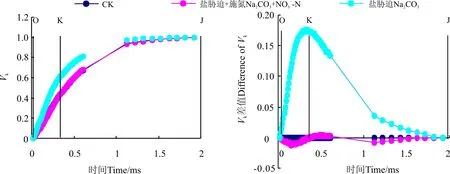
图4 增施硝态氮对Na2CO3胁迫下桑树幼苗叶片标准化O-J曲线的影响Fig. 4 Effect of NO3--N application on VO-J in leaves of Morus alba seedlings under Na2CO3 stresss

图5 增施硝态氮对Na2CO3胁迫下桑树幼苗叶片标准化O-K曲线的影响Fig. 5 Effect of NO3--N application on VO-K in leaves of Morus alba seedlings under Na2CO3 stress
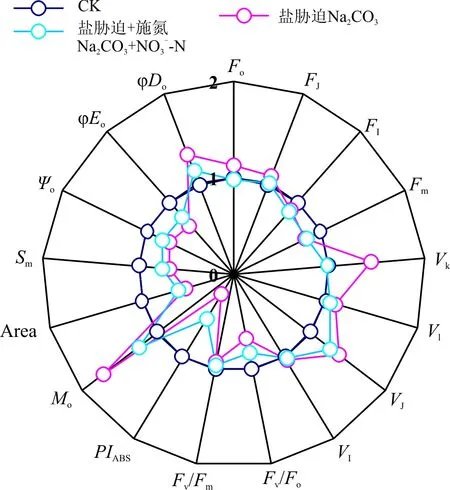
图6 增施硝态氮对Na2CO3胁迫下桑树幼苗叶片 叶绿素荧光参数的雷达变化图Fig. 6 Radar plot of fluorescence data in leaves ofMorus alba seedlings under Na2CO3 stress applied NO3--N
3 讨论
有研究表明,增施NO3--N可以明显缓解玉米(Zeamays)和小麦(Triticumaestivum)的盐害症状[21],本研究得到了相似的结论,在增施NO3--N下桑树植株的盐害症状明显减轻,植株的株高、冠幅和叶片面积较Na2CO3胁迫下明显增加。盐碱胁迫下植物光合能力的降低被认为是导致其生长受到抑制的主要原因之一,大量研究表明,盐胁迫下植物会通过气孔和非气孔因素的限制影响植物光合作用的正常进行[22],在非气孔因素中,PSⅡ反应中心活性的限制被认为是最敏感的过程之一[23-24]。叶绿素荧光动力学曲线在定性和定量反映PSⅡ原初光化学反应信息方面发挥着重要作用[25]。本研究中,Na2CO3胁迫下桑树幼苗叶片的初始荧光Fo稍有增加,而最大荧光Fm则明显降低,导致其Fv/Fm和Fv/Fo降低,特别是反映PSⅡ反应中心对光能的捕获和光合电子传递能力的叶绿素荧光参数PIABS降低幅度更是高达76.8%,说明Na2CO3胁迫下桑树幼苗叶片PSⅡ反应中心活性明显降低,光能吸收和利用能力受到限制。增施NO3--N可以明显缓解Na2CO3胁迫下桑树幼苗叶片PSⅡ反应中心的光抑制程度,与Na2CO3胁迫处理相比,Na2CO3胁迫+施氮处理下桑树幼苗叶片的Fv/Fm、Fv/Fo和PIABS均有不同程度的增加,特别是PIABS的增加更为明显,这同样也说明PIABS的变化对环境胁迫的响应更为敏感。
为了进一步分析增施NO3--N缓解Na2CO3胁迫下桑树幼苗叶片PSⅡ反应中心伤害程度的原因,分别将OJIP曲线按O-P、O-J和O-K进行标准化,以特异分析J、I、K和L点相对可变荧光VJ、VI、VK和VL的变化。JIP-test分析中,VJ的增加是QA向QB传递受阻的标志[26],I点的出现主要体现在QA-向QB传递过程中[27],VK的增加与放氧复合体OEC损伤和QA之前受体侧受到抑制有关,而VL的增加则是类囊体膜解离的重要标志[28]。本研究中,Na2CO3胁迫下桑树幼苗叶片VL、VK和VJ分别较CK明显增加,仅以VI的变化幅度相对较小,说明Na2CO3胁迫不但抑制了桑树幼苗叶片PSⅡ供体侧OEC的正常水裂解功能和电子由去镁叶绿素Pheo向QA的传递,并且导致了PSⅡ受体侧电子传递能力的降低,表现为电子由QA向QB传递受阻,但电子在QA-向QB传递过程中却没有发生明显变化,表明Na2CO3胁迫导致桑树幼苗叶片电子传递受阻主要体现在QA被还原过程之前。另外,Na2CO3胁迫还导致桑树幼苗叶片类囊体膜结构发生改变,这可能是由于电子传递受阻使电子传递链上电子泄露,攻击细胞中游离的氧分子产生超氧阴离子,或水的不完全裂解产生过氧化氢等活性氧[29],活性氧的增加会使类囊体膜脂发生过氧化[30]。增施硝态氮均明显降低了Na2CO3胁迫下桑树幼苗叶片各点的相对可变荧光,说明增施硝态氮可以促进Na2CO3胁迫下桑树幼苗叶片的光合电子传递能力,特别是Na2CO3胁迫下增施NO3--N处理下桑树幼苗叶片VK基本接近CK水平,说明增施NO3--N对放氧复合体OEC的保护作用较强。
Sm反映了使QA完全被还原所需要的能量,Sm和Area均是反映PSⅡ受体库容量的重要指标[31]。Mo为QA被还原的最大速率,而Ψo反映照光2 ms时有活性的反应中心的开放程度,受PSⅡ供体侧的电子供应能力和受体侧接收电子的能力制约[32]。本研究中,Na2CO3胁迫下桑树幼苗叶片的Sm、Area和Ψo均较CK明显降低,即PSⅡ受体库容量、PSⅡ受体接受电子能力及吸收光能用于QA-以后的电子传递的能量比例(φEo)均降低,而非光化学猝灭的最大量子产额(φDo)和光能用于还原QA的能量均增加,导致QA的还原加速,表现为Mo增加。可见,增施NO3--N可以增强PSⅡ反应中心受体侧的性能,优化光能的分配参数,在提高PSⅡ反应中心对Na2CO3胁迫的耐受性方面发挥着重要的作用。
4 结论
50 mmol·L-1的Na2CO3胁迫下桑树叶片的PSⅡ反应中心光化学活性明显降低,并且PSⅡ电子供体侧和受体侧均受到不同程度的影响。但是增施NO3--N使Na2CO3胁迫下桑树幼苗叶片PSⅡ电子供体侧放氧复合体OEC的功能增强,PSⅡ电子受体侧受体库接受电子能力增加,类囊体膜结构的稳定性增加,明显缓解了Na2CO3胁迫对桑树幼苗叶片PSⅡ反应中心的伤害程度。
References:
[1] 米国华,陈范骏,春亮,郭亚芬,田秋英,张福锁.玉米氮高效品种的生物学特征.植物营养与肥料学报,2007,13(1):155-159. Mi G H,Chen F J,Chun L,Guo Y F,Tian Q Y,Zhang F S.Biological characteristics of nitrogen efficient maize genotypes.Plant Nutrition and Fertilizer Science,2007,13(1):155-159.(in Chinese)
[2] Kuelland K.Amino acid absorption by arctic plants:Implications for plant nutrition and nitrogen cycling.Ecology,1994,75:2373-2383.
[3] Chapin F S,Autumn K,Pugnaire F.Evolution of suites of traits in response to environmental stress.The American Naturalist,1993,142:78-92.
[4] 陈永亮,刘明河,李修岭.不同形态氮素配比对红松幼苗光合特性的影响.南京林业大学学报:自然科学版,2005,29(3):77-80. Chen Y L,Liu M H,Li X L.Effects of different nitrogen forms and ratios on the photosynthetic characteristics ofPinuskoraiensisseedlings.Journal of Nanjing Forestry University:Natural Sciences Edition,2005,29(3):77-80.(in Chinese)
[5] 邹娜,李保海,强晓敏,施卫明.高铵胁迫对拟南芥根系向重性的影响及机制初探.土壤,2013,45(1):166-171. Zou N,Li B H,Qiang X M,Shi W M.Effect and mechanism of high ammonium on root gravitropic response inArabidopsis.Soils,2013,45(1):166-171.(in Chinese)
[6] Bhatnagar-Mathur P,Vadez V,Sharma K K.Transgenic approaches for abiotic stress tolerance in plants:Retrospect and prospects.Plant Cell Reports,2008,27:411-424.
[7] Zhu J K,Plant salt tolerance.Trends in Plant Science,2001,6(2):66-71.
[8] Jan A,Osman M B,Amanullah.Response of chickpea to nitrogen sources under salinity stress.Journal of Plant Nutrition,2013,36:1373-1382.
[9] 张会慧,张秀丽,朱文旭,许楠,李鑫,岳冰冰,王良再,孙广玉.桑树叶片光系统Ⅱ对NaCl和Na2CO3胁迫的响应.北京林业大学学报,2011,33(6):121-126. Zhang H H,Zhang X L,Zhu W X,Xu N,Li X,Yue B B,Wang L Z,Sun G Y.Responses of photosystem Ⅱ in leaves of mulberry to NaCl and Na2CO3stress.Journal of Beijing Forest University,2011,33(6):121-126.(in Chinese)
[10] 张会慧,张秀丽,李鑫,丁俊男,朱文旭,齐飞,张婷,田野,孙广玉.NaCl和Na2CO3胁迫对桑树幼苗生长和光合特性的影响.应用生态学报,2012,23(3):625-631. Zhang H H,Zhang X L,Li X,Ding J N,Zhu W X,Qi F,Zhang T,Tian Y,Sun G Y.Effects of NaCl and Na2CO3stresses on the growth and photosynthesis characteristics ofMorusalbaseedlings.Chinese Journal of Applied Ecology,2012,23(3):625-631.(in Chinese)
[11] 孔清华,李光永,王永红,霍宏旭.地下滴灌施氮及灌水周期对青椒根系分布及产量的影响.农业工程学报,2009,25(13):38-42. Kong Q H,Li G Y,Wang Y H,Huo H X.Effects of nitrogen application and irrigation cycle on bell pepper root distribution and yield under subsurface drip irrigation.Transactions of the CSAE,2009,25(13):38-42.(in Chinese)
[12] 王祥宇,魏珊珊,董树亭,刘鹏,张吉旺,赵斌.氮素对灌浆期夏玉米叶片蛋白质表达的调控.中国农业科学,2015,48(9):1727-1736. Wang X Y,Wei S S,Dong S T,Liu P,Zhang J W,Zhao B.Regulation of nitrogen on protein expression of summer maize (ZeamaysL.) leaves at filling stage.Scientia Agricultura Sinica,2015,48(9):1727-1736.(in Chinese)
[13] Pompeiano A,Giannini V,Gaetani M,Vita F,Guglielminetti L,Bonari E,Volterrani M.Response of warm-season grasses to N fertilization and salinity. Scientia Horticulturae,2014,177:92-98.
[14] Nathawat N S,Kuhad M S,Goswami C L,Patel A L,Kumar R.Interactive effect of N source on salinity on growth indices and ion content of Indian mustard.Journal of Plant Nutrition,2007,30:569-598.
[15] Ali A,Tucker T C,Thompson T L, Salim M.Effects of salinity and mixed ammonium and nitrate nutrition on the growth and nitrogen utilization of barley.Journal of Agronomy and Crop Science,2001,186:223-228.
[16] 杨瑛,马梅,郑青松,刘兆普,郭世伟.不同供氮形态下油菜幼苗对盐胁迫的响应.植物营养与肥料学报,2012,18(5):1220-1227. Yang Y,Ma M,Zheng Q S,Liu Z P,Guo S W.Response of canola seedlings to salt stress under different nitrogen forms.Plant Nutrition and Fertilizer Science,2012,18(5):1220-1227.(in Chinese)
[17] 许楠,张会慧,朱文旭,李鑫,岳冰冰,金微微,王良再,孙广玉.氮素形态对饲料桑树幼苗生长和光合特性的影响.草业科学,2012,29(10):1568-1572. Xu N,Zhang H H,Zhu W X,Li X,Yue B B,Jin W W,Wang L Z,Sun G Y.Effects of nitrogen from on seedling growth and its photosynthetic characteristics of forage mulberry.Pratacultural Science,2012,29(10):1568-1572.(in Chinese)
[18] 逄好胜,张会慧,敖红,田野,孙广玉.硝态氮对Na2CO3胁迫下桑树幼苗生长和光合特性的影响.草业科学,2014,31(8):1515-1522. Pang H S,Zhang H H,Ao H,Tian Y,Sun G Y.Effects of NO3-N on growth and photosynthetic characteristics of mulberryseedlings under Na2CO3stress.Pratacultural Science,2014,31(8):1515-1522.(in Chinese)
[19] 胡举伟,张会慧,张秀丽,逄好胜,孙广玉.高丹草叶片PSⅡ光化学活性的抗旱优势.草业科学,2015,32(3):392-399. Hu J W,Zhang H H,Zhang X L,Pang H S,Sun G Y.The heterosis of photosystem Ⅱfunctions inSorghumbicolor×S.sudanenseseedlings under drought stress.Pratacultural Science,2015,32(3):392-399.(in Chinese)
[20] Strasser R J,Srivastava A,Govindjee.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria.Photochemistry and Photobiology,1995,61(1):32-42.
[21] Lewis O A M,Leidi E O,Lips S H.Effect of nitrogen source on growth response to salinity stress in maize and wheat.New Phytologist,1989,111(2):155-160.
[22] 张会慧,张秀丽,胡彦波,许楠,李鑫,孙广玉.中碱钠盐胁迫对桑树幼苗生长及光合特性的影响.南京林业大学学报:自然科学版,2013,37(1):217-222. Zhang H H,Zhang X L,Hu Y B,Xu N,Li X,Sun G Y.Effects of NaCl and Na2CO3stresses on growth and photosynthetic characteristics characteristics of mulberry seedlings.Journal of Nanjing Forestry University:Natural Science Edition,2013,37(1):217-222.(in Chinese)
[23] 张会慧,张秀丽,王娟,田野,李鑫,胡举伟,孙广玉.利用快相叶绿素荧光参数综合评价3种丁香的耐盐性.南京林业大学学报:自然科学版,2013,37(5):13-19. Zhang H H,Zhang X L,Wang J,Tian Y,Li X,Hu J W,Sun G Y.A comprehensive evaluation of salt resistance in three clove varieties by the fast fluorescence transient parameters. Journal of Nanjing Forestry University:Natural Sciences Edition,2013,37(5):13-19.(in Chinese)
[24] 张会慧,张秀丽,许楠,李鑫,孙广玉.盐胁迫下桑树叶片D1蛋白周转和叶黄素循环对PSⅡ的影响.林业科学,2013,49(1):99-106. Zhang H H,Zhang X L,Xu N,Li X,Sun G Y.Role of D1 protein turnover and xanthophylls cycle in protecting of photosystem Ⅱ functions in leaves ofMorusalbaunder NaCl stress.Scientia Silvae Sinicae,2013,49(1):99-106.(in Chinese)
[25] Li P M,Cheng L L,Gao H Y,Jiang C D,Peng T.Heterogeneous behavior of PSⅡ in soybean (Glycinemax) leaves with identical PSⅡ photochemistry efficiency under different high temperature treatments.Journal of Plant Physiology,2009,166:1607-1615.
[26] 张子山,李耕,高辉远,刘鹏,杨程,孟祥龙,孟庆伟.玉米持绿与早衰品种叶片衰老过程中光化学活性的变化.作物学报,2013,39(1):93-100. Zhang Z S,Li G,Gao H Y,Liu P,Yang C,Meng X L,Meng Q W.Changes of photochemistry activity during senescence of leaves in stay green and quick-leaf-senescence inbred lines of maize.Acta Agronomica Sinica,2013,39(1):93-100.(in Chinese)
[27] 李鹏民,高辉远,Strasser R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用.植物生理与分子生物学学报,2005,31(6):559-566. Li P M,Gao H Y,Strasser R J.Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study.Journal of Plant Physiology and Molecular Biology,2005,31(6):559-566.(in Chinese)
[28] Strasser B J.Donor side capacity of photosystem Ⅱ probed by chlorophyll a fluorescence transients. Photosynthesis Research,1997,52(2):147-155.
[29] 张会慧,田褀,刘关君,胡彦波,吴翔宇,田野,李鑫,孙广玉.转2-CysPrx基因烟草抗氧化酶和PSⅡ电子传递对盐和光胁迫响应.作物学报,2013,39(11):2023-2029. Zhang H H,Tian Q,Liu G J,Hu Y B,Wu X Y,Tian Y,Li X,Sun G Y.Responses of antioxidant enzyme and PSⅡ electron transport in leaf of transgenic tobacco carrying 2-cysprxto salt and light stresses.Acta Agronomica Sinica,2013,39(11):2023-2029.(in Chinese)
[30] Reddy A R,Chaitanya K V,Vivekanandan M.Drought induced responses of photosynthesis and antioxidant metabolism in higher plants.Journal of Plant Physiology,2004,161(11):1189-1202.
[31] 马飞,徐婷婷,陈立同,张晓玮,赵发明.低温胁迫下二倍体杂交种高山松光系统Ⅱ功能稳定性研究.西北植物学报,2011,31(6):1174-1179. Ma F,Xu T T,Chen L T,Zhang X W,Zhao F M.Functional stability of photosystemⅡ in the diploid hybrid species(Pinusdensata)under low temperature stress.Acta Botanica Boreali-Occidentalia Sinica,2011,31(6):1174-1179.(in Chinese)
[32] 李耕,高辉远,赵斌,董树亭,张吉旺,杨吉顺,王敬锋,刘鹏.灌浆期干旱胁迫对玉米叶片关系统活性的影响.作物学报,2009,35(10):1916-1922. Li G,Gao H Y,Zhao B,Dong S T,Zhang J W,Yang J S,Wang J F,Liu P.Effects of drought stress on activity of photosystems in leaves of maize at grain filling stage.Acta Agronomica Sinica,2009,35(10):1916-1922.(in Chinese)
(责任编辑 张瑾)
Effects of increased NO3--N application on PSⅡ function in leaves ofMorusalbaseedlings under Na2CO3stress
Xu Nan1,2, Zhang Hui-hui3, Gu Si-yu3, Li Xin3,Zhu Yu-wei3, Yang Yan3, Liu Kun3, Zhang Xiu-li1
(1.College of Life Science, Northeast Forest University, Harbin 150040;2.Natural Resources and Ecology Institute, Heilongjiang Sciences Academy, Harbin 150040;3.College of resources and environment, Northeast Agricultural University, Harbin 150030)
In this study, we analysed the effects of increased nitrate (NO3--N) (from 7.5 mmol·L-1to 17.5 mmol·L-1) on the growth and photosynthetic characteristics of mulberry seedlings, which were subjected to alkaline salt (50 mmol·L-1Na2CO3) stress using hydroponic methods. The results showed that plants displayed obvious symptoms of injury when subjected to 50 mmol·L-1Na2CO3stress. Furthermore, compared with the control, the photochemical reaction centre activity of PSⅡ in stressed seedlings was significantly decreased, and electron transport was affected to different degrees on both the donor side and receptor side of PS Ⅱ. Under Na2CO3stress, increasing NO3--N promoted photosynthetic electron supply and transmission capacity, enhanced the function of the oxygen complex in the electron donor of PS Ⅱ, and increased the acceptor electron capacity of the receptor library. In addition, increasing NO3--N also improved the stability of leaf thylakoid membrane structure, promoted the distribution of more light energy to the photochemical reaction centre, and decreased the proportion of energy in the form waste heat dissipation. In conclusion, increasing NO3--N enhanced the function of PS Ⅱ under 50 mmol·L-1Na2CO3stress, which ensured the normal operation of photosynthesis.
mulberry; NO3--N; Na2CO3stress; PS Ⅱ;OJIP; electron transport; non-photochemical quenching
Zhang Hui-hui E-mail:xtwfwf@126.com Zhang Xiu-li E-mail:xlz619@yeal.net
10.11829/j.issn.1001-0629.2016-0249
2016-05-10 接受日期:2016-07-05
国家自然科学基金(31500323)
许楠(1982-),男,黑龙江哈尔滨人,助理研究员,博士,主要从事植物生理生态学研究。E-mail:xunan0451@126.com
张会慧(1986-),男,内蒙古赤峰人,讲师,博士,主要从事土壤学和植物营养生理学研究。E-mail:xtwfwf@126.com 张秀丽(1980-),女,吉林舒兰人,讲师,博士,主要研究方向为植物生理的分子生物学研究。E-mail:xlz619@yeah.net
S888.2;Q945.78
A
1001-0629(2017)1-0067-08*
许楠,张会慧,谷思玉,李鑫,朱玉伟,杨艳,刘昆,张秀丽.增施硝态氮对Na2CO3胁迫下桑树幼苗叶片PSⅡ功能的影响.草业科学,2017,34(1):67-74.
Xu N,Zhang H H,Gu S Y,Li X,Zhu Y W,Yang Y,Liu K,Zhang X L.Effects of increased NO3--N application on PSⅡ function in leaves ofMorusalbaseedlings under Na2CO3stress.Pratacultural Science,2017,34(1):67-74.
