绝经后子宫内膜样腺癌患者临床病理因素与复发的关系研究
2017-03-02刘聪慧夏凤艳
赵 倩,刘聪慧,夏凤艳
(华北理工大学附属医院 妇产科,河北 唐山 063000)
论 著
绝经后子宫内膜样腺癌患者临床病理因素与复发的关系研究
赵 倩,刘聪慧,夏凤艳
(华北理工大学附属医院 妇产科,河北 唐山 063000)
目的 探讨绝经后子宫内膜样腺癌患者临床病理因素与复发的相关性。方法 收集术后病理证实为子宫内膜样腺癌的201例绝经后患者的临床病理资料和随访情况。χ2检验或Fisher精确检验和logistic回归分析患者复发与组织学分级、侵肌深度、淋巴结受累、宫颈间质受累及淋巴血管间隙浸润(LVSI)的关系。结果 单因素分析显示子宫内膜样腺癌患者侵肌深度、淋巴结受累及淋巴血管间隙浸润在复发组与未复发组间差异有显著性意义(P<0.05);Logistic回归分析显示侵肌深度和淋巴结受累与复发相关(P<0.05)。结论 绝经后子宫内膜样腺癌患者,病理资料示侵肌深度≥1/2及有淋巴结受累,将增加患者复发风险。
子宫内膜样腺癌;绝经;复发
子宫内膜癌是妇女生殖道三大恶性肿瘤之一,约80%患者病理类型为子宫内膜样腺癌[1],从生育年龄到绝经后妇女都可发病,好发年龄60~70岁,主要发生于绝经后妇女,占76% 左右[2],约5%为<40岁女性[3]。在过去30年中,根据子宫内膜癌发病机制可将其分为两大类,即I型和II型子宫内膜癌[4]。
子宫内膜样腺癌属于I型子宫内膜癌,为雌激素依赖型,预后较好,5年总生存率85%[2]。绝经后妇女雌激素水平较低,但是仍有部分绝经后子宫内膜样腺癌预后较差。目前有多种方法预测子宫内膜样腺癌患者预后或复发,但对于影响绝经后子宫内膜样腺癌患者复发的因素则少有报道。本文旨在探讨绝经后子宫内膜样腺癌患者临床病理因素与复发的相关性。
1 资料与方法
1.1 一般临床资料
本研究纳入华北理工大学附属医院2000年1月至2011年8月收治的绝经后子宫内膜样腺癌患者共201例。纳入标准:(1)术后病理诊断为子宫内膜样腺癌;(2)已绝经;(3)未合并其它器官肿瘤;(4)术前未行放化疗。排除标准:(1)其它类型子宫内膜癌;(2)绝经前子宫内膜癌;(3)合并其它器官肿瘤;(4)术前已行放化疗患者;(5)临床资料不完整或治疗后失访者。
1.2 研究方法
记录201例符合纳入标准的绝经后子宫内膜样腺癌患者的临床资料和病理结果。评估的因素包括侵肌深度(深肌层受侵的标准为子宫肌壁外1/2受侵)、淋巴结受累、淋巴血管间隙浸润(LVSI)、宫颈间质受累、组织学分级(根据国际标准分为G1、G2和G3)。所有患者通过电话、定期门诊复诊等形式获得术后及肿瘤复发情况,均随访5年。按是否复发分为复发组及未复发组,分析子宫内膜样腺癌患者复发的危险因素。
1.3 统计学方法
2 结 果
2.1 临床及病理特征
201例患者年龄40~89岁,平均58岁,体重指数(BMI)≥24 kg/m2占67.7%。42.3%的患者合并高血压,16.9%合并糖尿病,21.4%合并家族肿瘤史,5.5%的患者未生育。
FIGO分期I期、II期及III期患者所占比例分别为78.1%、10.4%及11.4%,未包括IV期子宫内膜样腺癌患者,组织学分级高分化患者占36.8%,中分化占51.7%,低分化占11.4%,侵肌深度≥1/2者占31.8%,有5.0%患者淋巴结受累,10.4%患者淋巴血管间隙浸润,10.9%患者宫颈间质受累,5年内复发患者占8.0%。见表1。
表1 绝经后子宫内膜样腺癌201例患者临床病理特征
Tab 1 Clinical pathological features of 201 cases with endometrioid endometrial cancer after menopause
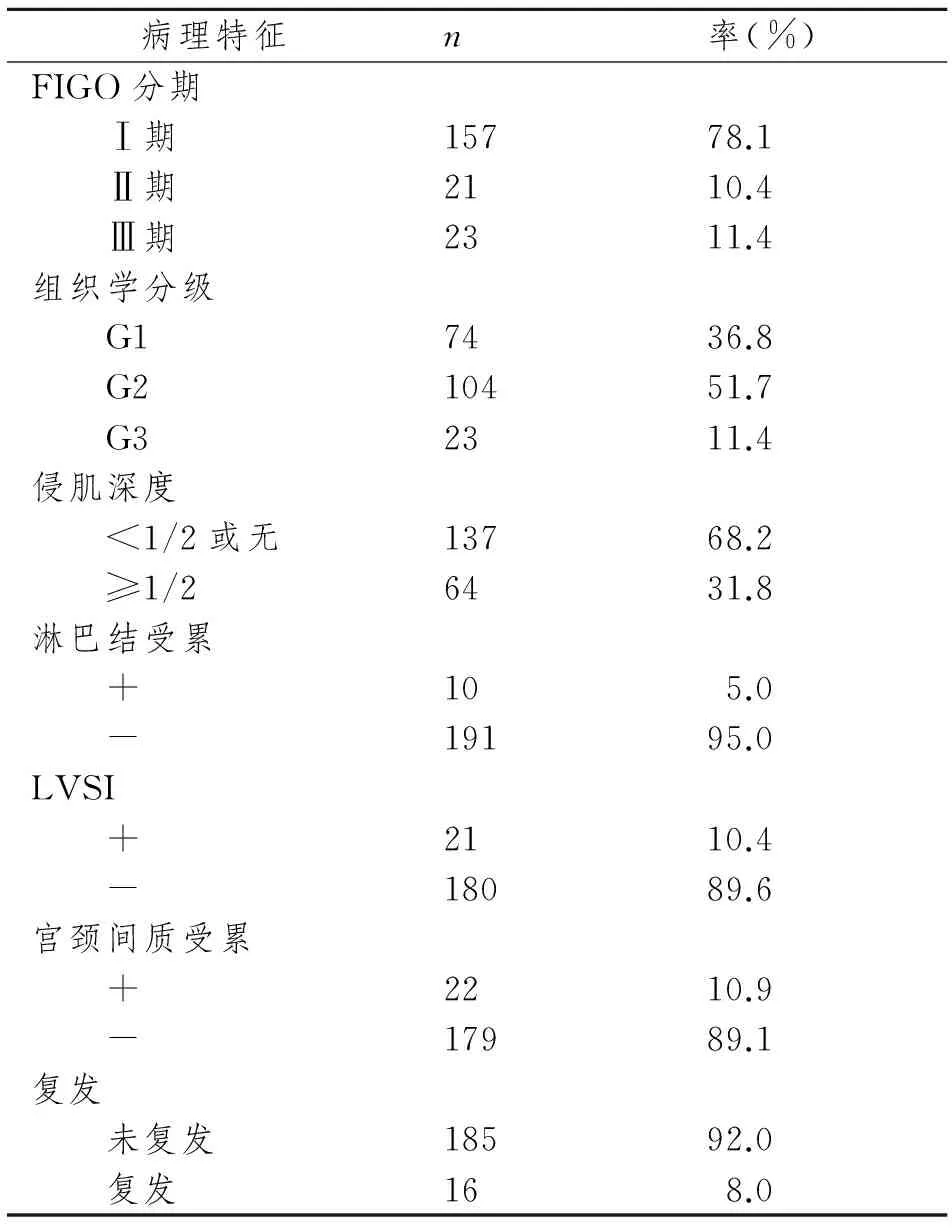
病理特征n率(%)FIGO分期 Ⅰ期15778.1 Ⅱ期2110.4 Ⅲ期2311.4组织学分级 G17436.8 G210451.7 G32311.4侵肌深度 <1/2或无13768.2 ≥1/26431.8淋巴结受累 +105.0 -19195.0LVSI +2110.4 -18089.6宫颈间质受累 +2210.9 -17989.1复发 未复发18592.0 复发168.0
2.2 单因素分析
201例绝经后子宫内膜样腺癌患者,随访5年,复发率8.0%。经单因素分析,侵肌深度、淋巴结受累及LVSI与绝经后子宫内膜样腺癌患者复发有关(P<0.05);而组织学分级程度及宫颈间质受累与复发无关(P>0.05)。见表2。
表2 影响子宫内膜样腺癌患者复发危险因素的单因素分析
Tab 2 The risk factors of recurrence among women with endometrioid EC using the univariate analysis
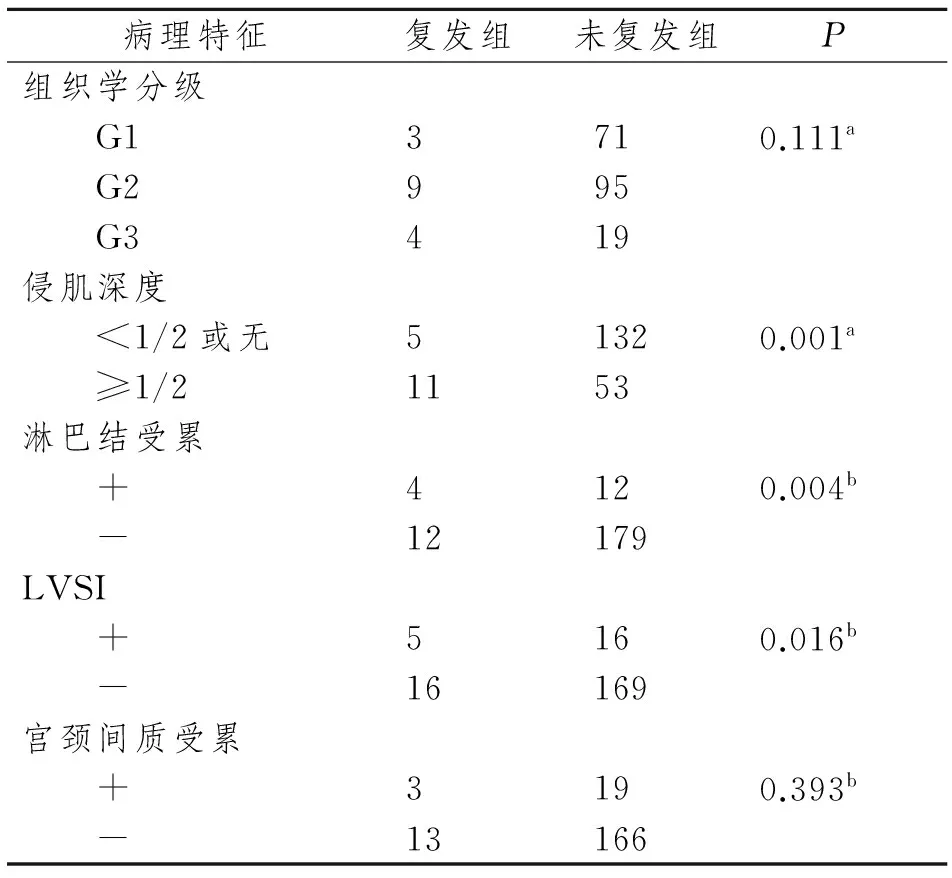
病理特征复发组 未复发组 P 组织学分级 G13710.111a G2995 G3419侵肌深度 <1/2或无51320.001a ≥1/21153淋巴结受累 +4120.004b -12179LVSI +5160.016b -16169宫颈间质受累 +3190.393b -13166
a: χ2检验; b:Fisher精确检验
2.3 多因素分析
经多因素分析,侵肌深度及淋巴结受累与绝经后子宫内膜样腺癌患者复发有关。侵肌深度≥1/2(OR=3.926;95%CI 1.184-13.023)及有淋巴结受累(OR=6.786;95%CI 1.309-35.184)会增加患者复发风险。见表3。
表3 影响子宫内膜样腺癌患者复发的危险因素的多因素分析
Tab 3 The risk factors of recurrence among women with endometrioid EC using Logistic regression analysis

POR95%CI上限下限组织学分级G20.9111.0890.2474.796组织学分级G30.6831.4670.2379.004侵肌深度0.0253.9261.18413.023淋巴结受累0.0236.7861.30935.184LVSI0.0643.3730.93212.210宫颈间质受累0.9541.0490.2085.279
3 讨 论
子宫内膜样腺癌属于I型子宫内膜癌,为雌激素依赖型,尽管相比于其他妇科恶性肿瘤(比如卵巢癌),子宫内膜样腺癌预后较好,但仍有少数患者预后较差。目前,对于现有的子宫内膜样腺癌患者的治疗仍有争议,争议的焦点在于:(1)如何避免因治疗不彻底导致复发风险的增加;(2)如何防止因过度治疗导致意外或并发症[5-6]。所以,预测子宫内膜癌的预后或复发对于临床治疗方案的选择很有意义。
目前,对于绝经后子宫内膜样腺癌患者的复发报道较少,但有多种预测子宫内膜样腺癌预后或复发的方法,其中有两种方法被广泛接受[7-8],第一种包含5个诊断标准:诊断时年龄、有无淋巴结转移、FIGO分期、组织学分级和组织学类型;第二种包含3个诊断标准:年龄、肿瘤分级和淋巴血管间隙浸润程度。此外,子宫内膜癌的瘤内微血管密度高于正常子宫内膜和良性子宫内膜改变时的微血管密度,这个特点也被认为是预测患者预后的标准[9]。还有一些研究显示,新型的生物标志物(如干细胞相关的核转录因子)也能帮助诊断子宫内膜样腺癌的复发情况[10]。子宫内膜样腺癌可以呈现多种组织学表现(有普通型、伴鳞状分化型、绒毛腺型、分泌性及绒毛细胞型)[11-12],虽然各种分型预后不同,但临床诊断时并未区分,所以不同分型的子宫内膜腺癌对患者复发的影响不太清楚。有研究显示,早期低分化的子宫内膜样腺癌与非子宫内膜样腺癌中5年内复发率无差别[13-16],也就是说早期低分化子宫内膜样腺癌的复发率也较高,但在本研究中,绝经后子宫内膜样腺癌患者的组织学分级程度对于复发无影响。
当怀疑复发时,完整的再分期诊断至少应包括腹部CT及盆腔CT。如无CT诊断,可使用MRI(最好使用造影剂)进行诊断。PET/CT在诊断子宫内膜癌复发中亦有广泛应用,在许多回顾性研究中,显示PET/CT扫描在检测淋巴结复发方面具有高度敏感性[17-19];最近1项meta分析显示,FDG-PET在检测子宫内膜癌复发上有95.8%敏感性及92.5%特异性[19]。此外,活检病理诊断是确定子宫内膜癌复发金标准。普遍认为I型子宫内膜癌的发生可能是在无孕激素拮抗的雌激素长期作用下,发生子宫内膜增生症(单纯型或复杂型,伴或不伴不典型增生),继而癌变。但是,目前并没有研究显示雌激素会影响子宫内膜癌的复发。故本研究未统计各患者的雌激素及雌激素受体水平。
在本研究中,绝经后子宫内膜样腺癌患者的复发率为7.9%,低于之前在其他研究中报道的子宫内膜癌复发率10%~18%[20]。虽然子宫内膜样腺癌复发率较低,但仍需重视,尽量做到早发现早诊断早治疗,对于侵肌深度≥1/2及存在淋巴结受累的患者,做到严格定期复查或必要时给予辅助治疗。
[1] Felix AS, Weissfeld JL, Stone RA, et al.Factors associated with Type I and Type II endometrial cancer[J]. CCC,2010,21(11):1851-1856.
[2] MoriceP, LearyA, CreutzbergC, et al.Endometrial cancer[J].The Lancet,2016,387(10023):1094-1108.
[3] Lee TS,Jung JY, Kim JW, et al.Feasibility of ovarian preservation in patients with early stage endometrial carcinoma[J].Gynecol Oncol,2007,104(1):52-57.
[4] Bokhman JV.Two pathogenetic types of endometrial carcinoma[J].Gynecol Oncol, 1983,15(1):10-17.
[5] Press JZ, Gotlieb WH. Controversies in the treatment of early stage endometrial carcinoma[J]. Obstet Gynecol Int, 2012, 2012:578490.
[6] Hsiao SM, Wei LH. Controversies in the adjuvant therapy of endometrial cancer[J]. ISRN Obstet Gynecol, 2011, 2011:724649.
[7] Abu-Rustum NR, Zhou Q, Gomez JD, et al. A nomogram for predicting overall survival of women with endometrial cancer following primary therapy: toward improving individualized cancer care[J]. Gynecol Oncol, 2010,116(3):399-403.
[8] Creutzberg CL, van Stiphout RG, Nout RA, et al. Nomograms for prediction of outcome with or without adjuvant radiation therapy for patients with endometrial cancer: a pooled analysis ofPORTEC-1 and PORTEC-2 trials[J]. Int J Radiat Oncol Biol Phys,2015,91(3):530-539.
[9] Czekierdowski A, Czekierdowska S, Czuba B, et al. Microvessel density assessment in benign and malignant endometrial changes[J]. J Physiol Pharmacol, 2008,59 (Suppl.4):45-51.
[10] Pitynski K, Banas T, Pietrus M, et al. SOX-2, but not Oct4, is highly expressed in early-stage endometrial adenocarcinoma and is related to tumour grading[J]. Int J Clin Exp Pathol,2015,8(7): 8189-8198.
[11] Anais Malpica. How to approach the many faces of endometrioid carcinoma[J]. Modern Pathology, 2016, 29(Suppl 1):S29-S44.
[12] Clement PH, Young RH. Endometrioid carcinoma of the uterine corpus: a review of its pathology with emphasis on recent advances and problematic aspects[J]. Adv Anat Pathol, 2002, 9(3):145-184.
[13] Reynaers EA, Ezendam NP, Pijnenborg JM. Comparable outcome between endometrioid and non-endometrioid tumors in patients with early-stage high-grade endometrial cancer[J].J Surg Oncol, 2015, 111(6):790-794.
[14] Creasman WT, Kohler MF, Odicino F, et al. Prognosis of papillaryserous, clear cell, and grade 3 stage I carcinoma of theendometrium[J].Gynecol Oncol, 2004, 95(3):593-596.
[15] Ayeni TA, Bakkum-Gamez JN, Mariani A, et al. Comparativeoutcomes assessment of uterine grade 3 endometrioid, serous, andclear cell carcinomas[J].Gynecol Oncol, 2013, 129(3):478-485.
[16] Cirisano FD Jr, Robboy SJ, Dodge RK, et al. The outcome ofstage I-II clinically and surgically staged papillary serous and clearcell endometrial cancers when compared with endometrioidcarcinoma[J]. Gynecol Oncol, 2000, 77(1):55-65.
[17] Kitajima K, Murakami K, Yamasaki E, et al. Performance of FDG-PET/CT in the diagnosis of recurrent endometrial cancer[J].Ann Nucl Med, 2008, 22(2):103-109.
[18] Sharma P, Kumar R, Singh H, et al. Carcinoma endometrium: role of 18-FDG PET/CT for detection of suspected recurrence[J]. Clin Nucl Med, 2012, 37(7):649-655.
[19] Kadkhodayan S, Shahriari S, Treglia G, et al. Accuracy of 18-FFDG PET imaging in the follow up of endometrial cancer patients: systematic review and meta-analysis of the literature[J]. GynecolOncol, 2013, 128(2):397-404.
[20] Tejerizo-García A,lvarez-Conejo C, Muoz-Hernando L, et al.Tumor recurrence and tumor-related mortality in endometrial cancer:Analysis in 276 patients[J]. Indian J Cancer, 2015, 52(4):682-684.
Association between recurrence and clinical pathological features among women with endometrioid endometrial cancer after menopause
ZHAO Qian, LIU Conghui, XIA Fengyan
(DepartmentofObstetricsandGynecology,NorthChinaUniversityofScienceandTechnologyAffiliatedHospital,Tangshan063000,China)
Objective To investigate the association between recurrence and clinical pathological features among women with endometrioid endometrial cancer after menopause.Methods Data from postmenopausal patients with endometrioid endometrial cancer were retrospectively analyzed. Associations between recurrence and tumor grade, myometrial invasion, lymph node status, lymphovascular space invasion(LVSI), cervical-stromal invasion were assessed by student t tests, chi-squaretests, fisher exact text and logistic regression analysis.Results In the univariate analysis, myometrial invasion, lymph node involvement and LVSI were significantly different betweenpatients with recurrence and without recurrence(P<0.05). Logistic regression analysis showed that deep myometrial invasion and lymph node involvement had an independent association with recurrence (P<0.05).Conclusion Inpatients with endometrioid endometrial cancer after menopause,the risk of recurrence would increase if the patients have myometrial invasion ≥50% and positive lymph node involvement.
endometrioid endometrial cancer; postmenopause; recurrence
赵 倩(1990-),女,硕士研究生。E-mail:zhaoq128@163.com
夏凤艳,教授。E-mail:xiafengyan1@163.com
10.11724/jdmu.2017.01.16
R711.74
A
1671-7295(2017)01-0070-04
赵倩,刘聪慧,夏凤艳.绝经后子宫内膜样腺癌患者临床病理因素与复发的关系研究[J].大连医科大学学报,2017,39(1):70-73.
2016-10-31;
2017-01-03)
