茶树对可溶性有机和无机态氮的吸收与运转特性
2017-03-02周碧青陈成榕杨文浩张黎明邢世和
周碧青,陈成榕,杨文浩,张黎明,邢世和*
(1 福建农林大学资源与环境学院/福建省土壤环境健康与调控重点实验室,福建福州 350002;2 School of Environment, Griffith University, Queensland Brisbane, QLD 4111)
茶树对可溶性有机和无机态氮的吸收与运转特性
周碧青1,陈成榕2,杨文浩1,张黎明1,邢世和1*
(1 福建农林大学资源与环境学院/福建省土壤环境健康与调控重点实验室,福建福州 350002;2 School of Environment, Griffith University, Queensland Brisbane, QLD 4111)
【目的】揭示亚热带茶树能否直接吸收利用分子态可溶性有机氮,探讨茶树吸收可溶性有机和无机氮后的运转特性差异。 【方法】采用13C、15N 双标记甘氨酸、15N 标记硫酸铵和15N 标记硝酸钾为同位素示踪剂,采用茶树 (黄金桂) 幼苗为试验材料进行同位素示踪盆栽试验,用同位素质谱仪测定茶树植株地上和地下部的13C、15N 丰度。 【结果】供试土壤施用13C、15N 双标记甘氨酸态有机氮后,2 h 和 6 h 茶苗地下部和整株中的13C 增量/15N 增量比值均接近于 1∶1 的理论值;2 h 和 6 h 茶苗地上部未检出13C 增量,而 72 h 地上部13C 增量达 0.284 μmol/(g, DW);施用铵态氮 2 h、6 h 和 72 h 茶苗地下部、地上部和整株中的15N 增量均极显著高于施用硝态氮和甘氨酸态有机氮;施用铵态氮 6 h 茶苗地上部15N 增量/地下部15N 增量比率分别比硝态氮和甘氨酸态有机氮的比率高 34.7% 和 65.0%,72 h 茶苗地上部15N 增量/地下15N 增量比率分别比硝态氮和甘氨酸态有机氮的比率高 88.6% 和 133.0%,差异均达极显著水平。 【结论】黄金桂茶苗具有从土壤中直接吸收利用甘氨酸分子态有机氮的能力,但吸收量不及铵态氮和硝态氮;吸收的可溶性分子态有机氮可以从茶树根系运转至地上部;不同形态氮素在茶树植株体内的迁移能力高低表现为:铵态氮 > 硝态氮 > 甘氨酸态氮,该研究结果进一步证明陆地生态系统植物直接吸收利用可溶性有机氮是普遍存在的现象。
同位素双标记示踪法;茶树;13C、15N 标记甘氨酸;吸收;运转
高山苔原、亚北极等特殊生境的植物具有从土壤中直接获取小分子有机氮 (如氨基酸) 的能力[1–2]。早期植物吸收有机氮研究主要采用土壤灭菌处理、15N 单标记氨基酸示踪法[3–5],但无菌条件忽略了土壤微生物分解作用及植物根系生境的完整性,而直接采用15N 单标记氨基酸示踪法可能因土壤微生物对氨基酸的快速分解而无法辨识植物吸收的15N 是直接源于有机氮还是其分解后的无机氮[6],致使获得的结果与实际情况相差甚远甚至相悖,13C 和15N 双标记氨基酸示踪法则可以排除15N 单标记氨基酸示踪法存在的有机氮可能矿化为无机氮才被植物吸收的可能性。国内外现有的自然界植物能否直接吸收利用有机氮的研究主要集中于北极莎草和高山苔原[1–2,8]、北方森林和高山草甸[7,9–10]、温带森林和草被[11–13]、漠境灌丛[14]、亚热带森林[15,16]以及萝卜、西红柿、小麦和白菜等农作物[17–20],而对亚热带茶树能否直接吸收利用有机氮则未见研究报道,人们至今对茶树直接吸收利用有机氮能力的大小以及吸收的有机氮在茶树体内的运转特性等知之甚少。为此,本研究采用 2-13C-15N 双标记甘氨酸、15N 标记硫酸铵和15N 标记硝酸钾为同位素示踪剂,通过茶树同位素盆栽示踪试验,研究施用不同形态氮素处理 (无机氮、有机氮)和不同施用时间下亚热带茶树对有机氮的直接吸收能力以及吸收的有机氮和无机氮在茶树植株内运转特性的差异,旨在揭示亚热带茶树是否具有直接吸收和运转有机氮的能力,为阐明土壤可溶性有机氮的生态功能提供科学依据。
1 材料与方法
1.1 供试材料
供试茶树为一年生的黄金桂 [C. Sinensis (L.) O. Kuntze cv. Huangjingui] 幼苗,由福建农科院茶叶研究所提供;供试土壤为发育于花岗岩坡残积物的酸性岩红壤,质地为中壤土,pH 值为 5.8,有机质含量为 12.4 g/kg,CEC 为 8.9 cmol/kg,全氮、磷、钾含量分别为 1.00 g/kg、0.98 g/kg 和 23.60 g/kg,碱解氮、有效磷和速效钾含量分别为 58 mg/kg、35 mg/kg和 23 mg/kg。在分别装有 200 g 供试土壤的 50 个小塑料盆中各移栽 1 株大小相对一致的黄金桂茶苗,采用常规盆栽方法在普通温室中栽培 1 个月备用。
1.2 研究方法
1.2.1 试验设计 同位素标记甘氨酸是国外学者在研究植物能否直接吸收利用可溶性有机氮时普遍采用的示踪剂,由于采用 2-13C-15N-甘氨酸具有以下优点:1) 可以保证等量的13C 和15N 加入到土壤中,以避免采用 U-13C2,15N-甘氨酸 (即普通标记甘氨酸) 导致大量13C 吸收被检出[12];2) 非羧基碳标记可以防止采用 1-13C,15N-甘氨酸 (即羧基碳标记甘氨酸) 和 U-13C2,15N-甘氨酸试验中存在的植物吸收的13C/15N 比率快速下降现象[7,12],故本研究也采用 2-13C-15N-甘氨酸为有机氮同位素示踪剂。参考 Näsholm 等[19]和 Wei等[16]的同位素示踪方法,试验设 2-13C-15N-甘氨酸 (有机氮)、15N-硫酸铵 (15NH4+-N)、15N-硝酸钾 (15NO3--N)和对照 (蒸馏水) 4 种处理,每种处理 3 个重复,采用完全随机排列。根据供试土壤冷水提取测定 (室温)的可溶性有机氮含量范围[21],按每克干土施 N 10 μg、每盆注射 21 mL 的用量,分别配制 2-13C,15N-甘氨酸、15N-硫酸铵和15N-硝酸钾同位素示踪液。从预先准备的盆栽茶苗中选择 36 株长势好且相对一致的茶树幼苗,采用不锈钢注射针分别将 21 mL 不同处理的同位素示踪液 (或蒸馏水) 围绕茶苗周围距茎干3 cm 处注入三个等间隔点 (每点注入 7 mL,深度为1~5 cm) 土壤中,使同位素示踪液均匀分布于供试茶苗的根区土壤中,将注射溶液后的茶苗置于常温普通温室中分别培养 2 h、6 h 和 72 h,到规定培养时间切除茶苗并收集每一茶苗地上和地下部,地下部根系先用流动的蒸馏水彻底洗净粘附的土壤,然后用 0.5 mmol/L CaCl2溶液冲洗根系 4 次 (合计冲洗时间约 15 min) 以彻底除去可能粘附于根系表面的同位素示踪液,最后用蒸馏水洗去粘附于根系表面的CaCl2。将采集的茶苗样品在 90℃ 温度下杀青 0.5 h后,继续在 50~60℃ 温度下烘干,最后利用微型植物样品粉碎机将烘干的茶苗样品研磨成粉末 (研磨时务必避免不同处理之间同位素的交叉污染),采用同位素质谱仪+元素分析仪分别测定不同处理茶苗地下和地上部样品中的全 C、N 量以及13C 和15N 丰度。
1.2.2 数据分析统计 茶苗样品中来源于标记同位素的15N 和13C 增量分别采用下式计算[16,22]:
XC=[(CT[%]/12)×(13CTatom%–13CCatom%)×f]×106
XN=[(NT[%]/14)×(15NTatom%–15CCatom%)×f]×106
式中,XC、XN分别表示每克干茶苗样品中13C、15N的增量 (μmol/g, DW);CT、NT分别表示茶苗样品中全 C、N 含量;13CTatom%、15NTatom% 分别表示施用氮标记同位素处理茶苗样品中13C、15N 丰度;13CCatom%、15NCatom% 分别表示对照处理茶苗样品中13C、15N 丰度;f 表示同位素示踪剂的富集系数 (或富集因子),其中同位素双标记甘氨酸的13C 富集系数为 100%/99%,15N 富集系数为 100%/98%;同位素单标记硫酸铵的 NH4+富集系数为 100%/10.65%;同位素单标记硝酸钾的 NO3–富集系数为 100%/ 10.30%。
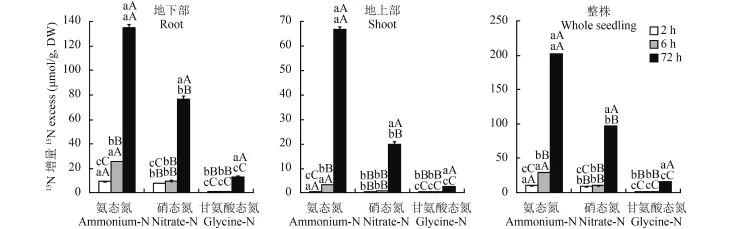
图1 不同氮同位素处理后不同时间茶苗地下部、地上部和整株15N 增量Fig.1 15N excesses in tea roots , shoots and whole seedlings at different times after various N isotope applications
借助数据统计软件 (DPS v14.50) 进行实验数据的统计分析,采用方差分析和 LSD 检验分析茶树对不同形态可溶性氮吸收和迁移的差异显著性,采用 t检验分析同位素双标记甘氨酸处理茶树中13C/15N 比率与理论比率 (1∶1) 的差异显著性。
2 结果分析
2.1 施用同位素标记氮素后茶苗中15N 增量随时间变化
比较图 1 相同同位素标记氮处理、不同施用时间茶苗植株间15N 增量差异 (上层字母) 可见,施用同位素标记的三种不同形态氮素后,茶苗地上部、地下部和整株检出的15N 增量均随施用时间延长而增加。施用铵态氮后 6 h 和 72 h 茶苗地下部15N 增量分别是 2 h 的 2.82 倍和 14.85 倍,施用硝态氮的15N 增量分别是 2 h 的 1.15 倍和 9.60 倍,施用两种无机态氮三个时段间茶苗地下部15N 增量差异均达极显著水平;施用甘氨酸态有机氮后 72 h 茶苗地下部15N 增量分别是 2 h 和 6 h 的 15.59 倍和 9.94 倍,差异达到极显著水平,但 2 h 与 6 h 间的15N 增量差异未达显著水平。施用铵态氮后 6 h、72 h 茶苗地上部的15N增量分别是 2 h 的 5.21 倍、102.75 倍,三个时段间的15N 增量均呈极显著差异;而施用硝态氮和甘氨酸态有机氮后 72 h 茶苗地上部的15N 增量均极显著高于 2 h、6 h,其中施用硝态氮 72 h 后的15N 增量分别是 2 h、6 h 的 40.09 倍、22.13 倍,施用甘氨酸态有机氮的15N 增量分别是 2 h、6 h 的 65.20 倍、26.47倍,但 2 h、6 h 处理间茶苗地上部的15N 增量差异均未达显著水平。施用三种不同形态氮素后茶苗整株 2 h、6 h、72 h 间的15N 增量变化及其差异均表现出与茶苗地上部相似的规律。
2.2 不同形态同位素标记氮对茶苗15N 增量的影响
比较图 1 中相同施用时间、不同形态同位素标记氮的茶苗植株间15N 增量差异 (下层字母) 可见,施用三种形态同位素标记氮素后,茶苗地上部、地下部和整株 2 h、6 h 和 72 h 的15N 增量也均表现为铵态氮 > 硝态氮 > 甘氨酸态有机氮,在同一施用时间茶苗地上部、地下部和整株的三种形态氮素处理之间15N 增量差异也均达极显著水平。
2.3 施用不同形态同位素标记氮后茶苗地上部与地下部15N 增量比率
由图 2 可见,施用三种不同形态同位素标记氮素后茶苗地上部和地下部15N 增量的比率均随施用时间的延长而增大,且施用后 2 h、6 h、72 h 之间茶树地上部和地下部15N 增量比率的差异均达极显著水平,其中铵态氮处理 72 h 的茶苗地上部和地下部15N增量比率分别是 2 h、6 h 的 6.96 倍、3.74 倍;硝态氮处理 72 h 的茶苗地上部和地下部15N 增量比率分别是 2 h、6 h 的 4.16 倍、2.67 倍;甘氨酸态有机氮处理 72 h 的茶苗地上部和地下部15N 增量比率分别是 2 h、6 h 的 4.24 倍、2.65 倍。
施用氮素后 2 h,三种不同形态同位素标记氮之间茶苗地上部和地下部15N 增量比率差异不明显,但在施用后 6 h 和 72 h,地上部和地下部15N 增量比率差异均达极显著水平。施用后 6 h,铵态氮处理的茶苗地上部与地下部15N 增量比率分别比硝态氮和甘氨酸态有机氮高 34.7% 和 65.0%,72 h 的15N 增量比率分别比硝态氮和甘氨酸态有机氮高 88.6% 和 133.0%,表明随时间的延长,施用不同形态同位素标记氮的茶苗中氮素由地下部向地上部的转移量均增加,转移速度表现为铵态氮>硝态氮>有机态氮。
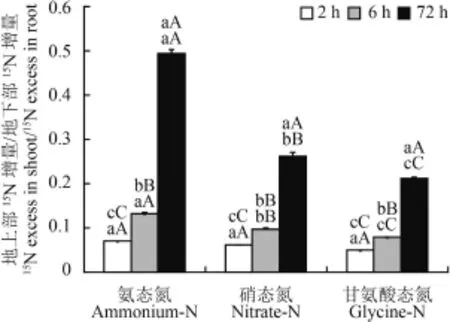
图2 不同形态氮同位素处理后不同时间茶苗地上部与地下部15N 增量比值Fig.2 The shoot/root ratios in15N excess of tea seedlings at different times after various N isotope applications
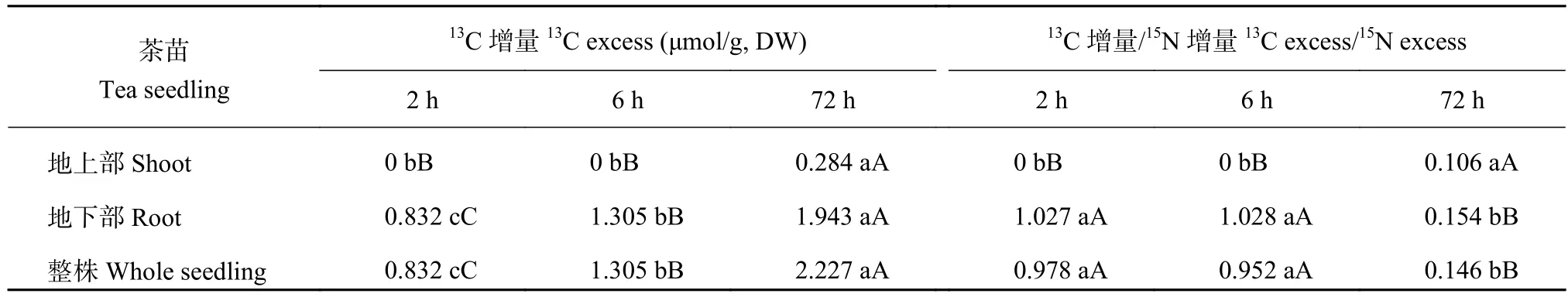
表1 施用碳氮同位素双标记甘氨酸后茶苗中13C 增量及13C 和15N 增量比率Table 1 13C excess and13C excess/15N excess of tea seedlings after the 2-13C-15N-glycine application
2.4 施用碳氮同位素双标记甘氨酸后茶苗中13C和15N 增量
由表 1 可见,施用同位素双标记甘氨酸态有机氮后 2 h 和 6 h,只在茶苗的地下部检出13C 增量,而茶苗地上部则未检出13C 增量,但 72 h 后茶苗地上部检出13C 增量,且与 2 h、6 h 的差异达到极显著水平,表明经较长时间后,茶苗吸收的13C 同位素已从根系运转到地上部;茶苗整株的13C 增量随施用时间的延长而增加,72 h 的13C 增量分别比 2 h 和 6 h增加 168.3% 和 70.7%,三者间13C 增量差异也达到极显著水平。
由表 1 结果还可看出,在施用同位素标记氮后的早期 (2 h 和 6 h),茶苗地下部和整株的13C 增量/15N 增量无显著差异,且接近于13C 增量/15N 增量的理论值 (1∶1)。t 检验结果表明,施用同位素标记氮后2 h 茶苗地下部和整株13C 增量/15N 增量实测值与理论值之间均无显著差异 (p地下部= 0.360,p整株= 0.420,n = 3),6 h 茶苗地下部和整株的13C 增量/15N 增量实测值与理论值之间差异也未达显著水平 (p地下部= 0.162,p整株= 0.063,n = 3);但施用后 72 h 茶苗地下部和整株的13C 增量/15N 增量则显著下降,实测值与理论值之间的差异均达到极显著水平 (p地下部= 0.001,p整株= 0.001,n = 3)。施用 72 h 后,茶苗地上部13C 增量/15N 增量显著增大,且与 2 h 和 6 h 之间的13C 增量/15N 增量差异均达到极显著水平。
3 讨论
3.1 茶树对有机氮和无机氮的吸收能力
氨基酸在土壤可溶性有机氮中占有一定的比例,有研究表明,由于植物根系无法单独吸收土壤中的碳,通过注射13C、15N 双标记氨基酸,若植物体内能够同时测出13C、15N 且两者间呈现一定的比例关系,则可认为植物能够直接吸收分子态氨基酸[23],故采用13C、15N 双标记氨基酸示踪法可以排除15N 单标记氨基酸示踪法中有机氮可能在土壤中被微生物矿化为无机氮后才被植物吸收的可能性。本研究表明,施用13C、15N 双标记甘氨酸处理的茶苗地下部和整株均检出13C 和15N 增量,且在施用后 2 h 和 6 h的13C 增量/15N 增量均接近于理论上的 1∶1 值,说明13C、15N 双标记甘氨酸中的13C 已伴随着茶苗对分子态甘氨酸的吸收而进入根系内部,这一现象有力地证明了供试茶苗可以从土壤中吸收完整的甘氨酸分子。本研究还表明,在施用13C、15N 双标记甘氨酸后 72 h 的茶苗中13C 增量明显低于15N 增量,这是因为本研究中采用的 2-13C-15N-甘氨酸标记的是非羧基碳,相较标记羧基碳能够有效减少氨基酸在植物体内进行脱羧反应而损失13C,但非羧基碳也会通过脱氨基作用和三羧酸循环进行呼吸作用使13C 损失[24],故被茶树吸收的13C 在经历一定时间后会因呼吸作用和新陈代谢作用分解而下降,导致 72 h 茶苗吸收甘氨酸中13C 测定值低于实际吸收值。
已有研究表明,自然界不同植物对铵态氮和硝态氮具有选择吸收特性[25],茶树是喜氨的多年生植物,对铵态氮的吸收利用比硝态氮快,且在两种无机氮共存时,茶树优先吸收铵态氮[26]。本研究结果与已有的研究结论相一致,即供试茶树对铵态氮的吸收能力显著高于硝态氮。茶树的喜氨特性首先与其要求酸性的土壤环境密切相关,植物通过吸收利用铵态氮而释放出 H+而使土壤酸化[27],故茶树喜氨特性有利于创造其适宜生长的酸性环境;其次,植物吸收利用硝态氮需要经过硝酸还原酶的还原过程,比吸收铵态氮需要更多能量[28],致使茶树更易吸收耗能低的铵态氮;此外,植物体内对两种无机氮素的吸收运输途径不同,相关控制基因的表达受氮素形态影响[29],植物对铵态氮和硝态氮的吸收均由两个不同的高亲和与低亲和转运系统调控,且随外界 NH4+和 NO3–的浓度高低交替起作用,硝态氮的高亲和转运系统还分为组成型和诱导型[30],故茶树偏好吸收铵态氮可能与其无机氮吸收运输途径不同有关。
就理论而言,13C、15N 双标记甘氨酸示踪法中供试植物体内13C 测定值高低是作为判断植物吸收利用分子态甘氨酸能力高低的理想指标,但由于吸收的13C 也会因呼吸作用和新陈代谢作用分解而损失[24],故利用15N 测定值高低作为植物直接吸收利用分子态甘氨酸数量高低的判断指标可能更为科学,Näsholm等研究也表明可以采用植物体内15N 增量高低作为植物直接吸收利用分子态甘氨酸能力大小的判断指标[19]。本研究表明,施用甘氨酸态有机氮处理的茶苗地下部、地上部和整株的15N 增量均显著低于施用铵态氮和硝态氮处理,表明茶树虽然可以直接吸收利用甘氨酸态有机氮,但吸收量明显低于铵态氮和硝态氮,这可能是由于茶树长期生长在相对富含无机氮的土壤环境中,适应环境的结果导致茶树体内并未形成大量吸收有机氮的机制,属于非嗜好有机氮的植物。已有的研究已证实,植物通过质膜上的特异性载体蛋白 (质子耦合运输蛋白) 主动吸收氨基酸[31],植物根系表面存在氨基酸转运载体[32–34],包括负责中性和酸性氨基酸转运和负责碱性氨基酸转运的两大转运系统[35,36],故茶树对甘氨酸态氮的吸收可能与其体内中性氨基酸转运载体活性有关,其吸收机理有待于进一步的深入研究。
3.2 有机氮和无机氮在茶树中的运转能力
甘氨酸态氮等可溶性有机氮被植物吸收后,能够通过脱氨基作用、转氨基作用以及其它过程进行同化[37]。已有研究发现,植物根部产生的13C、15N 增量明显高于茎叶部,认为外源13C、15N 双标记氨基酸进入植物体的初期首先聚集在根部,然后再通过木质部和韧皮部运输到其它部位,并非一开始就在植物体内均匀分布[4,34]。本研究也发现,13C、15N 双标记甘氨酸处理茶苗地下部的13C、15N 增量均高于地上部,且施用后 2 h 和 6 h 茶苗地上部未检出13C增量,施用后 72 h 茶苗地上部才检出13C 增量,表明茶树吸收的甘氨酸初期也是先聚集于根部,而后逐步运转到地上部。当然,茶苗地上部的13C 增量也有可能是来自叶片光合作用固定空气中的13CO2,但本研究中盆栽试验是在开放的普通温室中进行,并采用完全随机排列,且对照、铵态和硝态氮处理的茶苗地上部均未检出13C 增量,表明甘氨酸处理茶苗地上部的13C 增量来自叶片光合作用固定空气中13CO2的可能性不大。因此,茶苗地上部的13C 增量是来自根部吸收的甘氨酸向上运移的结果,即茶苗具有吸收氨基酸态有机氮并向地上部运转的能力。此外,本研究还发现,施用后短时间内 (2 h) 三种形态氮素处理间茶苗地上部和地下部15N 增量比率差异不显著,但施用 6 h 和 72 h 后铵态氮处理茶苗地上部与地下部15N 增量比率均显著高于硝态氮和甘氨酸态有机氮处理,表明在施用初期,铵态氮、硝态氮和甘氨酸态氮在茶苗中的运转能力差异不大,但施用 6 h 后铵态氮在茶苗中的运转能力则显著高于硝态氮和甘氨酸态氮,这与茶树对三种形态氮素吸收能力大小密切相关。
4 结论
供试的黄金桂茶苗具有从土壤中直接吸收利用甘氨酸分子态有机氮的能力,但吸收量不及铵态氮和硝态氮;根系吸收的氨基酸态有机氮可以分子形态向地上部运转;茶苗对不同形态氮素的喜好性及其在植株体内的运转能力均表现出以下规律:铵态氮>硝态氮>甘氨酸态氮。该研究结果为进一步证明自然界植物直接吸收利用可溶性有机氮是普遍存在的现象提供了依据,但茶苗直接吸收利用分子态可溶性有机氮及其运转机理有待于进一步的深入研究。
[1]Chapin F S, Moilanen L, Kielland K. Preferential use of organic nitrogen for growth by a non-mycorrhizal arctic sedge [J]. Nature, 1993, 361: 150–153.
[2]Fisk M C, Schmidt S K. Nitrogen mineralization and microbial biomass nitrogen dynamics in three alpine tundra communities [J]. Soil Science Society of America Journal, 1995, 59: 1036–1043.
[3]张夫道, 孙羲. 氨基酸对水稻营养作用的研究[J]. 中国农业科学, 1984, 5: 61–66. Sun F D, Sun X. Function of amino acid on rice nutrition [J]. Scientia Agricultra Sinica, 1984, 5: 61–66.
[4]许玉兰, 刘庆城. 用15N示踪方法研究氨基酸的肥效作用[J]. 氨基酸和生物资源, 1998, 20(2): 20–23. Xu Y L, Liu Q C. Study on the fertilizer efficiency of amino acid by15N tracer method [J]. Amino Acid and Bioresource, 1998, 20(2): 20–23.
[5]Thornton B. Uptake of glycine by non-mycorrhizal Lolium perenne. [J]. Journal of Experimental Botany, 2001, 52: 1315–1322.
[6]徐兴良, 白洁冰, 欧阳华. 植物吸收土壤有机氮的研究进展[J]. 自然资源学报, 2011, 26(4): 715–724. Xu X L, Bai J B, Ouyang H. Advance in studies on organic N uptake by terrestrial plants [J]. Journal of Nature Resources, 2011, 26(4): 715–724.
[7]Näsholm T, Ekblad A, Nordin A, et al. Boreal forest plants take up organic nitrogen [J]. Nature, 1998, 392: 914–916.
[8]Lipson D A, Monson R K. Plant-microbe competition for soil amino acids in the alpine tundra: effects of freeze-thaw and dry-rewet events [J]. Oecologia, 1998, 113: 406–414.
[9]Gao J Q, Mo Y, Xu X L, et al. Spatiotemporal variations affect uptake of inorganic and organic nitrogen by dominate plant species in an alpine wetland [J]. Plant and Soil, 2014, 381: 21–278.
[10]Xu X L, Hua O Y, Kuzyakov Y, et al. Significance of organic nitrogen acquisition for dominant plant species in an alpine meadow on the Tibet plateau, China [J]. Plant and Soil, 2006, 285: 221–231.
[11]Bardgett R, Streeter T, Bol R. Soil microbes compete effectively with plants for organic-nitrogen inputs to temperate grasslands [J]. Ecology, 2003, 84: 1277–1287.
[12]Weigelt A, Bol R, Bardgett R D. Preferential uptake of soil nitrogen forms by grassland plant species [J]. Oecologia, 2005, 142: 627–635.
[13]Scott E E, Rothstein D E. Amino acid uptake by temperate tree species characteristic of low-and high-fertility habitats [J]. Oecologia, 2011, 167: 547–57.
[14]Jin V L, Evans R D. Elevated CO2increases plant uptake of organic and inorganic N in the desert shrub Larrea tridentate [J]. Oecologia, 2010, 163: 257–266.
[15]Kahmen A, Livesley S J, Arndt S K. High potential but low actual glycine uptake of dominant plant specis in three Australian land-use types with intermediate N availability [J]. Plant and Soil, 2009, 325: 109–121.
[16]Wei L L, Chen C R, Xu Z H, et al. Direct uptake and rapid decrease of organic nitrogen by Wollemia nobilis [J]. Biology and Fertility of Soils, 2013, 49: 1247–1252.
[17]Matsumoto S, Ae N, Yamagata M. Possible direct uptake of organic nitrogen from soil by chingensai (Brassica campestris L.) and carrot (Daucus carota L.) [J]. Soil Biology and Biochemistry, 2000, 32: 1301–1310.
[18]葛体达. 番茄对有机氮的吸收及土壤可溶性有机氮行为特性研究[D]. 上海: 上海交通大学博士学位论文, 2008: 62–70. Ge T D. Study on the characteristic of absorption of organic nitrogen by tomato and behavior of soluble organic nitrogen in the soils [D].Shanghai: PhD Dissertation of Shanghai Jiao Tong University, 2008. 62–70.
[19]Näsholm T, Huss-Danell K, Högberg P. Uptake of glycine by field grown wheat [J]. New Phytologist, 2001, 150: 59–63.
[20]Cao X C, Wu L H, Yuan L, et al. Uptake and uptake kinetics of nitrate, ammonium and glycine by pakchoi seedlings (Brassica Campestris L. ssp. Chinensis L. Makino) [J]. Scientia Horticulturae, 2015, 186: 247–253.
[21]穆兰. 茶园土壤可溶性有机氮及其主要影响因素研究[D]. 福州: 福建农林大学硕士学位论文, 2011. 31–32. Mu L. Studies on soil soluble organic nitrogen and its key influencing factors in tea plantations [D]. Fuzhou: MS Thesis of Fujian Agriculture and Forestry University, 2011.31-32.
[22]Taylor A F S, Gebauer G, Read D J. Uptake of nitrogen and carbon from double-labelled (15N and13C) glycine by mycorrhizal pine seedlings [J]. New Phytologist, 2004, 164: 383–388.
[23]Jones D L, Healey J R, Willett V B, et al. Dissolved organic nitrogen uptake by plants-an important N uptake pathway? [J]. Soil Biology and Biochemistry, 2005, 37: 413–423.
[24]Näsholm T, Persson J. Plant acquisition of organic nitrogen in boreal forests [J]. Physiologia Plantarum, 2001, 111: 419–426.
[25]张彦东, 白尚斌. 氮素形态对树木养分吸收和生长的影响[J]. 应用生态学报, 2003, 14(11): 2044–2048. Zhang Y D, Bai S B. Effects of nitrogen forms on nutrient uptake and growth of tree [J]. Chinese Journal of Applied Ecology, 2003, 14(11): 2044–2048.
[26]黄意欢. 茶树营养生理与土壤管理[M]. 长沙: 湖南科学技术出版社, 1992. 32–38. Huang Y H. Nutition physiology and soil management of tea plant [M]. Changsha: Science and Technology Press in Hunan, 1992. 32–38.
[27]陆景陵. 植物营养学(上册)[M]. 北京: 中国农业大学出版社, 2003. 23–35. Lu J L. Plant nutrition (Volume one) [M]. Beijing: Press of China Agriculture University, 2003. 23–35.
[28]杜旭华. 氮素形态对茶树生长及氮素吸收利用的影响[D]. 南京:南京林业大学博士学位论文, 2009. Du X H. Effects of nitrogen forms on growth and nutrient uptake of tea plant [D]. Nanjing: PhD Dissertation of Nanjing Forestry University, 2009.
[29]杜旭华, 彭方仁. 无机氮素形态对茶树氮素吸收动力学特性及个体生长的影响[J]. 作物学报, 2010, 36(2): 327–334. Du X H, Peng F R. Effects of inorganic nitrogen forms on the dynamic characteristics of nitrogen uptake and individual growth of tea plant [J]. Acta Agromica Sinica, 2010, 36(2): 327–334.
[30]李宝珍, 范晓荣, 徐国华. 植物吸收利用铵态氮和硝态氮的分子调控[J]. 植物生理学通讯, 2009, 45(1): 80–88. Li B Z, Fan X R, Xu G H. Molecular regulation for uptake and utilization of ammonium and nitrate in plant [J]. Plant Physiology Communications, 2009, 45(1): 80–88.
[31]袁伟, 董元华, 王辉. 植物对氨基酸态氮吸收和利用的研究进展[J].中国土壤与肥料, 2009, (4): 4–9. Yuan W, Dong Y H, Wang H. Uptake and utilization of amino acid nitrogen by plants[J]. Soil and Fertilizer Science in China, 2009, (4): 4–9.
[32]Bush D R. Proton-coupled sugar and amino acid transporters in plants [J]. Annual Review of Plant Physiology and Molecular Biology, 1993, 44: 513–542.
[33]Tanner W, Caspari T. Membrane transport carriers [J]. Annual Review of Plant Physiology and Molecular Biology, 1996, 47: 595–626.
[34]Fischer W F, Andre B, Rentsch D, et al. Amino acid transport in plant [J]. Trends in Plant Science, 1998, 3: 188–195.
[35]Kinraide T B. Inter amino acid inhibition of transport in higher plants. Evidence for two transport channels with ascertainable affinities for amino acids [J]. Plant Physiology, 1981, 68: 1327–1333.
[36]Datko A H, Mudd S H. Uptake of amino acids and other organic compounds by Lemna paucicostata Hegelm. 6746 [J]. Plant Physiology, 1985, 77: 770–778.
[37]马林. 植物对氨基酸的吸收和利用[J]. 西南科技大学学报, 2004, 19(1): 102–107. Ma L. Uptake and utilization of amino acid by plants [J]. Journal of Southwest University of Science and Technology, 2004, 19(1): 102–107.
Uptake and transport characteristics of soluble organic and inorganic nitrogen by tea plant
ZHOU Bi-qing1, CHEN Cheng-rong2, YANG Wen-hao1, ZHANG Li-ming1, XING Shi-he1*
( 1 College of Resource and Environment, Fujian Agriculture and Forestry University/Key Lab of Soil Environment Health and Regulation in Fujian, Fuzhou 350002, China; 2 School of Environment, Griffith University,
Queensland, Brisbane, QLD 4111, Australia )
【Objectives】Whether tea plants in subtropics could directly take up soluble molecular organic nitrogen from soil or not does not have agreeable conclusions. Studying the transport charecteristics of soluble organic and inorganic nitrogen in tea plants will help the deep understanding of the problem. 【Methods】The isotope tracing method was used in a pot experiment using tea seedlings (Huangjingui) as tested material. The isotope tracers were 2-13C-15N-glycine, (15NH4)2SO4and15N-KNO3, which were injected into soil at the bottom of tea seedlings. Aboundance of13C and15N in shoots and roots were measured by isotope ratio mass spectrometer with a Eurovector Elemental Analyser. 【Results】The ratios of13C to15N excess in roots and whole seedlings of Huangjingui were much close to 1∶1, the theroretical ratio of13C to15N aboundance, at 2 h and 6 h after the 2-13C-15N-glycine application in soil. The13C excess was not detected in Huangjingui shoots at 2 h and 6 h,while it reached 0.284 μmol/(g, DW) in shoots at 72 h after the 2-13C-15N-glycine application. The15N excesses of roots, shoots and whole seedlings of Huangjingui at 2 h, 6 h and 72 h after the (15NH4)2SO4application were significantly higher than those after the15N-KNO3and 2-13C-15N-glycine application in soil. The shoot/root ratio in15N excessat 6 h after the (15NH4)2SO4application was 34.7% and 65.0% higher than those after the15N-KNO3and 2-13C-15N-glycine application, while the ratio at 72 h after the (15NH4)2SO4application was 88.6% and 133.0% higher than those after the15N-KNO3and 2-13C-15N-glycine application, respectively, and the differences of the ratios between the (15NH4)2SO4and15N-KNO3or 2-13C-15N-glycine treatments reached the 1% level. 【Conclusions】Tea plants of Huangjingui could directly take up intact glycine molecule from the soil, but preferred to uptake ammonium-N and nitrate-N. The glycine molecule taken up by Huangjingui could be transported from roots to shoots. The transport ability of different forms of nitrogen in Huangjingui plants showed following order: ammonium-N >nitrate-N > glycine-N. These results provided further evidence that uptake of soluble organic N by plants is a widespread adaptation strategy in terrestrial ecosystems.
isotopic double marking tracer method; tea plant; 2-13C-15N-glycine; uptake; transport
2016–02–18接受日期:2016–08–18
国家自然科学基金面上项目(31170485);福建省自然科学基金项目(2015J01090)资助。
周碧青(1963—),女,福建莆田人,正高级实验师,主要从事生态环境监测与碳氮循环研究。E-mail:1963zbq@163.com * 通信作者 E-mail:fafuxsh@126.com
