三种硝化抑制剂抑制土壤硝化作用比较及用量研究
2017-03-02王雪薇褚贵新
王雪薇,刘 涛,褚贵新
(新疆生产建设兵团绿洲生态农业重点实验室/石河子大学农学院,新疆石河子 832000)
三种硝化抑制剂抑制土壤硝化作用比较及用量研究
王雪薇,刘 涛,褚贵新*
(新疆生产建设兵团绿洲生态农业重点实验室/石河子大学农学院,新疆石河子 832000)
【目的】硝化抑制剂是调控土壤氮素转化与硝化作用微生物群落结构的有效途径。本文通过室内模拟试验对 3 种硝化抑制剂在不同剂量下的硝化抑制效果进行研究,旨在筛选出效果最佳的剂型与剂量,为石灰性土壤硝化抑制剂的合理应用提供依据。【方法】培养试验在生长箱内进行,25℃ 黑暗条件培养;盆栽试验在温室内进行。供试硝化抑制剂为双氰胺 (DCD)、3, 4-二甲基吡唑磷酸盐 (DMPP) 和 2-氯-6-三氯甲基吡啶(Nitrapyrin),DCD 和 DMPP 用量均设定为纯氮(N)量的 0 (CK)、1.0%、2.0%、3.0%、3.5%、4.0%、4.5%、5.0%、6.0% 和 7.0%;Nitrapyrin 用量分别为纯氮量的 0、0.1%、0.125%、0.2%、0.25%、0.3%、0.35%、0.4%、0.45% 和 0.5%,三种硝化抑制剂均设 10 个水平,每个水平 3 次重复。盆栽试验氮加入量为每公斤风干土 0.50 g,三种硝化抑制剂用量分别为纯氮用量的 5%、1%、0.648%。调查比较了三者的硝化抑制效果及对土壤氮素转化的影响及其对小青菜鲜重的生物学效应;采用变性梯度凝胶电泳 (DGGE) 法分析了不同硝化抑制剂对土壤AOA、AOB 群落结构的影响。【结果】DCD、DMPP、Nitrapyrin 均可显著抑制土壤硝化作用 (P < 0.05),各硝化抑制剂处理土壤的 NH4+-N 含量分别较对照提高了 46.2~256.1 mg/kg、291.8~376.7 mg/kg、3.68~372.9 mg/kg。DCD 与 DMPP 处理的硝化抑制率分别为 49.3%~79.4% 和 96.4%~99.4%,DCD 表现出明显的剂量效应,但 DMPP 在 1%~7% 浓度范围内的剂量效应不明显。Nitrapyrin 在 0.1%~0.2% 浓度范围内有明显的剂量效应。0.25%~0.5% Nitrapyrin 的硝化抑制率为 98.9%~99.9%,其硝化抑制效果与 DMPP 处理相同。DCD、DMPP、Nitrapyrin 处理的小青菜地上部分鲜重分别比氮肥处理 (ASN) 提高了 12.7%、11.1%、17.6%。施用硝化抑制剂可改变土壤 AOA 和 AOB 群落结构,且对 AOA 群落结构的影响大于 AOB,不同硝化抑制剂之间对AOA 和 AOB 群落结构的影响无差异。【结论】3 种硝化抑制剂的硝化抑制效果表现为 Nitrapyrin ≥ DMPP >DCD,均对 AOA 与 AOB 群落结构产生明显影响。各硝化抑制剂处理均可提高小青菜地上部鲜重、叶片 Vc 含量及可显著提高小青菜叶片氨基酸含量 (P < 0.05)。综合比较,Nitrapyrin 硝化抑制效果好于 DMPP,DCD 效果最差,推荐用量为基于纯氮 0.25% 的 Nitrapyrin 添加量。
硝化抑制剂;石灰性土壤;铵态氮;硝态氮;硝化抑制率;氨氧化古菌;氨氧化细菌
硝化抑制剂 (nitrification inhibitors,NI) 是一类抑制硝化过程的化学合成或天然的制剂。利用其延缓 NH4+-N 向 NO3–-N 的转化[1],可提高土壤对氮的固持,实现作物铵硝同步供给,达到改善作物氮素营养与提高氮肥利用率的目的[2]。生物硝化抑制剂主要指具有硝化抑制效应的氨基酸和氮碱类有机化合物,如印度楝树饼、非洲湿生臂形草、十字花科等植物[3]。20 世纪 50 年代中期以来化学合成硝化抑制剂的研究发展迅速,其主要分为氰胺类、含氮杂环化合物、含硫化合物、烃类及其衍生物四大类[4]。当前国内外研究最为广泛的硝化抑制剂有双氰胺(DCD)、3,4-二甲基吡唑磷酸盐 (DMPP)、2-氯-6-三氯甲基吡啶 (Nitrapyrin) 等[5]。研究发现施用Nitrapyrin 可使土壤氮素淋溶损失比对照降低13%[6]。DCD 和 DMPP 能有效减少 NO3–淋溶和 N2O排放[7]。
氨氧化细菌 (ammonium-oxidizing bacteria, AOB)和氨氧化古菌 (ammonium- oxidizing archaea, AOA)是驱动土壤硝化生物过程的主要微生物群落。孙志梅等[8]研究发现施用硝化抑制剂可显著降低土壤的硝化潜势及 AOA 与 AOB 数量。但不同土壤类型、pH等条件下土壤的硝化作用微生物群落结构与多样性存在很大差异。尽管不同种类硝化抑制剂对土壤 AOA、AOB 的影响已有研究,但从剂型、剂量上把目前几种主要硝化抑制剂的作用效果及对土壤氨氧化关键微生物群落结构进行系统比较的研究尚不多见。
石灰性土壤硝化作用发生强烈[9],通过适量硝化抑制剂结合氮肥施用可调控作物根区氮素供给形态,提高作物氮肥利用效率。而比较不同硝化抑制剂及其添加剂量对土壤硝化过程及其关键微生物群落结构影响是确定合适硝化抑制剂剂型与合理剂量的基础。本研究通过比较双氰铵 (DCD )、2-氯-6-(三氯甲基) 吡啶 (Nitrapyrin)、3, 4-二甲基吡唑磷酸盐(DMPP) 三种硝化抑制剂对土壤铵态氮、硝态氮动态变化、硝化抑制率和表观硝化率的剂量效应,并利用 PCR-DGGE 的方法比较三者对土壤 AOA、AOB群落结构及对小青菜氮素营养与品质的影响,旨在筛选出效果最佳的剂型与剂量,为石灰性土壤硝化抑制剂的合理应用提供依据。
1 材料与方法
1.1 试验材料
供试土壤为灌溉灰漠土 (calcaric fluvisals),采自新疆石河子莫索湾垦区 147 团,土壤质地为壤土,土壤 pH 8.0、有机质 15.8 g/kg、全氮 1.11 g/kg、碱解氮 63.8 mg/kg、速效磷 12.3 mg/kg、速效钾215.6 mg/kg。新鲜土样剔除杂物及残留根系,风干后过 2 mm 筛备用。供试硝化抑制剂为双氰胺 DCD (dicyandiamide,含量 98.00%,白色晶体,分析纯,上海山浦化工有限公司生产)、3, 4-二甲基吡唑磷酸盐 DMPP (3, 4-dimethylpyrazole phosphate,含量97.00%,白色粉末,分析纯,美国 J&K 化学有限公司生产)、2-氯-6-三氯甲基吡啶 (nitrapyrin,含量24.00%,浅黄色乳油,浙江奥复托化工有限公司生产),供试氮肥为硫酸铵 ASN (ammonium sulfate,含量 99.00%,白色晶体)。供试小青菜为黑油小白菜(Brassica campestris L. ssp. chinnesis)。土壤总 DNA的提取采用 PowerSoil DNA Isolation Kit (MO BIO Laboratories Inc. USA)。试验所用引物和 Taq 酶试剂盒均由大连宝生公司生产。
1.2 试验设计与方法
1.2.1 培养试验 设计 DCD 和 DMPP 用量分别为纯氮量的 0 (CK)、1.0%、2.0%、3.0%、3.5%、4.0%、4.5%、5.0%、6.0% 和 7.0%;Nitrapyrin 用量为纯氮(N)量的 0、0.1%、0.125%、0.2%、0.25%、0.3%、0.35%、0.4%、0.45% 和 0.5%,均为 10 个水平,每个水平 3 次重复。
供试氮源为硫酸铵 (ASN,含 N 21.21%),用量为 N 0.5 g/kg,风干土。将硫酸铵与各硝化抑制剂按试验设计要求溶解于水中,与 1 kg 风干土充分混匀,放入 PVC 自封袋,在靠近土壤上方 1 cm 处扎 1横排通气小孔 (共 6 个) 以创造好气环境,后置于25℃ 人工气候室中恒温黑暗培养。培养期间,每天采用称重法补水 1 次,使土壤含水量保持在田间持水量的 60%~65%。在培养开始后的第 2、4、8、10、15、25、30 d 分别取样,每次取样 25 g,取样土样立即用 2.0 mol/L KCl 溶液浸提,浸提溶液放置于 –20℃ 冰箱,保存待测。
1.2.2 盆栽试验 试验所用瓷盆,规格为上端内径 20 cm,下端内径 9.5 cm,高 11 cm。每盆装过 2 mm 尼龙筛的风干土 4 kg。试验设 5 种处理:1) 不添加氮肥和硝化抑制剂 (CK);2) 只添加硫铵 (ASN);3) 硫铵 + DCD (ASN + DCD);4) 硫铵 + DMPP (ASN + DMPP);5) 硫铵 + Nitrapyrin (ASN + Nitrapyrin)。每1 kg 风干土纯氮用量为 0.50 g,按 ASN 计 2.36 g/kg;P2O50.15 g/kg,按重过磷酸钙计 0.33 g/kg;K2O 0.30 g/kg,即硫酸钾 (含 K2O 51%) 为 0.59 g/kg。DCD、DMPP、Nitrapyrin 用量分别为纯 N 用量的 5%、1%、 0.648%。每个处理重复 4 次,随机排列。将硫酸铵和硝化抑制剂溶解于水中,分别在小青菜定苗后第 2 d和 16 d 时各追施 50%,磷、钾肥作为基肥一次性施入。幼苗长出第二片真叶后进行间苗,每盆定苗 10棵。定苗后 40 d 收获。灌溉采用人工浇灌方式,各盆每次浇灌等量水量。盆栽试验在第 15 d 及收获期40 d 分别取土样与植株样,对各项指标进行测定。
1.2.3 土壤 DNA 提取与 PCR-DGGE 测定 盆栽试验自小青菜定苗后第 15 d 采集的土壤取样后立即带回实验室进行过筛,去除细小根系,保存于–20℃ 冰箱用于土壤 DNA 提取。
氨氧化古菌 (AOA) PCR 扩增及变性梯度凝胶电泳(DGGE):氨氧化古菌 (AOA) rDNA PCR 扩增采用通用引物对 CrenamoA23f (5′-ATGGTCTGGCTWAGACG-3′)和 CrenamoA616R (5′-GCCATCCATCTGTATGTCCA-3′)[10]。PCR 扩增条件为 94℃ 变性 5 min,接着 35 个循环(94℃ 变性 45 s,53℃ 退火 1 min,72℃ 延伸 1 min),最后再 72℃ 延伸 10 min。产物片段长度 600 bp。AOA 的 PCR 产物进行 DGGE 分离时,使用 6%的胶,变性浓度 15%~55%,缓冲液为 1 × TAE 溶液,电泳条件为电压 110 V、温度 60℃、时间 17 h。
氨氧化细菌 (AOB) PCR 扩增及变性梯度凝胶电泳 (DGGE):氨氧化细菌 (AOB) rDNA PCR 扩增采用通用引物对 amoA1F (5′-GGGGHTTYTACTGGTGGT-3′) 和amoA2R (5′-CCCCTCKGSAAAGCCTTCTTC-3′)[11]。PCR 扩增条件为 94℃ 变性 5 min,接着 35 个循环(92℃ 变性 1 min,50℃ 退火 1 min,72℃ 延伸 45 s),最后再 72℃ 延伸 5 min。产物片段长度 500 bp。土壤中氨氧化细菌 PCR 产物进行 DGGE 分离时,使用 7%的胶,变性浓度 27%~45%,缓冲液为 1 × TAE 溶液,电泳条件为电压 110 V、温度 60 ℃、时间 17 h。
DGGE 均使用 6% SYBR Gold (Invitrogen 公司)核酸凝胶染色 20 min。IngenyPhorU (荷兰)。
1.3 测定项目与方法
土壤 pH 值采用电位法测定 (土水比 1∶5);含水量测定为烘干法;有机质采用高温重铬酸钾氧化—容量法;全氮采用凯氏消煮法;有效磷测定采用 Olsen法;速效钾测定采用乙酸铵浸提—火焰光度法;土壤 NH4+-N 含量采用靛酚蓝比色法;土壤 NO3–-N 含量测定采用铜镉还原柱法[12]。
植株叶片维生素 C 含量采用 2, 6-二氯酚靛酚滴定法测定[15];氨基酸含量采用 80% 的乙醇提取茚三酮比色法测定,通过分光光度计 570 nm 波长测定,结果用 1 g 植株鲜样含有的氨基氮量的毫克数表示。
1.4 计算公式

式中,A 为不加抑制剂处理的土壤培养前后 NO3–-N含量之差 (mg/kg),B 为添加硝化抑制剂处理的土壤培养前后 NO3–-N 含量之差 (mg/kg)。

1.5 数据分析
用 Excel 和多元统计分析软件 GraphPad Prism 5.0 (GraphPad Software,San Diego,USA) 进行图表制作,使用 SPSS 17.0 统计分析软件对土壤化学性质结果和土壤生理功能及多样性指标结果进行处理,处理间的差异显著性采用 Duncan 法进行单因素和双因素多重比较。DGGE 指纹图谱采用 Gel-QuantTM1.0软件 (Multiplexed Biotechnologies Inc, USA) 进行条带判读及迁移率、强度和面积计算。所得数据利用Primer 6.0 软件 (Plymouth,United Kingdom) 首先通过 Log (X + 1) 进行归一化处理,采用 Resemblance measure (S17 Bray Curtis similarity) 方法进行聚类分析,在此基础上对 DGGE 指纹图谱进行多维尺度(MDS) 分析。
2 结果与分析

图1 不同剂量 DCD、DMPP、Nitrapyrin 处理土壤中 NO3–-N、NH4+-N 含量的动态变化Fig.1 Dynamics of soil NO3–-N and NH4+-N treated with different rates of DCD, DMPP and Nitrapyrin
2.1 DCD、DMPP、Nitrapyrin 对土壤铵、硝态氮转化的影响
由图 1 可知,CK 处理土壤 NO3–-N 含量在 30 d培养过程中显著上升,由第 2 d 的 35.0 mg/kg 增加到30 d 的 427.5 mg/kg。3 种硝化抑制剂处理的土壤NO3–-N 显著低于 CK 处理 (P < 0.05)。表明 ASN 在土壤中很快转化为硝态氮,而硝化抑制剂可明显抑制土壤硝化作用。相比较,DMPP 与 Nitrapyrin 的硝化抑制效果作用时间较 DCD 长,但 DCD 剂量效应较前二者明显。如各剂量 DMPP 处理的土壤 NO3–-N含量在整个培养期间增幅并不明显,各浓度处理的土壤 NO3–-N 含量在第 30 d 仍保持在较低水平,较CK 处理减少了 394.3~401.3 mg/kg,且不同剂量间无显著差异。在培养前 8 d,土壤 NO3–-N 含量随Nitrapyrin 浓度升高无显著差异,而在第 8 d 后,低浓度 (0.10%~0.20%) 处理的土壤 NO3–-N 含量迅速大幅度上升,明显高于中浓度 (0.25%~0.35%) 和高浓度 (0.40%~0.50%) 处理,但中浓度与高浓度处理间的土壤 NO3–-N 含量仍保持较低水平 (在 30 d 时,平均仅为 19.8 mg/kg)。与 Nitrapyrin、DMPP 相比,DCD 对土壤硝化抑制作用时间短且效果差,尤其是在培养后期。
2.2 DCD、DMPP、Nitrapyrin 对土壤硝化抑制率的影响
硝化抑制率可表征硝化抑制剂对土壤硝化作用抑制的程度。由图 2 可知,在培养的第 30 d,DCD用量从纯氮的 1% 增加到 7% 时,其硝化抑制率由49.3% 提高到 79.4%,表明土壤的硝化抑制率随DCD 浓度升高而显著提高。在 1%~7% 剂量范围内,DMPP 浓度处理的硝化抑制率为 96.4%~99.4%,各浓度处理间差异不显著。Nitrapyrin 浓度由 0.10% 增加到 0.25% 时,硝化抑制率显著上升,由 41.7% 提高到 98.9%,当 Nitrapyrin 剂量大于 0.25% 后,各浓度处理间的土壤硝化抑制率也无明显差异,始终保持在 99.0% 左右。从剂量效应分析,DCD 抑制效果随剂量的升高而增强。各剂量 DMPP 处理间的硝化抑制率无差异,说明 1% 的用量已可发挥显著效应。低、中、高 Nitrapyrin 剂量间的土壤硝化抑制率有明显差异。0.25%~0.5% 的 Nitrapyrin 剂量可实现与1%~7% DMPP 相同抑制效果,均明显高于 DCD。

图2 培养 30 天后不同剂量 DCD、DMPP、Nitrapyrin 对土壤硝化抑制率的影响Fig.2 Response of soil nitrification inhibition rates to different dosages of DCD, DMPP and Nitrapyrin 30 days since incubation
2.3 DCD、DMPP、Nitrapyrin 对土壤表观硝化率的影响
由图 3 可知,CK 处理的土壤硝化作用发生强烈,在培养期间表观硝化率可增加到 94.1%,而各硝化抑制剂均可显著降低土壤表观硝化率 (P < 0.05)。DCD 对表观硝化率作用的剂量效应表现为低浓度(1.0%~3.0%) 的最高 (55.77%),后为中浓度 (3.5%~4.5%) > 高浓度 (5.0%~7.0%),且从第 15 d 起,3 个浓度范围处理之间差异显著 (P < 0.05)。DMPP 各浓度表观硝化率均较低,且在各剂量间无明显差异。在培养的 2~15 d,Nitrapyrin 三个浓度区间的土壤表观硝化率差异不显著,但在 15~30 d 时,低浓度(0.10%~0.20%) 土壤表观硝化率急剧上升到 61.4% (30 d),比 15 d 的表观硝化率提高 52.3%,显著高于中浓度 (0.25%~0.35%) 和高浓度 (0.40%~0.50%) 的(P < 0.05)。中浓度和高浓度区间的土壤表观硝化率在 0~30 天培养期内差异不显著。3 种硝化抑制剂对土壤表观硝化率影响总体表现为 Nitrapyrin ≤ DMPP< DCD,与硝化抑制率的变化 (图 2) 相互印证。
2.4 不同种植方式对氨氧化古菌、氨氧化细菌群落结构的影响
氨氧化古菌 (AOA) 和氨氧化细菌 (AOB) 是驱动土壤硝化生物过程的关键微生物。在相似度为 68%下,3 种硝化抑制剂处理的 AOB 群落结构明显不同于对照处理 (CK)。在相似度为 75% 下,Nitrapyrin处理的 AOB 群落结构明显有别于 DMPP 和 DCD 处理 (图 4A),应力系数为 0.14,表明拟合度好,差异显著 (Stress < 0.2)。AOA 群落在相似度 85% 水平下可分为 CK、施氮处理 (ASN) 及 3 种硝化抑制剂处理3 类 (图 4B),且差异极显著 (Stress = 0.09),但DCD、DMPP 及 Nitrapyrin 之间对 AOA 群落结构的影响差异不明显。以上说明施用硝化抑制剂可改变土壤 AOA 和 AOB 群落结构,且对 AOA 群落结构的影响大于 AOB。然而不同硝化抑制剂之间对 AOA和 AOB 群落结构的影响无明显差异。

图3 不同剂量 DCD、DMPP、Nitrapyrin 处理 2、15、30 d 时对土壤表观硝化率的影响Fig.3 Response of soil apparent nitrification rates to different dosages of DCD, DMPP and Nitrapyrin at the 2 th, 15 th and 30 th days of incubation
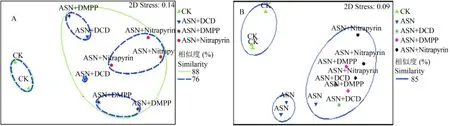
图4 土壤氨氧化细菌 (A) 和氨氧化古菌 (B) 群落结构进行的多维尺度 (MDS) 分析Fig.4 MDS analysis of community structures of AOB (A) and AOA (B) as affected by DCD, DMPP and Nitrapyrin
2.5 各硝化抑制剂与氮肥配施对小青菜品质的影响
由表 1 可知,与 CK 处理相比,施用氮肥 (ASN)可以增加小青菜产量、维生素 C 含量和氨基酸含量;与氮肥处理 (ASN) 相比,加入硝化抑制剂对小青菜产量、维生素 C 及氨基酸含量均有提高,且对氨基酸含量的提高效应显著 (P < 0.05)。DCD、DMPP、Nitrapyrin 处理的小青菜地上部分鲜重较ASN 处理分别提高了 12.7%、11.1%、17.6%,叶片维生素 C 含量分别较 ASN 处理提高了 15.7%、19.5%、24.4%,叶片氨基酸含量分别比 ASN 处理提高了 18.2%、17.8%、16.7%。3 种硝化抑制剂对小青菜产量、维生素 C 及氨基酸含量总体效果表现为Nitrapyrin > DMPP > DCD。

表1 不同剂量硝化抑制剂配施对小青菜产量和叶片中Vc、氨基酸的影响Table 1 The influences of DCD, DMPP and Nitrapyrin addition on the yields, Vc contents and amino acid contents of pakchoi
3 讨论
石灰性土壤广泛分布于干旱半干旱地区,pH 一般在 7.5~8.5 之间、通气良好,硝化作用发生强烈[15]。氨氧化古菌 (AOA) 与氨氧化细菌 (AOB) 是影响土壤硝化过程的主要微生物群落。辜运富等通过大田试验表明,施肥能增加 AOB 微生物数量并改变其群落结构[16]。贺纪正等对河南封丘长期定位试验点碱性潮土 (pH 8.3~8.7) 的 DGGE 分析显示,不同施肥处理引起 AOB 群落结构的变化,同时发现碱性土壤中长期施肥处理对 AOB 的数量及组成有明显影响而对AOA 的影响较小[17]。本研究结果也表明,在石灰性土壤中单施硫铵与配施 3 种硝化抑制剂组合对土壤AOA、AOB 的群落结构均有一定影响。
不同硝化抑制剂在土壤中发挥硝化抑制作用的有效时间与其自身结构特点密切相关。Chalk 等研究表明 DCD 能显著抑制硝化活性较高的土壤中铵的氧化,减少硝酸盐的形成[18],但由于 DCD 水溶性很高(13℃ 水中的溶解度为 22.6 g/L),在土壤剖面中移动性强,容易与 NH4+在土壤空间分布上发生分离现象,从而影响其硝化抑制效果,当遇到强降雨或在保水能力较差的土壤中,容易发生淋溶损失[19]。由于土壤胶体和有机质的吸附作用,DMPP 在土壤中的移动性非常有限,在土壤中的降解速度慢,不易与NH4+发生分离现象和淋溶[19],使得 DMPP 硝化抑制效果稳定,发挥作用时间长。Nitrapyrin 易于见光分解为 6-氯-吡啶甲酸,造成挥发损失,不适合表施,但将其应用于高有机质的土壤时,其挥发损失可通过有机质的吸附相应减少[20]。本试验结果表明,DCD 在培养过程 30 d 中,硝化抑制率仅为49.3%~79.4%,而 DMPP 硝化抑制效果始终保持在99.0% 左右,Nitrapyrin 的硝化抑制效果在前 8 d 与DMPP 相一致,而 8 d 后稍有下降,尤其是低浓度条件下。在当前水氮一体化节水滴灌施肥条件下,1 个滴灌周期为 8~10 d,DMPP、Nitrapyrin 可与每次滴施氮肥相结合,通过滴灌管道系统把肥料氮与硝化抑制剂随水均匀分布于作物根区附近,抑制土壤硝化作用,从而达到优化耕层土壤铵硝供给比例,改善作物氮素营养和促进作物生长的目的。
研究表明,田间条件下 DMPP 施用量为 0.5~1.5 kg/hm2时,硝化抑制效应时间可持续 4~10 周[21]。Azam 等发现当 DMPP 在土壤中均匀分布时,0.39 μg/g 土 DMPP 即可起显著硝化抑制效果[19],DMPP用量仅为 DCD 的 1/10 时,其硝化抑制效果仍然高于DCD。石美等指出,0.5% DMPP 与 1% DMPP 处理的硝化抑制效果并无显著差异[22]。而对于同种硝化抑制剂不同浓度的处理,硝化抑制效果及其作用时间也会随浓度增高而增加,本研究结果显示,在 1%~3.5% DCD 硝化抑制效果只能维持 5~15 d,且效果欠佳,而高浓度的 DCD 处理却能维持 30 d;0.1% Nitrapyrin 的硝化抑制效果仅能维持 8 d,但达到0.25%~0.5% 剂量时,直到培养结束其硝化抑制率依旧保持在 99.0%。同样在 1%~7% 的剂量下,DCD的硝化抑制剂效果作用时间短,剂量效应显著,而DMPP 的硝化抑制作用并未随浓度增加而明显升高,说明低浓度的 DMPP 就可发挥显著硝化抑制效应,在石灰性土壤 DMPP 的剂量还应小于 1.0%,合理的剂量需进一步通过浓度梯度试验确定。Nitrapyrin 在中、高剂量的硝化抑制率和表观硝化率与 DMPP 基本一致,低剂量虽然降低了硝化抑制剂效果,但仍高于 DCD 处理。当 Nitrapyrin 用量仅为纯氮用量 0.25% 时已可达到最佳的硝化抑制效果。
此外,Zerulla 等[23]研究指出,Nitrapyrin 是一种有机氯化合物,如果施用量过大,或长期施用会对某些作物产生毒性;Thomson 等[24]研究表明当Nitrapyrin 施用量仅为 10 mg/kg 时,会因致毒作用而导致豆类植株根系和地上部生长受到抑制,干物质量下降 50% 左右。但 Swezey 等[25]研究表明,施用1% 的 Nitrapyrin 非但对棉花无副作用,反而使其产量提高 12%。本研究也发现 0.65% 剂量的 Nitrapyrin对小青菜并无抑制作用,反而显著提高了小青菜的生物量和营养品质 (维生素 C 和氨基酸含量,表 1),且在 3 种硝化抑制剂中表现最好,可能是今后在农业氮素管理中广泛应用的合适剂型。
4 结论
1) 三种硝化抑制剂均可显著抑制土壤 NH4+-N 向NO3–-N 转化,使 NH4+-N 在培养期维持较高含量。不同处理间土壤 NH4+-N 含量表现为 DMPP ≥ Nitrapyrin >DCD。
2) DCD 的硝化抑制率为 49.3%~79.4%,且在1.0%~7.0% 浓度范围内表现出明显的剂量效应;DMPP 的硝化抑制率为 96.7%~99.4%,且剂量效应(1.0%~7.0%) 不显著。Nitrapyrin 的硝化抑制率为41.7%~99.9%,在低剂量下 (0.1%~0.2%) 表现出明显的剂量效应,在中、高剂量 (0.25%~0.5%) 下无明显剂量效应,三者硝化抑制效果表现为 Nitrapyrin ≥DMPP > DCD。
3) 三种硝化抑制剂均改变了土壤 AOA 和 AOB群落结构,且对 AOA 群落结构的影响大于 AOB。施用硝化抑制剂均可提高小青菜的产量、氨基酸含量与维生素 C 的含量。
参 考 文 献:
[1]曾后清, 朱毅勇, 王火焰, 等. 生物硝化抑制剂-一种控制农田氮素流失的新策略[J]. 土壤学报, 2012, 49(2): 382–388. Zeng H Q, Zhu Y Y, Wang H Y, et al. Biological nitrification inhibitor–a new strategy for controlling nitrogen loss from farmland[J]. Acta Pedologica Sinca, 2012, 49(2): 382–388.
[2]孙志梅, 张阔, 刘建涛, 等. 氮肥调控剂对潮褐土中不同氮源氮素转化及油菜生长的影响[J]. 应用生态学报, 2012, 23(9): 2497–2503. Sun Z M, Zhang K, Liu J T, et al. Effects of nitrogen regulators on fertilizer nitrogen transformation in meadow cinnamon soil and on pakchoi growth[J]. Chinese Journal of Applied Ecology, 2012, 23(9): 2497–2503.
[3]Slangen J, Kerkhoff P. Nitrification inhibitors in agriculture and horticulture: A literature review[J]. Nutrient Cycling in Agroecosystems, 1984, 5(1): 1–76.
[4]奉小忧, 曾清如, 皮荷杰, 等. 3种硝化抑制剂对小麦幼苗生长毒性的比较[J]. 生态毒理学报, 2010, 5(2): 268–273. Feng X Y, Zeng Q R, Pi H J, et al. Comparison of toxicity induced by three nitrification inhibitors on wheat[J]. Asian Journal of Ecotoxicology, 2010, 25(2): 268–273.
[5]Weiske A, Benckiser G, Herbert T, et al. Influence of the nitrification inhibitor 3, 4-dimethyl pyrazole phosphate(DMPP) in comparison to dicyandiamide (DCD) on nitrous oxide emissions, carbon dioxide fluxes and methane oxidation during 3 years of repeated application in field experiments[J]. Biology and Fertility of Soils, 2001, 34: 109–117.
[6]Owens L B. Effects of nitrapyrin on nitrate movement in soil columns[J]. Journal of Environmental Quality, 2001, 10(3): 308–310.
[7]Zaman M, Blennerhassett J D. Effects of the different rates of urease and nitrification inhibitors on gaseous emissions of ammonia and nitrous oxide, nitrate leaching and pasture production from urine patches in an intensive grazed pasture system[J]. Agriculture, Ecosystems & Environment, 2010, 136(3–4): 236–246.
[8]孙志梅, 武志杰, 梁文举, 等. 3, 5-二甲基吡唑对铵态氮硝化及作物生长的影响[J]. 植物营养与肥料学报, 2006, 12(6): 869–874. Sun Z M, Wu Z J, Liang W J, et al. Effects of different application rates of 3, 5-dimethylpyrazole on soil ammonium nitrification and crop growth[J]. Plant Nutrition and Fertilizer Science, 2006, 12(6): 869–874.
[9]刘倩, 褚贵新, 刘涛, 等. DCD在不同质地土壤上的硝化抑制效果和剂量效应研究[J]. 中国生态农业学报, 2011, 19(4): 765–770. Liu Q, Chu G X, Liu T, et al. Nitrification inhibition and dosedependent effect of dicyandiamide on sandy, loamy and clayey soils[J]. Chinese Journal of Eco-Agriculture, 2011, 19(4): 765–770.
[10]Ovres L, Forney L, Daae F L, et al. Distribution of bacterioplankton in meromictic Lake Saelenvannet, as determined by denaturing gradient gel electrophoresis of PCR-amplified gene fragments coding for 16S rRNA[J]. Applied and Environmental Microbiology, 1997, 63: 3367–3373.
[11]Yergeau E, Filion M, Vujanovic V, et al. A PCR denaturing gradient gel electrophoresis approach to assess Fusarium diversity in asparagus[J]. Journal of MicrobiologicalMethods, 2005, 60: 143–154.
[12]鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. Bao S D. Soil and agrochemical analysis[M]. Beijing: China Agriculture Press, 2000.
[13]McCarty G W, Bremner J M. Laboratory evaluation of dicyandiamide as a soil nitrification inhibitor[J]. Communication in Soil Science and Plant Analysis, 1989, 20(19/20): 2049–2065.
[14]林江辉, 李辉信, 胡锋, 等. 干土效应对土壤生物组成及矿化与硝化作用的影响[J]. 土壤学报, 2004, 41(6): 924–930. Lin J H, Li H X, Hu F, et al. Effects of rewetting on soil biota structure and nitrogen mineralization, nitrification in air-dried red soil[J]. Acta Pedologica Sinca, 2004, 41(6): 924–930.
[15]杜景龙, 陈德超, 王兆华. GIS 支持下的土壤综合肥力指标的定量计算[J]. 土壤肥料, 2005, (2): 17–20. Du J L, Chen D C, Wang Z H. Construction and application of a variable fertilizer model based on GIS[J]. Soils & Fertilizers, 2005, (2): 17–20.
[16]辜运富, 云翔, 张小平, 等. 不同施肥处理对石灰性紫色土微生物数量及氨氧化细菌群落结构的影响[J]. 中国农业科学, 2008, 41(12): 4119–4126. Guo Y F, Yun X, Zhang X P, et al. Effect of different fertilizer treatments on soil microbes and ammonium oxidizing bacterial community in a calcareous purple paddy soil[J]. Scientia Agricultura Sinica, 2008, 41(12): 4119–4126.
[17]贺纪正, 张丽梅. 氨氧化微生物生态学与氮循环研究进展[J]. 生态学报, 2009, 29(1): 406–415. He J Z, Zhang L M. Advances in ammonia-oxidizing microorganisms and global nitrogen cycle[J]. Acta Ecologica Sinica, 2009, 29(1): 406–415.
[18]Chalk P M, Victoria RK, Muraoka T, et al. Effect of a nitrification inhibitor on immobilization and mineralization of soil and fertilizer nitrogen[J]. Soil Biology and Biochemistry, 1990, 22: 533–538.
[19]Azam F, Benckiser G, Müller C, et al. Release, movement and recovery of 3, 4-dimethylpyrazole phosphate (DMPP), ammonium, and nitrate from stabilized nitrogen fertilizer granules in a silty clay soil under laboratory conditions[J]. Biology and Fertility of Soils, 2001, 34: 118–125.
[20]黄益宗, 冯宗炜, 张福珠. 硝化抑制剂硝基吡啶在农业和环境保护中的应用[J]. 土壤与环境, 2001, 10(4): 323–326. Huang Y Z, Feng Z W, Zhang F Z. Application of nitrapyrin in agriculture and environmental protection[J]. Soil and Environmental Science, 2001, 10(4): 323–326.
[21]Di H J, Cameron K C. How does the application of different nitrification inhibitors affect nitrous oxide emissions and nitrate leaching from cow urine in grazed pastures?[J]. Soil Use and Management, 2012, 28(1): 54–61.
[22]石美, 张妹婷, 沈锋, 等. 石灰性土壤中不同硝化抑制剂的抑制效果及其对亚硝态氮累积的影响[J]. 中国农业科学, 2011, 44(3): 500–506. Shi M, Zhang M T, Shen F, et al. Effects of nitrification inhibitors on nitrification inhibition and nitrite accumulation in calcareous soil[J]. Scientia Agricultura Sinica, 2011, 44(3): 500–506.
[23]Zerulla W, Barth T, Dressel J, et al. 3, 4-Dimethylpyrazole phosphate (DMPP): A new nitrification inhibitor for agriculture and horticulture: An introduction[J]. Biology and Fertility of Soils, 2001, 34: 79–84.
[24]Thomson C J, Marschner H, Romheld V. Effect of nitrogen fertilizer form on the pH of the bulk soil and rhizosphere, and on the growth, phosphorus, and micronutrient uptake by bean[J]. Journal of Plant Nutrition, 1993, 16: 493–506.
[25]Swezey A W, Turner G O. Crop experiments on the effect of 2-chloro-6-(trichloromethyl) pyridine for the control of nitrification of ammonium and urea fertilizers1[J]. Agronomy Journal, 1962, 54(6): 29–29.
Inhibition of DCD, DMPP and Nitrapyrin on soil nitrification and their appropriate use dosage
WANG Xue-wei, LIU Tao, CHU Gui-xin*
( College of Agronomy, Shihezi University/Production and Construction Group Key Laboratory of Oasis Ecological Agriculture, Shihezi, Xinjiang 832003, China )
【Objectives】Nitrification inhibitors are effective in regulating the transformation of soil nitrogen and the community structure of microbes which involve in the N nitrification process. Incubation and pot experiments were conducted to compare nitrification effects of 3 common used nitrification inhibitors, and to study the dosage for practical use in calcareous soil.【Methods】The incubation experiment was carried out in a plant growth chamber at 25℃ in dark condition, and the pot experiment was conducted in greenhouse. The tested three inhibitors were dicyandiamide (DCD), 3,4-dimethylpyrazole phosphate (DMPP) and chloro-6-trichloromethyl-pyridine (nitrapyrin). The dosage of DCD and DMPP designed as 0 (CK), 1.0%, 2.0%, 3.0%,3.5%, 4.0%, 4.5%, 5.0%, 6.0% and 7.0% of the N addition, those of nitrapyrin were 0, 0.1%, 0.125%, 0.2%, 0.25%, 0.3%, 0.35%, 0.4%, 0.45% and 0.5%. N 0.50 g per kg of dry soil was added in pot experiment, and the dosages of three inhibitors were all 5%, 1%, 0.648% of the N addition. The nitrate inhibition rate and the biomass of pakchoi were investigated; the soil microbial community structures of AOA and AOB were analyzed using the method of denaturing gradient gel electrophoresis (DGGE).【Results】Soil nitrification was significantly inhibited by DCD, DMPP and nitrapyrin (P < 0.05). Compares with the CK, soil NH4+-N concentrations were increased by 46.2–256.1 mg/kg with DCD, by 291.8–376.7 mg/kg with DMPP and by 3.68–372.9 mg/kg with nitrapyrin, respectively. The nitrification inhibition rates were 49.3%–79.4% with DCD and 96.4%–99.4% with DMPP. The DCD addition exhibited an obvious dose effect, namely, the nitrification inhibition rates were increased significantly with DCD dose increasing, the DMPP did not in the addition range of 1.0%–7.0%, Although nitrapyrin only showed dose response in low concentrations from 0.1% to 0.2%, the inhibition rate had reached 98.9%–99.9% when nitrapyrin concentration raised over 0.25%. The inhibition ability followed the order of nitrapyrin ≥ DMPP > DCD. A significant impact of all three NIs on AOA and AOB community structure alteration was found, but there was no significant difference among the three inhibitors. The pakchoi above-ground weight, the contents of Vitamin C and amino acid were significantly improved by DCD, DMPP and nitrapyrin addition (P < 0.05), with the increase of pakchoi biomass of 12.7% with DCD, 11.1% with DMPP and 17.6% with nitrapyrin, respectively.【Conclusions】Briefly, DCD, DMPP and nitrapyrin showed significant role in retarding nitrification in calcareous soil and exerted an obvious influence on AOA and AOB community structure (P < 0.05). Comparatively, nitrapyrin was superior over DMPP and DCD on the soil inhibition, and the addition dose of 0.25% based on pure N was recommended for nitrapyrin application.
nitrification inhibitor; calcareous soil; ammonium; nitrate; nitrification inhibition rate; AOA; AOB
2016–03–30接受日期:2016–05–17
国家“十二五”科技支撑项目(2012BAD42B02)资助。
王雪薇(1993—),女,新疆乌鲁木齐人,硕士研究生,主要从事植物营养方面研究。E-mail:grammays17@163.com
* 通信作者 E-mail:chuguixinshzu@163.com
