全脊椎切除术在脊柱转移瘤中的应用
2017-03-01杨耀贺增良
杨耀,贺增良
(南京市第二医院骨科,江苏 南京 210003)
全脊椎切除术在脊柱转移瘤中的应用
杨耀,贺增良
(南京市第二医院骨科,江苏 南京 210003)
目的探讨一期后路全脊椎切除术治疗脊柱转移瘤的临床疗效。方法回顾性分析2013年11月至2016年3月我科收治的8例脊柱转移瘤患者的临床资料资料,所有患者术前均有不同程度疼痛,脊髓损伤神经功能Frankel分级B级1例,C级4例,D级3例,所有患者均行一期后路全脊椎切除术椎弓根螺钉加椎间钛网自体骨固定,观察患者的手术时间、术中出血量、围手术期并发症等指标,术后随访3~24个月,比较术前及末次随访VAS评分、脊髓损伤神经功能Frankel分级。结果所有患者均顺利完成手术,手术时间310~600 min,平均438 min;术中出血量800~7 500 mL,平均3 000 mL;VAS评分由术前(8.56±0.77)分下降至末次(4.12±0.83)分,差异有统计学意义(P<0.05);术前1例因选择性肿瘤动脉栓塞发生截瘫,术后双下肢肌力0级,只能佩戴支具坐轮椅;;Frankel级别从D级跌至A级,余均获得改善;术中发生1例硬脊膜撕裂伴脑脊液漏,予以缝合修补,术后切口愈合良好,未发生中枢系统感染;还有1例神经根牵拉损伤,术后通过营养神经等对症处理已恢复。结论全脊椎切除术在脊柱转移瘤的应用可以明显改善临床症状,延长患者生存期,是一种积极的外科治疗手段。
脊柱转移瘤;全脊椎切除术;围手术期并发症;外科治疗
在所有骨转移肿瘤中有10%发生于脊柱[1],但大部分脊柱肿瘤为恶性转移性肿瘤,主要来源于乳腺癌、肺癌、前列腺癌、肾癌、胃肠道肿瘤及甲状腺癌,一般累及胸椎,其次为腰椎,最后为颈椎。大部分患者主要症状是顽固性疼痛,表现为休息后也不能缓解或表现为夜间痛,常伴有神经根损伤或者脊柱不稳,一般治疗原则主要是止痛对症、放化疗等姑息性治疗。随着对脊柱转移性肿瘤分期认识的提高,外科治疗成为可能,而全脊椎切除术在去除病变、缓解疼痛、重建脊柱结构方面发挥着重要作用。我科自2013年11月开始应用全脊椎切除术治疗脊柱转移瘤患者,临床效果可靠,现报道如下:
1 资料与方法
1.1 一般资料 本科室2013年11月至2016年3月期间共收治8例脊柱转移瘤患者,其中男性6例,女性2例;年龄37~66岁,平均(55.62±10.58)岁;按累及节段:胸椎2例,胸腰段3例,腰椎3例;临床表现:病理性骨折5例,马尾神经综合征2例,截瘫1例;按术后病理来源:肺癌3例,乳腺癌2例,弥漫性大B淋巴瘤1例,甲状腺滤泡性肿瘤1例,浆细胞瘤1例。术前常规摄胸腰椎正侧位片,胸腰椎CT及MRI检查,核素骨显像。
1.2 常规选择性动脉栓塞术 常规介入术前准备,患者取仰卧位,消毒铺巾后在局部麻醉下穿刺右侧股动脉,置入5F导管鞘,经鞘插管,分别进入行腰动脉造影显示病椎的腰动脉增粗,椎体见肿瘤染色病灶,其血管分支增多、紊乱,实质期染色明显,以3F微导管分别超选插入双侧病椎腰动脉肿瘤供血动脉分支,在透视下经微导管缓慢栓塞适量明胶海绵颗粒直至血流停滞,最后造影见双侧肿瘤供血动脉闭塞,术毕退出导管,拔除导管鞘,右侧股动脉压迫止血,加压包扎。
1.3 一期后路全脊椎切除术 麻醉成功后消毒铺巾,以病椎棘突为中心后做正中直切口约12 cm,切开皮肤、皮下、肌肉筋膜,显露双侧病椎上下两节邻椎椎板及关节突关节,定位无误后于椎弓根置入8根椎弓根螺钉。术中可见L1病椎椎弓根及附件骨质疏松,破坏明显,椎体向前方凹陷不稳(图1);钛棒预弯后右侧上棒临时固定,适当撑开椎间隙,拧紧螺帽。游离病椎邻近关节突关节,剪去病椎棘突,后方复合结构整体移除,切除部分黄韧带,显露硬脊膜,保护神经根,从左侧摘除病椎邻近椎间盘,两侧会师刮除椎体,术后送病理常规检查及免疫组化,刮除上下邻近终板,蒸馏水浸泡后换顺铂继续浸泡,准备椎间融合床,测量椎间高度,放置适当高度装有自体骨钛网行椎间融合,两侧上棒,横连固定,椎弓根钉抱紧,固定锁紧螺帽,透视见内椎间融合器位置良好。大量生理盐水冲洗,再次用无菌蒸馏水反复冲洗,彻底止血,置引流管1根,接负压球。清点器械、敷料无误后,逐层缝合肌筋膜、皮下及皮肤,无菌敷料覆盖。术中常规持续进行体感诱发电位监测,术后波幅同术前。
1.4 观察指标 手术时间、术中出血量、围手术期并发症、末次疼痛视觉模拟评分(VAS)情况、脊髓损伤神经功能Frankel分级等指标。
1.5 统计学方法 应方法用IBM SPSS Statistics19.0统计软件进行数据分析,计量资料以以均数±标准差(±s)表示,计量指标采用配对t检验,以P<0.05为差异有统计学意义。
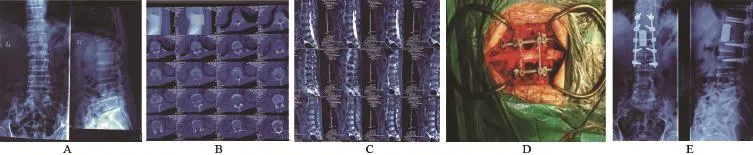
图1 患者XXX,男,因“外伤致腰痛4个月余,加重伴双下肢麻木1个月”而入院
2 结 果
所有患者均顺利完成,手术时间310~600 min,平均438 min;术中出血量800~7 500 mL,平均3 000 mL;VAS评分由术前(8.56±0.77)分下降至末次(4.12±0.83)分,差异有统计学意义(P<0.05)。术前1例因选择性肿瘤动脉栓塞发生截瘫,术后双下肢肌力0级,只能佩戴支具坐轮椅,Frankel级别从D级跌至A级,余均获得改善;术中发生1例硬脊膜撕裂伴脑脊液漏,予以缝合修补,术后切口愈合良好,未发生中枢系统感染;还有1例神经根牵拉损伤,术后通过营养神经等对症处理已恢复。
3 讨 论
3.1 手术适应证 脊柱转移性肿瘤在临床的发生率逐年上升,其诊断及治疗对临床医生提出很高的要求,而术前评分分级系统能提示一定的预后,对治疗手段选择及策略具有很好的指导作用。最早四肢骨肿瘤的Enneking分期主要用于脊柱转移性肿瘤的范围及边界,不能够充分指导进一步治疗策略。后来基于局部解剖结构发展的WBB分期,虽在肿瘤侵入范围的界定有很清新的划分,但过于复杂不易掌握,且临床实用性不大,后期发展形成Tomita[2]以及Tokuhashi评分系统为大多数脊柱外科医师所认可,准确性很高,目前临床应用最多。有学者[3]曾提出修正的Tokuhashi评分系统对于短期预后的判断较为准确,而Tomita评分系统则更适用于长期预后结果的推测。我科一般多采用Tomita评分及分级系统,根据患者全身情况,原发病灶情况以及脊柱转移肿瘤的病变范围,初步得到大概量化数值,决定何种治疗方式,一般来说全脊椎切除术适用于Ⅱ~Ⅴ型,Ⅰ及Ⅵ型为相对禁忌证,本组收治的病例最终均在2~4分之间,判断预后生存期尚可,可进一步提高生活质量及延长生存时间,适合于广泛切除,存在全脊椎切除手术指征。
3.2 手术方式选择及生物力学重建 脊柱转移性肿瘤的早期治疗一般是采取姑息性手段,包括放疗、化疗、瘤内切除术等,短期治疗效果尚可。Greco等[4]回顾了立体定向放疗在脊柱转移性肿瘤的应用,指出单次剂量放疗可以消除局部肿瘤,减少了对脊髓的放射损伤。Pkp/Pvp技术在临床应用比较成熟,具有微创,出血量少,强化病椎,术后可下地负重,即刻疼痛改善明显等优点。Chen等[5]回顾分析了PVP技术治疗282例脊柱转移性肿瘤,术后随访VAS、KPS及QOL评分均较术前明显提高,椎体前柱高度恢复,后凸成角降低。廖绪强等[6]通过比较PVP和SKY治疗椎体肿瘤患者,发现两种经皮椎体成形方法都可以有效缓解疼痛,而SKY椎体成形术能明显减低骨水泥渗漏。而全脊椎切除术主要指切除整个脊椎及假包膜,一般在瘤外正常组织进行操作,能够完整切除肿瘤,减少残余肿瘤的发生,脊柱转移瘤治愈率明显改善,其长期随访生存期得到一定的提高[7]。本研究在充分评估患者术前全身状态,严格掌握手术适应证,采取更为积极的整块脊椎切除术,一般常规术前介入行选择性肿瘤血管栓塞[8],减少肿瘤血供,减少术中出血量,术后24 h内立即行全脊椎切除术,这在骨肿瘤外科手术中已达成共识,不同于传统意义上的Tomita一步切除,防止切割过程中潜在的脊髓损伤风险,我们先行截断后方的椎弓根及附件,一边填塞止血纱布一边钝性游离前方椎体,避免损伤椎前大血管,从而分步骤完整切除肿瘤及病椎,理论上达到广泛性切除,充分显示单纯依靠后路单切口可以完成整个病椎的彻底切除,无需额外联合其他辅助切口。术中我们还依次浸泡蒸馏水及顺铂数分钟,做到预防瘤体残留,周边组织无污染,末次随访情况显示未见肿瘤复发情况,说明肿瘤手术范围已做到边缘性切除,为后续的综合治疗提供良好的基础。采取何种入路手术方式来重建脊柱生物力学取决于肿瘤侵入范围及脊柱结构,大致分为单纯后路,后-前联合入路、还有后-侧前方联合入路,我们的经验是采用一期后路病椎上下邻近两个节段椎弓根螺钉固定加椎间钛网自体骨融合固定重建脊柱结构,相比于前后联合入路缩短了手术时间,减小了手术创伤,减少了手术并发症的发生,有效地缓解疼痛,末次随访VAS评分比较有显著的统计学意义,术后可佩戴支具床上坐起,后期可在康复师指导下辅助下地,恢复时间短,患者自身满意度高。另一方面长节段固定能够提供可靠脊柱的强度,重建了脊柱的后柱结构稳定性,为前柱椎间的植骨融合创造条件,最终达到邻椎间的骨性愈合,而椎间植骨融合成功又可以减小椎弓根螺钉所受应力,减少内固定失败率,重建整个脊椎正常的生物力学,通过本组末次随访X线片未见内固定植入物松动及移位现象。早期Disch等[9]建立全脊椎切除模型,比较应用后路长节段和短节段重建固定,指出后路长节段可获得比正常脊柱更好的稳定性。
3.3 手术并发症 脊柱转移性肿瘤位置比较特殊,解剖结构比较复杂,毗邻重要的脊髓神经血管,全脊椎切除术围手术期风险比较高,可发生不同程度的并发症,常见为切口撕裂、深部感染、脑脊液渗漏、肿瘤复发、重建内固定失败等,文献中有不少报道。Hayashi等[10]回顾分析全脊柱切除术125例患者总的手术部位感染率为6.4%,而应用碘支持的内固定装置重建的69例患者感染率仅为1.4%,指出联合入路及非碘支持的内固定装置应用是感染发生的高危因素。Matsumoto等[11]报道了全脊柱切除术在恶性脊柱肿瘤治疗中内固定失败率高达到40%。而本组病例中发生一例严重的围手术期并发症,术前的L1肿瘤血管栓塞术后突然双下肢肌力0级,感觉障碍平面为腹股沟区以下,急诊复查腰椎MRI未见明显椎管占位,排除搬运过程脊柱病理性骨折继发性加重,究其原因,推断栓塞过程中不慎堵塞根髓动脉[12],造成脊髓缺血,临床表现为截瘫,未能完全恢复,Frankel级别从D级跌落至A级,造成不可逆的损伤,术后双下肢肌力0级,只能佩戴支具坐轮椅。术中发生1例硬脊膜撕裂,脑脊液流出,予以立即修补,术后常规引流观察引流量及液体色泽,采取头低脚高位,禁用激素消肿,预防脊髓感染,一周后引流量减少予以拔除,病程中患者生命体征平稳,无发热,未诉头痛等不适感,无感染迹象。另有术后1例患者下肢感觉麻木感有所加重,考虑术中长时间神经根牵拉损伤所致,术后通过营养神经等对症处理已恢复。
总而言之,脊柱转移性肿瘤在临床上的发生率呈现上升趋势,其病残率及预后严峻性值得脊柱外科医生重视,在治疗策略方面,外科手段是不可或缺的,应充分评估患者全身情况,肿瘤生长情况。而全脊椎切除术是一种更为积极主动的治疗手段,可以彻底切除肿瘤,重建脊柱生理结构,理论意义上的根治性手术,临床效果改善明显,生存期得到进一步提高,但存在很高的手术风险,需要临床医生过硬的手术技术及经验。考虑本组病例样本量不足,随访时间短,一期后路全脊椎切除术在脊柱转移瘤中的长期疗效与预后仍需进一步观察。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2008[J].CA Cancer J Clin,2008,58(2):71-96.
[2]Tomita K,Kaw ahara N,Kobayashi T,et al.Surgical strategy for spinal metastases[J].Spine(Phila Pa 1976),2001,26(3):298-306.
[3]邹学农,GrejsA,李海声,等.预期寿命估计对脊柱转移瘤手术选择与预后预测的临床意义[J].癌症,2006,25(11),1406-1410.
[4]Greco C,Pares O,Pimentel N,et al.Spinal metastases:From conventional fractionated radiotherapy to single-dose SBRT[J].Rep Pract Oncol Radiother,2015,20(6):454-463.
[5]Chen F,Xia YH,Cao WZ,et al.Percutaneous kyphoplasty for the treatmentofspinalmetastases[J].OncolLett,2016,11(3): 1799-1806.
[6]廖绪强,赵新建,张奎渤,等.两种经皮椎体成形术治疗椎体肿瘤的比较[J].中山大学学报(医学科学版),2011,32(6):807-811.
[7]Amendola L,Cappuccio M,De Iure F et al.En bloc resections for primary spinal tumors in 20 years of experience:effectiveness and safety[J].The Spine Journal,2014,14(11):2608-2617.
[8]Shao J,Tang Y,Yang HL,et al.The clinial application of interventional embolization in surgical treatment of spinal tumors[J].J Intervent Radiol,2014,23(11):993-996.
[9]Disch AC,Luzzati A,Melcher I,et al.Three-dimensoinal stiffness in a thoracelumbar en-bloc spondylectomy model:a biomechanical in vitro study[J].Clin Biomech,2007,22(9):957-964.
[10]Hayashi H,Murakami H,Demura S,et al.Surgical site infection after total en bloc spondylectomy:risk factors and the preventive new technology[J].The Spine Journal,2015,15(1):132-137.
[11]Matsumoto M,Watanabe K,Tsuji T,et al.Late instrumentation failure after total en bloc spondylectomy[J].J Neurosurg Spine,2011,15 (3):320-327.
[12]欧阳强,董伟华,肖湘生,等.脊柱肿瘤术前靶动脉栓塞[J].介入放射学杂志,2004,13(1):43-45.
R738.1
B
1003—6350(2017)01—0146—03
2016-06-07)
杨耀。E-mail:dragon_spring@yeah.net
10.3969/j.issn.1003-6350.2017.01.048
