过氧化物酶增殖物激活受体γ在分化型甲状腺癌中的表达及临床意义
2017-02-28茹晓婷刘勤江杨荣
茹晓婷+刘勤江+杨荣
[摘要] 目的 探讨过氧化物酶增殖物激活受体γ(PPAR-γ)在分化型甲状腺癌(DTC)中的表达情况与临床病理特征及分子特征(BRAFV600E)之间的关系。 方法 收集甘肃省肿瘤医院头颈外科2014年10月~2016年1月临床病理确诊的分化型甲状腺癌219例[206例乳头状甲状腺癌(PTC)、13例滤泡状甲状腺癌(FTC)]、52例结节性甲状腺肿及癌旁正常甲状腺组织31例;通过免疫组织化学染色检测PPAR-γ表达。 结果 PTC、FTC、结节性甲状腺肿及癌旁正常甲状腺组织PPAR-γ阳性表达率分别为48.5%(100/206)、53.9%(7/13)、46.2%(24/52)和64.5%(20/31),差異无统计学意义(χ2=3.172,P = 0.366);PPAR-γ表达与分化型甲状腺癌性别(P = 0.266)、年龄(P = 0.187)、肿块大小(P = 0.323)、淋巴结转移(P = 0.558)、TNM分期(P = 0.146)及复发危险度分层(P = 0.974)均无相关性;BRAFV600E突变组和BRAFV600E野生组中PPAR-γ表达阳性率分别为54.1%(85/157)和35.5%(22/62),差异有统计学意义(χ2=6.191,P = 0.013)。 结论 未发现PPAR-γ表达和临床病理特征之间的关系,还需进一步研究;PPAR-γ可能与BRAFV600E突变共同参与DTC的发生和发展,提示PPAR-γ有望作为治疗分化型甲状腺癌的靶点。
[关键词] 分化型甲状腺癌;过氧化物酶增殖物激活受体γ;BRAFV600E突变
[中图分类号] R736.1 [文献标识码] A [文章编号] 1674-4721(2016)11(a)-0025-04
过氧化物酶增殖物激活受体γ(PPAR-γ)是一类由配体激活的核转录因子,PPAR根据结构不同分为α、β和γ三种类,其中PPAR-γ分布最为广泛。PPAR-γ编码一种细胞核内受体转录因子亚型的过氧化酶增殖物激活受体,具有调节脂肪细胞分化、脂肪及碳水化合物的代谢、抑制炎性反应、细胞增殖与分化、细胞周期调控及肿瘤形成等多种功能[1]。研究证实,PPAR-γ在肺癌、胃癌、乳腺癌、结直肠癌、前列腺癌等多种恶性肿瘤中均有表达[2-6],并且在肿瘤的发生、发展和治疗中发挥着重要作用。但国内关于PPAR-γ在甲状腺癌中的报道相对较少。因此,本研究采用免疫组化检测PPAR-γ在分化型甲状腺癌(DTC)中的表达情况,并分析PPAR-γ与分化型甲状腺癌中临床病理特征及分子特征之间的关系,为DTC的诊断及治疗提供理论指导。
1 材料与方法
1.1 研究对象
收集甘肃省肿瘤医院头颈外科2014年10月~2016年1月临床病理确诊的分化型甲状腺癌219例,包括206例乳头状甲状腺癌(PTC)、13例滤泡状甲状腺癌(FTC)[男62例,女157例;年龄14~81岁,平均(45.6±12.9)岁]。按照美国癌症联合委员会(AJCC)第7版DTC的TNM分期系统,Ⅰ期107例,Ⅱ期28例,Ⅲ~Ⅳ期84例;并取正常甲状腺组织31例作为对照。所有患者均按照统一方案进行诊断和治疗[7]。根据《甲状腺结节和分化型甲状腺癌诊治指南》[8]提出的复发危险度分层将所有标本划分为低危组和中、高危组,其中低危组98例,中、高危组121例。本次研究已获医院伦理委员会的审批和认可,且所有标本均获患者及家属知情同意。
1.2 研究方法
1.2.1 主要试剂 一抗PPAR-γ兔抗人多克隆抗体(1∶200)、SP-9000试剂盒、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.2.2 PPAR-γ免疫组织化学染色 所有标本经4%中性甲醛固定,脱水后石蜡包埋,将石蜡包埋标本行4 μm厚的连续切片,60℃烘烤过夜。严格按照SP法免疫组织化学染色操作说明进行:切片脱蜡至水;高压修复抗原5 min;PBS冲洗3次,每次3 min,擦干;使用二抗同种动物血清15 min擦干后,直接滴加一抗(1∶200),放于37℃恒温箱2 h;PBS冲洗3次,每次3 min,擦干;滴加生物素化二抗,室温,15 min;PBS冲洗3次,每次3 min,擦干;滴加三抗辣根酶复合物15 min;PBS冲洗3次,每次3 min,擦干。DAB显色5 min,显微镜下控制;水洗终止染色;酸分化水洗、碱返蓝水洗、梯度乙醇脱水;中性树胶封固,显微镜下观察;PBS代替一抗作为空白对照。在进行免疫组化切片后,另切5~10 μm厚的蜡片放于EP管送基因突变检测实验室进行BRAFV600E突变检测,根据检测结果,将全部标本分为BRAFV600E突变组和BRAFV600E野生组。
1.3 结果判定
PPAR-γ定位于细胞质和/或细胞核。免疫组织化学染色结果判断参照文献[9]采用半定量分析法:依照细胞阳性着色程度(抗原含量)可分为:弱阳性(+)计1分;中等阳性(++)计2分;强阳性(+++)计3分,无着色直接计0分。依照阳性细胞数量可分为:弱阳性(+),阳性细胞数在25%以下计1分;中等阳性(++),阳性细胞数在25%~<50%计2分;强阳性(+++),阳性细胞数≥50%计3分;阳性细胞数在5%以下直接计0分。随机选取5个视野,200倍光学显微镜计数100个细胞,阳性细胞数为这5个视野的平均数。将每张片子着色程度得分和着色细胞百分率得分相乘,最后得分0分为阴性,≥1分为阳性(1~2分为+;3~4分为++;≥5分为+++)。
1.4 统计学方法
本文所有数据均借助于SPSS 22.0统计软件进行分析,计量资料采用均数±标准差(x±s)表示,率的比较采用交叉表格Pearsonchi-square(χ2)检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 PPAR-γ在分化型甲状腺癌组织以及正常甲状腺组织中的表达
PPAR-γ免疫组化阳性产物主要定位于细胞浆和/或细胞核周(图1,封四),PTC、FTC、结节性甲状腺肿及正常甲状腺组织PPAR-γ阳性率分别为48.5%、53.9%、46.2%和64.5%,PPAR-γ在甲状腺恶性肿瘤、良性肿瘤及正常甲状腺组织中均有表达,统计结果显示差异无统计学意义(χ2=3.172,P = 0.366>0.05)。见表1。
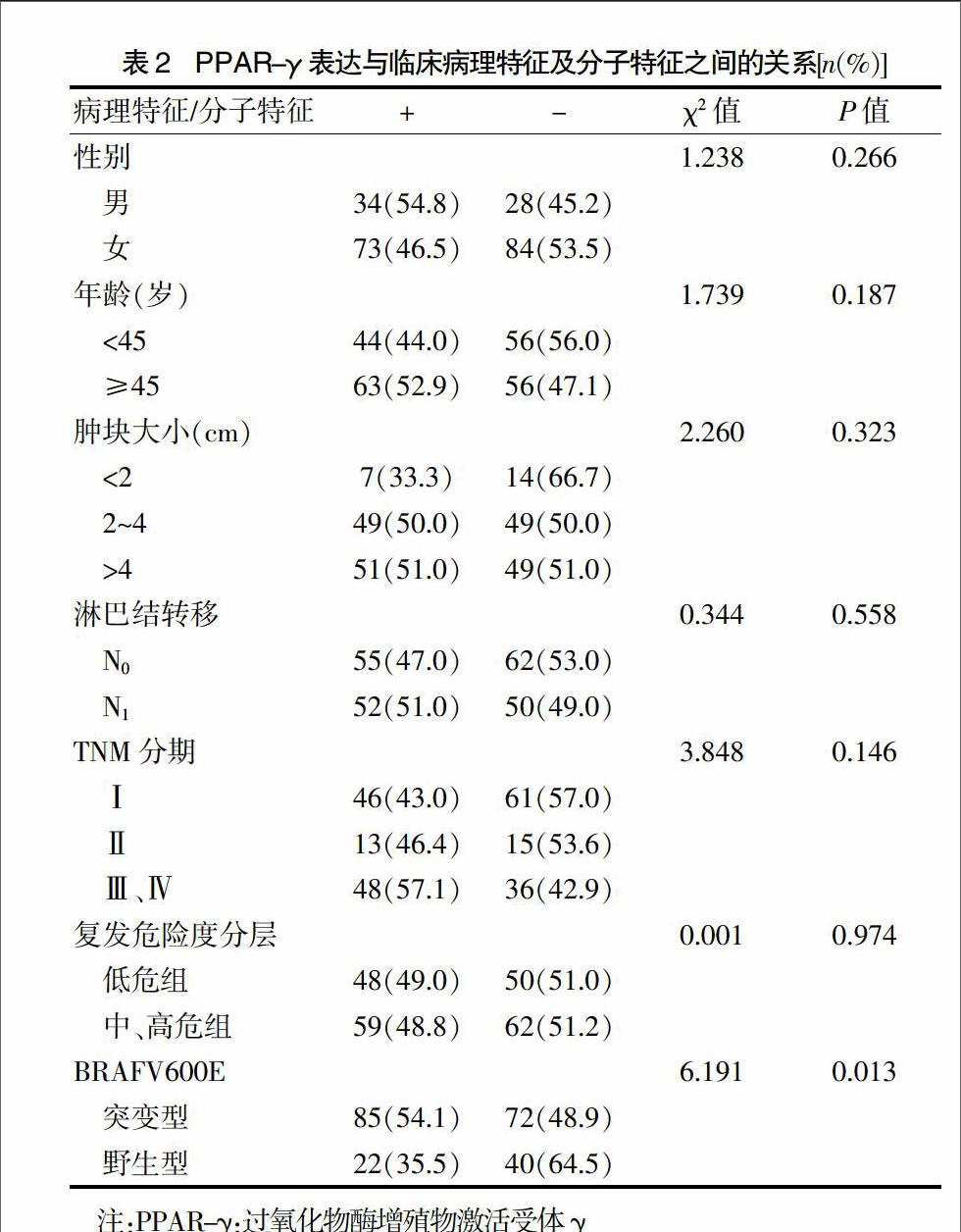
2.2 PPAR-γ表达与分化型甲状腺癌临床病理特征及分子特征之間的关系
统计结果显示PPAR-γ表达与分化型甲状腺癌性别(P = 0.266)、年龄(P = 0.187)、肿块大小(P = 0.323)、淋巴结转移(P = 0.558)、TNM分期(P = 0.146)及复发危险度分层(P = 0.974)均无相关性。而BRAFV600E突变组PPAR-γ阳性率[54.1%(85/157)]高于BRAFV600E野生组[35.5%(22/62)],差异有统计学意义(P = 0.013<0.05)。
3 讨论
近年来,甲状腺癌的发病率日渐上升,而DTC占所有甲状腺癌的90%以上。DTC治疗以手术为主,包括131I和TSH抑制治疗在内的综合治疗,10年生存率达95%以上[10],但DTC复发率高达30%[11],将会影响其生存率。因此,寻找特异性的分子标志对DTC的预后进行评估极其重要。
PPAR-γ基因位于染色体3p25,编码一种细胞核内受体转录因子亚型的PPAR-γ,属于核内受体超家族成员,PPAR-γ活化后通过与靶基因启动子区的过氧化酶增殖物反应原件(PPRE)相互作用进而调控相关基因的表达。在甲状腺中,PPAR-γ在良性及不同病理分类的恶性肿瘤组织中均有不同程度的表达[12-13]。本研究发现,PTC中PPAR-γ阳性率为48.5%,FTC中为53.9%,结节性甲状腺肿中为46.2%,正常甲状腺组织中为64.5%,PPAR-γ在甲状腺良性与恶性组织中均有表达且差异不大,与以前研究结果相似[14]。因此本研究结果提示PPAR-γ免疫组化染色并不能作为诊断甲状腺肿瘤的特异性分子标志。本研究发现PPAR-γ表达与DTC性别、年龄、肿块大小、淋巴结转移、TNM分期及复发危险度分层也均无相关性。出现这种结果可能由于PPAR-γ在甲状腺癌致癌机制中的作用极其复杂所造成的。一部分研究认为PPAR-γ可作为肿瘤抑制因子,PPAR-γ激动剂能阻滞细胞周期和诱导细胞凋亡,从而有效抑制癌细胞增殖[14],Kato等[15]研究认为PTC中PPAR-γ表达不足,通过激活核内NF-κB信号通路促进肿瘤形成。而另一部分研究认为PPAR-γ可作为肿瘤促进因子,Wood等[16]研究认为PPAR-γ被敲除后,降低了甲状腺未分化癌的侵袭性;PPAR-γ在DTC细胞中高水平表达,并且缺乏任何配体,也促进癌细胞生长。Kroll等[17]报道,在FTC中,PPAR-γ与Pax8发生基因重排,表达一种包括PAX8前9个外显子及全长PPAR-γ1在内的融合蛋白PPFP。Giordano等[18]研究认为PPAR-γ与Pax8发生重排后产生的融合蛋白PPFP是一种转录因子,在相应的基因启动子和细胞环境下,使一些蛋白的基因表达增加,如通过上调表皮生长因子受体(EGFR)基因的表达,导致下游相关基如BRAF等的激活,致使下游信号通路被持续性激活,从而使细胞发生癌变,并且基因报告分析证明PPAR-γ与PPFP功能相似,说明PPAR-γ确实能促进细胞癌变。另外,部分研究认为PPAR-γ激动剂可以抑制癌细胞生长[14],但这并不能确定PPAR-γ激动剂是受体依赖性的还是独立性的,更不能说明是PPAR-γ自身产生了抑癌效应。产生这种争议也可能是由于许多体外的试验研究并不能与体内肿瘤所处的微环境完全一致所造成。然而,本研究在分析PPAR-γ在BRAFV600E突变组和未突变组中的表达情况时发现,BRAFV600E突变组PPAR-γ阳性率(54.1%)高于BRAFV600E未突变组(35.5%),差异有统计学意义(P < 0.05)。该结果似乎也支持PPAR-γ作为促癌因子的观点。笔者推测可能是由于PPAR-γ活化后通过与过氧化酶增殖物反应原件PPRE相互作用进而调控相关基因的表达,一些生长调控基因如RAS、C-myc等就含有PPRE原件[19],而BRAF是RAS癌基因下游的效应器,PPAR-γ过表达与RAS基因内的PPRE原件相结合,引起RAS-RAF-MEK-ERK信号通路的紊乱,由于BRAFV600E的突变更是加剧了这一过程,导致癌的发生。因此,PPAR-γ在甲状腺肿瘤中的作用是极其复杂的,再一个可能也与PPAR-γ/PAX-8重排相关,该重排不仅发生于FTC也发生于PTC及良性甲状腺组织[20],当进行免疫组化染色时,阳性部位具体是PPAR-γ基因编码的PPAR-γ蛋白还是由PPAR-γ/PAX-8重排后表达的融合蛋白的PPAR-γ所表达的部分,其中的机制并不十分明确,所以关于PPAR-γ在甲状腺癌发生、发展中的作用以及是否可作为诊断或预后评估指标还需进一步研究确认。
然而就本研究结果来看,本研究虽未发现PPAR-γ对DTC诊断和预后评估的价值,但发现在BRAFV600E突变组的DTC中,PPAR-γ阳性率是较高的,提示PPAR-γ可能参与调控RAS-RAF-MEK-ERK信号通路,与BRAFV600E突变共同作用促进肿瘤产生,PPAR-γ有望作为治疗DTC的靶点。
[参考文献]
[1] Willson T,Brown P,Sternbach DB. The PPARs:from orphan receptors to drug discovery [J]. J Med Chem,2000, 43(43):527-550.
[2] Herrera CL,Kim DY,Kumar SR,et al. Peroxisome proliferator activated receptor γ protein expression is asymmetrically distributed in primary lung tumor and metastatic to lung osteosarcoma samples and does not correlate with gene methylation [J]. Bmc Veterinary Research,2015,11(1):1-11.
[3] Guo F,Ren X,Dong Y,et al. Constitutive expression of PPAR-γ inhibits proliferation and migration of gastric cancer cells and down-regulates Wnt/β-Catenin signaling pathway downstream target genes TERT and ENAH [J]. Gene,2016,584(1):31-37.
[4] Abduljabbar R,Alkaabi MM,Negm OH,et al. Prognostic and biological significance of peroxisome proliferator-activated receptor-gamma in luminal breast cancer [J]. Breast Cancer Research & Treatment,2015,150(3):511-522.
[5] Kwon KA,Yun J,Oh SY,et al. Clinical significance of peroxisome proliferator-activated receptor γ and TRAP220 in patients with operable colorectal cancer [J]. Cancer Research & Treatment,2016,48(1):198-207.
[6] Park HK,Kim HK,Kim HG,et al. Expression of peroxisome proliferator activated receptor gamma in prostatic adenocarcinoma [J]. Journal of Korean Medical Science,2015,30(5):533-541.
[7] 高明.頭颈肿瘤学[M].北京:科学技术文献出版社,2014.
[8] 高明.甲状腺结节和分化型甲状腺癌诊治指南[J].中华核医学与分子影像杂志,2013,33(2):1249-1272.
[9] Brunello AG,Weissenberger J,Kappeler A,et al. Astrocytic alterations in interleukin-6/soluble interleukin-6 receptor α double-transgenic mice [J]. American Journal of Pathology,2000,157(5):1485-1493.
[10] Ho AS,Louise Davies MD,Nixon IJ,et al. Increasing diagnosis of subclinical thyroid cancers leads to spurious improvements in survival rates [J]. Cancer,2015,121(11):1793-1799.
[11] Jiang L,Chu H,Zheng H. B-Raf mutation and papillary thyroid carcinoma patients [J]. Oncology Letters,2016,11(4):2699-2705.
[12] Gustafson KS,Livolsi VA,Furth EE,et al. Peroxisome proliferator-activated receptor gamma expression in follicular-patterned thyroid lesions. Caveats for the use of immunohistochemical studies [J]. American Journal of Clinical Pathology,2003,120(2):175-181.
[13] Galusca B,Dumollard JM,Chambonniere ML,et al. Peroxisome proliferator activated receptor gamma immunohistochemical expression in human papillary thyroid carcinoma tissues. Possible relationship to lymph node metastasis [J]. Anticancer Research,2004,24(3b):1993-1997.
[14] Copland JA,Marlow LA,Kurakata S,et al. Novel high-affinity PPARgamma agonist alone and in combination with paclitaxel inhibits human anaplastic thyroid carcinoma tumor growth via p21WAF1/CIP1 [J]. Oncogene,2006, 25(16):2304-2317.
[15] Kato Y,Ying H,Zhao L,et al. PPAR[gamma] insufficiency promotes follicular thyroid carcinogenesis via activation of the nuclear factor-[kappa] B signaling pathway [J]. Oncogene,2006,25(19):2736-2747.
[16] Wood WM,Sharma V,Bauerle KT,et al. PPARgamma promotes growth and invasion of thyroid cancer cells [J]. Ppar Research,2011,2011(5):1-11.
[17] Kroll TG,Sarraf P,Pecciarini L,et al. PAX8-PPAR-γ1 fusion in oncogene human thyroid carcinoma [J]. Science,2000,289(5483):1357-1360.
[18] Giordano TJ,Au AY,Kuick R,et al. Delineation,functional validation,and bioinformatic evaluation of gene expression in thyroid follicular carcinomas with the PAX8-PPARG translocation [J]. Clin Cancer Res,2006,12(7 Pt 1):1983-1993.
[19] Vanden Heuvel JP. Peroxisome proliferator-activated receptors:a critical link among fatty acids,gene expression and carcinogenesis [J]. Journal of Nutrition,1999,129(2S Suppl):575S-580S.
[20] Castro P,Rebocho AP,Soares RJ,et al. PAX8-PPARgamma rearrangement is frequently detected in the follicular variant of papillary thyroid carcinoma [J]. Journal of Clinical Endocrinology & Metabolism,2006,91(91):213-220.
(收稿日期:2016-07-14 本文編辑:张瑜杰)
