一株鸡源H9N2亚型禽流感病毒的致病性及其HA基因遗传进化分析
2017-02-28刘丽娅金映红沙依兰卡依扎陆桂丽
汪 萍,刘丽娅,金映红,沙依兰·卡依扎,陆桂丽,夏 俊,成 进
(新疆畜牧科学院兽医研究所/新疆畜牧科学院动物临床医学研究中心,新疆乌鲁木齐 830011)
一株鸡源H9N2亚型禽流感病毒的致病性及其HA基因遗传进化分析
汪 萍,刘丽娅,金映红,沙依兰·卡依扎,陆桂丽*,夏 俊,成 进
(新疆畜牧科学院兽医研究所/新疆畜牧科学院动物临床医学研究中心,新疆乌鲁木齐 830011)
为了解H9N2亚型禽流感病毒在新疆蛋鸡养殖场的致病性及遗传进化特点,对一株分离自蛋鸡的禽流感病毒A/Chicken/Xinjiang/01/2010 (H9N2)进行了致病性及遗传进化分析。结果显示,分离株的MDT为92 h,ICPI指数为1.125,IVPI指数为0.14,HA裂解位点处氨基酸序列为335RSSRGLF342,这些特征均证实该分离株为低致病性AIV。HA基因遗传进化分析表明,该分离株在系统进化树上与A/swine/XJWLMQ/7/09(H9N2)及3株野生鸟类新疆分离株的亲缘关系最为接近,该分离株HA基因属于欧亚谱系的A/chicken/Beijing/94(H9N2)和A/chicken/Hongkong/G9/97(H9N2)的一个分支。
禽流感病毒;H9N2亚型;蛋鸡;致病性;遗传进化
近年来,国内外对人及哺乳动物H9N2亚型禽流感病毒抗体的检测显示,人、猪、犬及猫等哺乳动物体内均可检出H9N2亚型AIV抗体[1-3]。目前,已有文献报道的H9N2亚型AIV感染人的病例约17例,均未引起死亡[4-7],但足以说明H9N2亚型AIV已经具备感染人的能力。虽然该亚型病毒尚不能在人与人之间传播,但存在和其他亚型病毒重组产生新毒株的潜在危害。2013年,我国H7N9亚型流感病毒流行,最终证实该病毒是H7病毒的HA基因、N9病毒的NA基因及H9N2病毒的6个内部基因片段组成的重配病毒[8]。本研究对从新疆蛋鸡养殖场产蛋下降鸡体内分离的一株H9N2亚型禽流感病毒(命名为A/Chicken/Xinjiang/01/2010 (H9N2))进行致病力及分子流行病学特点研究,以分析新疆分离株产生变异的位点及新疆分离毒株HA基因在H9N2亚型禽流感分类中所处的分支,为新疆禽流感的防控提供依据。
1 材料与方法
1.1 材料
1.1.1 SPF鸡胚 SPF鸡胚购自济南斯帕法斯家禽有限公司。
1.1.2 病毒、载体和宿主细胞 H9N2亚型禽流感病毒(A/Chicken/Xinjiang/01/2010)和E.coli感受态细胞DH5α由新疆畜牧科学院兽医研究所病毒室保存;pMD18-T载体购自宝生物工程(大连)有限公司。
1.1.3 主要试剂 One Step RT-PCR Kit Ver.2、ExTaqDNA聚合酶、DNA Marker DL 2 000、DNA Fragment Purification Kit Ver.2、MiniBEST Plasmid Purification Kit Ver.2等,宝生物工程(大连)有限公司产品;Ampicillin trihydrate,上海生工生物工程技术服务有限公司产品。
1.2 方法
1.2.1 病毒致病性试验
1.2.1.1 鸡胚最小致死量的平均致死时间(MDT)测定 将分离株3代毒液用PBS稀释液做10倍系列稀释,接种10日龄SPF鸡胚,连续7 d在相应接种时间记录每一鸡胚的死亡时间,并测定每胚尿囊液的HA活性,计算MDT值。1.2.1.2 脑内接种致病指数(ICPI)测定 将分离株3代毒液用PBS稀释液1∶10稀释后,经脑内接种10只1日龄SPF鸡,每只接种 0.05 mL。连续8 d在相应时间观察鸡群发病、死亡情况,计算ICPI值。1.2.1.3 静脉接种致病指数(IVPI)测定 将分离株3代毒液用PBS稀释液1∶10稀释后,经翅静脉接种10只6周龄SPF鸡,每只 0.1 mL。连续观察10 d,记录发病和死亡情况。
1.2.2 HA基因的克隆
1.2.2.1 PCR引物设计与合成 根据国内外已发表的H9亚型禽流感病毒HA基因序列,用Oligo6.0软件设计特异性引物,由上海生工生物工程技术服务有限公司合成。引物序列HA-U(5′-AGCAAAAgCAGGGGAATTT-3′)和HA-D(5′-TTATATACAAATGTTGCATCTGC-3′)。
1.2.2.2 RNA提取 吸取250 μL的鸡胚尿囊液,按照 TRIZOL LS Reagent试剂盒使用说明书进行操作。
1.2.2.3 HA基因的RT-PCR扩增 以提取的5 μL RNA溶液做模板,应用HA-U和HA-D为引物进行RT-PCR反应,反应程序为:50℃ 30 min;94℃ 5 min;94℃ 30 s,55℃ 45 s,72℃ 2 min,35个循环;72℃ 10 min。用10 g/L琼脂糖凝胶电泳进行RT-PCR产物分析。
1.2.2.4 HA基因的鉴定 使用DNA Fragment Purification Kit Ver.2试剂盒对RT-PCR产物进行纯化,纯化产物连接于pMD18-T载体,连接产物转化DH5α感受态细胞,涂布于含有10 mg/mL Amp+的LB琼脂板上,37℃培养过夜;随机挑取单菌落接种于含Amp+的LB液体培养基中,37℃摇床培养14 h;按照MiniBEST Plasmid Purification Kit Ver.2试剂盒说明提取质粒,并进行PCR鉴定,将阳性质粒送上海生工生物工程技术服务有限公司测序。1.2.3 HA基因遗传进化分析 应用MEGA6.06软件对分离株HA序列与国内外各AIV分支代表毒株的HA序列进行遗传进化分析,参考毒株名称及登录号见表1。

表1 H9N2亚型AIV参考毒株
1.2.4 HA蛋白质氨基酸序列分析 应用Lasergene7.1 DNA Star软件对分离株的HA裂解位点、糖基化位点进行分析。
2 结果
2.1 MDT测定
接种10日龄SPF鸡胚,该分离株可致鸡胚死亡,胚体出现明显的出血斑点(图1)。MDT指数为92 h。
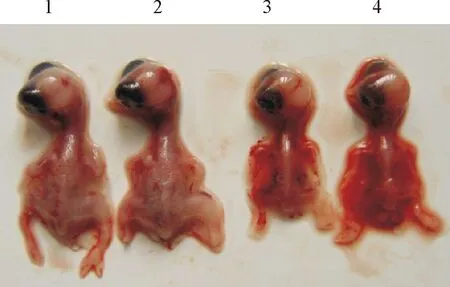
1、2.阴性对照;3、4.分离株感染鸡胚
1 ,2.Negative control; 3,4.Isolated virus infected chicken embryos
图1 分离病毒感染鸡胚的病变
Fig.1 Isolated virus infected chicken embryos
2.2 ICPI测定
病毒接种1日龄SPF鸡,1 d有1只鸡发病,8 d共有10只鸡发病死亡, ICPI指数为1.125。
2.3 IVPI测定
10只试验鸡10 d内死亡2只,IVPI指数为0.14。表明该禽流感分离株为低致病力毒株,对鸡具有弱致病性。
2.4 HA基因的克隆
2.4.1 RT-PCR扩增 用特异性引物成功扩增出大小约1.7 kb的目的片段,与预期大小相符(图2)。

1.HA基因扩增产物;2.阴性对照;M.DNA标准DL 2 000
1.HA gene products;2.Negative control;M.DNA Marker DL 2 000
图2 分离株HA基因RT-PCR扩增结果
Fig.2 RT-PCR amplification result of HA gene of isolated virus
2.4.2 HA基因的克隆与鉴定 目的片段连接于pMD18-T载体上(图3);以重组质粒为模板,用上述特异性引物进行PCR鉴定,结果扩增出与预期大小一致的约1.7 kb的目的片段,表明HA基因已成功克隆到pMD18-T载体上。
2.5 HA基因遗传进化分析
该分离株在系统进化树上与A/swine/XJWLMQ/7/09(H9N2)及3株野生鸟类新疆分离株的亲缘关系最为接近,其次与西北地区分离毒株,如陕西、宁夏、甘肃的H9N2亚型HA亲缘关系较为接近。该分离株HA基因属于欧亚谱系的Y280-Like 亚群的A/chicken/Beijing/1/94(H9N2)和A/chicken/Hongkong/G9/97(H9N2)的一个分支(图4)。A/chicken/Beijing/1/94(H9N2)是中国最早分离的H9N2亚型的代表毒株,具有中国大陆AIV的地域特点,对鸡可产生较高的病死率。A/chicken/Hongkong/G9/97(H9N2)仅对鼠有致病性。
2.6 HA蛋白氨基酸序列分析
HA裂解位点处氨基酸序列为335RSSRGLF342,为非连续的碱性氨基酸。存在8个糖基化位点分别为335RSSRGLF342,为非连续的碱性氨基酸。存在8个糖基化位点,分别为29NST、141NVS、218NRT、298NTT、305NVS、313NCS、492NGT、551NGS。与我国早期的分离株A/Chicken/Beijing/1/94(H9N2)比较,A/Chicken/Xinjiang/01/2010 (H9N2)、A/Chicken/Ningxia/1/2011(H9N2)、A/Chicken/shaanxixy/1/2012(H9N2)在第315位氨基酸由P突变为S,增加了1个糖基化位点。

1、5.阳性克隆;2~4.阴性克隆;M.DNA标准DL 15 000
1,5. Positive clones; 2-4.Negative clones;M.DNA Marker DL 15 000
图3 HA基因克隆至pMD18-T载体的扩增产物
Fig.3 Amplification products of HA gene cloned pMD18-T vector

图4 分离株与参考株HA基因遗传进化分析
3 讨论
我国对H9N2亚型禽流感的防控主要采取疫苗免疫预防的措施,但因其致病力较弱,感染后多表现为亚临床症状而容易被忽视。近年来,H9N2亚型禽流感病毒不断跨越种间屏障,感染人及哺乳动物,且存在与其他亚型流感毒株重组产生新致病株的可能性,给公共卫生安全带来重大隐患。因此,针对病毒的分子生物学特征开展研究很必要。HA基因是流感病毒重要的糖蛋白,且该基因发生突变常会引起病毒抗原性改变。该基因的裂解位点、受体结合位点以及糖基化位点发生变化可能会影响病毒毒力、致病性、吸附能力和感染宿主范围[9-12]。
本试验对一株分离自蛋鸡的H9N2亚型AIV进行了致病性试验,MDT指数、IVPI指数和ICPI指数均证明该毒株为低致病力毒株。HA基因序列分析表明,新疆分离株HA裂解位点处氨基酸序列为335RSSRGLF342,具有典型的低致病性毒株特点,该结论与致病性试验结果一致。HA蛋白糖基化位点在315位的氨基酸发生了突变,使糖基化位点由7位增加到8位。另外,第234位氨基酸受体结合位点为由Q突变为L,表明病毒已经可识别人呼吸道上皮细胞的唾液酸α 2,6-半乳糖,该分离株具有潜在感染人的能力[9,12-13],应该引起足够重视。
禽流感病毒新疆分离株致病力试验及HA基因分子生物学分析证明该毒株为低致病力毒株,第234位氨基酸发生变异,与新疆AIV野鸟分离株、猪源分离株同处于一个小分支内,亲缘关系很近,新疆临近省份的AIV分离株亲缘关系也较近,提示根据地域特征制定针对野生鸟类、哺乳动物、家禽流感的综合防控措施具有非常重要的意义。
[1] Wang Q, Ju L, Liu P,et al.Serological and virological surveillance of avian influenza A virus H9N2 subtype in humans and poultry in shanghai,China,between 2008 and 2010[J].Zoonoses Public Health,2015,62(2):131-140.
[2] Butt K M,Smith G J,Chen H,et al.Human infection with an avian H9N2 influenza A virus in Hong Kong in 2003[J].J Clin Microbiol,2005,43:5760-5767.
[3] 刘秀梵.H5和H7亚型禽流感的防控[J].中国家禽,2013,35(22):7-8.
[4] 蔡访潺,詹幼芳,黄建云,禽(h9n2)亚型流感病毒感染汕头人群的报告[J].海峡预防医学杂志,2002(6):26-28.
[5] Peiris M,Yuen K Y,Leung C W,et al.Human infection with influenza H9N2 [J].Lancet,1999 (354):916-917.
[6] Cheng V C,Chan J F,Wen X,et al.Infection of immunocompromised patients by avian H9N2 influenza A virus[J].J Infect,2011,62:394-399.
[7] 汪 萍,夏 俊,参都哈什,等.新疆哺乳动物流感病毒血清学监测与分析[J].中国预防兽医学报,2013,35(9):767-769.
[8] 黄欣梅,李 银,刘宇卓,等.华东地区H9N2亚型禽流感病毒HA基因的遗传演化分析[J].江苏农业学报,2015,31(2):382-388.
[9] 徐晓龙,包红梅,陈化兰,等.影响禽流感病毒致病性和传播的关键氨基酸位点的研究进展[J].中国预防兽医学报,2014,36(2):165-168.
[10] Huang Yiwei,Zhang Hong,Li Xiaodan,et al.Detection and genetic characteristics of H9N2 avian influenza viruses from live poultry markets in Hunan Province,China[J].PLoS One,2015,10(11):e0142584. doi: 10.1371/journal.pone.
[11] Schrauwen E J A, Fouchier R A M.Host adaptation and transmission of influenza A viruses in mammals[J].Emerg Microbes Infect,2014,3(2):e9.
[12] de Graaf M, Fouchier R A M.Role of receptor binding specificity in influenza A virus transmission and pathogenesis[J].EMBO J,2014 ,33(8):823-841.
[13] Shi Weifeng,Li Wei,Li Xianbin,et al.Phylogenetics of varied subtypes of avian influenza viruses in China potential threat to humans [J].Protein Cell,2014,5(4) :253-257.
Pathogenicity and Phylogenetic Analysis of a H9N2 Subtype Avian Influenza Virus Isolated from Chicken
WANG Ping, LIU Li-ya, JIN Ying-hong, SHAYILAN·Ka-zha-yi, LU Gui-li, XIA Jun, CHENG Jin
(VeterinaryResearchInstitute,AnimalScienceAcademyofXinjiang,AnimalClinicalMedicineResearchCenter,AnimalScienceAcademyofXinjiang,Urumqi,Xinjiang,830011,China)
For understanding the pathogenicity and phylogenetic characteristics of avian influenza virus which isolated from laying hen in a egg chicken plant of Xinjiang,the pathogenicity and phylogenetic analysis of A/Chicken/Xinjiang/01/2010 (H9N2) were studied.The results indicated that the MDT,ICPI and IVPI of the isolated strain were 92h,1.125 and 0.14,respectively.The cleavage site of HA was 335RSSRGLF342.All of the above indicated that the isolated strain was LPAIV.Phylogenetic analysis of HA gene showed that the isolated strain has close relationship with A/swine/XJWLMQ/7/09(H9N2) and other three AIV which isolated from wild bird in Xinjiang.The isolated strain belongs to the branch of A/chicken/Beijing/94(H9N2) and A/chicken/Hongkong /G9/97(H9N2).
Avian influenza virus; H9N2 subtype; laying hen; pathogenicity; phylogenetic analysis
2016-05-27
公益性行业(农业)科研专项经费项目(201103008)
汪 萍(1979-),女,安徽砀山人,学士,主要从事家畜传染病诊断及人畜共患病研究。*通讯作者
S852.659.5
A
1007-5038(2017)01-0041-04
