下调TCF3抑制非小细胞肺癌细胞的增殖和迁移能力
2017-02-28王士猛
王士猛
(山东省菏泽市立医院胸外科,山东 菏泽 274000)
下调TCF3抑制非小细胞肺癌细胞的增殖和迁移能力
王士猛△
(山东省菏泽市立医院胸外科,山东 菏泽 274000)
目的: 探索下调T细胞因子3(TCF3)抑制非小细胞肺癌细胞增殖和迁移的分子机制。方法: 运用Lipofectamine 2000转染法将siTCF3和阴性对照siRNA(NCsiRNA)转染非小细胞肺癌A549和H1299细胞;运用real-time PCR和Western blot分别测定TCF3的mRNA和蛋白水平;运用萤光素酶报告基因实验测定TCF3的转录活性;MTT、克隆形成实验、Transwell实验和Annexin V-FITC/PI染色联合流式细胞术分别测定细胞的活力、克隆形成能力、转移能力及细胞凋亡率;Western blot检测Wnt、c-Myc、基质金属蛋白酶(MMP)-9、MMP-13、金属蛋白酶组织抑制物(TIMP)-1的蛋白表达水平。结果: 与NCsiRNA转染组的细胞比较,siTCF3显著抑制A549细胞和H1299细胞中TCF3的mRNA 和蛋白水平 (P<0.01)。TCF3转录活性和c-Myc蛋白表达水平明显低于NCsiRNA细胞(P<0.05)。MTT实验结果显示,培养24 h、48 h、72 h和96 h的A549-siTCF3和H1299-siTCF3细胞活力均显著低于NCsiRNA细胞(P<0.05)。与NCsiRNA细胞相比,siTCF3显著抑制A549细胞 和H1299细胞的克隆形成能力(P<0.01)。Transwell实验结果显示A549-siTCF3和H1299-siTCF3细胞迁移数显著低于A549-NCsiRNA和H1299-NCsiRNA组细胞(P<0.05)。流式细胞术分析结果显示A549-siTCF3细胞和H1299-siTCF3细胞的凋亡率显著高于A549-NCsiRNA和H1299-NCsiRNA细胞(P<0.01)。Western blot实验结果显示,下调TCF3表达能抑制Wnt蛋白的表达,MMP-9和MMP-13的蛋白表达明显降低,TIMP-1的蛋白表达增高。结论: siTCF3显著抑制A549细胞和H1299细胞的增殖和迁移能力,并诱导细胞凋亡,其分子机制可能通过下调Wnt通路活性以及调控MMP家族关键成员的表达而实现。
非小细胞肺癌; T细胞因子3; 基质金属蛋白酶
肺癌已成为严重威胁人类健康与生命最常见的恶性肿瘤之一,其发病率和死亡率位居所有癌症之首[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌的主要类型,约占肺癌的80%~85%[2]。目前放疗是NSCLC的主要治疗方案,但NSCLC对放疗产生耐受是导致预后不良和五年生存率低的主要原因[3]。因此,寻找和研发治疗NSCLC的小分子靶向药物是亟需解决的问题,已成为治疗肺癌的重要课题。
T细胞因子3(T-cell factor 3,TCF3)是经典Wnt信号通路的效应分子之一。早期的研究发现TCF3基因缺失导致早期胚胎发育致死,表现为神经和中胚层发育缺陷[4]。TCF3过表达能刺激人皮肤毛囊隆突表皮原始祖细胞分裂并抑制细胞分化。研究发现TCF3与Oct4、Sox2、Nanog基因启动子区域结合,拮抗这些基因的作用进而抑制鼠胚胎干细胞的自我更新[5-6]。Wnt通路激活使TCF3从相应的基因启动子上脱离,激活靶基因转录从而增强多能干细胞的分裂活性并延迟对分化刺激的应答[7]。最近研究表明TCF3对肾癌、乳腺癌、胚胎癌等人类肿瘤的发生起着抑制或促进作用[8]。目前TCF3的功能在肺癌中的研究甚少[9],近新研究发现TCF3在肺癌病人手术切除的癌变组织及几种NSCLC细胞系中均有表达,在正常16HBE细胞中亦有表达,而在癌旁组织中无表达。但TCF3对肺癌发生、发展是促进还是抑制作用尚不清楚。本研运用siRNA干扰技术下调人肺腺癌细胞系A549细胞和H1299细胞中TCF3的表达,体外研究下调TCF3表达对肺腺癌细胞增殖和迁移的影响及其可能的分子机制,为以TCF3为靶点研发治疗肺癌的靶向药物提供理论依据。
材 料 和 方 法
1 试剂和材料
非小细胞肺癌细胞系A549和H1299购自ATCC;MTT、DMSO和胰蛋白酶购自Sigma;DMEM培养基(Gibco);胎牛血清和双抗购自北京金博益生物技术有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;TOP-Flash/FOP-Flash质粒购自Upstate;Lipofectamine 2000转染试剂购自Invitrogen;Dual-Luciferase Reporter Assay System购自Promega;Transwell板购自Corning;抗c-Myc和GAPDH抗体购自Abcam;抗CTF3、基质金属蛋白酶(matrix metalloproteinase,MMP)-9、MMP-13和金属蛋白酶组织抑制物1(tissue inhibitor of metalloproteinase-1,TIMP-1)抗体购自Cell Signaling Technology;辣根过氧化物酶(HRP)标记的IgG II 抗购自北京中杉金桥公司;Total RNA 提取试剂、反转录试剂盒(PrimeScript®RT reagent Kit with gDNA Eraser)和real-time PCR 试剂盒(SYBR®Premix Ex TaqTMⅡ)购自 TaKaRa;BCA蛋白浓度检测试剂盒购自Thermo。
2 主要方法
2.1 细胞培养 A549细胞和H1299细胞培养于DMEM培养基(含10% 胎牛血清、1%青霉素和1%链霉素)中,置于37 ℃、5% CO2及完全湿度培养箱内,待细胞融合度达到80%~90%时进行细胞传代。
2.2 siRNA合成和细胞转染 针对TCF3基因开放阅读框序列,运用Ambion的网上在线软件(http://www.ambion.com/techlib/misc/siRNA_finder.html)设计siTCF3,同时设计阴性对照siRNA (negative control siRNA, NCsiRNA),由上海生工合成。将生长良好的A549细胞和H1299细胞以细胞密度为每孔2×105个接种到6孔板中,培养至细胞融合度达到85%左右时按照Lipofectamine 2000说明书进行转染。先用无血清OptiMEM培养液将Lipofectamine 2000稀释和配置siTCF3,然后将等体积Lipofectamine 2000与siTCF3轻轻混匀,室温静置10 min后加入细胞中使siTCF3终浓度为30 μmol/L,培养4 h后换成完全培养基,以转染NCsiRNA为阴性对照,置于培养箱中培养用于后续实验。
2.3 Real-time PCR 转染的细胞培养48 h后收集细胞,按照TRIzol试剂说明书提取总RNA,浓度测定并保存于-80 ℃。按照RT-PCR试剂盒说明书合成cDNA,反应条件为42 ℃ 1 h、70 ℃ 5 min;4 ℃放置10 min。cDNA置于-80 ℃保存。取2 ng cDNA进行real-time PCR反应,扩增引物见表1。反应条件为95 ℃ 5 min;95 ℃ 30 s、58 ℃ 30 s、72 ℃ 40 s,35个循环;72 ℃ 10 min。运用 SYBR Green Ⅱ 荧光染料法和IQ5TMReal-time PCR Detection System (Bio-Rad)进行real-time PCR数据分析,结果经内参照GAPDH校正,mRNA相对表达量用 2-ΔΔCt表示。
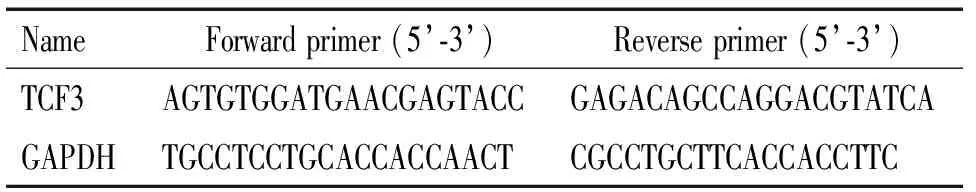
表1 Real-time PCR引物序列
2.4 萤光素酶报告基因检测 将转染的A549和H1299细胞经胰酶消化,计数后以每孔5×104个接种于24孔板中,待细胞融合度为70%左右时进行细胞转染。按照Lipofectamine 2000说明书将200 ng TOP-Flash报告质粒和10 ng FOP-Flash海肾萤光素酶对照质粒共转染细胞,48 h后收集细胞。加入1×被动裂解缓冲液重悬细胞,置于4 ℃裂解24 h,12 000 r/min,4 ℃离心10 min,收集上清并测定细胞上清中萤光素酶的活性。以海肾萤光素酶活性为内参照计算样品中萤火虫萤光素酶的活性。
2.5 MTT实验测定细胞活力 将转染的A549细胞和H1299细胞经胰酶消化后,以每孔2.5×104个接种于96孔板中,于培养箱中分别在24 h、48 h、72 h、96 h时进行MTT实验,每孔加入20 μL(5 g/L)MTT,37 ℃继续培养4 h,弃掉培养液,每孔加入150 μL DMSO,置于摇床上室温振荡5 min,用酶标仪测定492 nm处的吸光度(A)值,按下式计算细胞活力抑制率(%)=(对照组A均值-实验组A均值)/实验组A均值×100%。
2.6 克隆形成实验 转染的A549细胞和H1299细胞经胰酶消化后计数,细胞以每皿500个/接种于90 mm细胞培养皿中,置于37 ℃、5% CO2培养箱中培养,设3个平行皿,置于37 ℃、5% CO2孵箱中培养,直到通过出现肉眼能清晰观察到可见的细胞克隆(约2周);弃掉培养基,PBS洗涤,4%甲醛固定10 min,PBS洗涤,吉姆萨染色10 min,自来水清洗,晾干后计数,按下列公式计算细胞克隆形成率=(细胞克隆数平均值/铺板细胞总数)×100%。
2.7 细胞迁移实验 转染的A549细胞和H1299细胞经胰酶消化,然后在Transwell每个培养孔上室中加入2×104个细胞,下室为无血清培养基,设置空白对照组;37 ℃继续培养6 h后,经4%多聚甲醛固定、乙醇脱水、结晶紫染色、洗涤。用棉签轻轻擦去上室的贴壁细胞,在显微镜下拍照并计数从Transwell上室迁移至微孔膜下层的细胞,每组设3个重复孔,通过每组Transwell的迁移细胞数比较细胞的迁移能力。
2.8 流式细胞术测定细胞凋亡 转染的A549细胞和H1299细胞经消化后以细胞密度为每孔3×104个接种接种到6孔板中,培养72 h后弃掉培养基,用PBS洗涤3次,无EDTA的胰酶消化,离心收集细胞,按照Annexin V/PI试剂盒说明书操作,先加入500 μL的binding buffer重悬细胞,再加入5 μL FITC标记的Annexin V和5 μL PI混匀,室温下避光孵育15 min,运用流式细胞仪测定细胞凋亡。
2.9 Western blot实验 转染的A549细胞和H1299细胞培养48 h。收集细胞,加入RIPA重悬细胞,超声破碎、12 000 r/min,4 ℃离心10 min,按照BCA试剂盒说明书测定总蛋白浓度。每个样本取30 μg进行SDS-PAGE,将蛋白转移到硝酸纤维素膜上,5%脱脂奶粉室温封闭1 h,分别孵育 Ⅰ 抗(Wnt、c-Myc、CTF3、MMP-9、MMP-13和TIMP-1),β-actin为内参照,4 ℃过夜。TBST洗膜、孵育 II 抗,室温1 h。ECL显影后扫描,蛋白相对表达量经内参照归一化后经Quanity One软件分析。
3 统计学处理
每个实验进行3次独立重复试验。应用SPSS 17.0统计软件进行相关数据分析,结果用均数±标准差(mean±SD)表示,多组间的比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD法。以P<0.05为差异有统计学意义。
结 果
1 A549和H1299细胞中TCF3的mRNA及蛋白表达情况
Real-time PCR结果显示,siTCF3显著抑制A549细胞和H1299细胞中TCF3 mRNA的表达显著低于阴性对照组(P<0.01)。Western blot实验结果进一步显示,siTCF3明显下调A549细胞和H1299细胞TCF3蛋白的表达,与阴性对照组比较差异具有统计学意义(P<0.01),见图1。
2 Wnt通路的转录活性及其靶基因c-Myc的蛋白表达水平
TOP-Flash/FOP-Flash双萤光素酶报告基因结果显示,与阴性对照组比较,siTCF3转染组细胞的TOP-Flash/FOP-Flash比值明显降低(P<0.01),提示TCF3可能具有促进转录调节的作用。Western blot实验结果显示,与阴性对照组比较,siTCF3转染组细胞的c-Myc蛋白表达量明显降低(P<0.01),见图2、表2。
3 干扰TCF3表达对肺癌细胞增殖的影响
MTT实验结果显示,转染siTCF3的A549和H1299细胞培养24 h、48 h、72 h和96 h的细胞活力分别为(96.26±15.23)%、(78.93±11.27)%、(56.32±6.58)%、(43.54±5.52)%和(83.74±16.20)%、(65.31±9.52)%、(57.00±7.33)%、(36.90±4.38)%。除了24 h的A549细胞外,各时点的细胞活力显著低于阴性对照组(P<0.05),提示下调TCF3的表达能抑制A549细胞和H1299细胞的活力,见图3。为了进一步证明下调TCF3能抑制肺癌细胞增殖,我们运用克隆形成实验发现下调TCF3表达能抑制A549和H1299细胞的克隆形成,与阴性对照组比较,siTCF3显著抑制A549和H1299细胞的克隆形成能力,其克隆形成率分别为(0.58±0.03)和(0.24±0.01),与对照组比较差异具有统计学意义(P<0.01),见图4。

Figure 1.The expression of TCF3 at mRNA and protein levels in the lung cancer cells with RNA interference. Mean±SD.n=3.**P<0.01vsNCsiRNA group.
图1 RNA干扰肺癌细胞中TCF3 mRNA和蛋白表达

Figure 2.The effect of down-regulated TCF3 expression on the transcriptional activity of Wnt pathway and the expression of target gene c-Myc protein. A: the detection of transcriptional activity in Wnt pathway by TOP-Flash/FOP-Flash; B: the protein expression of c-Myc detected by Western blot. Mean±SD.n=3.**P<0.01vsNCsiRNA group.
图2 下调TCF3表达对Wnt通路转录活性及靶基因c-Myc蛋白表达的影响

表2 Wnt通路的转录活性及Wnt靶基因c-Myc的蛋白表达水平
**P<0.01vsNCsiRNA group.
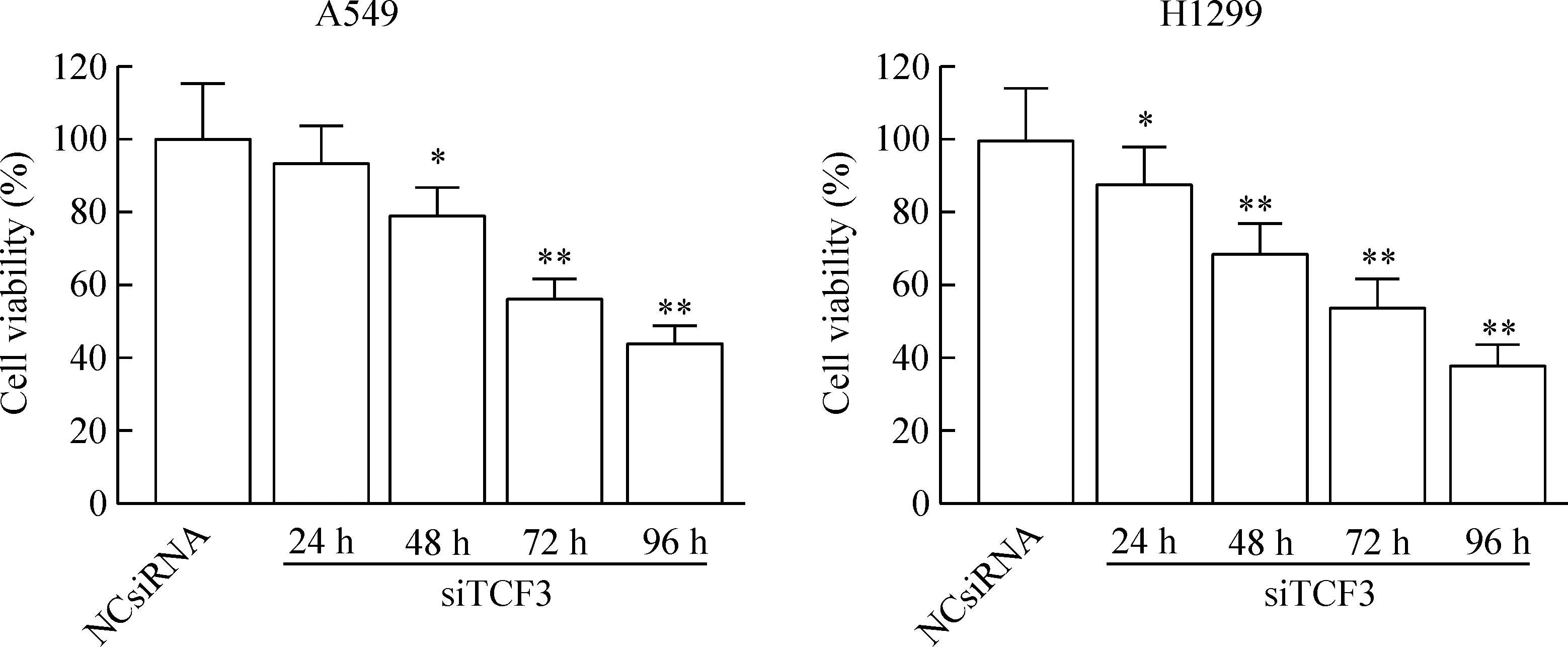
Figure 3.The effect of TCF3 down-regulation on the viability of lung cancer cells. Mean±SD.n=3.*P<0.05,**P<0.01vsNCsiRNA group.
图3 下调TCF3的表达对肺癌细胞活力的影响
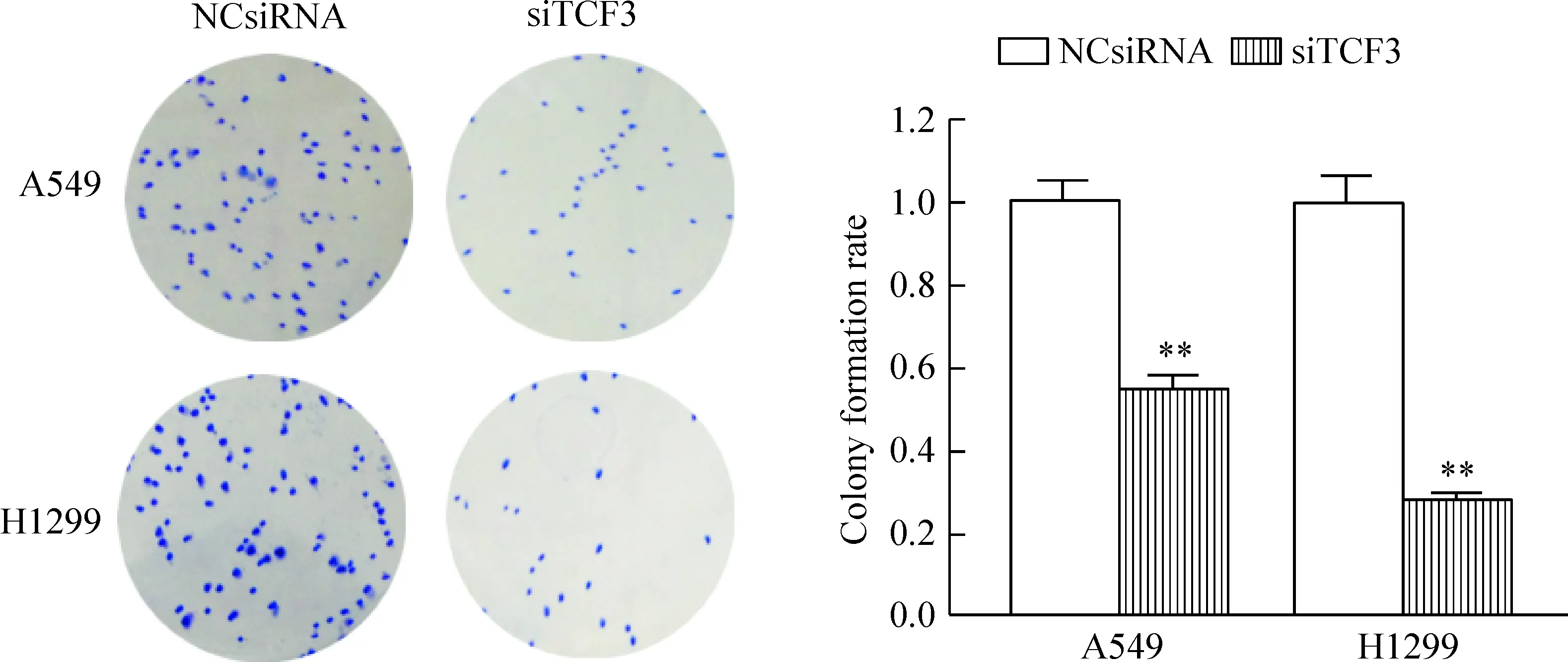
Figure 4.The effect of down-regulation of TCF3 expression on the colony formation ability of lung cancer A549 cells and H1299 cells. Mean±SD.n=3.**P<0.01vsNCsiRNA group.
图4 下调TCF3的表达对肺癌细胞克隆形成能力的影响
4 干扰TCF3表达对肺癌细胞迁移能力的影响
Transwell实验结果显示对照组细胞转移通过肌质膜的数量明显增多,而siTCF3转染的A549细胞和H1299细胞迁移至下室的细胞数显著降低,与对照组比较差异具有统计学意义(P<0.05),见图5。
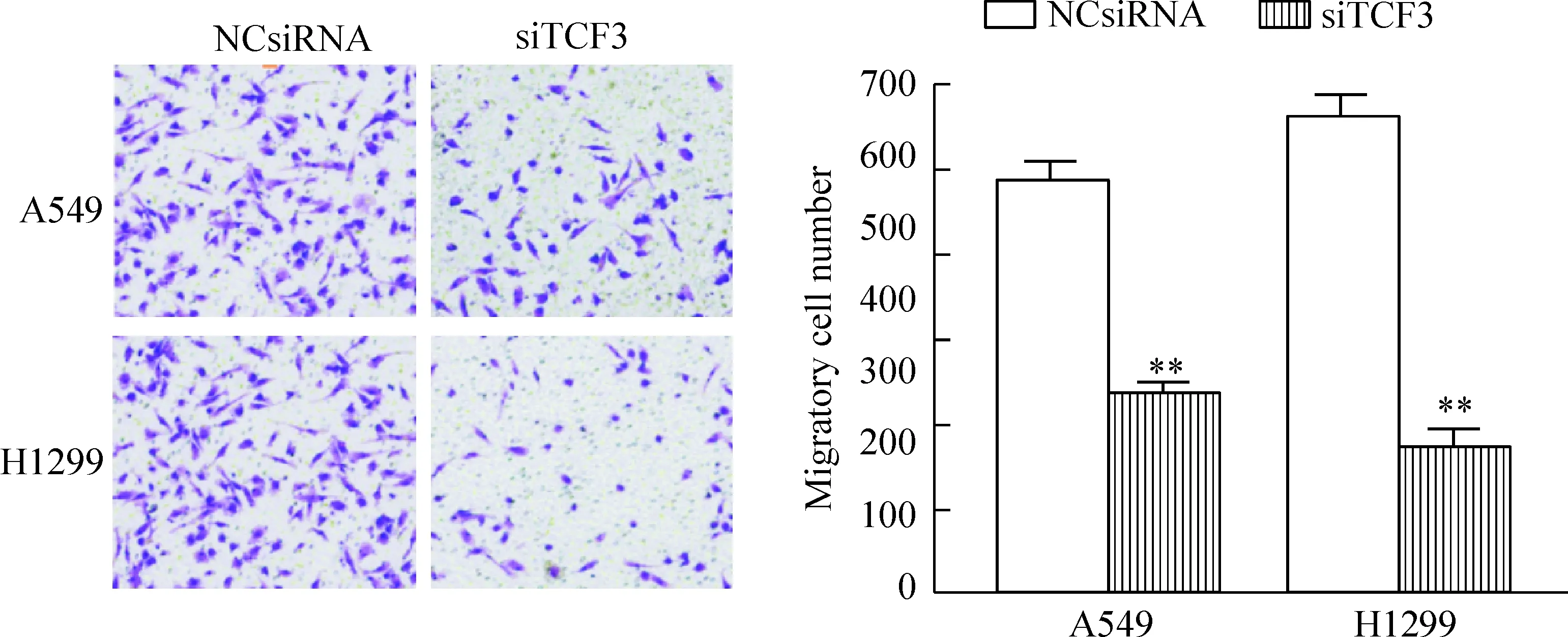
Figure 5.The effect of TCF3 down-regulation on the migratory ability of lung cancer A549 cells and H1299 cells. Mean±SD.n=3.**P<0.01vsNCsiRNA group.
图5 下调TCF3表达对A549和H1299迁移的影响
5 下调TCF3表达对肺癌细胞凋亡的影响
流式细胞术分析结果显示在TCF3下调的A549细胞和H1299细胞中,其细胞凋亡率明显增高,分别为(31.40±4.12)%和(39.52±3.58)%,与阴性对照组比较差异具有统计学意义,提示下调TCF3的表达能诱导A549和H1299细胞凋亡,见图6。
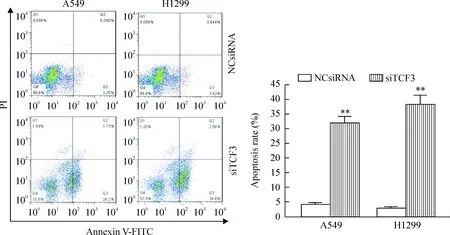
Figure 6.The effect of TCF3 down-regulation on the apoptosis of lung cancer A549 cells and H1299 cells. Mean±SD.n=3.**P<0.01vsNCsiRNA group.
图6 下调TCF3表达对A549和H1299细胞凋亡的影响
6 下调TCF3表达对肺癌细胞Wnt通路相关蛋白水平的影响
Western blot结果发现,下调TCF3的表达后,A549和H1299细胞中的Wnt、MMP-9和MMP-13的相对表达量显著低于NCsiRNA细胞;TIMP-1蛋白的相对表达量显著高于NCsiRNA细胞,见图7。
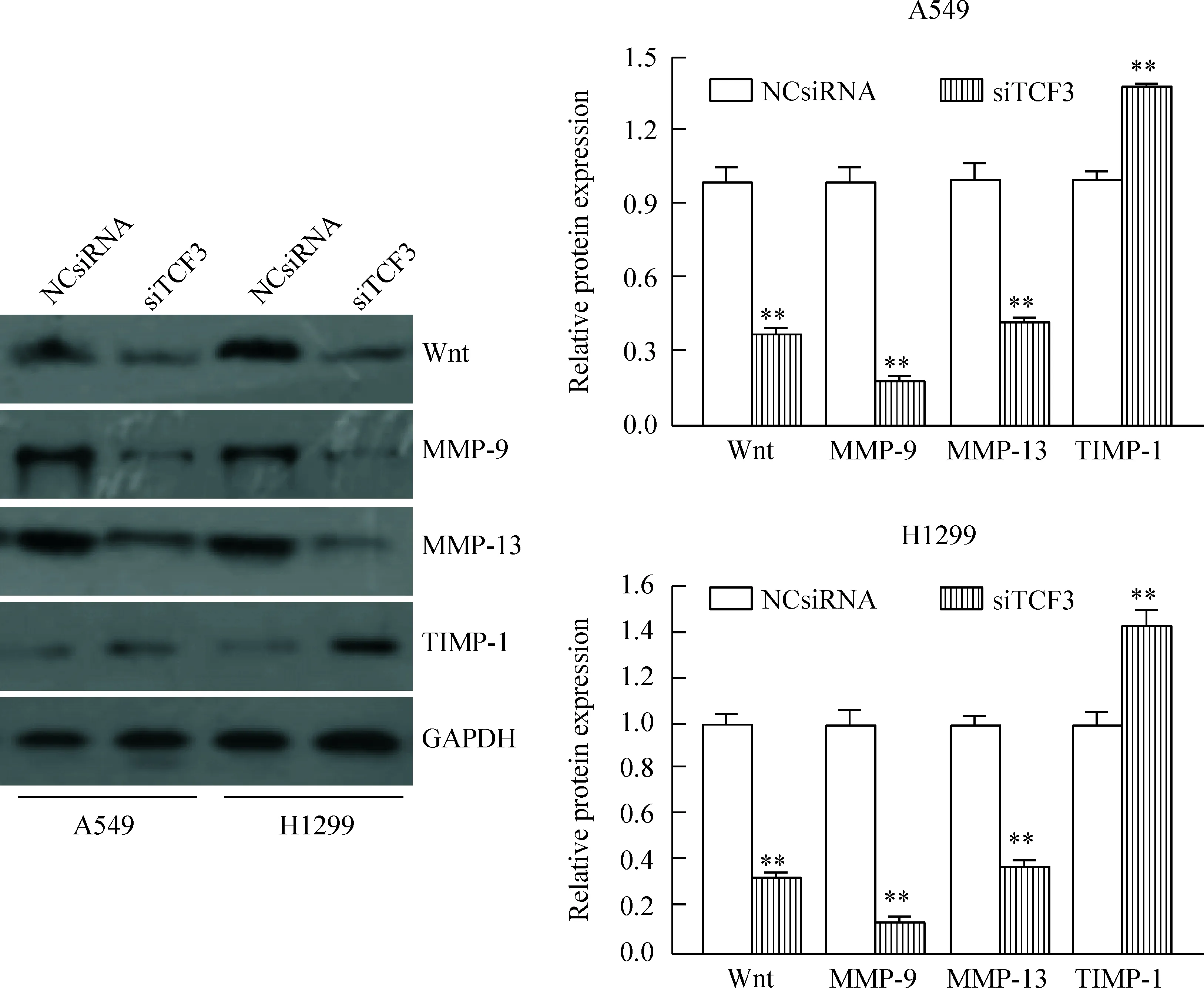
Figure 7.The effect of TCF3 down-regulation on the expression of Wnt pathway-related proteins in lung cancer A549 cells and H1299 cells. Mean±SD.n=3.**P<0.01vsNCsiRNA group.
图7 下调TCF3的表达对Wnt通路相关蛋白水平的影响
讨 论
Wnt/β-catenin信号通路是哺乳动物细胞内高度保守的关键信号通路,其与肺癌的发生发展密切相关[10]。TCF3是TCF/LEF家族的重要成员之一,是经典Wnt/β-catenin信号通路的关键成分。研究表明TCF3在一些分化程度较低的恶性肿瘤中表达[11],但目前对TCF3在恶性肿瘤中的作用及机制研究较少。Lin等[11]证实TCF3可能通过下调Oct4抑制胚胎癌细胞的恶性表型。TCF3对乳腺癌组织的形成及维持癌细胞生长起着重要作用,但对乳腺癌细胞的侵袭及迁移能力无明显影响[10]。然而,TCF3在肺癌中的作用及分子机制仍不清楚,相关的研究报道较少。
研究证实,在无Wnt信号刺激时TCF3与共阻遏因子Groucho、CtBP和HDAC等结合抑制Wnt基因转录[12-13];异常的Wnt信号刺激下TCF3一方面作为β-catenin依赖的转录激活因子促进Wnt靶基因的转录激活,同时也能作为转录抑制因子下调Wnt靶基因的转录[14]。本研究结果显示,干扰肺癌细胞系A549细胞和H1299细胞中的TCF3表达后,Wnt通路转录活性明显降低,其下游靶基因c-Myc的表达明显下调,提示TCF3在肺癌细胞的Wnt通路中起着转录激活的功能。可能的机制为Wnt通路激活时,大量游离的β-catenin进入细胞核,通过与Groucho/TLE竞争结合TCF3,将TCF3转换为转录激活因子[15]。我们通过MTT、克隆形成实验证实TCF3对肺癌细胞的增殖活性的影响,结果发现降低TCF3的表达使A549细胞和H1299细胞的活力和克隆形成率显著降低。为了进一步探讨TCF3影响A549和H1299细胞增殖的原因,我们运用Annexin V-FITC/PI染色和流式细胞术进行了细胞凋亡实验,结果显示干扰TCF3表达72 h后细胞的凋亡率明显升高。推测TCF3可能通过调控Wnt通路下游勘基因c-Myc[16]等细胞凋亡相关基因而影响肺癌细胞的生长。
基质金属蛋白酶基因家族在肿瘤细胞转移过程中发挥关键作用[17],MMP基因家族成员的表达与恶性肿瘤的高转移活性密切相关[18]。研究证实MMP-1过表达能促进前列腺癌的增殖和转移[19]。本研究观察到下调TCF3表达显著抑制A549细胞和H1299细胞的迁移,由此我们推测TCF3可能通过调控MMP家族基因的表达影响肺癌细胞的转移。我们在A549和H1299细胞中的研究发现,siTCF3显著抑制MMP-9和MMP-13蛋白的表达,促进基质金属蛋白酶抑制因子TIMP-1的蛋白表达,提示siTCF3可能通过抑制MMP-9和MMP-13的表达抑制A549和H1299细胞的迁移能力。Western blot实验结果发现下调TCF3表达抑制Wnt蛋白的表达,但是本研究没有进一步证实MMP-9、MMP-13和TIMP-1表达与Wnt信号通路的关系,MMP家族成员中MMP-9、MMP-13和TIMP-1是否是Wnt通路靶基因?或者MMP通路和Wnt通路形成一种交叉网络共同调控肺癌细胞转移,这方面工作值得进一步研究。我们的研究发现,siTCF3显著抑制A549和H1299细胞的增殖、迁移和诱导细胞凋亡,其分子机制可能通过下调Wnt通路活性以及调控MMP家族关键成员的表达而实现。提示TCF3有望成为治疗肺癌的潜在靶向药物,本研究为以TCF3为靶点研发治疗肺癌的分子靶向药物提供理论依据。
[1] Bray F, Jemal A, Grey N, et al. Global cancer transitions according to the Human Development Index (2008-2030): a population-based study[J]. Lancet Oncol, 2012, 13(8):790-801.
[2] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90.
[3] 邹 敏, 周韶璋, 于起涛, 等. 非小细胞肺癌患者肿瘤组织和血清表皮生长因子受体第19、21外显子的检测及其临床特征的分析[J]. 中国病理生理杂志, 2013, 29(5):839-844.
[4] Merrill BJ, Pasolli HA, Polak L, et al. Tcf3: a transcriptional regulator of axis induction in the early embryo[J]. Development, 2004, 131(2):263-274.
[5] Cole MF, Johnstone SE, Newman JJ, et al. Tcf3 is an integral component of the core regulatory circuitry of embryonic stem cells[J]. Genes Dev, 2008, 22(6):746-755.
[6] Tam WL, Lim CY, Han J, et al. T-cell factor 3 regulates embryonic stem cell pluripotency and self-renewal by the transcriptional control of multiple lineage pathways[J]. Stem Cells, 2008, 6(8):2019-2031.
[7] Yi F, Pereira L, Hoffman JA, et al. Opposing effects of Tcf3 and Tcf1 control Wnt stimulation of embryonic stem cell self-renewal[J]. Nat Cell Biol, 2011, 13(7):762-770.
[8] Uernatsu K, He B, You L, et al. Activation of the Wnt pathway in non small cell lung cancer: evidence of disheveled overexpression[J]. Oncogene, 2013, 2(46):7218-7221.
[9] 范雨辰, 刘煜亮, 闵 利, 等. TCF3对非小细胞肺癌A549细胞株生长和迁移的影响[J]. 重庆医科大学学报, 2015, 3(40):435-530.
[10]Ben-Porath I, Thomson MW, Carey VJ, et al. An embryonic stem cell-like gene expression signature in poorly differentiated aggressive human tumors[J]. Nat Genet, 2008, 40(5):499-507.
[11]Lin G, Zhao L, Yin F, et al. TCF3 inhibits F9 embryonal carcinoma growth by the down-regulation of Oct4[J]. Oncol Rep, 2011, 26(4):893-899.
[12]Slyper M, Shahar A, Bar-Ziv A, et al. Control of breast cancer growth and initiation by the stem cell-associated transcription factor TCF3[J]. Cancer Res, 2012,72(21):5613-5624.
[13]Stamos JL, Weis WI. The β-catenin destruction complex[J]. Cold Spring Harb Perspect Biol, 2013, 5(1):a007898.
[14]Arce L, Yokoyama NN, Waterman ML. Diversity of LEF/TCF action in development and disease[J]. Oncogene, 2006, 25(57):7492-7504.
[15]Chodaparambil JV, Pate KT, Hepler MR, et al. Molecular functions of the TLE tetramerization domain in Wnt target gene repression[J]. EMBO J, 2014, 33(7):719-731.
[16]Doose G, Haake A, Bernhart SH, et al. MINCR is a MYC-induced lncRNA able to modulate MYC’s transcriptional network in Burkitt lymphoma cells [J]. Proc Natl Acad Sci U S A, 2015, 112(38):5261-5270.
[17]Kim HJ, Park MK, Kim SY, et al. Novel suppressive effects of ketotifen on migration and invasion of MDA-MB-231 and HT-1080 cancer cells[J]. Biomol Ther, 2014, 22(6):540-546.
[18]Duffy MJ, Maguire TM, Hill A, et al. Metalloproteina-ses: role in breast carcinogenesis, invasion and metastasis[J]. Breast Cancer Res, 2000, 2(4):252-257.
[19]Fanjul-Fernández M1, Folgueras AR, Fueyo A, et al. Matrix metalloproteinase Mmp-1a is dispensable for normal growth and fertility in mice and promotes lung cancer progression by modulating inflammatory responses[J]. J Biol Chem, 2013, 288(20):14647-14656.
(责任编辑: 陈妙玲, 罗 森)
Down-regulated TCF3 expression inhibits growth and migratory abilities of non-small cell lung cancer cells
WANG Shi-meng
(DepartmentofThoracicSurgery,HezeMunicipalHospital,Heze274000,China.E-mail: 48947925@qq.com)
AIM: To investigate the effects of T-cell factor 3 (TCF3) expression on the growth and migratory abilities of the non-small cell lung cancer cells (NSCLC) and the underlying mechanisms. METHODS: The non-small cell lung cancer cells A549 and H1299 were transfected with siTCF3 or negative control siRNA (NCsiRNA) using Lipofectamine 2000. The expression of TCF3 at mRNA and protein levels was detected by real-time PCR and Western blot, respectively. The activity of TCF3 transcription was measured using luciferase reporter gene assay. The cell viability, colony formation ability, migratory ability and apoptotic rate were monitored by MTT assay, colony formation assay, Transwell method and flow cytometry with Annexin V-FITC/PI double staining, respectively. The protein expression levels of Wnt, c-Myc, matrix metalloproteinase (MMP)-9, MMP-13 and tissue inhibitor of metalloproteinase-1 (TIMP-1) were detected by Western blot. RESULTS: Compared with A549-NCsiRNA and H1299-NCsiRNA cells, the mRNA and protein levels of TCF3 were significantly inhibited in A549-siTCF3 and H1299-siTCF3 cells (P<0.01). The activity of TCF3 transcription and levels of c-Myc protein expression remarkably decreased as compared with NCsiRNA cells (P<0.05). The viability of A549-siTCF3 cells and H1299-siTCF3 cells cultured for 24 h, 48 h, 72 h and 96 h were notably lower than that of NCsi-RNA cells (P<0.05). The colony formation ability was significantly inhibited by siTCF3 compared with NCsiRNA cells (P<0.01). The numbers of migratory A549-siTCF3 and H1299-siTCF3 cells were significantly lower than those of A549-NCsiRNA and H1299-NCsiRNA cells (P<0.05). The apoptotic rates of A549-siTCF3 cells and H1299-siTCF3 cells were notably higher than those of A549-NCsiRNA cells and H1299-NCsiRNA cells (P<0.01). Down-regulated TCF3 expression inhibited the protein expression of Wnt, decreased the protein levels of MMP-9 and MMP-13 and enhanced the protein level of TCF3. CONCLUSION: siTCF3 suppresses the abilities of growth and migration, and induces apoptosis in A549 cells and H1299 cells by down-regulating Wnt pathway and regulating expression of key MMP family genes.
Non-small cell lung cancer; T-cell factor 3; Matrix metalloproteinases
1000- 4718(2017)02- 0289- 08
2016- 08- 11
2016- 10- 09
R730.23
A
10.3969/j.issn.1000- 4718.2017.02.016
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0530-5613311; E-mail: 48947925 @qq.com
