家蚕丝素多孔共混膜的结构及性能研究
2017-02-24刘洪玲于伟东
徐 娟,刘洪玲,于伟东
(东华大学纺织学院,上海 201620)
家蚕丝素多孔共混膜的结构及性能研究
徐 娟,刘洪玲,于伟东
(东华大学纺织学院,上海 201620)
通过冷冻干燥法制备出几种家蚕丝素多孔共混膜,采用扫描电子显微镜(SEM)、傅里叶转换红外光谱(FTIR)、X射线衍射(XRD)和差示扫描仪(DSC)对多孔丝素共混膜的结构和性能进行分析,研究了加入不同试剂得到的家蚕丝素多孔共混膜的结构及性能变化。表面形态的分析结果表明几种共混膜的孔的形状多呈不规则状,孔的大小和密度随着试剂的不同而不同。红外光谱分析、X射线衍射分析和热分析结果表明,几种多孔丝素共混膜的分子构象为α-螺旋结构、β-折叠结构和无规卷曲结构共存。不同添加剂对丝素蛋白分子构象影响不同。
家蚕丝素 冷冻干燥 多孔材料 共混膜 结构性能
0 引言
家蚕丝素蛋白是一种通过将蚕丝溶解提纯,得到由乙氨酸、丙氨酸、丝氨酸等十八种氨基酸所组成的天然高分子材料[1-3],其来源丰富,具有良好的生物相容性、透气透湿性和可降解性等优点[4-5]。丝素蛋白材料除用于外科手术缝合线、化妆品及食品添加剂等行业,近年来越来越多的研究者已开始探讨它应用于创面覆盖材料、酶固定化电极、隐形眼镜、透析膜及抗凝血材料等生物医学材料的可能性。将丝素膜用于创面覆盖材料时,各项动物实验及临床试验结果都表明:丝素蛋白无毒、无刺激并且具有良好的生物相容性。而今,研究者将家蚕丝素制备成多孔材料并将其应用于人工皮肤、药物控制释放载体及细胞培养基等生物医学领域[6]。
冷冻干燥法作为一种温和的干燥方式,不仅有利于减少丝素蛋白质中分子的变性程度而且能够获得结构比较疏松、内部相互贯通的多孔材料。因此冷冻干燥是制备多孔丝素膜的有效方法[7]。
本文通过对几种家蚕丝素多孔共混膜进行扫描电子显微镜(SEM)观察、傅里叶转换红外光谱(FTIR)、X射线衍射(XRD)以及差示扫描(DSC)分析,探讨了不同添加剂对家蚕丝素结构及性能的的影响。
1 实验部分
1.1 实验材料
家蚕蚕茧是自己饲养的。所用的化学品包括无水碳酸氢钠(NaHCO3)、一水溴化锂(LiBr·H2O)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC粉末)、聚乙烯吡络烷酮K30(PVP粉末),化学品均为购自国药集团化学试剂有限公司的分析纯。透析袋(Sigma,截留分子量为3500KDa),购自国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 丝素蛋白溶液的制备
丝素蛋白溶液的制备包括蚕茧脱胶、蚕丝溶解和丝素蛋白溶液透析三个过程。(1)将家蚕蚕茧加入质量分数为0.5%的NaHCO3去离子水溶液中,煮沸 30min进行蚕茧脱胶(重复此操作3次),取出后在去离子水中搓揉洗涤并烘干;(2)将脱胶得到的蚕丝放入9.3 mol/L的LiBr溶液中并于70℃加热直至纤维完全溶解得到丝素溶液;(3)过滤丝素溶液,冷却至室温后放入透析袋中,在去离子水浴中透析 72 h,最后装入试剂瓶中保存于4℃ 冰箱中储存备用,丝素蛋白溶液如图1所示。

图1 透析得到的丝素蛋白溶液
透析后的丝素蛋白溶液的体积分数可通过将一定体积的丝素溶液于 105 ℃的烘箱中烘干并称重算出。具体测定过程为自制金属表面皿并编号放入105 ℃烘箱中半个小时后取出、称重得到皿重为W(g);在金属表面皿内倒入适量的家蚕丝素蛋白溶液后称重W1(g)然后放入烘箱四个小时后取出称重,以后每隔20分钟称重一次直至重量不再变化时记下数据为W2(g)。依据式(1)计算可得到家蚕丝素蛋白溶液的浓度。

(1)
1.2.2 丝素多孔共混膜的制备
取25 ml质量分数为6%的上述透析后的丝素蛋白溶液,分别加入20% EDC、30% PVP及30% PVP和20% EDC的试剂制备成混合溶液。然后用玻璃棒搅拌五分钟后在室温下静置三十分钟,将混合溶液倒入已编号的聚乙烯盘中放到冰箱中冷冻24 h后取出,然后放入冷冻干燥机中真空干燥,得到多孔丝素共混膜。
1.3 测试方法
1.3.1 SEM测试
采用JSM-5600LV型扫描电子显微镜对几种家蚕丝素多孔共混膜的表面微观形貌进行观察,放大倍数为1000倍。将试样放在相应的铜台上并对其进行喷金,然后进行测试,扫描电镜的加速电压为10 kV。
1.3.2 FTIR光谱分析
采用Nicolet TM 5700型红外光谱仪进行测试,对试样在690cm-1~4000 cm-1范围内进行扫描,扫描64次,分辨率为8 cm-1。
1.3.3 XRD分析
采用D/Max-2550PC型X射线衍射仪,管电压为40 kV,管电流为200 mA,采用CuKα射线(λ=1.54056×10-10m),扫描范围为5°~60°,扫描速度为0.06o/min。
1.3.4 DSC分析
采用DSC4000型差示扫描量热仪进行测试,在50℃~350℃范围内对样品进行加热,升温速率为10℃/min。
2 结果与讨论
2.1 表面形态分析
经冷冻干燥后得到的多孔丝素共混膜不开裂、外观为白色且手感比较柔软,如图2所示。图3((a)-(d))所示为多孔丝素共混膜表面的电镜照片,从图中可以看出,纯丝素膜(图3(a))表面有较多的孔洞,但孔洞分布不均匀。EDC(图3(b))处理的丝素膜表面呈现层状褶皱,与其他几种共混膜表面外观不同。PVP(图3(c))处理得到的丝素膜表面孔隙率比较小。EDC和PVP(图3(d))共同作用得到的丝素膜表面孔隙率比较大,几乎达到100%,且呈现蜂窝状的多孔结构。可以看出,几种共混膜的孔的形状多呈不规则状,不同共混膜的孔的大小和密度随着试剂的不同而不同。

a-SF b-SF+EDC c-SF+PVP d-SF+EDC+PVP


图3 几种家蚕丝素多孔共混膜表面的扫描电子显微镜照片
2.2 多孔丝素共混膜结构分析
2.2.1 傅里叶变换红外光谱分析
家蚕丝素蛋白的红外光谱显示其无规卷曲结构的吸收峰主要出现在1235 cm-1,1535cm-1~1545 cm-1及1655cm-1~1660cm-1附近。Silk I的吸收峰主要出现在1655 cm-1(酰胺 I),1525cm-1~1540 cm-1(酰胺 II)及1266 cm-1(酰胺 III)附近。Silk II 的吸收峰主要出现在1620cm-1~1635 cm-1(酰胺 I),1530 cm-1(酰胺 II)及1230cm-1~1235 cm-1(酰胺 III)附近[8]。家蚕丝素蛋白中Silk II主要包含β-折叠结构,而Silk I主要包含α-螺旋结构及少量无规卷曲和β-转角结构[9]。
由于家蚕丝素蛋白酰胺谱带是由多个谱带共同构成,其中包括α-螺旋结构、β-折叠结构和无规卷曲结构。图4所示为几种家蚕丝素多孔共混膜的红外吸收光谱图,根据图4可知,曲线 a、b、c、d均在1647cm-1(酰胺I)、1532 cm-1(酰胺 II)和1235 cm-1(酰胺III)附近出现了吸收峰,这是由于α-螺旋结构、β-折叠结构和无规卷曲结构的共同作用所造成的。单独加入PVP试剂的丝素膜(曲线c)在1626cm-1(酰胺I)附近有Silk II 结晶结构特征峰,说明PVP的加入使丝素膜内出现了β-折叠结构。这些结构的转变导致酰胺I带C=O的伸缩振动,可以用1 626 cm-1处的吸收强度与1 650 cm-1处的吸收强度之比来表达β-折叠及α-螺旋和无序结构的转变。表1为1 626 cm-1处的吸收强度(Iβ)与1 650 cm-1处吸收强度(Iα)之比的计算结果。根据表1可知,单独EDC的加入,使得Iβ/Iα的比值相对于纯的丝素膜增加,根据吸光度值可知,β-折叠结构没有发生变化,而α-螺旋结构减少,说明多孔膜中无规卷曲的量增加。当单独加入PVP时,Iβ/Iα的比值相对于纯的丝素膜也增加,根据吸光度值可知,β-折叠结构和α-螺旋结构都增加,说明多孔膜中有序结构增加,无规结构减少。而加入EDC和PVP的多孔膜,从吸光度的值来看,β-折叠结构的吸收值(0.0311)相对于纯丝素膜(0.022)增加,但相应的α-螺旋结构(0.059)相对于纯丝素膜(0.0328)增加得更多,说明在d这种材料中有序结构增加,相应的无定形结构减少。
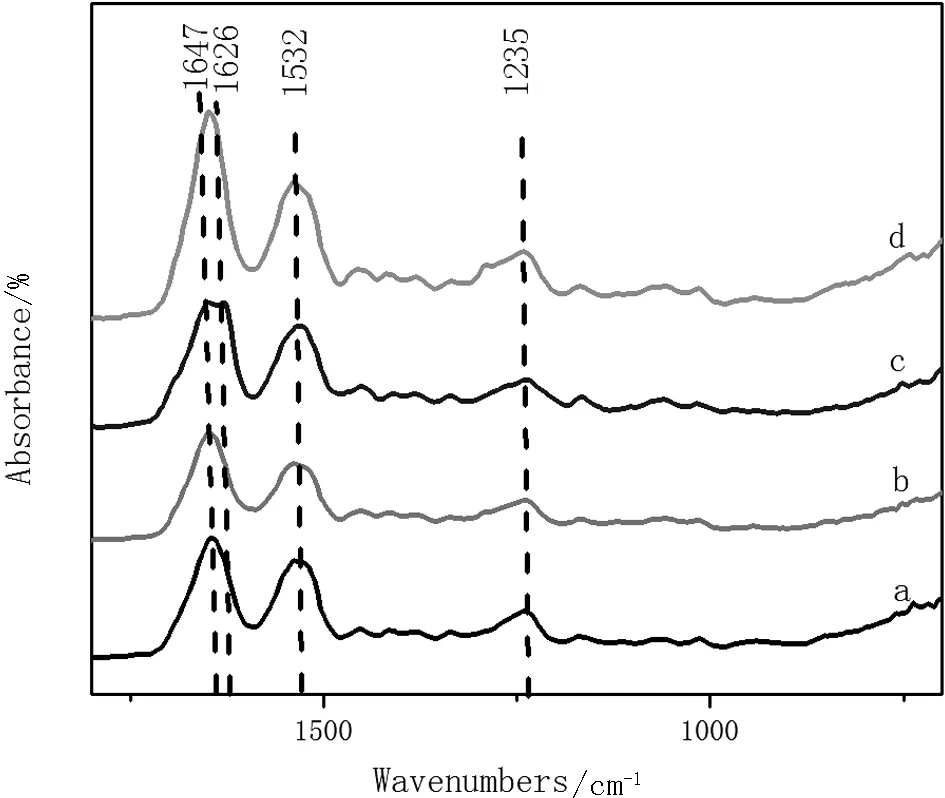
图4 家蚕丝素多孔共混膜的红外吸收光谱
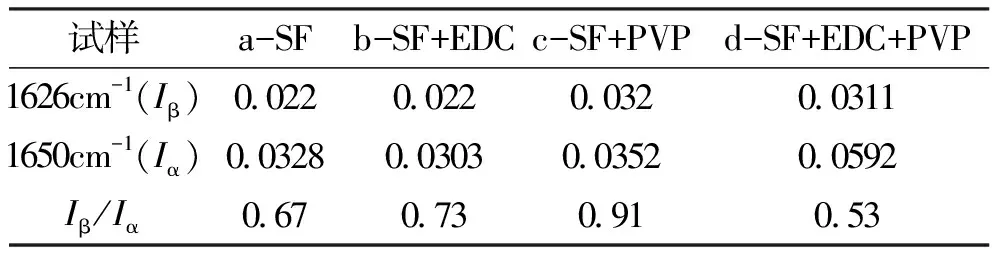
试样a-SFb-SF+EDCc-SF+PVPd-SF+EDC+PVP1626cm-1(Iβ)002200220032003111650cm-1(Iα)00328003030035200592Iβ/Iα067073091053
2.2.2 X射线衍射分析
对家蚕丝素蛋白采用X衍射实验分析可知Silk II的主要衍射峰出现在9.1°、18.9°和 20.7° 附近而Silk I的主要衍射峰出现在12.2°、19.7°、24.7°、28.2°附近[8,10]。
图5为几种多孔膜的X衍射图,从图中可以看出,曲线a在2θ=20.1o附近有一个衍射峰,这个位置位于Silk I和Silk II的中间位置,说明β-折叠结构和α-螺旋结构的共同作用,使峰的位置发生偏移;b、c、d均在2θ=20.7o附近有一个衍射峰,这个峰归属于β-折叠结构,说明这几种家蚕丝素多孔共混膜含有β-折叠结构。


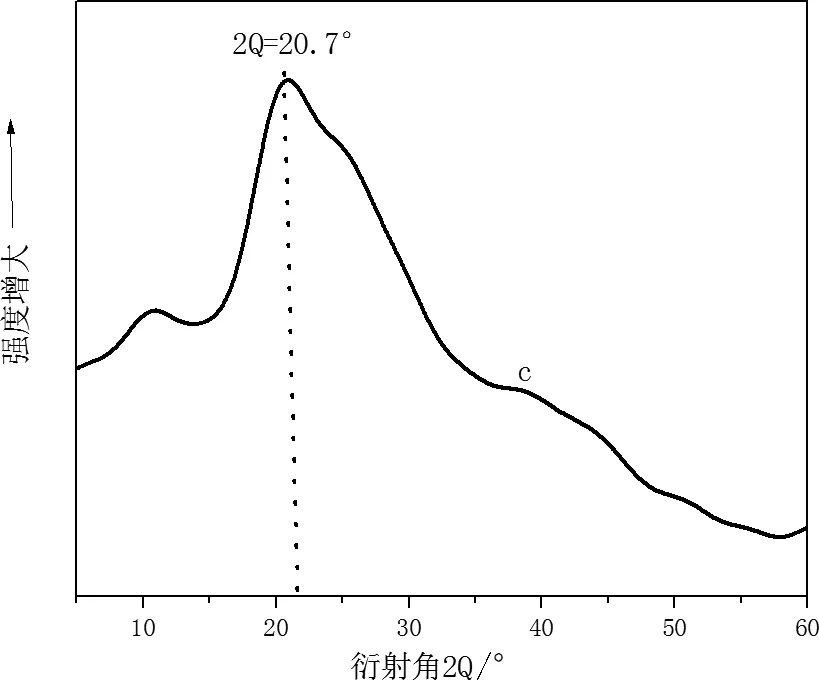

图5 家蚕丝素多孔共混膜的X射线衍射图
2.2.3 热分析
根据Magoshi等人对无定型丝素膜热性能的研究结果表明家蚕丝素的DSC曲线在207℃~260℃所显示的放热是无定型结构向结晶结构转化所造成的,在280℃~300℃所显示的吸热则是丝素膜的热分解吸热温度。
图6为几种家蚕丝素共混膜的DSC曲线。由图6可以看出,几种丝素共混膜的DSC曲线在75℃~80℃间有个峰,这是由于加热导致水分的丢失所造成的。在200℃~350℃这个区间里,几种家蚕丝素蛋白膜的DSC曲线发生了明显的变化,出现了吸热放热的转变,主要体现在加入PVP的丝素膜在250℃~260℃区间出现了一个明显的吸热放热峰转变,曲线a、b、d分别在280℃、282℃和283℃出现了明显的吸热峰,这个峰归属于β-折叠结构,表明在加热过程中发生了由α-螺旋结构(SilkI结晶结构)或无规线团到β-折叠结构(SilkII结晶结构)的转变。曲线c中PVP的加入使得曲线的峰移到250℃处,说明此添加剂可以加速丝素蛋白中的α-螺旋结构(Silk I结晶结构)剧烈的分子运动以及无规线团转变成β-折叠结构[11-12]。从图中可以看出,随着温度的升高,不断出现吸热反应,说明里面的结构不稳定。表明了PVP试剂能够使丝素蛋白中β-折叠结构向无规线团结构转变。同时加入EDC和PVP,EDC会影响PVP对丝素蛋白的作用。说明PVP对丝素蛋白分子构象影响较大。这与上述FTIR和XRD结果一致。
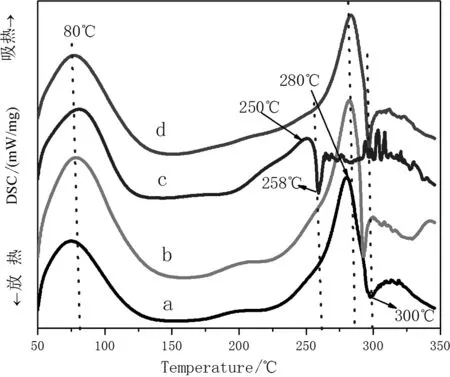
图6 冷冻干燥法得到的几种家蚕丝素共混膜的DSC曲线
3 结论
本文对几种家蚕丝素多孔共混膜进行表面形态、红外光谱、X射线衍射和热分析测试,分析了多孔共混膜的结构及性能变化,得到了如下结论:
(1)从表面形态的分析可以看出,几种共混膜的孔的形状多呈不规则状,不同共混膜的孔的大小和密度随着试剂的不同而不同;
(2)从红外光谱分析、X射线衍射分析和热分析中可以看出,几种多孔丝素共混膜的分子构象为α-螺旋结构、β-折叠结构和无规线团结构共存。PVP对丝素蛋白分子构象影响较大,使得共混膜中出现了β-折叠结构向无规卷曲结构转变的情况。EDC对丝素蛋白分子构象基本没有影响。同时加入EDC和PVP后,EDC会影响PVP对丝素蛋白分子结构的作用。
[1] Li Jiao.Zhang Shanshan.Xing Tieling.Li Mingzhong.Lu Shenzhou.Silk fibroin film blended with poly( ethylene glycol-glycerin)[J].Journal of Donghua University(English Edition),2014(4):507-510.
[2] Zhou Yuannan.Liang Wenhao.Ruan Biaopeng.Jiang Fang.Wang Weihan.Zhang Kuihua.Mo Xiumei.VE TPGS-Loaded silk fibroin / hydroxybutyl chitosan nanofibrous scaffolds for skin care application[J].Journal of Donghua University(English Edition),2014(4):533-537.
[3] Elshanshory Ahmed.Chen Weiming.Mo Xiumei.Preparation of antibacterial electrospun PVA / Regenerated silk fibroin nanofibrous composite containing ciprofloxacin hydrochloride as a wound dressing[J].Journal of Donghua University(English Edition),2014(5):566-571.
[4] Xie Ruijuan.Zhang Meng.Liu Yu.Lu Shenzhou.Preparation of nano silver / silk fibroin composite films[J].Journal of Donghua University(English Edition),2014(5):646-648.
[5] Zhao Huijing.Li Pengju.YOU Renchuan.Liu Guiyang.Li Mingzhong.Structure changes of silk fibroin(SF) by blending with poly(ε-caprolactone)(PCL):characterization of SF and PCL blended electrospinning films[J].Journal of Donghua University(English Edition),2014(3):368-374.
[6] Dong Z M,Zhao P,Wang C,et al. Comparative proteomics reveal diverse functions and dynamic changes of Bombyx mori silk proteins spun from different development stages[J].J Proteome Res,2013,11(12) : 5213 -5222.
[7] Tsukada M,Freddi G, Gotoh Y,Kasai N.Physical and chemical properties of tussah silk fibrin films[J].Polym. Sci. B:Polym Phys,1994 (32) :1407-1412.
[8] Kim U J,Park J,Li C,et al. Structure and properties of silk hydrogels [J].Biomacromolecules, 2004(5): 786-792.
[9] Zhou G Q, Shao Z Z, Knight D P, et al. Silk fibers extruded artificially from aqueous solutions of regenerated bombyx mori silk fibroin are tougher than their natural counterparts [J]. Advanced Materials,2009(21):366-370.
[10]Koperska M A, Pawcenis D, Bagniuk J, et al. Degradation markers of fibroin in silk through infrared spectroscopy[J]. Polymer Degradation and Stability, 2014(105): 185-196.
[11]Li Y S,Zhao P,Liu S P,et al. A novel protease inhibitor in Bombyx mori is involved in defense against Beauveria bassiana[J]. Insect Biochem Mol Biol,2012,42(10) : 766 -775.
[12]Zhang Y,Zhao P,Dong Z M,et al. Comparative proteome analysis of multi-layer cocoon of the silkworm,Bombyx mori[J].PLoS ONE,2015,10(4) : 15-19.
2016-11-12
徐娟(1990-),女,硕士研究生,研究方向:蚕丝蛋白材料研究。
刘洪玲,女,博士,副教授,硕士生导师。
TS 176.9
A
1008-5580(2017)01-0008-05
