齐口裂腹鱼白介素-1β基因的克隆及表达谱
2017-02-22段荟芹王利
段荟芹王利
(1. 西南民族大学青藏高原研究院,成都 610041;2. 西南民族大学生命科学与技术学院,成都 610041)
齐口裂腹鱼白介素-1β基因的克隆及表达谱
段荟芹1王利2
(1. 西南民族大学青藏高原研究院,成都 610041;2. 西南民族大学生命科学与技术学院,成都 610041)
探讨齐口裂腹鱼白介素-1β(Interleukin-1β,IL-1β)基因的基本特点。用RT-PCR方法以齐口裂腹鱼脾脏cDNA作为模板扩增IL-1β基因,用生物信息学软件分析其序列,用RT-PCR方法检测IL-1β基因在齐口裂腹鱼6种组织的表达情况。克隆获得的IL-1β序列长1 252 bp,共编码276个氨基酸。GenBank 序列号为KU886235。IL-1β蛋白相对分子量为31.25 kD,等电点5.45,预测为亲水性蛋白。二级结构主要结构元件为随机卷曲和延伸链,有4个N-糖基化位点和16个磷酸化位点。NJ法系统进化树显示,齐口裂腹鱼与鲤鱼、鲫鱼的亲缘关系最近。组织表达分析显示,IL-1β基因主要在脾脏和肾脏中表达。这为深入研究鱼IL-1β的生物学功能提供理论依据。
齐口裂腹鱼;白介素-1β;克隆;蛋白质分析;基因表达
白细胞介素 1(interleukin1,IL-1)是一种炎症反应前期释放的细胞因子,具有广泛的免疫调节功能[1],白介素-1β(Interleukin-1β,IL-1β)作为IL-1的一种亚型,是Stylianou等[2]在研究人类及老鼠的免疫系统基础上被发现的。IL-1β是一种多效炎症因子,在诱发炎症、造血及调节代谢等过程中发挥重要作用[3]。它可由多种细胞产生,如巨噬细胞、内皮细胞、成纤维细胞以及树状细胞等[4]。目前,关于IL-1β亚基的研究主要集中在生理学、病理学、免疫调控、基因克隆及差异表达分析等方面[5-12]。而在鱼类中的研究,自Zou等[13]采用同源克隆方法从虹鳟(Oncorhynchus mykiss)克隆得到IL-1β基因序列以来,该基因在多种鱼类中被克隆出。包括军曹鱼(Rachycentron canadium Linnaeus)、鲢(Hypophthalmichthys molitrix)、鲤鱼(Cyprin carpio)、黑石斑鱼(Sebastes schlegeli)、黄鳍鲷(Acanthopagrus latus)、大鳍鳠(Mystus macropterus Bleeker)、斜带石斑鱼(Epinephelus coioides)等[9,10,14-18]。IL-1β作为鱼类重要的免疫细胞因子,对其进行研究将能丰富鱼类免疫学内容。齐口裂腹鱼(Schizothorax prenanti),属鲤科(Cyprinidae)、裂腹鱼亚科、裂腹鱼属,是我国青藏高原地区及长江中下游地区特有的冷水性鱼种,该鱼有极高的营养和经济价值。目前,关于IL-1β基因在齐口裂腹鱼体内的报道研究甚少。本试验克隆了齐口裂腹鱼IL-1β基因,分析了其序列结构,并应用半定量PCR技术研究了该基因在不同组织中的表达情况,这为齐口裂腹鱼IL-1β基因的功能研究及免疫应答基因的筛选提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 齐口裂腹鱼来自四川雅安某养殖场,体长为37-42 cm,体重为395-420 g。
1.1.2 主要试剂和仪器 2×Taq PCR Master Mix、pMD19-T载体、DL2000 DNA marker(购于北京天根生化科技有限公司),E.coli DH5α菌种(本实验室保存),Trizol(Invitrogen),PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(TaKaRa),DNA凝胶回收试剂盒(Axygen),凝胶成像系统、电泳仪(均购于美国Bio-Rad公司),PCR仪(购于Eppendorf Germany)。
1.2 方法
1.2.1 总RNA的提取及cDNA合成 齐口裂腹鱼正常饲喂,处死后无菌操作收集鱼体脾脏、心脏、肾脏、肝脏、肌肉、肠道6种组织于液氮快速冷冻。各剪取100 mg鱼组织加1 mL Trizol提取总RNA,用10 g/L琼脂糖凝胶电泳及分光光度计检测RNA提取质量和完整性。用cDNA反转录试剂盒合成cDNA,反转录程序为37℃ 15 min,85℃ 5 s,最后4℃保存。合成的6种组织cDNA于-20℃保存备用。
1.2.2 引物设计与合成 根据本课题组前期测的转录组数据中的IL-1β基因的EST序列,用Primer Premier 5.0设计特异性引物,用齐口裂腹鱼18S rRNA作为内参引物,引物序列详见表1。引物由生工生物工程(上海)有限公司合成。
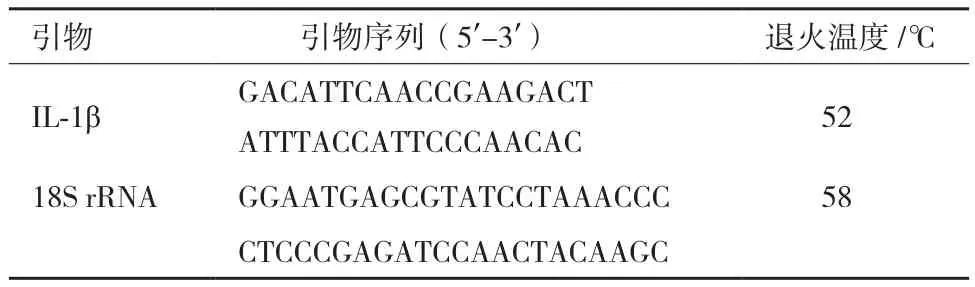
表1 基因的引物序列
1.2.3 PCR扩增 以齐口裂腹鱼脾脏cDNA为模板,进行PCR扩增。扩增体系(50 μL):2×Taq PCR Master Mix 25 μL,正、反向引物各1 μL,超纯水18 μL,模板5 μL。PCR条件:94℃预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸 50 s,32个循环;72℃延伸5 min。
1.2.4 目的基因的克隆 扩增后的产物用10 g/L琼脂糖凝胶电泳检测,将扩增所得产物用通用型凝胶回收纯化试剂盒纯化,并与pMD19-T连接,转化至DH5α(E.coli)感受态细胞,并涂布于含Amp+的LB固体培养基上,37℃培养12 h。挑单菌落于含Amp+LB液体培养基中,经菌液PCR后,将阳性克隆菌液测序。
1.2.5 组织表达 以齐口裂腹鱼脾脏、心脏、肾脏、肝脏、肌肉、肠道6种组织cDNA为模板,进行普通PCR扩增。PCR扩增体系及条件详见1.2.3。内参基因18S rRNA在各组织中的扩增体系为50 μL,扩增程序:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸 50 s,32个循环;72℃延伸5 min。所得产物均经10 g/L的琼脂糖凝胶电泳检测。
1.2.6 分析与处理 应用DNAMAN软件翻译IL-1β基因序列,IL-1β蛋白质的理化性质、二级结构、信号肽和结构域分析分别应用ExPASy程序中的Protparam、SOPMA、SignalIP 4.1和SMART进行分析;磷酸化位点、糖基化位点预测运用NetPhos 2.0和NetNGlyc 1.0进行分析;氨基酸系统进化树的构建应用Clustalx1.83、Mega5.0软件。
2 结果
2.1 IL-1β基因扩增
取齐口裂腹鱼脾脏、心脏、肾脏、肝脏、肌肉、肠道6种组织的总RNA琼脂糖凝胶电泳检测,可观察到5 S、28 S和18 S三条带,分光光度计检测OD260/OD280值均在1.8-2.0之间(图1),可达到试验要求。用10 g/L琼脂糖凝胶电泳检测(图2),测的齐口裂腹鱼IL-1β基因PCR产物片段大小与预期结果基本相符,约为1 300 bp。

图1 齐口裂腹鱼6种组织RNA提取检测结果
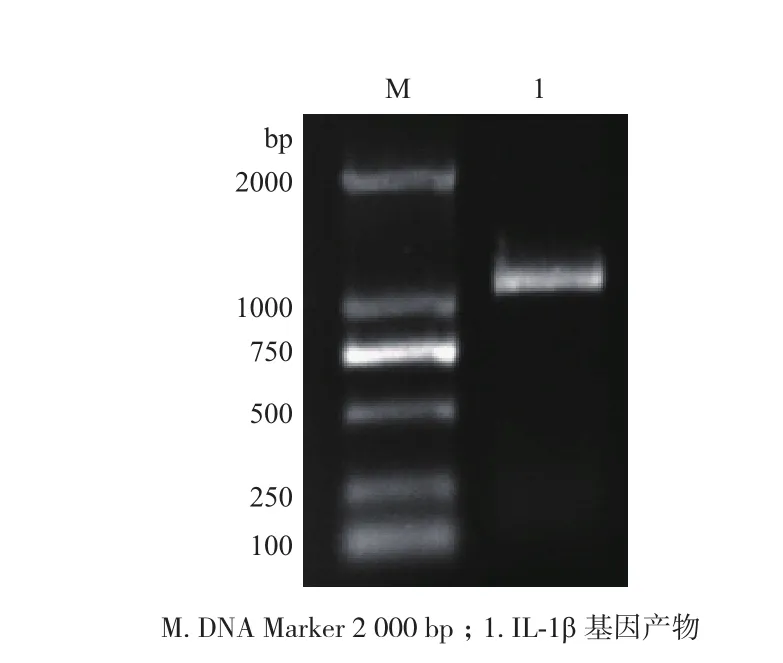
图2 齐口裂腹鱼脾脏IL-1β基因PCR扩增结果
2.2 IL-1β基因序列及蛋白理化性质分析
将测序得到的1 252 bp的序列提交至GenBank,序列号为:KU886235。该序列包含一个831 bp的开放阅读框,共编码276个氨基酸。Protparam软件预测IL-1β蛋白分子量为31.25 kD,等电点5.45。出现频率较高的氨基酸残基包括:Leu(9.8%)、Ser(9.1%)、Asp(7.2%)、Thr(6.9%)。带正电氨基酸残基数为29,带负电的残基数为35,此蛋白带负电。平均亲水性为-0.267,可知该蛋白为亲水性蛋白。
2.3 IL-1β蛋白二级结构、信号肽和结构域预测
SOPMA在线软件分析(图3)显示,IL-1β蛋白由随机卷曲(random coil,32.25%)、延伸链(extended strand,31.52%)、α-螺旋(Alpha helix,26.09%)和β-转角(Beta turn,10.14%)组成,表明该蛋白的主要结构元件为随机卷曲和延伸链。SignalIP 4.1分析显示,该蛋白无信号肽序列。SMART分析显示,IL-1β蛋白存在IL-1超家族结构域,为第112-269位氨基酸。

图3 齐口裂腹鱼IL-1β蛋白二级结构预测
2.4 IL-1β蛋白磷酸化位点、糖基化位点预测
NetNGlyc 1.0 N-糖基化位点预测表明,IL-1β蛋白有4个N-糖基化位点,分别为(103NATP106)、(132NLTN135)、(216NDSL219)及(265NFTL268)。NetPhos 2.0磷酸化位点预测显示,IL-1β蛋白有16个磷酸化位点,即有11个丝氨酸磷酸化位点、3个苏氨酸磷酸化位点和2个酪氨酸磷酸化位点。
2.5 IL-1β 同源性及系统进化分析
应用NCBI中的Blastp程序进行蛋白比对分析显示,齐口裂腹鱼IL-1β编码的氨基酸序列与鲤鱼(Cyprinus carpio)、鲫鱼(Carassius auratus)、南亚野鲮(Labeo rohita)、印度鲮(Cirrhinus mrigala)、团头鲂(Megalobrama amblycephala)等物种的相似性分别是81%、79%、77%、76%和57%。基于IL-1β氨基酸序列,采用Mega5.0软件构建氨基酸系统进化树(图4),由进化树可知,齐口裂腹鱼最先与鲤鱼和鲫鱼聚为一类,再与其他鱼类聚为一类,最后与哺乳动物聚为一类。

图4 齐口裂腹鱼IL-1β氨基酸系统进化树
2.6 IL-1β 基因组织表达分析
以齐口裂腹鱼18S rRNA为内参基因,琼脂糖凝胶电泳检测IL-1β基因在心脏、肝脏、脾脏、肾脏、肠道、肌肉6种组织中的表达量大小为:脾脏>肾脏>肌肉>心脏>肝脏>肠道(图5),可知,IL-1β基因主要在脾脏和肾脏中表达,且具有组织特异性。
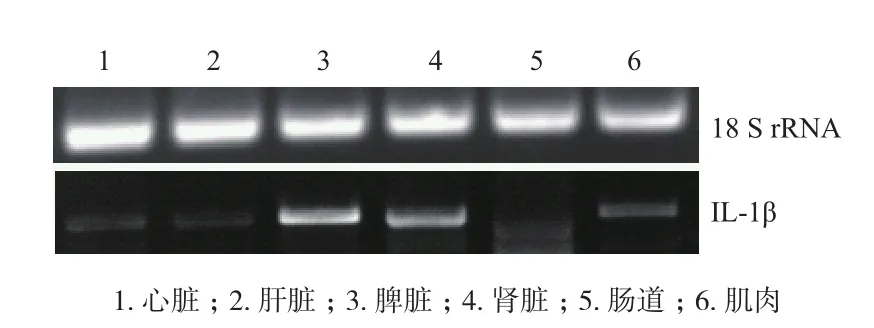
图5 齐口裂腹鱼IL-1β基因在不同组织中的表达情况
3 讨论
IL-1β是白介素-1家族中重要的成员之一,为一种重要的炎症和免疫原性细胞因子,能增强体液免疫和细胞免疫介导的组织损伤过程[19],并能促进B、T细胞的活化、增殖与分化,增强NK细胞的杀伤活力,刺激巨噬细胞和单核细胞产生IL-6和TNF-α等细胞因子。IL-6与IL-1β通过调节细胞的生长和分化,也能影响T细胞、B细胞的免疫功能[20,21]。迄今为止,IL-1β基因已在军曹鱼、鲢、鲤鱼、黑石斑鱼、黄鳍鲷、大鳍鳠、斜带石斑鱼等鱼体内被克隆出[9,10,14-18],尚未见在齐口裂腹鱼中的研究报道。
本实验成功克隆出齐口裂腹鱼IL-1β基因cDNA全长序列1 252 bp,编码276个氨基酸。研究显示,鲤鱼IL-1β蛋白也由276个氨基酸组成。这虽然与齐口裂腹鱼氨基酸数目相同,但氨基酸组分却存在差异。大鳍鳠IL-1β蛋白是由296个氨基酸残基组成的多肽,黑石斑鱼IL-1β蛋白是由252个氨基酸组成的多肽,鲢IL-1β蛋白由275个氨基酸组成。这说明不同品种鱼IL-1β蛋白序列存在一定差异或不同生境下其变异程度不同相关。经Blastp程序同源性分析发现齐口裂腹鱼与其他已知鱼类的IL-1β序列具有较高的同源性。且与已报道的鲤鱼IL-1β氨基酸序列同源性达81%[11,16]。在进化演变过程中,氨基酸序列比DNA序列更为保守,基于齐口裂腹鱼IL-1β氨基酸序列构建的系统进化树显示,齐口裂腹鱼IL-1β蛋白序列与鲤鱼、鲫鱼的聚类较近,与南亚野鲮、印度鲮等其他鱼类的聚类次之,而与人和小家鼠的聚类较远,显示该蛋白从鱼类到哺乳动物的进化规律符合从低等到高等的原则,且这对研究IL-1家族各因子出现的时间顺序有所帮助[11,16]。蛋白结构域分析,该蛋白含有IL-1超家族结构域,符合IL-1超家族结构特点,与相关报道IL-1β蛋白结构域特点相一致[9,11,16]。SignalIP 4.1信号肽预测显示,齐口裂腹鱼IL-1β编码的蛋白质未发现信号肽序列及IL-1转换酶(Interleukin-1 conveting enzyme,ICE)切割位点。研究报道哺乳动物是通过此位点被ICE切割后释放功能成熟肽,可推测齐口裂腹鱼编码的蛋白质可能是被某些酶消化后才成为具有生物学功能的成熟肽[22-24]。
IL-1β基因在鱼类免疫反应中的作用往往是通过表达方面的研究体现。本实验组织表达显示,IL-1β基因在齐口裂腹鱼脾脏、肾脏中表达量最高,在肌肉、心脏和肝脏中次之;在肠道中最弱。这提示IL-1β基因在6种组织中的表达具有一定的特异性,且这种特异性可能决定该基因在免疫应答过程中发挥作用的程度。大鳍鳠IL-1β在脾脏和头肾中表达量高,鲢只在脾脏中少量表达,在其他组织并无表达[10,15],这说明与其他组织相比,IL-1β基因可能在脾脏中的免疫应答过程中发挥的作用更大。
4 结论
本试验以齐口裂腹鱼为研究对象,成功克隆了IL-1β基因,并对其序列结构及在不同组织中的表达情况进行了分析。
[1]高珊, 余涛, 周景祥, 等. 鱼类白介素及其受体的研究[J]. 水产学杂志, 2014, 27(3):62-64.
[2]Stylianou E, Saklatvala J. Interleukin-1[J]. International Journal of Biochemistry & Cell Biology, 1998, 30(10):1075-1079.
[3]Bird S, Zou J, Wang T, et al. Evolution of interleukin-1 beta[J]. Cytokine&Growth Factor Reviews, 2002, 13(6):483-502.
[4]Huising MO, Stet RJ, Savelkoul HF, et al. The molecular evolution of the interleukin-1 family of cytokines:IL-18 in teleost fish[J]. Dev Comp Immunol, 2004, 28(5):395- 413.
[5]崔国东, 张雪梅, 陈立杰. IL-1β在急性脑缺血中作用机制的研究进展[J]. 临床神经病学杂志, 2015, 28(6):466-468.
[6]崔波, 吴健. 颅脑损伤患者急性期白细胞介素-1β及细胞间黏附分子-1水平的变化[J]. 中国实用神经疾病杂志, 2015, 18(24):13-14.
[7]张玉彪, 柳云恩, 金红旭, 等. 大鼠低温爆震伤对肺组织中IL-1β和TNF-α表达的影响[J]. 临床急诊杂志, 2015, 16(9):658-661.
[8]韩俊源, 郭华, 张亚群, 等. PCV通过激活MyD88调控体外培养PAMs分泌IL-1β、IL-6和IL-10[J]. 畜牧兽医学报, 2014, 45(4):647-653.
[9]Herath HM, Elvitigala DA, Godahewa G, et al. Molecular characterization and comparative expression analysis of two teleostean pro-inflammatory cytokines, IL-1β and IL-8, from Sebastes schlegeli[J]. Gene, 2016, 575(2Pt3):732-742.
[10]杨莹莹, 张其中, 李春涛, 等. 大鳍鳠IL-1β 基因 cDNA 克隆及表达分析[J]. 水产学报, 2012, 36(2):321-328.
[11]何江帅, 卢强, 李伟, 等. 鲤鱼白细胞介素-1β 全长 c DNA 的克隆·鉴定及其差异表达分析[J]. 安徽农业科学, 2011, 39(12):7301-7304.
[12]曾国航, 曹玉华, 王娟娟, 等. 多浪羊IL-1β基因的克隆及序列分析[J]. 新疆农业科学, 2013, 50(7):1347-1352.
[13]Zou J, Grabowski PS, Cunningham C, et al. Molecular cloning of interleukin1β from rainbow trout Oncorhynchus mykiss reveals no evidence of an ICE cut site[J]. Cytokine, 1999, 8:552-560.
[14] 邱丽华, 冯娟, 江世贵, 等. 军曹鱼白细胞介素1β基因的克隆、分析及表达[J]. 中国水产科 学, 2005, 12(2):119-125.
[15]蒋菁菁. 鲢补体C7和白细胞介素-1β基因的克隆、表达及序列分析[D]. 重庆:重庆师范大学, 2012.
[16]何江帅. 鲤鱼白细胞介素一基因克隆、鉴定及时空转录分析[D]. 长春:吉林大学, 2011.
[17]Jiang SG, Zhang DC, Li JZ, et al. Molecular characterization, recombinant expression and bioactivity analysis of the interleukin-1β from the yellowfin sea bream, Acanthopagrus latus(Houttuyn)[J]. Fish&Shellfish Immunol, 2008, 3:323-336.
[18]Lu DQ, Bei JX, Feng LN, et al. Interleukin-1β gene in orangespotted grouper, Epinephelus coioides:Molecular cloning, expression, biological activities and signal transduction[J]. Molecular Immunology, 2008, 45(4):857-867.
[19]Christman JW, Sadikot RT, Blackwell TS. The role of nuclear factor-κb in pulmonary diseases[J]. Chest, 2000, 117(5):1482-1487.
[20]金伯泉. 细胞和分子免疫学[M]. 第2版. 北京:科学出版社, 2001:134-146.
[21]Schindler R, Mancilla J, ENDRES S, et al. Correlations and interactions in the production of interleukin-6(IL-6), IL-1, and tumor necrosis factor(TNF)in human blood mononuclear cells:IL-6 suppresses IL-1 andTNF[J]. Blood, 1990, 75(1):40-47.
[22]Zou J, Bird S, Minter R, et al. Molecular cloning of the gene for interleukin-1 β from Xenopus laevis and analysis of expression in vivo and in vitro[J]. Immunogenetics, 2000, 51, (4):332-338.
[23]Nielsen H, Engelbrecht J, Brunk S, et al. Identification of prokaryotic signal peptides and prediction of their cleavage sites[J]. Protein Engineering, 1997, 10(1):1-6.
[24]Tsutsui S, Iwamoto T, Nakamura O, et al. LPS induces gene expression of interleukin-1β in congereel(Conger myriaster)macrophages:First cytokine sequence within Anguilliformes[J]. Fish&Shellfish Immunology, 2007, 23(4):911-916.
(责任编辑 狄艳红)
Cloning and Expression Profile of Interleukin-1β Gene in Schizothorax prenanti
DUAN Hui-qin1WANG Li2
(1. Institute of Qinghai-Tibet Plateau,Southwest University for Nationalities,Chengdu 610041;2. College of Life Science and Technology,Southwest University for Nationalities,Chengdu 610041)
This work aims to characterize interleukin-1β(IL-1β)gene of Schizothorax prenanti. First,RT-PCR was used to amplify IL-1β gene with cDNA of S. prenanti spleen as template. Then,the IL-1β gene sequence was analyzed with various bioinformatics tools,and the expressions in 6 tissues of S. prenanti were detected used RT-PCR. As results,the length of IL-1β gene was 1 252 bp,and it encoded 276 amino acids. Its GenBank accession number was KU886235,the molecular weight of IL-1β was 31.25 kD,and pI was 5.45. It was induced as a hydrophilic protein,and its secondary structure mainly consisted of random coil and extended strand. There were 4 N-glycosylation sites and 16 phosphorylation sites in this protein. Phylogenetic relationships revealed that S. prenanti presented a closest genetic relationship with Cyprinus carpio and Carassius auratus. The analysis of tissue expression indicated that IL-1β gene was mainly expressed in the spleen and kidney. It provides theoretical evidence for further studying the biological function of IL-1β gene.
Schizothorax prenanti;interleukin-1β;cloning;protein analysis;gene expression
10.13560/j.cnki.biotech.bull.1985.2017.02.014
2016-06-16
四川省科技支撑项目(2016NZ0044),西南民族大学研究生学位点建设项目(2016XWD-SO71007)
段荟芹,女,硕士生,研究方向:动物遗传学;E-mail:917077886@qq.com
王利,女,副教授,研究方向:动物免疫学;E-mail:qinxin916@aliyun.com
