肾动脉CTA最佳成像时间点分析:CT灌注成像与CTA对比
2017-02-22刘静红刘爱连刘义军邓锡佳刘晓冬孙美玉大连医科大学附属第一医院放射科辽宁大连116011
刘静红,刘爱连,刘义军,邓锡佳,方 鑫,刘晓冬,赵 莹,孙美玉(大连医科大学附属第一医院放射科,辽宁 大连 116011)
肾动脉CTA最佳成像时间点分析:CT灌注成像与CTA对比
刘静红,刘爱连*,刘义军,邓锡佳,方 鑫,刘晓冬,赵 莹,孙美玉
(大连医科大学附属第一医院放射科,辽宁 大连 116011)
目的 采用全肾CT灌注成像(CTP)数据提取最佳CTA期相,并与自动触发扫描获得的CTA图像进行对比。方法 回顾性分析因怀疑肾脏或上中腹部疾病行肾脏CT增强及灌注扫描的连续患者(n=21)以及同时期进行全腹CTA成像的患者(n=19)。灌注扫描患者先进行肾脏平扫,然后进行灌注扫描;CTA成像患者使用自动触发技术扫描。灌注图像采用CT Perfusion 4D肾脏灌注软件进行分析,根据左肾动脉和左肾静脉的时间-密度曲线(TDC)选择两个肾动脉CTA的期相,分别为A组和B组。CTA扫描数据使用Viewer功能进行测量,为C组。记录左肾动脉、左肾静脉CT值以及皮下脂肪的CT值和SD值。计算左肾动脉与左肾静脉的CT值差值、CNR及SNR,并进行对比。将CTA数据进行肾动脉血管重建,进行主观评分并进行分析。结果 3组的左肾动脉CT值、左肾静脉CT值、动静脉CT值差值、皮下脂肪CT值、皮下脂肪SD值、CNR、SNR间差异均有统计学意义(P均<0.001)。除A组与C组肾动脉CT值、A组与B组和B组与C组动静脉CT值差值、A组与B组皮下脂肪CT值和SD值、CNR、SNR差异无统计学意义外(P均>0.05),余两两比较差异均有统计学意义(P均<0.05)。结论 利用肾脏CTP数据,可获得肾动脉CTA数据;肾动脉与肾静脉CT值差值最大且满足肾动脉CT值超过300 HU的期相为最佳肾动脉CTA成像期相。
肾脏;体层摄影术,X线计算机;灌注成像;血管造影术
16 cm宽体探测器扫描可覆盖双侧肾脏,不仅可获得肾脏动态增强的信息,还可获得肾脏灌注信息,使全肾脏CT灌注成像(CT perfusion, CTP)成为可能。因肾脏CTP为连续动态扫描,包含动脉期,可通过灌注数据获得肾动脉数据并行后处理成像。本研究旨在利用全肾CTP数据提取最佳CTA期相,并与自动触发扫描获得的CTA图像进行对比,为完善一站式检查奠定基础。
1 资料与方法
1.1一般资料 收集2015年8月—11月我院疑似肾脏或中上腹部疾病、行肾脏CT增强及灌注扫描的连续患者(n=21)和同时期行全腹部CTA的患者(n=19)共40例,其中男29例,女11例,年龄22~84岁,平均(57.0±14.2)岁。纳入标准:①肾脏无器质性病变及肾萎缩;②无碘对比剂使用禁忌证;③无溶栓病史。本研究经本院伦理委员会审核批准。
1.2仪器与方法 采用GE Revolution CT机,所有患者检查前禁食、禁水4 h。患者取仰卧位,扫描时常规加用腹带,整个检查过程要求患者轻微呼吸。先进行肾脏平扫,然后行灌注扫描。灌注扫描协议为:轴扫模式,ASiR-V 60%,球管旋转时间0.5 s,z轴覆盖范围160 mm,矩阵512×512,SFOV 50.0 cm;完全覆盖患者双侧肾脏;扫描层厚5 mm,层间隔5 mm,重建层厚1.25 mm,重建间隔1.25 mm。注射对比剂后 5.9 s行CT数据采集,管电压80 kVp,管电流 200 mA,每2 s(曝光0.5s,间隔1.5s)采集1次,共采集25次,总灌注扫描时间为50 s。
CTA扫描条件:螺旋扫描模式,管电压100 kVp,自动毫安调制,ASiR-V 50%,螺旋扫描速度0.5秒/周,探测器宽度80 mm;扫描层厚及层间隔均为 1.25 mm。采用高压注射器(Ulrich)经肘前静脉注入85 ml非离子型对比剂(碘海醇350 mgI/ml),注射速率 5 ml/s;后将20 ml生理盐水以同样速率注射。采用自动触发扫描技术,监测腹主动脉CT值达220 HU后触发动脉期扫描。
1.3图像处理 由1名影像诊断医师(CTP诊断经验10年,观察者1)和1名放射科研究生(CTP诊断经验2年,观察者2)共同对获得数据进行测量。
将灌注图像的原始数据传至GE AW 4.6工作站,采用CT Perfusion 4D肾脏灌注软件,分别于左肾动脉及左肾静脉内手动勾画圆形ROI(直径均为 3 mm),左肾动脉选择起始处,左肾静脉选择腹主动脉前方水平走行的层面,生成左肾动脉及左肾静脉的时间-密度曲线(time-density curve, TDC)。根据两条TDC选择肾动脉CTA期相:首先选择左肾动脉与左肾静脉差值最大的期相,即左肾静脉开始出现上升趋势前、两条TDC距离最大且左肾动脉CT值高于300 HU的期相,为A组(图1A);然后再选择左肾动脉CT值最高期相,即左肾动脉CT值位于峰值的期相,为B组(图1B)。
CTA扫描数据使用Viewer功能进行浏览、测量,为C组。
记录3组的左肾动脉及左肾静脉CT值,记录皮下脂肪的CT值和SD值。计算左肾动脉与左肾静脉的CT值差值;计算CNR及SNR:CNR=(左肾动脉CT值-皮下脂肪CT值)/皮下脂肪SD值;SNR=左肾动脉CT值/皮下脂肪SD值。
将3组CTA数据进行肾动脉血管重建,重建方式包括VR、MIP及CPR。2名观察者分别采用5分制对肾动脉CTA图像进行评分[1]:5分,肾动脉及分支显示清晰,无任何静脉的影响;4分,肾动脉及分支显示清晰,下腔静脉浅淡显影,但不影响动脉的观察;3分,肾动脉及分支显示清晰,下腔静脉及1条肾静脉浅淡显影,轻微影响动脉的观察;2分,肾动脉及分支显示清晰,下腔静脉及2条肾静脉显影,影响动脉观察;1分,肾动脉分支显示不清,下腔静脉及2条肾静脉明显显影,严重影响动脉观察。
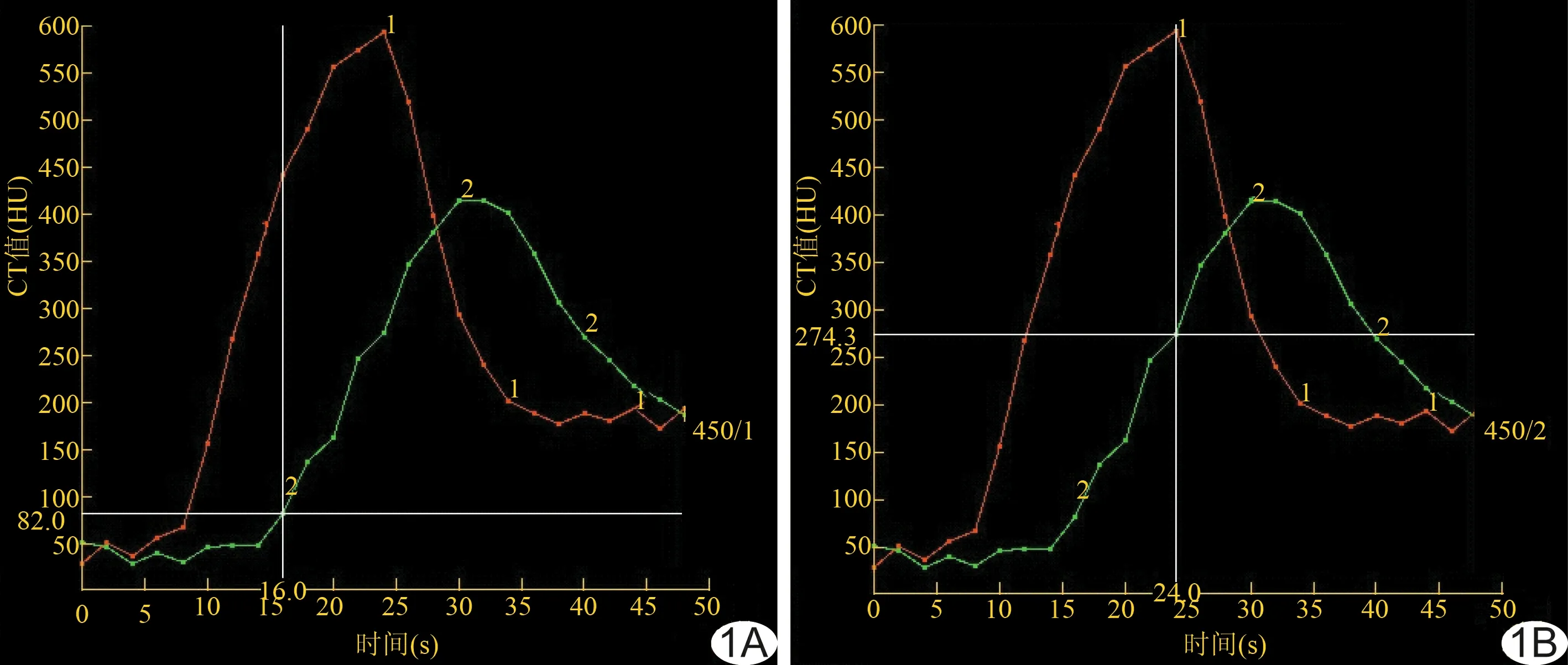
图1 患者男,48岁,红色曲线为左肾动脉TDC,绿色曲线为左肾静脉TDC A.A组CTA期相选择方法(差值最大期相),为第16秒即第8期; B.B组CTA期相选择方法(肾动脉CT值最高期相),为第24秒即第12期
1.4统计学分析 采用SPSS 17.0统计分析软件。2名观察者对3组肾动脉CTA图像主观评分的一致性采用Kappa检验(Kappa值>0.75为一致性良好,0.40~0.75为一致性一般,<0.40为一致性差),如评分一致性良好,则使用观察者1的评分结果。对数据行正态分布检验及方差齐性分析,正态分布的计量资料以±s表示,3组左肾动脉CT值、左肾静脉CT值、左肾动脉与左肾静脉CT值差值、左肾动脉CNR、左肾动脉SNR比较采用单因素方差分析,采用LSD或Tamhane'sT2法行两两对比;3组的主观评分的比较采用Kruskal-Wallis秩和检验。P<0.05为差异有统计学意义。
2 结果
2名观察者对3组主观评分的一致性良好(Kappa=0.877、0.928、0.917)。取观察者1的评分结果,3组主观评分差异无统计学意义(秩均值分别为38.05、26.26、28.45,P=0.06)。
A组肾动脉CTA的动静脉差值最大期相位于4~11期,平均为第8期;B组肾动脉CT值最高期相位于9~15期,平均为第12期。3组的左肾动脉CT值、左肾静脉CT值、动静脉CT值差值、皮下脂肪CT值、皮下脂肪SD值、CNR、SNR差异均有统计学意义(P均<0.05),见表1。
A组和C组左肾动脉CT值均明显低于B组 (P=0.001、0.004),而A、C组间差异无统计学意义 (P=0.652);A组左肾静脉CT值最低,B组左肾静脉CT值最高,3组两两比较差异均有统计学意义 (P均<0.001);A组左肾动静脉CT值差值明显高于B组和C组(P=0.029、0.007),而B组与C组间差异无统计学意义(P=0.535)。A、B组皮下脂肪CT值及SD值差异均无统计学意义(P=0.652、0.728),C组的皮下脂肪CT值及SD值均明显高于A组和B组 (P均<0.001)。A、B组CNR和SNR差异无统计学意义(P=0.483、0.222),均明显高于C组(P均<0.001),见表1。3组肾动脉VR成像见图2。
表1 3组各参数对比结果(±s)
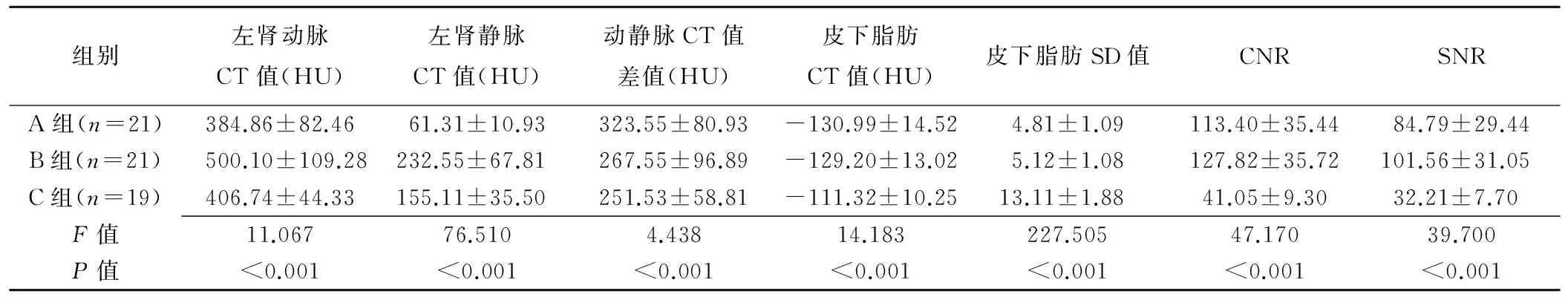
表1 3组各参数对比结果(±s)
组别左肾动脉CT值(HU)左肾静脉CT值(HU)动静脉CT值差值(HU)皮下脂肪CT值(HU)皮下脂肪SD值CNRSNRA组(n=21)384.86±82.4661.31±10.93323.55±80.93-130.99±14.524.81±1.09113.40±35.4484.79±29.44B组(n=21)500.10±109.28232.55±67.81267.55±96.89-129.20±13.025.12±1.08127.82±35.72101.56±31.05C组(n=19)406.74±44.33155.11±35.50251.53±58.81-111.32±10.2513.11±1.8841.05±9.3032.21±7.70F值11.06776.5104.43814.183227.50547.17039.700P值<0.001<0.001<0.001<0.001<0.001<0.001<0.001
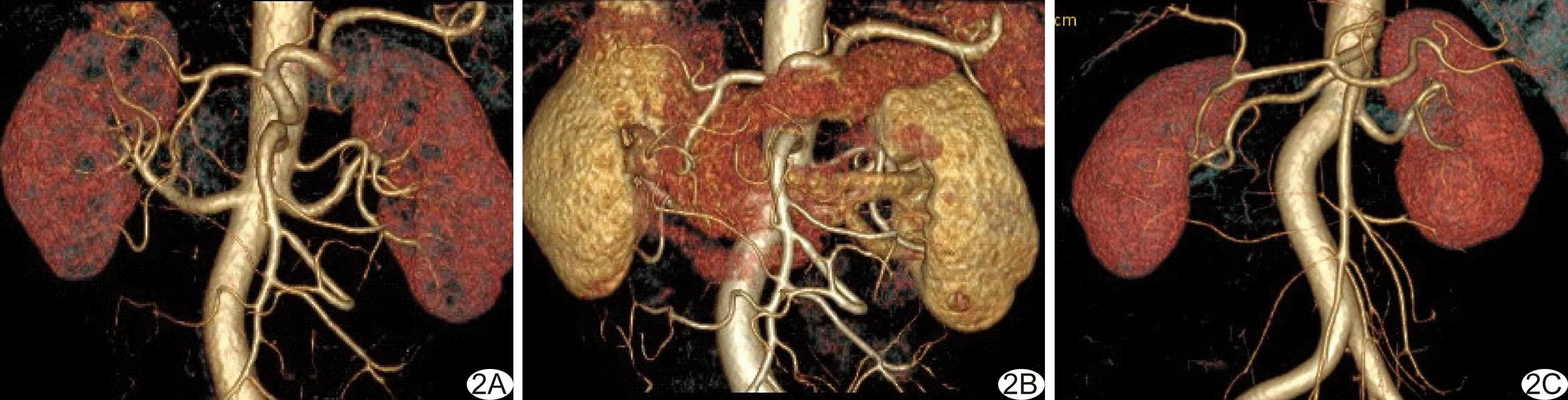
图2 肾动脉的VR成像 A.A组图像,肾动脉显示清晰,无肾静脉、下腔静脉污染,主观评分为5分; B.B组图像,肾动脉显示良好,但肾静脉、胰腺、脾脏等器官明显显影,部分遮挡肾动脉显示,评分为3分; C.C组图像,肾动脉显示清晰,无肾静脉及下腔静脉污染,评分为5分
3 讨论
3.1 肾动脉CTA意义 多种肾脏疾病需获得肾动脉的信息,如对于肾动脉狭窄患者,术前需明确狭窄程度及范围,拟定支架直径和长度。近期有学者[2]将肾动脉CTA测量的肾动脉狭窄直径和长度与DSA进行对比,发现CTA测量的结果与DSA结果差异无统计学意义。也有学者[3]选择47例肾血管性高血压患者进行CTA、MRA和卡托普利肾图试验,发现11例在卡托普利试验中呈阳性结果,显示肾动脉血流减少时MRA的ROC曲线下面积为0.91,CTA的ROC曲线下面积为0.90,两者差异无统计学意义,证实CTA和MRA均可测量肾动脉狭窄直径及长度。CTA不但可以指导肾动脉狭窄治疗前的支架选择,还可用于评估肾动脉狭窄的治疗疗效,研究[4]结果亦表明,与金标准DSA相比,CTA对于肾动脉病变诊断的敏感度、特异度、阳性预测值及阴性预测值分别为0.868、0.833、0.983和0.357。
此外,对于肾脏肿瘤的患者,亦需要获得肾动脉信息。目前部分肾脏切除术已经成为低分期肾细胞癌的标准治疗方法,其肿瘤预后与肾脏根治性切除术预后相似[5]。与开放性部分肾脏切除术相比,腹腔镜部分肾切除(laparoscopicpartial nephrectomy, LPN)的应用缩短了住院周期,降低了术中出血以及手术时间[6]。为避免全肾缺血且使肾功能损伤最小化[7],可采用肾段动脉夹闭包括选择性肾动脉分支夹闭技术。因此,术前了解肾动脉的解剖学信息并明确肿瘤的供血动脉,对成功进行肾动脉分支夹闭有重要意义。CTA可准确显示肾血管解剖[8-9]。有研究[10]采用256排CT对肿瘤供血动脉与术中观察的肾段动脉进行对比,发现CTA观察肿瘤供血动脉分支的准确率为85.7%,CTA预测的肿瘤供血动脉数量与LPN观察到的数量差异无统计学意义(P=0.839)。CTA所示肿瘤供血动脉的肾外长度与术中观察差异无统计学意义(P=0.183)。因此,CTA可用于术前评估肾动脉,为外科手术提供肿瘤供血动脉,使LPN时肾段动脉夹闭更容易成功[11]。
3.2肾动脉CTA常规获得方法及优缺点 常用的肾动脉CTA数据获得方法是通过监测腹主动脉CT值,使用跟踪自动触发技术进行扫描,大大提高了肾动脉CTA的成功率。也有学者[12]对肾动脉CTA进行低管电压低对比剂的研究,发现采用最佳能谱51 keV单能量成像可降低对比剂用量,提高CT值,维持与常规CTA相同的图像质量;但只能获得CTA图像,不能获得肾脏动态增强图像。获得肾脏动态增强图像及肾动脉CTA的图像需进行两次增强扫描,增加了对比剂用量,使肾脏负担加重;同时增加了患者的辐射剂量和患者术前等待时间。随着宽体16 cm探测器的出现,肾脏全器官灌注成像成为研究的热点。灌注CT为连续性采集,可通过灌注数据获得肾脏动态增强图像,也可通过灌注数据提取肾动脉CTA数据。本研究结果表明,利用左肾动脉及左肾静脉TDC曲线可获得满意的肾动脉CTA图像。本研究发现左肾动脉CT值达最高峰时显示肾动脉效果最佳,但此时肾静脉、下腔静脉等静脉系统亦出现强化,无法避免静脉污染。肾脏为富血供器官,早期肾皮质即出现明显强化,因肾静脉较其他部位静脉短小,因此很快便出现肾静脉回流。因此,当肾动脉达最大峰值时,肾静脉甚至下腔静脉亦出现强化,严重干扰肾动脉显影。如选择肾动脉与肾静脉CT值差值最大的期相,且满足肾动脉CT值超过300 HU,则不但可满足肾动脉成像的CT值要求,也最大程度地避免了肾静脉等静脉系统的污染,提示该时相为肾动脉CTA最佳期相。而该方法与常规CTA扫描进行对比时,其动静脉密度差值高于常规CTA,静脉污染最小。本研究结果表明自CTP中提取的肾动脉图像的CNR及SNR均高于常规肾动脉CTA,CTA主观评分差异无统计学意义。本研究将最佳期相选择的肾动脉CT值阈值设定为300 HU,根据既往经验当动脉CT值>300 HU时,可以满足重建要求。
本研究的不足:样本量偏小,后续可增加入组患者数量,以期结果更为精准;根据临床要求进行随机分组,未采用非劣效试验设计。
总之,利用肾脏CTP数据,可获得肾动脉CTA数据,选择肾动脉与肾静脉CT值差值最大,且满足肾动脉CT值超过300 HU的期相为最佳肾动脉CTA期相,与常规CTA成像主观效果相似。
[1] 刘静红,刘爱连,田士峰,等.低浓度对比剂结合能谱CT最佳单能量成像对胆囊动脉的显示能力.中国医学影像技术,2014,30(7):1091-1094.
[2] Kadziela J, Michalowska I, Pregowski J, et al. Stent sizing strategies in renal artery stenting: The comparison of conventional invasive renal angiography with renal computed tomographic angiography. Adv Interv Cardiol, 2016,12(2):116-121.
[3] Andersson M, Jägervall K, Eriksson P, et al. How to measure renal artery stenosis—a retrospective comparison of morphological measurement approaches in relation to hemodynamic significance. BMC Med Imaging, 2015,15:42.
[4] Mao Q, Zhong B, Lin Y, et al. Clinical application of computed tomographic angiography in patients with renal arterial hemorrhage: Diagnostic accuracy and subsequent therapeutic outcome. Exp Ther Med, 2015,10(2):508-512.
[5] Van Poppel H, Da Pozzo L, Albrecht W, et al. A prospective, randomised EORTC intergroup phase 3 study comparing the oncologic outcome of elective nephron-sparing surgery and radical nephrectomy for low-stage renal cell carcinoma. Eur Urol, 2011,59(4):543-552.
[6] Gill IS, Kavoussi LR, Lane BR, et al. Comparison of 1,800 laparoscopic and open partial nephrectomies for single renal tumors. J Urol, 2007,178(1):41-46.
[7] Shao P, Qin C, Yin C, et al. Laparoscopic partial nephrectomy with segmental renal artery clamping: Technique and clinical outcomes. Eur Urol, 2011,59(5):849-855.
[8] Kang WY, Sung DJ, Park BJ, et al. Perihilar branching patterns of renal artery and extrarenal length of arterial branches and tumour-feeding arteries on multidetector CT angiography. Br J Radiol, 2013,86(1023):20120387.
[9] Rastogi N, Sahani DV, Blake MA,et al. Evaluation of living renal donors: Accuracy of three-dimensional 16-section CT. Radiology, 2006,240(1):136-144.
[10] Meng X, Mi Q, Fang S, et al. Preoperative evaluation of renal artery anatomy using computed tomography angiography to guide the superselective clamping of renal arterial branches during a laparoscopic partial nephrectomy. Exp Ther Med, 2015,10(1):139-144.
[11] Li X, Huang Y, Liu W,et al. A model for assuring clamping success during laparoscopic partial nephrectomy with segmental renal artery clamping. World J Urol, 2016,34(10):1421-1427.
[12] 吴青霞,朱绍成,谢瑞刚,等.应用低管电压能谱CT成像降低肾动脉CTA对比剂用量.中国医学影像技术,2013,29(2):280-284.
Analysis of optimal imaging time for renal CTA: Comparision of CT perfusion
LIUJinghong,LIUAilian*,LIUYijun,DENGXijia,FANGXin,LIUXiaodong,ZHAOYing,SUNMeiyu
(DepartmentofRadiology,FirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China)
Objective To select the optimal imaging phase for renal CTA extracted from the renal CT perfusion (CTP) data, and to compare its image quality with the conventional CTA triggered using an automatic bolus tracking technique. Methods The images of 21 consecutive renal CTP (n=21) patients and 19 renal CTA (n=19) patients were analyzed retrospectively. The CTP was performed followed by noncontrast CT. The CTA was performed using an automatic bolus tracking technique. The CTP data was postprocessed on CT Perfusion 4D kidney software. The renal artery CTA images in the CTP imaging were extracted at the scan phases based on the time-density curve (TDC) of the left renal artery (group A) and left renal vein (group B). CTA images (group C) were analyzed using the Viewer function. The CT values of left renal artery and left renal vein, CT values and SD values of subcutaneous fat in the three groups were recorded. The difference of CT value between left renal artery and left renal vein, CNR and SNR of the left renal artery were recorded and compared. The subjective scoring of CTA images was performed and compared. Results There were significant differences on CT values of left renal artery and left renal vein, differences of CT value between left renal artery and vein, CT value of subcutaneous fat, SD of subcutaneous fat, CNR and SNR of left renal artery among the three groups (allP<0.001). Except the CT values of renal artery in group A and group C, differences of CT value between artery and vein in group A and group B, group B and group C, CT value and SD value of subcutaneous fat, CNR, SNR in group A and group B, there were significant differences in all comparisons between any two groups (allP>0.05). Conclusion The renal CTA images can be extracted from CTP scans. The optimal phase is when the differences of CT value between the left renal artery and vein at the maximum, combined with the CT value of the left renal artery is more than 300 HU. CTA image generated at the optimal phase is much better than that of the CTA obtained with the automatic bolus tracking technique.
Kidney; Tomography, X-ray computed; Perfusion imaging; Angiography
刘静红(1979—),女,辽宁锦州人,硕士,副主任医师。研究方向:泌尿系统影像诊断学。E-mail: liujinghong54@163.com
刘爱连,大连医科大学附属第一医院放射科,116011。E-mail: cjr.liuailian@vip.163.com
2016-10-19
2016-12-13
10.13929/j.1672-8475.201610019
R692; R814.42
A
1672-8475(2017)02-0108-05
方法技术学
