基于UPLC-Triple TOF MS/MS技术分析苍耳子炒制前后的差异化学成分
2017-02-21刘娟秀罗益远刘训红宋建平华愉教王胜男
刘娟秀,罗益远,刘训红,宋建平,华愉教,王胜男,赵 慧,严 颖
(1.南京中医药大学,江苏 南京 210023;2.盐城卫生职业技术学院,江苏 盐城 224006)
基于UPLC-Triple TOF MS/MS技术分析苍耳子炒制前后的差异化学成分
刘娟秀1,罗益远1,刘训红1,宋建平2,华愉教1,王胜男1,赵 慧1,严 颖1
(1.南京中医药大学,江苏 南京 210023;2.盐城卫生职业技术学院,江苏 盐城 224006)
为探讨苍耳子炒制前后化学成分的变化,采用超高效液相色谱-串联四极杆飞行时间高分辨质谱(UPLC-Triple TOF MS/MS)法,结合多元统计分析技术,对苍耳子炒制前后化学成分的差异性进行分析。通过分析二级串联质谱,针对峰匹配、峰对齐、滤噪处理等进行特征峰提取;采用主成分分析(PCA)和偏最小二乘-判别分析(PLS-DA)法进行数据处理;根据一级质谱精确质荷比和二级质谱碎片信息,结合软件数据库搜索、标准品比对及相关文献数据进行成分鉴定。结果表明,苍耳子炒制前后的化学组成得到了有效区分,初步筛选出44个差异化学成分,并鉴定出其中的41个成分;所分析的样品共有10个差异化学成分,在不同样品中呈现不同的变化规律。该方法可为解析苍耳子药材的品质形成机制提供基础资料,也可为解释苍耳子炒制减毒的科学内涵提供依据。
苍耳子;炒制;超高效液相色谱-串联四极杆飞行时间高分辨质谱法(UPLC-Triple TOF MS/MS);差异化学成分
苍耳子系菊科植物苍耳(XanthiumsibiricumPatr.)的干燥成熟带总苞的果实,是中医临床常用药材,收载于2015年《中国药典》,具散风寒、通鼻窍、祛风湿之功效,为历代治疗鼻渊及头痛的要药[1]。苍耳子化学成分复杂,主要含有酚酸类、倍半萜内酯类、挥发油、脂肪油和水溶性苷类等[2-4]。现代研究表明,酚酸类成分具有抗炎、抗菌和抗血栓等作用[5-7];蒽醌类成分具有抗菌消炎、抗病毒、降血脂和增加免疫力等作用[8];黄酮类成分具有抗炎、抗氧化和抗肿瘤等作用[9-10]。苍耳子资源丰富,临床使用量大,但其生品药材有毒,经炒制后可降低毒性。目前,苍耳子炮制规范及制品质量标准尚不完善,炒制过程缺乏客观、科学的工艺参数,导致药材质量参差不齐,难以实现商品药材标准化及保障临床使用的有效性。
目前,对苍耳子药材的质量评价及炮制研究主要集中在环烯醚萜苷、苯丙素苷及有机酸等几种指标成分的含量测定[11-17]以及其指纹图谱分析[18],分析方法多为高效液相色谱(HPLC)法[11-14,19]或高效毛细管电泳(HPCE)法[15],尚未见苍耳子炮制前后化学成分的整体变化或显著差异化学成分的研究报道。其中,HPLC法操作简便、灵敏度较高;HPCE法载样量小、柱效高、分辨率好,但重现性差、灵敏度较低。以上两种方法主要用于定量分析,定性分析则需要标准品对照。液相色谱-质谱技术广泛用于中药复杂体系的定性和定量分析,常用的质谱技术有四极杆质谱、离子阱质谱、飞行时间质谱及复合式串联质谱等[20]。其中,低分辨率的四极杆质谱和离子阱质谱得到的碎片离子较少,而高分辨率质谱能够测得化合物的精确分子质量,进而获得化合物的分子式。根据多级质谱给出的化合物碎片信息,并结合相关文献[21]资料,可快速鉴定化合物的结构。近年来,超高效液相色谱-串联四极杆飞行时间高分辨质谱(UPLC-Triple TOF MS/MS)法已成为植物代谢组学研究的重要手段之一。
植物代谢组学技术是对植物抽提物中代谢组进行高通量、无偏差、全面分析的技术,可用于研究生物整体、系统或器官的内源性代谢物质的代谢途径及其所受内在或外在因素的影响,该技术也适用于中药多组分复杂体系的分析。
本研究借鉴植物代谢组学的思路和方法,采用超高效液相色谱-串联四极杆飞行时间高分辨质谱法分析苍耳子炒制前后化学成分的变化。通过多元统计分析找出变化显著的差异化学成分,并探讨其变化规律,希望为揭示苍耳子炒制前后化学成分变化规律及其品质形成机制提供基础资料。
1 实验部分
1.1 仪器和材料
SHIMADZU SIL-20A XR超快速液相色谱仪:日本岛津公司产品,配有DGU-20A3脱气装置,LC-20AD XR液相,SIL-20A XR 自动进样器,CTO-20AC 柱温箱;Triple Q-TOF 5600 质谱仪:美国AB Sciex公司产品,配有电喷雾离子源(ESI)系统,Analyst Software TF1.6数据采集处理工作站;BSA224S型电子分析天平:德国Sartorius公司产品;KQ-500E型超声波清洗器(功率500 W,频率40 kHz):昆山市超声仪器有限公司产品;DHG-9140A型电热恒温鼓风干燥箱:上海沪粤明科学仪器有限公司产品;湘仪H1650-W高速离心机:湖南湘仪实验室仪器开发有限公司产品。
甲醇,甲酸:均为质谱纯,德国Merck公司产品;实验用水:超纯水,由Millipore纯水器制备。
苍耳子样品分为商品药材和实地采集两种,均由南京中医药大学刘训红教授鉴定为菊科植物苍耳XanthiumsibiricumPatr.的成熟带总苞的果实,样品信息列于表1。其中,S8为S4根据《中国药典》2015版一部的炒苍耳子制法制得的对应炮制品。每种样品平行取3份进行分析,留样凭证存放于南京中医药大学中药鉴定实验室。

表1 苍耳子药材样品详情Table 1 Sample details of Xanthii Fructus
1.2 实验条件
1.2.1 色谱条件 Agilent Zorbax SB-C18色谱柱(250 mm×4.6 mm, 5 μm);流动相:甲醇(A),0.2%甲酸水溶液(B);梯度洗脱程序:0~10 min(20%~30%A),10~20 min(30%~35%A),20~30 min(35%~80%A),30~45 min(80%~100%A),45~48 min(100%~20%A);流速1.0 mL/min;柱温35 ℃;进样量10 μL。
1.2.2 质谱条件 电喷雾离子源(ESI)负离子模式,质量扫描范围m/z50~1 000,喷雾电压5.0 kV,气帘气流速30 L/min,雾化气流速55 L/min,辅助气流速55 L/min,离子源温度500 ℃,碰撞室射出电压(CXP)9 V,去簇电压(DP)100 V。
1.3 供试品溶液的制备
精密称取1.0 g药材粉末(已过3号筛),置于100 mL具塞锥形瓶中,加入40 mL甲醇,称其质量;在室温下超声提取30 min后取出,放冷,用甲醇补足质量损失,静置冷却;以12 000 r/min离心10 min,取上清液,经0.22 μm微孔滤膜过滤,即得供试品溶液。
1.4 方法学考察
1.4.1 精密度实验 精密吸取同一供试品溶液,连续进样6次,对各主要色谱峰的峰面积进行积分,计算其相对保留时间和相对峰面积的RSD值,考察仪器的精密度。
1.4.2 稳定性实验 精密吸取同一供试品溶液,分别于第0、4、8、12、24 h进样检测,对各主要色谱峰的峰面积进行积分,计算其相对保留时间和相对峰面积的RSD值,考察供试品溶液的稳定性。
1.4.3 重复性实验 精密称取1 g苍耳子样品,按1.3节方法制备6份供试品溶液,色谱分析后,对各主要色谱峰的峰面积进行积分,计算其相对保留时间和相对峰面积的RSD值,考察样品制备的重复性。
1.5 谱图处理与统计分析
将原始质谱数据和色谱图导入Peakview 1.2 数据处理工作站进行峰匹配、峰对齐、滤噪等处理,结果保存为文本格式,然后将文本文件调整后导入SIMCA-P 13.0软件进行分析。采用主成分分析(PCA)法,通过初步观察各样品的聚集情况,直观地表达苍耳子炒制前后的化学成分差异;采用偏最小二乘判别分析(PLS-DA)法对各样品进行分类,其中R2X、R2Y越接近1,表示模型越稳定,Q2>0.5表示预测率高。根据PLS-DA模型得到的变量权重值(VIP>1)找到潜在的差异化学成分,采用t检验法验证多维统计中的差异化学成分是否在单维统计中具有显著性差异,其中P<0.05表示有显著性差异。
1.6 差异化学成分的鉴定
通过一级质谱确定精确的相对分子质量,二级质谱获得裂解信息,结合HMDB(http:∥www.hmdb.ca/)和METLIN(http:∥metlin.Scripps.edu/)数据库搜索、标准品比对及相关文献报道,确定或推测化合物结构信息。共有差异成分的含量以各样品对应的峰强度数值表示,通过对生苍耳子与炒苍耳子样品间同一物质峰强度的平均值和标准差进行计算,得到共有差异成分在苍耳子炒制前后的相对含量变化。
2 结果与讨论
2.1 色谱条件的优化
分别考察了甲醇-水、乙腈-水、甲醇-0.1%甲酸水、甲醇-0.2%甲酸水等溶液作为流动相时对样品中各峰分离度的影响。结果表明,在流动相中加入一定比例的甲酸可增强样品中待测物的保留,并减少色谱峰拖尾。采用甲醇-0.2%甲酸水溶液作为流动相时,峰形较好且可达到良好的分离效果。
2.2 质谱条件的优化
分别考察了样品中化学成分在正、负离子模式下的响应情况。结果表明,负离子模式比正离子模式能提供更多的质谱峰信息,故本实验采用负离子模式进行分析。苍耳子炒制前后样品的UPLC-Triple TOF MS/MS 基峰强度离子流(BPI)色谱图示于图1。
2.3 供试品处理方法的优化
分别考察了甲醇、70%甲醇、50%甲醇3种溶液作为提取溶剂的情况,结果表明,以甲醇为溶剂的色谱峰峰形优于其他两种溶剂。还考察了超声提取30、60、90 min对提取效果的影响,结果表明,超声提取30 min与其他两种超声时间的提取效果无明显差异。同时考察了料液比分别为1∶20、1∶30、1∶40对提取效率的影响,结果表明,料液比为1∶40时具有较高的提取效率。
2.4 方法学考察结果
按1.4节方法考察方法的精密度、稳定性和重复性,结果显示,各项实验中主要色谱峰的相对保留时间和相对峰面积的RSD值均小于2%,这表明仪器精密度良好,供试品溶液在24 h内稳定且方法重复性良好。
2.5 主成分分析(PCA)
采用PCA多变量模式识别方法对苍耳子炒制前后样品进行降维分析,其得分图示于图2。由图2可见,生苍耳子与炒苍耳子样品可以被明显地分开,生苍耳子样品位于PC1轴的负方向,炒苍耳子样品位于PC1轴的正方向,而且各自聚为一类,这说明炒制前后苍耳子化学组成明显不同。生苍耳子样品分布相对比较集中,说明组内均一性较好,即化学物质组成相近;而炒苍耳子样品分布相对比较分散,即组内样品化学成分组成差异相对较大,这可能是由炒苍耳子商品药材缺乏统一的炮制规范和工艺参数导致的。
2.6 偏最小二乘判别分析(PLS-DA)
为进一步证实苍耳子炒制前后样品中化学成分的差异性,采用有监督的模式识别方法PLS-DA来分析确定苍耳子炒制前后样品间的差异化学成分,其得分图示于图3。在图3中,生苍耳子与炒苍耳子样品沿PC1轴明显分开,其模型参数为R2X(cum)=0.904,R2Y(cum)=0.982,Q2(cum)=0.891,证明模型有效可靠。与模型相对应的柱状载荷图示于图4,采用常用的变量载荷评价参数(VIP)值来描述变量的贡献程度,当VIP>1时,认为存在潜在的差异化学成分。通过VIP值和柱状载荷图对两组样品中的差异化学成分进行考察,初步筛选出44个差异化学成分。

注:a.生苍耳子;b.炒苍耳子图1 苍耳子炒制前后UPLC-Triple TOF-MS/MS 基峰强度离子流BPI色谱图Fig.1 UPLC-Triple TOF MS/MS base peak intensity (BPI) chromatogramsof Xanthii Fructus before and after stir-frying

注:a.生苍耳子;b.炒苍耳子S1.□;S2.◇;S3.○;S4.*;S5.▲;S6.■;S7.◆;S8.△图2 负离子模式下苍耳子炒制前后的PCA得分图Fig.2 PCA scores of Xanthii Fructus before and after stir-frying in negative ion mode

注:a.生苍耳子;b.炒苍耳子S1.□;S2.◇;S3.○;S4.*;S5.▲;S6.■;S7.◆;S8.△图3 苍耳子炒制前后样品的PLS-DA得分图Fig.3 PLS-DA scores of Xanthii Fructus before and after stir-frying
2.7 差异化学成分的鉴定
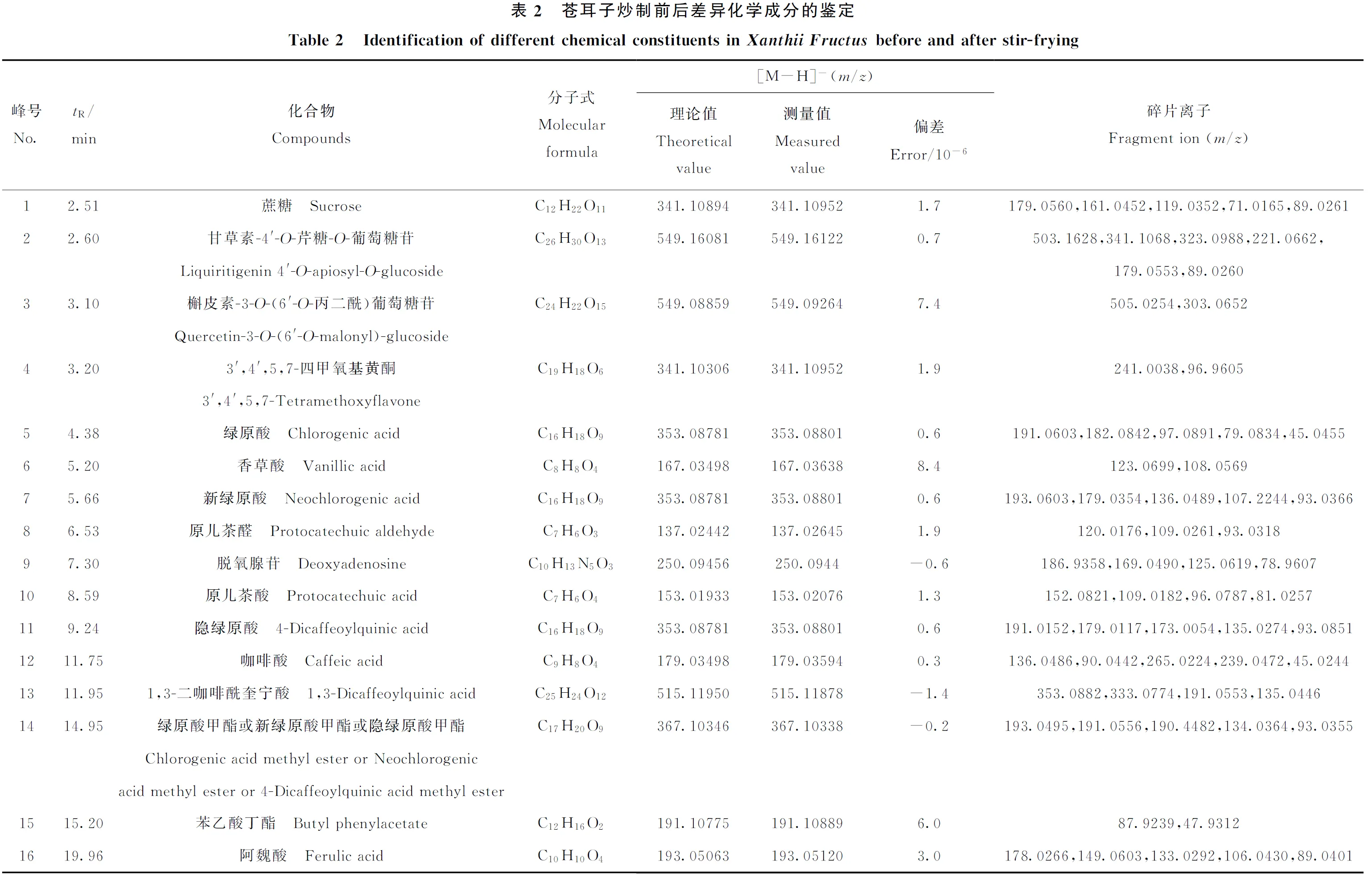
通过HMDB和METLIN数据库结合已有的文献[22-29]搜索差异化学成分的精准质荷比,对VIP>1的44个差异显著化学成分进行结构鉴定,初步鉴定出其中的41个化学成分,其质谱数据列于表2。
2.8 共有差异化学成分的相对含量变化分析
所分析的8个苍耳子炒制前后样品中共有10种差异化学成分,包括甘草素-4′-O-芹糖-O-葡萄糖苷、3′,4′,5,7-四甲氧基黄酮、绿原酸、脱氧腺苷、隐绿原酸、1,3-二咖啡酰奎宁酸、3,4-二咖啡酰奎宁酸、紫云英苷、4′-去磺基苍术苷和β-胡萝卜素。以共有差异成分的峰强度数值代表其含量,对生苍耳子和炒苍耳子样品间同一物质峰强度的平均值和标准差进行计算和作图,得到各共有差异成分在苍耳子炒制前后后样品间含量的变化情况,示于图5。由图5可见,10种差异化学成分中,甘草素-4′-O-芹糖-O-葡萄糖苷、脱氧腺苷、1,3-二咖啡酰奎宁酸、3,4-二咖啡酰奎宁酸、紫云英苷及β-胡萝卜素的相对含量在炒制品中较高;而3′,4′,5,7-四甲氧基黄酮、绿原酸、隐绿原酸及4′-去磺基苍术苷的相对含量在生品中较高。
3 结论
本实验采用UPLC-Triple TOF MS/MS联用技术分析苍耳子炒制前后化学成分的差异,初步确定出41个差异显著的化学成分,在苍耳子炒制前后的8个样品中共同含有10个差异化学成分,其相对含量呈现不同的变化规律。炒制后的样品中,甘草素-4′-O-芹糖-O-葡萄糖苷、脱氧腺苷、1,3-二咖啡酰奎宁酸、3,4-二咖啡酰奎宁酸、紫云英苷和β-胡萝卜素的含量增高,这可能是苍耳子“炒制增效”的物质基础;而3′,4′,5,7-四甲氧基黄酮、绿原酸、隐绿原酸及4′-去磺基苍术苷的含量降低。苍术苷是苍耳子的主要毒性成分之一,4′-去磺基苍术苷为苍术苷在酸性条件下解离出K+,然后脱去一分子磺酸基而得,炒制样品中4′-去磺基苍术苷含量显著降低,这可能是苍耳子“炒制减毒”的原因之一。该方法能够找出苍耳子炒制前后差异显著的化学成分,并揭示其变化规律,可为解析苍耳子药材的品质形成机制提供基础资料,也可为解释苍耳子炒制减毒的科学内涵提供依据。

图4 苍耳子炒制前后样品的PLS-DA柱状载荷图Fig.4 PLS-DA contribution loading plot of Xanthii Fructus before and after stir-frying



注:a.生苍耳子;b.炒苍耳子1.甘草素-4′-O-芹糖-O-葡萄糖苷;2. 3′,4′,5,7-四甲氧基黄酮;3.绿原酸;4.脱氧腺苷;5.隐绿原酸;6.1,3-二咖啡酰奎宁酸;7.3,4-二咖啡酰奎宁酸;8.紫云英苷;9. 4′-去磺基苍术苷;10. β-胡萝卜素图5 苍耳子炒制前后样品中共有差异化学成分的相对含量Fig.5 Relative contents of different chemical constituents in Xanthii Fructus before and after stir-frying
[1] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:中国医药科技出版社,2015:162.
[2] RODRIGUEZ E, TOWERS G H N, MITCHELL J C. Biological activities of sesquiterpene lactones[J]. Biochemical Systematics & Ecology, 1986, 15: 1 573-1 580.
[3] 王淑萍,张桂珍,高英. 苍耳子挥发油化学成分分析[J]. 长春工程学院学报:自然科学版,2007,8(2):81-83.
WANG Shuping, ZHANG Guizhen, GAO Ying. Analysis of chemical constituents of volatile oil fromXanthiiFructus[J]. Journal of Changchun Institute of Technology (Natural Science Edition), 2007, 8(2): 81-83(in Chinese).
[4] 代英辉,崔征,李建林. 苍耳属植物化学成分及药理作用研究进展[J]. 沈阳药科大学学报,2007,24(12):786-790.
DAI Yinghui, CUI Zheng, LI Jianlin. Research progress on chemical constituents and pharmacological activities of theXanthiumsibiricum[J]. Journal of Shenyang Pharmaceutical University, 2007, 24(12): 786-790(in Chinese).
[5] 韩进庭. 苍耳子的药理作用与临床应用[J]. 现代医药卫生,2008,24 (20):3 067-3 068.
HAN Jinting. The pharmacological effects ofXanthiiFructusand clinical application[J]. Journal of Modern Medicine & Health, 2008, 24 (20): 3 067-3 068(in Chinese).
[6] 韩婷,李慧梁,胡园,等. 苍耳子中酚酸类化合物及不同品种和居群苍耳子中总酚酸含量的测定[J]. 中国中西医结合学报,2006,4(2):194-198.
HAN Ting, LI Huiliang, HU Yuan, et al. Phenolic acids inFrucutusXanthiiand determination of contents of total phenolic acids in diffenert species and populations ofXanthiumin China[J]. Journal of Chinese Integrative Medicine,2006, 4(2): 194-198(in Chinese).
[7] 宋琳琳,沙靖全,赵宏,等. 苍耳草中总酚酸的含量测定及其抗炎作用研究[J]. 时珍国医国药,2013,24(10):2 331-2 332.
SONG Linlin, SHA Jingquan, ZHAO Hong, et al. Determination of TPA content of Xanthium sibiricum Patrin exWidder and anti-inflammatory effect[J]. Lishizhen Medicine and Materia Medica Research, 2013, 24(10): 2 331-2 332(in Chinese).
[8] 曹亮,周建军. 蒽醌类化合物的研究进展[J]. 西北药学杂志,2009,24(3):237-238.
CAO Liang, ZHOU Jianjun. Progress anthraquinone compounds[J]. Northwest Pharmaceutical Journa, 2009, 24(3): 237-238(in Chinese).
[9] 钟地长,张淑凤,陈振锋,等. 天然产物黄酮类化合物的提取、纯化及其金属配合物的研究进展[J]. 化学世界,2006,47(9):561-564.
ZHONG Dichang, ZHANG Shufeng, CHEN Zhenfeng, et al. Research progress on the extraction and purification of natural flavonoides and their metal complexes[J]. Chemical World, 2006, 47(9): 561-564(in Chinese).
[10]王如阳,刘晓芳,刘满红,等. 苍耳子提取液的抗氧化活性研究与总黄酮含量测定[J]. 云南中医中药杂志,2008,29(9):42-43.
WANG Ruyang, LIU Xiaofang, LIU Manhong, et al. Study on the antioxidant activity of the extract and determine the content of total flavonoids ofFructusXanthii[J]. Yunnan Journal of Traditional Chinese Medicine and Materia Medica, 2008, 29(9): 42-43(in Chinese).
[11]田静,夏玉凤,房克慧. HPLC法同时测定苍耳类药材中8种酚酸类成分的含量[J]. 中药材,2013,36(10):1 623-1 626.
TIAN Jing, XIA Yufeng, FANG Kehui. Simultaneous determineation of 8 phenolic acids inXanthiumsibiricummedicines by HPLC[J]. Jorunal of Chinese Medicinal Materials, 2013, 36(10): 1 623-1 626(in Chinese).
[12]朵睿,刘玉红,王明奎,等. HPLC 同时测定苍耳子中6个化学成分的含量[J]. 药物分析杂志,2013,33(1):78-82.
DUO Rui, LIU Yuhong, WANG Mingkui, et al. HPLC simultaneous determination of the content of 6 constituents inFructusXanthii[J]. Chinese Journal of Pharmaceutical Analysis, 2013, 33(1): 78-82(in Chinese).
[13]杨柳,苏芝军,许舜军,等. UPLC法同时测定苍耳子中4 种酚酸类成分的含量[J]. 药学学报,2010,45(12):1 537-1 540.
YANG Liu, SU Zhijun, XU Shunjun, et al. Simultaneous determination of 4 phenolic acids in Cangerzi by ultra-performance liquid chromatography[J]. Acta Pharmaceutica Sinica, 2010, 45 (12): 1 537-1 540(in Chinese).
[14]洪燕,韩燕全,夏伦祝,等. 超高效液相色谱法同时测定不同产地苍耳子9种酚酸类成分的含量[J]. 中国药学杂志,2013,48(13):1 109-1 112.
HONG Yan, HAN Yanquan, XIA Lunzhu, et al. Simultaneous determination of nine phenolic acid components inXanthiiFructus[J]. Chinese Pharmaceutical Journal, 2013, 48(13): 1 109-1 112(in Chinese).
[15]刘娟秀,罗益远,刘训红,等. 毛细管电泳同时测定苍耳类药材中7种酚酸类成分的含量[J]. 中国药学杂志,2015,50(4):366-370.
LIU Juanxiu, LUO Yiyuan, LIU Xunhong, et al. Simultaneous determination of seven phenolic acids fromXanthiiHerbaandXanthiiFructusby HPCE[J]. Chinese Pharmaceutical Journal, 2015, 50(4): 366-370(in Chinese).
[16]刘娟秀,罗益远,刘训红,等. 衍生化GC-MS同时测定苍耳子中14种脂肪酸的含量[J]. 天然产物研究与开发,2016,28(1):76-82.
LIU Juanxiu, LUO Yiyuan, LIU Xunhong, et al. Simultaneous determination of fourteen fatty acids inXanthiiFructusby derivatized GC-MS[J]. Natural Product Research and Development, 2016, 28(1): 76-82(in Chinese).
[17]刘娟秀,罗益远,刘训红,等. 不同采收期苍耳草中酚酸类及蒽醌类成分的动态积累分析[J]. 中草药,2016,47(7):1 204-1 209.
LIU Juanxiu, LUO Yiyuan, LIU Xunhong, et al. Dynamic changes of phenolic acids and anthraquinones in aerial parts ofXanthiumsibiricumfrom different collection periods[J]. Chinese Tradit Herbal Drugs, 2016, 47(7): 1 204-1 209(in Chinese).
[18]王光忠,安靖,吴慧,等. 苍耳子炒制前后毒性部位的高效液相指纹图谱研究[J]. 时珍国医国药,2013,24(3):663-665.
WANG Guangzhong, AN Jing, WU Hui, et al. HPLC fingerprint of toxic sites inXanthiiFructusbefore and after stir-frying[J]. Lishizhen Medicine and Materia Medica Research, 2013, 24(3): 663-665(in Chinese).
[19]秦泗涟,马利华,王振中,等. UPLC法同时测定炒苍耳子配方颗粒中5种酚酸类成分[J]. 中成药,2012,34(7):1 393-1 395.
QIN Silian, MA Lihua, WANG Zhenzhong, et al. UPLC Determination fried cocklebur Granule 5 kinds of phenolic acids[J]. Chinese Traditional Patent Medicine, 2012, 34(7): 1 393-1 395(in Chinese).
[20]奇小城,章弘扬,梁琼麟,等. 液质联用技术及其在代谢组学研究中的应用[J]. 中成药,2009,31(1):106-112.
QI Xiaocheng, ZHANG Hongyang, LIANG Qionglin, et al. LC-MS technology and the application in metabolomics research[J]. Chinese Traditional Patent Medicine, 2009, 31(1): 106-112(in Chinese).
[21]李坤平,高崇凯,李卫民. UPLC/ESI-TOF-MS/MS分析蛇床子提取物中香豆素类化合物[J].中成药,2009,31(4):584-587.
LI Kunping, GAO Chongkai, LI Weimin. Analysis of coumarins in extract ofCnidiummonnieriby UPLC/ESI-TOF-MS/MS[J]. Chinese Traditional Patent Medicine, 2009,31(4): 584-587(in Chinese).
[22]程智,王伦,陈斌,等. 苍耳子的化学成分[J]. 应用与环境生物学报,2011,17(3):350-352.
CHENG Zhi, WANG Lun, CHEN Bin, et al. Chemical constituents fromFructusXanthii[J]. Chinese Journal of Applied & Environmental Biology, 2011, 17(3): 350-352(in Chinese).
[23]陈洁,王瑞,师彦平.苍耳子的化学成分研究[J]. 中草药,2013,44(13):1 717-1 720.
CHEN Jie, WANG Rui, SHI Yanping. Chemical constituents fromXanthiiFructus[J]. Chinese Tradit Herbal Drugs, 2013, 44(13): 1 717-1 720(in Chinese).
[24]韩婷. 苍耳子的生物活性成分及品质评价[D]. 上海:第二军医大学,2006.
[25]汪洋. 中药苍耳子的毒性物质基础及中毒机制研究[D]. 上海:第二军医大学,2010.
[26]张树军,刘焕,李军,等. 蒙古苍耳全草化学成分研究[J]. 中草药,2015,46(3):329-333.
ZHANG Shujun, LIU Huan, LI Jun. et al. Study on chemical constituents from whole herbs ofXanthiummongolicum[J]. Chinese Tradit Herbal Drugs, 2015, 46(3): 329-333(in Chinese).
[27]池玉梅,李瑶,张瑜,等. 超高效液相色谱-四极杆串联飞行时间质谱分析黄酮类化合物及小毛茛茎叶的成分[J]. 色谱,2013,31(9):838-844.
CHI Yumei, LI Yao, ZHANG Yu, et al. Analysis of flavonoids and components of stems & leaves ofRanunculusternatusThunb. uing ultra performance liquid chromatography-quadrupole tandem time of flight mass spectrometry[J]. Chinese Journal of Chromatography, 2013, 31(9): 838-844(in Chinese).
[28]闫利利,史家文,王金芳,等. 基于UPLC/Q-TOF-MSE方法分析半夏泻心汤的化学成分[J].药学学报,2013,48(4):526-531.
YAN Lili, SHI Jiawen, WANG Jinfang, et al. UPLC/Q-TOF-MSEbased analysis of chemical composition of Banxia Xiexin decoction[J]. Acta Pharmaceutica Sinica, 2013, 48(4): 526-531(in Chinese).
[29]李辰辰,陆小腾驾,童华荣. HPLC-Q-TOF-MS-MS测定桑椹中多酚类物质[J]. 食品科学,2015,36(2):101-104.
LI Chenchen, LU Xiaotengjia, TONG Huarong. Analysis of phenolic compounds in mulberry by high performance liquid chromatography-time of flight mass spectrometry[J]. Food Science, 2015, 36(2): 101-104(in Chinese).
Differences of Chemical Compositions inXanthiiFructusbefore and after Stir-Frying by UPLC-Triple TOF MS/MS
LIU Juan-xiu1, LUO Yi-yuan1, LIU Xun-hong1, SONG Jian-ping2, HUA Yu-jiao1, WANG Sheng-nan1, ZHAO Hui1, YAN Ying1
(1.NanjingUniversityofChineseMedicine,Nanjing210023,China;2.YanchengHealthVocational&TechnicalCollege,Yancheng224006,China)
The method of UPLC-Triple TOF MS/MS combined with multivariate statistical analysis was used to study the differences of chemical compositions inXanthiiFructusbefore and after stir-frying. Through the analysis of the multistage tandem mass spectrometry, the characteristic peaks were extracted with mass spectrometry data peak matching, peak alignment, noise filtering. Principal component analysis (PCA) and partial least-squares discriminant analysis (PLS-DA) were used for data processing. The chemical compositions were identified and tentative presumed according to MS accurate mass and MS/MS spectrometry fragmentation information, combined with the software of database search and comparison with reference standards and literature. The results show that the chemical compositions inXanthiiFructusbefore and after stir-frying are clearly distinguished. A total of 44 different chemical compositions are detected inXanthiiFructusbefore and after stir-frying, and 41 chemical compositions of which are identified. Among of them, there are 10 kinds of common differential compositions, such as liquiritigenin 4′-O-apiosyl-O-glucoside, 3′,4′,5,7-tetramethoxyflavone, chlorogenic acid, deoxyadenosine, 4-dicaffeoylquinic acid, 1,3-dicaffeoylquinic acid, 3,4-dicaffeoylquinic acid, astragalin, 4′-desulphate-atractylosid andβ-carotene, which present different change laws. In the 10 differential components, the contents of liquiritigenin 4′-O-apiosyl-O-glucoside, deoxyadenosine, 1,3-dicaffeoylquinic acid, 3,4-dicaffeoylquinic acid, astragalin, andβ-carotene are much higher inXanthiiFructusafter stir-frying, while the contents of 3′,4′,5,7-tetramethoxyflavone, chlorogenic acid, 4-dicaffeoylquinic acid, and 4′-desulphate-atractylosid are lower. This study provides a basic information for revealing the change law of chemical compositions inXanthiiFructusbefore and after stir-frying.
XanthiiFructus; stir-frying; UPLC-Triple TOF-MS/MS; chemical compositions
2016-05-09;
2016-10-05
江苏高校优势学科建设工程项目(YSXK-2014);江苏高校品牌专业建设工程项目(PPZY2015A070);盐城市医学科技发展计划项目(YK2014051)资助
刘娟秀(1990—),女(汉族),江苏人,硕士研究生,生药学专业。E-mail: liujx0516@163.com
刘训红(1959—),男(汉族),江苏人,教授,从事中药鉴定与品质评价研究。E-mail: liuxunh1959@sohu.com
O657.63
A
1004-2997(2017)01-0157-12
10.7538/zpxb.2017.38.01.0157
