雨生红球藻中虾青素萃取工艺优化
2017-02-18李亚鹤徐年军
徐 煜, 张 琳, 李亚鹤, 杨 柳, 王 东, 孙 雪, 徐年军
(宁波大学 海洋学院, 宁波 315211)
雨生红球藻中虾青素萃取工艺优化
徐 煜, 张 琳, 李亚鹤, 杨 柳, 王 东, 孙 雪, 徐年军
(宁波大学 海洋学院, 宁波 315211)
建立了雨生红球藻中虾青素的超声波提取和高效液相色谱检测方法, 优化了雨生红球藻虾青素萃取工艺各项参数。实验数据显示: 相对于其他有机溶剂, 最佳提取溶剂为丙酮, 以虾青素含量作为衡量标准, 各溶剂提取效率的顺序为: 丙酮>二氯甲烷/甲醇(1∶3,V/V)>甲醇>石油醚>氯仿。通过响应面实验, 对影响虾青素提取的各项因素实施了优化, 确定了超声波辅助提取虾青素的最佳工艺参数: 料液比1∶377, 超声时间5.19 min, 超声波功率为145 W, 虾青素含量的预测值为2.931%, 在优化条件下, 虾青素含量实际测定值为2.896%。在该条件下,雨生红球藻虾青素含量明显提高。
雨生红球藻; 虾青素; 超声波提取法; 响应面; 高效液相色谱法
雨生红球藻(Haematococcuspluvialis)为已知虾青素含量最高的藻类之一[1]。虽然很多藻类都能够合成虾青素(astaxanthin), 如斜生栅藻(Scenedesmusobliquus)[2]、极地雪藻(Chlamydomonasnivalis)[3]、绿球藻(Chlorococcumsp.)[4]等, 但雨生红球藻是较为典型的种类, 它的虾青素含量远高于其他藻类, 达到细胞干重1.0%~3.0%[5], 并且雨生红球藻含有丰富的不饱和脂肪酸[6]。雨生红球藻积累速率也高于目前已知藻类, 并且其所含虾青素及其酯类的配比与鲑鱼等水产动物的配比极为类似[7]。因此, 学界将它作为天然虾青素的可靠来源, 并开展了深入的研究。
目前, 人们主要使用植物油[8-9]或有机溶剂[10]作为溶剂来萃取雨生红球藻中的虾青素。大部分虾青素以游离形态存在于藻类中[11], 溶剂直接萃取的效果较好, 但提取时间长, 需要加以辅助技术, 如微波萃取[12]、超临界萃取[13]、亚临界水萃取[14]和超声波[15]等技术手段。超声波技术的优点包括成本低、效果佳、处理时间短[16]等。本文使用超声波辅助技术对虾青素进行提取, 借助于超声波的空化作用, 雨生红球藻的细胞壁和细胞膜被损坏, 虾青素溶出, 增强了溶剂的提取效果[17]。
由于雨生红球藻含有包括叶绿素、类胡萝卜素在内的其他色素物质[18], 普通检测方法容易受到杂质干扰, 本文使用C18反向色谱柱[19]进行分离定量, 减弱了以上不利因素带来的误差。本研究为藻类抗氧化物质生产与检测提供了基本的技术参考。
1 材料与方法
1.1 材料与仪器
雨生红球藻藻粉: 上海嘉兴泽元生物制品有限公司; 虾青素标准品: 德国Dr.Ehrenstorfer公司; 色谱级甲醇: 美国CNW公司; 2,6-二叔丁基-4-甲基苯酚(BHT); 其他试剂均为分析纯。
LC-P310型高效液相色谱仪: 江苏天瑞仪器股份有限公司; R-215型旋转蒸发仪: 瑞士BUCHI公司。
1.2 实验方法
1.2.1 不同提取溶剂的影响
准确称量藻样若干份, 每份20 mg, 各置于15 mL离心管中。向各离心管中分别加入甲醇、二氯甲烷/甲醇(1∶3,V/V)、丙酮、石油醚、氯仿各10 mL, 将超声波组织破碎仪设置为模式3(总时间: 10 min, 超声1.5 s/间歇2 s, 超声波频率40%, 调节超声探头在液面下同一位置), 在冰浴环境中超声波破碎, 时间10 min。处理过后的液体在8000 r/min低温4 ℃离心15 min, 取上清液, 将其在-4 ℃条件下避光保存。将以上的实验步骤重复2~3次, 直到离心管中的细胞沉淀物呈现乳白色。将得到的等体积样品在50 ℃条件下, 旋转挥发全部有机溶剂后, 使用甲醇将残留物溶解并且定容至5 mL容量瓶中, 再使用0.22 μm有机系滤膜将获得的溶液过滤, 最后进行HPLC检测(以虾青素含量作为衡量指标)。
1.2.2 液相色谱检测条件
流动相(甲醇∶水=95∶5), 流速1 mL/min, 设置波长478 nm, 柱温30℃, 色谱柱welch ultimate XB-C18, 5 μm, 4.6×250 mm。每次进样量为20 μL。
1.2.3 标准曲线的绘制
精确称取5 mg虾青素标准品, 使用BHT甲醇溶液, 将虾青素标准品定容在25 mL容量瓶中, 此为0.2 mg/mL虾青素标准品储备液,-4 ℃避光保存备用, 使用前取出恢复至室温。分别吸取0.125、0.250、0.625、1.25、2.5、5和10 mL储备液, 稀释于25 mL容量瓶。对制备好的标准品梯度溶液进行检测。
以虾青素浓度平均值(μg/mL)为纵坐标, 峰面积(mAU*s)为横坐标, 制作标准曲线。标准曲线的回归方程为:Y=0.0006X+0.7331,R2=0.9977, 其中Y为浓度(μg/mL),X为峰面积(mAU*s), 回归方程的线性范围为1~80 μg/mL, 最低检出限为0.5 μg/mL。
1.2.4 虾青素含量计算公式
η(%)=(c×v)/m×100%
η为虾青素含量(%),c为提取液的虾青素浓度(mg/mL),v为定容体积(mL),m为藻样质量(mg)。
1.2.5 单因素实验设计
1)料液比: 称量5份藻样, 每份0.0200 g, 分别置于10 mL离心管中, 向各管中加入1、2、4、8、12和16 mL丙酮, 将料液比(mg/mL)各设置为: 1∶50、1∶100、1∶200、1∶400、1∶600及1∶800, 超声波功率设置为300 W, 超声时间设置为10 min, 进行浸提实验, 后续步骤同1.2.1, 比较虾青素含量。
2)超声波时间: 称量5份藻样, 每份0.0200 g, 分别置于10 mL离心管中, 向各管中加入4 mL丙酮, 使其料液比为1∶800, 分别提取2、4、6、8和10 min, 后续骤同 1.2.1, 比较虾青素含量。
3)超声波功率: 称量5份藻样, 每份0.0200 g, 分别置于10 mL离心管中, 设置超声波功率分别为100、200、300、400和500 W, 分别向5支管中各加入4 mL丙酮, 使其料液比为1∶800, 总超声时间10 min, 进行浸提实验, 后续步骤同1.2.1, 比较虾青素含量。
1.2.6 响应面实验设计
使用design-expert V8.0.6进行实验设计(见表1), 以虾青素含量为考察指标, 以料液比(A)、超声时间(B)和超声波功率(C)为自变量, 设置17个处理组。

表1 雨生红球藻虾青素提取响应面实验设计Table 1 Response surface experiment design of extraction of astaxanthin from Haematococcus pluvialis
1.3 数据处理
使用Excel 2007、Origin 8.0及SPSS 19.0对数据进行处理。
2 结果与分析
2.1 HPLC分离结果和标准曲线的建立
虾青素标准溶液的高效液相色谱图(图1), 红球藻提取液的高效液相色谱图(图2)。通过与已有的研究结果对比分析[20], 使用保留时间法对虾青素进行定性分析, 确定在13.12 min处色谱峰为虾青素。
2.2 雨生红球藻虾青素提取的单因素实验结果
2.2.1 不同提取溶剂对虾青素含量的影响
超声波能量在不同介质中的传播效果是不同的, 所以选取合适的溶剂可以增强提取效果。另外, 根据虾青素的溶解度差异和藻粉的物料性质, 选取二氯甲烷/甲醇(1∶3,V/V)、石油醚、氯仿、甲醇、丙酮作为实验溶剂, 进行提取。不同溶剂按效果排序为: 丙酮>二氯甲烷/甲醇(1∶3,V/V)>甲醇>石油醚>氯仿, 与其他溶剂相比, 丙酮的提取效率明显高于其他溶剂。丙酮的极性相对较高, 藻粉在极性较高的溶剂中的分散性很好, 且丙酮是一种提取色素物质的传统理想溶剂。因此本实验选择丙酮作为提取溶剂(图3)。

图 1 虾青素标准溶液色谱图Fig 1 Chromatogram of astaxanthin standard
注: 1为虾青素

图 2 雨生红球藻提取液色谱图Fig 2 Chromatogram of extract from Haematococcus pluvialis
注:1为虾青素
2.2.2 料液比的影响
将丙酮作为溶剂, 设置超声时间10 min, 料液比对虾青素含量的影响如图4。在料液比从1∶50增加到1∶600时, 含量从1.372%增加到1.781%, 提高幅度较大。当料液比高于1∶200时, 随着料液比提高, 含量变化减小, 在料液比为1∶600时, 含量达到1.835%。
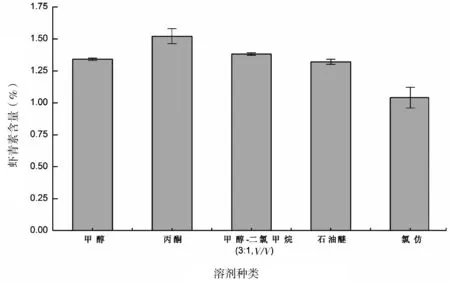
图 3 不同类型溶剂对雨生红球藻虾青素含量的影响Fig 3 Effects of different solvents on astaxanthin yields of Haematococcus pluvialis

图 4 料液比对雨生红球藻虾青素含量的影响Fig 4 The effect of ratio of solid/liquid on astaxanthin yield of Haematococcus pluvialis
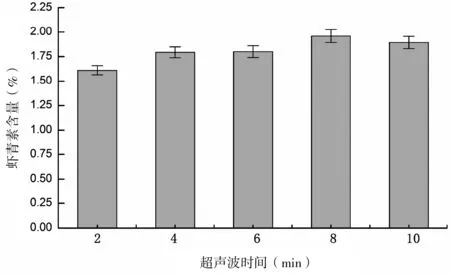
图 5 超声波时间对雨生红球藻虾青素含量的影响Fig 5 The effect of ultrasonic time on astaxanthin yield of Haematococcus pluvialis
2.2.3 超声时间的影响
超声时间对虾青素含量的影响如图5。料液比设置为1∶200, 伴随着超声波时间增加, 在8 min以内, 虾青素含量缓慢提高, 当8 min时, 含量为2.53%, 之后, 随着时间延长, 含量缓慢降低, 10 min时降为2.33%。由于雨生红球藻的红孢囊细胞(haematocysts)的直径通常仅为20~40 μm[21], 相对于其他微藻具有较厚的细胞壁, 只有经过破壁后[22], 溶剂才能迅速渗入, 让溶解扩散作用到达均衡状态。提取达到溶解扩散均衡以后, 较长时间超声波处理对虾青素稳定性的负面效果增大。

图 6 超声波功率对雨生红球藻虾青素含量的影响Fig 6 The effect of ultrasonic power on astaxanthin yield of Haematococcus pluvialis
2.2.4 超声波功率的影响
超声波功率对虾青素含量的影响见图6。 当超声波功率从100 W提高至400 W, 含量从1.527%增至2.024%。超声作用使雨生红球藻的细胞壁与细胞膜破损, 随着超声波功率的增强, 利于虾青素溶出。功率高于400 W时, 含量开始缓慢降低。当超声于丙酮中传播时, 由超声造成的分子震动被摩擦力限制, 让部分能量转化成热量, 由于超声波产生的热量较多,而虾青素对热敏感, 容易降解成其他物质[23], 所以当超声波功率超过400 W时, 虾青素含量有所降低。

表 2 响应面分析方案及实验结果Table 2 Experimental design and result of response surface method
2.3 雨生红球藻虾青素提取响应面实验结果及分析
实验设计因素、水平和实验结果如表2, 选取料液比(A)、超声波时间(B)及超声波功率(C)进行三水平三因素响应面分析。运用软件Design-expert V8.0.6, 以多元回归拟合的方法对数据进行处理, 获得雨生红球藻中虾青素含量的回归方程:
Y=0.48+7.64×10-3×A+0.16×B+8.12×10-3×C-1.25×10-4×AB-9.33×10-6×AC-1.12×10-4×BC-7.47×10-6×A2-9.27×10-3×B2-1.36×10-5×C2
由表3可以得出, 模型F值极显著(P<0.01), 而失拟项的F值不显著(P>0.05), 数学模型的相关系数R2是96.94%, 表明模型的误差较小,拟合效果良好。可以使用该数学模型, 进行预测与分析。
以回归方程为基础, 可以通过软件导出等高线图与响应面分析图(图7), 通过等高线的轮廓可以反映出2个因素交互作用的强与弱, 圆形与椭圆形代表交互作用的显著与不显著。由图7可知,超声波时间与料液比交互作用较为显著, 超声波时间与料液比的交互作用较显著, 超声波时间与超声波功率交互作用也较显著。在所选的各因素水平范围内, 各因素对虾青素含量影响的强弱排序: 料液比>超声波功率>超声时间。

图 7 各因素对雨声红球藻中虾青素含量影响的响应面图及等高线Fig 7 Response surface plot and contour plot of interaction effects between every two factors on the extraction astaxanthin yield from Haematococcus pluvialis
使用软件处理后,获得的最优参数是: 料液比1∶377, 超声时间5.19 min, 超声波功率为145 W。虾青素含量预测值为2.931%。在此条件下, 采用超声波辅助提取红球藻虾青素, 提取过程重复3次, 虾青素含量实际测量值是2.896%, 和预测值对比, 相对误差为0.035%, 与预测值基本一致。

表3 方差分析结果Table 3 Analysis of variance results
注: **P<0.01, 差异极显著;*P<0.05, 差异显著
3 讨论
雨生红球藻中含有多种具有良好开发前景的天然类胡萝卜素, 包括虾青素紫黄素、环氧化玉米黄质、新黄素等[24], 其中, 目前市场价值最高的是具有强抗氧化活性的虾青素[25]。也有研究进行了红发夫酵母发酵生产虾青素的相关研究[26]。虾青素作为一种已经在市场化销售并且收到良好反馈的化妆品原料, 其提取与稳定储存是学者关注的方面之一。当虾青素从藻细胞中提取出来后, 会在强光及高温条件下发生降解[21]。Bustamante等[27]发现了一种提高虾青素稳定性方法, 将雨生红球藻与油性树脂微囊化, 以降低虾青素的降解率与减小半衰期。但在实验室层面上, 其方法不宜采用。
为了克服传统提取与检测方法的缺点,本实验使用高效液相色谱法检测,此法可缩短样品处理周期,且所需样品量小,让避光、恒温[28]、氮气保护等更容易操作,在一定程度上提高了虾青素的稳定性,降低了实验误差,也符合国家最新出台的行业标准[29]。本研究同时使用软件获得超声波辅助提取虾青素的回归方程,对雨生红球藻虾青素超声波辅助提取技术进行了优化,各参数为料液比1∶377,超声时间5.19 min,提取功率145 W,虾青素含量预测结果是2.931%,实际测量结果是2.896%,同预测结果对比仅相差0.035%, 实际结果与模型预测值基本符合。与国内已经报道的虾青素提取工艺优化研究[30-33]相比, 本方法的优势在于首次将高效液相色谱检测技术与响应面优化设计有机结合, 提高了数据的准确性。
[1]张 丽. 雨生红球藻的紫外诱变、抗铵品系筛选及培养条件优化[D]. 青岛: 青岛科技大学, 2010.
[2]秦 山, 刘国祥, 胡征宇. 斜生栅藻中虾青素的积累过程及其光合活性变化[J]. 水生生物学报, 2009, 33(3): 509-515.
[3]REZANKA T, NEDBALOVL, KOLOUCHOVI, et al. LC-MS/APCI identification of glucoside esters and diesters of astaxanthin from the snow algaChlamydomonasnivalisincluding their optical stereoisomers[J]. Phytochemistry, 2013, 88(8): 34-42.
[4]向文洲, 吴华莲, 谢 科, 等. 一种绿球藻的极端适应特性与虾青素高效诱导[J]. 热带海洋学报, 2007, 26(1): 50-54.
[5]高桂玲, 成家杨, 马 炯. 雨生红球藻和虾青素的研究[J]. 水产学报, 2014, 38(2): 297-304.
[6]季晓敏, 王亚男, 黄 健, 等. 气-质联用法分析雨生红球藻中的脂肪酸[J]. 中国食品学报, 2014, 14(5): 244-252.
[7]蔡明刚, 王杉霖, 李文权, 等. 天然虾青素在水产养殖业中的应用研究进展[J]. 应用海洋学学报, 2003, 22(3): 377-385.
[8]KANG C D, SIM S J. Direct extraction of astaxanthin fromHaematococcusculture using vegetable oils[J]. Biotechnology Letters, 2008, 30(3): 441-444.
[9]吴彩娟. 天然虾青素提取和纯化工艺研究[D]. 杭州: 浙江大学, 2003.
[10]李 婷, 韩丽君, 袁 毅. 不同有机溶剂对雨生红球藻中虾青素提取成分的影响[J]. 海洋科学, 2012, 36(7): 34-38.
[11]许培雅, 章银军. 虾壳虾青素提取工艺的研究[J]. 粮食与饲料工业, 2003(2): 27-28.
[12]赵晓燕, 陈 军, 陈锋亮, 等. 变频微波法辅助萃取雨生红球藻中虾青素的研究[J]. 食品科技, 2014(3): 188-193.
[13]季晓敏, 王亚男, 徐嘉杰, 等. 扫描电镜和响应面优化雨生红球藻破壁萃取虾青素的工艺研究[J]. 核农学报, 2014, 28(6): 1052-1061.
[15]姜 玲, 董庆霖, 邢向英, 等. 雨生红球藻细胞破碎的工艺优化[J]. 食品研究与开发, 2010, 31(7): 72-75.
[16]许培雅, 章银军. 虾壳虾青素提取工艺的研究[J]. 粮食与饲料工业, 2003(2): 27-28.
[17]孙协军, 李佳伟, 李秀霞, 等. 响应面法优化盐藻β-胡萝卜素超声波提取工艺[J]. 食品工业科技, 2015, 36(12): 278-281.
[18]陈 勇, 李德发, 陆文清, 等. 测定雨生红球藻中虾青素及其它色素含量的高效液相色谱法[J]. 分析测试学报, 2003, 22(4): 28-31.
[19]应国清, 王晓艳, 沈寅初. 高效液相色谱法分析检测虾青素[J]. 食品与发酵工业, 2001, 27(11): 43-44.
[20]姜 淼, 杨贤庆, 李来好, 等. 高效液相色谱法测定虾壳中的虾青素[J]. 食品科学, 2010, 31(20): 371-375.
[21]CHEKANOV K, LOBAKOVA E, SELYAKH I, et al. Accumulation of astaxanthin by a newHaematococcuspluvialisstrain BM1 from the White Sea coastal rocks (Russia)[J]. Marine Drugs, 2014, 12(8): 4504-4520.
[22]周湘池, 刘必谦, 曾庆国, 等. 雨生红球藻(Haematococcuspluvialis)破壁方法对虾青素提取率的影响[J]. 海洋与湖沼, 2006, 37(5): 424-429.
[23]袁 超, 金征宇. 虾青素的热稳定性及分解动力学[J]. 天然产物研究与开发, 2010, 22(6): 1085-1087.
[24]GU W, XIE X, GAO S, et al. Comparison of different cells ofHaematococcuspluvialisreveals an extensive acclimation mechanism during its aging process: from a perspective of photosynthesis[J]. PLoS One, 2013, 8(7): e67028.
[25]卢国栋, 陈 谦. 新型动物资源: 甲壳素与虾青素[J]. 生物学杂志, 2006(4): 63-64.
[26]李婉珍, 朱龙宝, 陶玉贵, 等. 法夫酵母分批发酵虾青素动力学研究[J]. 生物学杂志, 2009, 26(3): 29-32.
[27]BUSTAMANTE A, MASSON L, VELASCO J, et al. Microencapsulation ofH.pluvialisoleoresins with different fatty acid composition: kinetic stability of astaxanthin and alpha-tocopherol[J]. Food Chemistry, 2016, 190: 1013-1021.
[28]MEZQUITA P C, HUERTA B E, RAMREZ J C, et al. Milks pigmentation with astaxanthin and determination of colour stability during short period cold storage[J]. Journal of Food Science & Technology, 2015, 52(3): 1634-1641.
[29]GB/T 31520-2015. 红球藻中虾青素的测定液相色谱法[S]. 北京: 中国标准出版社, 2015.
[30]赵晓燕, 朱海涛, 陈 军, 等. 响应曲面法优化有机溶剂萃取雨生红球藻中虾青素[J]. 食品工业, 2014(10): 124-127.
[31]赵立艳, 陈 芳, 廖小军, 等. 影响雨生红球藻中虾青素的提取条件的研究[J]. 食品科学, 2006, 27(3): 110-114.
[32]郭文晶, 张守勤, 张 格. 超高压提取雨生红球藻中虾青素的工艺优化[J]. 农业机械学报, 2008, 39(5): 201-203.
[33]齐计英, 姚依婧, 岑 琴, 等. 响应面法优化雨生红球藻虾青素的超声提取工艺[J]. 食品工业科技, 2015, 36(6): 313-316.
Optimization of extracting process of astaxanthin fromHaematcoccuspluvialis
XU Yu, ZHANG Lin, LI Ya-he, YANG Liu, WANG Dong, SUN Xue, XU Nian-jun
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
This paper established a method for astaxanthin extracting by ultrasonic extraction and detection by high performance liquid chromatography(HPLC). The result showed that acetone was the optimal solvent among the selected solvents. The astaxanthin yield ofHaematococcuspluvialiswas used as measurement index, the sequence of extraction efficiency of different solvent was that acetone> methylene chloride: methanol(3∶1,V/V) > methanol > petroleum ether > chloroform. The mathematical model of ultrasound assisted astaxanthin extraction ofH.pluvialiswas established by response surface method. The optimal condition for extraction technique was that S/L 1∶377, ultrasonic time 5.19 min and ultrasonic power 145 W. Under the optimal condition, the predicted astaxanthin yield was 2.931%, and the measured value was 2.896%. It indicated that the adaptable of model was good. Compared with conventional reflux extraction methods, extraction efficiency of astaxanthin was improved significantly assisted by response surface method.
Haematococcuspluvialis; astaxanthin; ultrasound assisted extraction; response surface; HPLC
2016-03-07;
2016-04-21
国家自然科学基金(31572638);浙江省科技厅公益项目(2015C32021); 宁波市科技计划项目(2014C10023)
徐 煜, 硕士, 研究方向为藻类生物技术, E-mail:bioxuyu@163.com
徐年军, 研究员, 博士生导师, 研究方向为藻类生理生化, E-mail:xunianjun@nbu.edu.cn
Q949.2;TQ914.2
B
2095-1736(2017)01-0098-05
doi∶10.3969/j.issn.2095-1736.2017.01.098
