微卫星技术筛选大黄鱼耐低温标记
2017-02-18穆方申李明云
穆方申, 苗 亮, 李明云, 胡 谋, 陈 炯, 张 浩
(宁波大学 应用海洋生物技术教育部重点实验室, 宁波 315211)
微卫星技术筛选大黄鱼耐低温标记
穆方申, 苗 亮, 李明云, 胡 谋, 陈 炯, 张 浩
(宁波大学 应用海洋生物技术教育部重点实验室, 宁波 315211)
为筛选大黄鱼耐低温性状相关分子标记,对大黄鱼进行降温实验(15℃降至6℃)后用SSR标记对低温敏感个体和低温耐受个体进行扩增分析。结果显示:10对SSR引物共扩增到39个条带,仅标记KPC43的扩增条带在低温敏感和低温耐受个体间的出现频率存在显著差异。标记KPC43共扩增到3个等位基因,其中KPC43170bp在低温耐受组中出现的频率(80.0%)显著高于低温敏感组(23.33%),该条带与大黄鱼耐低温能力存在极显著正相关(P<0.01),相关系数为0.498;KPC43150bp在低温敏感组中出现的频率(76.67%)显著高于低温耐受组(30.0%),与大黄鱼耐低温能力存在极显著负相关(P<0.01),相关系数达到-0.417。序列比对显示KPC43170bp仅核心序列比KPC43150bp多了10个(TG)重复。推测SSR标记KPC43可能与大黄鱼耐低温性状相关基因连锁,其核心序列的重复次数可能与该基因的表达活性有关,从而影响大黄鱼个体的耐低温能力。
大黄鱼;耐低温;微卫星标记
大黄鱼是一种暖水性鱼类,是浙江、福建两省的重要海水养殖经济鱼类之一。近年来,我国东南沿海在冬季常受寒潮侵袭,并多次出现特大寒潮,降温幅度大、持续时间长,养殖海域水温持续偏低,导致大黄鱼被大量冻死,经济损失严重[1-2]。因此有必要研究低温对大黄鱼的影响,选育耐低温能力强的大黄鱼。
随着现代生物技术的发展,分子标记辅助育种成为培育具有优良性状新品种的一种重要方法。例如在鲤鱼抗寒新品种荷包红鲤的选育及其后续研究中,梁利群等[3-5]利用RAPD技术获得6个与鲤鱼耐寒相关的标记,并且将其中1个标记定位在鲤鱼的第5号连锁群上;潘贤等[6]筛选出2个与鲤鱼抗寒性状相关的SSR标记,这些标记的开发与应用在鲤鱼抗寒新品种的选育中起到了重要作用;黄海水产研究所的研究人员[8]在开发了半滑舌鳎雌性特异性AFLP标记的基础上,研究了培育单性群体的方法。
微卫星标记(Simple sequence repeat, SSR)是进行遗传分析和鉴定的有力手段之一,具有分布广泛、呈孟德尔共显性遗传、多态性丰富等特点[9],目前已经筛选到了罗非鱼体重与体长性状[10-11]、虹鳟抗肝胰脏坏死病性状[12]、褐牙鲆耐热性状[13]相关的多种SSR标记。在大黄鱼的研究中,高国强等[14]、王惠儒等[15]分别发现微卫星标记LYC002和LYC0015可能与大黄鱼的耐低温能力有关。这说明大黄鱼耐低温性状可能受基因的控制,使用SSR筛选大黄鱼的耐低温标记是可行的。
笔者所在课题组先后通过分析低温下大黄鱼血清生化、抗氧化水平、肝脏蛋白质组、脂肪酸含量的变化探讨了大黄鱼低温应激和适应的机理[16-19],并且双向电泳分析显示经过低温选择后大黄鱼肝脏蛋白质组中与抗细胞凋亡、能量供应等功能相关的蛋白质表达显著上调[20]。课题组运用群体选育技术、经连续5代选育获得的新品种大黄鱼“东海1号”不但生长速度快,而且耐低温能力也大幅提高[21],但我们认为大黄鱼的耐低温能力仍有较大提高余地,有必要做进一步、更有针对性的遗传育种。本研究利用10对微卫星引物对降温实验中的“东海1号”大黄鱼低温敏感和低温耐受个体进行扩增分析,旨在寻找与大黄鱼耐低温性状相关的分子标记,以期为耐低温品系选育提供依据。
1 材料与方法
1.1 实验材料
实验用“东海1号”大黄鱼200尾,于2012年12月取自浙江省象山港湾水产苗种有限公司养殖网箱,实验鱼健康无伤,体重43.5~45.5 g,体长13.2~15.6 cm。
实验开始前,将鱼置于0.86 m2×1.3 m 的水泥池中,在水温(15.0±0.5)℃下暂养1周,避免其他应激因素对实验造成干扰。用THD-1006型低温恒温槽(宁波天恒仪器厂)进行降温和控温,对实验鱼以0.5℃/48 h速率降温,直至6℃。温度降到6℃后,持续5 d。实验用水为象山港大黄鱼养殖海区的沙滤海水,鱼暂养与试验期间,早晚各换水1次,每次换水量1/3,换水前新水先预冷,并保持换水前后温差在±0.2 ℃范围之内,对温度降到9℃之前对低温不能耐受的个体(低温敏感)和降至6 ℃且维持5 d后仍能良好存活的个体(低温耐受)进行采样,剪取鳍条液氮速冻后-80℃保存,用常规酚/氯仿法提取基因组DNA。
1.2 微卫星分析
采用An等[22]开发的10对大黄鱼微卫星引物,序列及扩增参数见表1,引物由生工生物工程有限公司合成。PCR反应总体积20 μL,包括10 μL 2XTaqpremix-Dye(上海博彩生物科技有限公司)、上下游引物各1 μL、DNA模板1μL、超纯水7 μL。反应程序为:94 ℃预变性5 min;94 ℃变性30 s,58℃~60 ℃退火30 s,72 ℃延伸30 s,循环35次;最后72 ℃再延伸10 min。

表1 微卫星引物信息Table 1 The characteristics of the 11 microsatellite loci isolated from Pseudosciaena crocea
聚丙烯酰胺凝胶电泳的步骤主要参照张秀华等人的实验[23]。PCR扩增产物首先用1.5 %琼脂糖凝胶进行电泳分离,以100 bp DNA Ladder作为分子量标准,电泳结束后,EB溶液染色,凝胶成像系统进行观察、拍照进行检测。然后进行8%变性聚丙烯酰胺凝胶电泳。先将玻璃板使用乙醇擦拭干净后固定,灌入8% 变性聚丙烯酰胺凝胶,灌完胶后立即将齿梳插入胶面,室温放置2 h或密封于4 ℃冰箱过夜聚合。800 V电压进行0.5 h的预电泳。样品处理如下:PCR产物与变性上样缓冲液按1∶1体积混合均匀, 95 ℃变性5 min后,放于冰上冷却3 min复性后点样,再使用1000 V电压电泳3~4 h。电泳完毕后使用100%冰醋酸摇床固定30 min后漂洗,硝酸银染色30 min,染色结束使用预冷的显色液显色,出现条带后放入冰醋酸终止显色。使用Quantity One 4.62 (Bio-Rad公司)凝胶成像后统计、分析条带。
1.3 数据分析
使用SPSS15.0软件对微卫星扩增等位基因片段与大黄鱼耐低温性状这两个变量进行皮尔逊检验(Pearson correctlation),检测有差异的等位基因片段与大黄鱼耐低温性状是否具有相关性。
1.4 差异等位基因片段的克隆、测序及序列比对
利用凝胶回收试剂盒(天根生化科技有限公司)从8%的PAGE凝胶中回收和纯化特异的目的片段,将其连接到PMD19-T vector(TaKaRa公司),转入DH5α菌株,每个特异片段随机挑取3个重复的阳性克隆送至Invitrogen公司进行测序。利用DNAstar软件对特性片段序列进行比对分析。
2 结果
2.1 10对微卫星引物的扩增特征
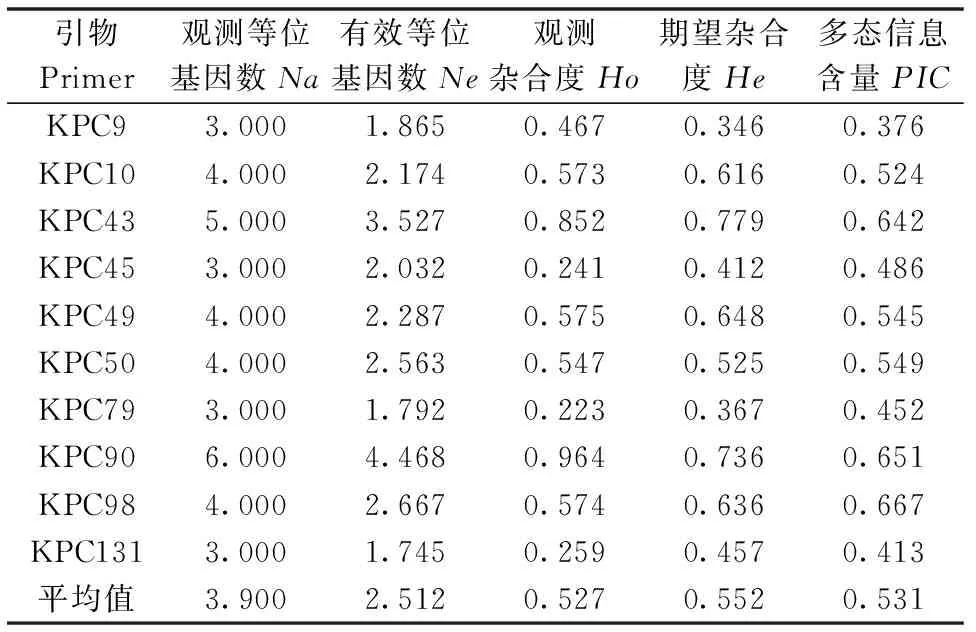
表2 10个微卫星位点的扩增特征Table 2 The genetic diversity of 10 microsatillite loci from Pseudosciaena crocea
本研究所用的10对微卫星引物均能扩增出稳定的条带,且均为多态性位点;10对引物扩增的等位基因数为3~6 个,共扩增到39个等位基因,平均每对引物3.9个;观测杂合度为0.223~0.964(平均0.527),期望杂合度范围0.346~0.779(平均0.552);多态信息含量PIC范围为0.376~0.667(平均0.531),其中6个位点呈高度多态性(PIC>0.5),具体见表2。表明获得了较丰富的SSR标记遗传信息。
2.2 两个差异等位基因片段与耐低温的相关性
对低温耐受和低温敏感两组大黄鱼间10对SSR引物的扩增结果分析显示,仅KPC43位点的等位基因在低温敏感组和低温耐受组之间具有明显差异(图1)。在KPC43位点,两组大黄鱼中均检测到3个等位,其中KPC43170bp在低温耐受组中有80 %扩增出了该片段,而低温敏感组中仅有23.33 %扩增出该片段,该等位基因片段在低温耐受特性有较明显的偏好性;KPC43150bp在低温耐受组中有30 %扩增出该片段,而低温敏感组30个个体中有76.67 %扩增出该片段,该等位基因片段对大黄鱼的低温敏感特性有较明显的偏好性(表3)。
泊松相关系数显示(表3), KPC43170bp差异等位基因与耐低温性存在极显著的正相关性,相关系数为0.498;KPC43150bp差异等位基因与耐低温性存在极显著的负相关性,相关系数为-0.417。

图 1 微卫星引物KPC43扩增的两群体间差异显著的部分条带Fig 1 Significantly different band amplified by microsatellite primer KPC43
注:1~10为低温敏感组;11~30为低温耐受组;M:PUC19 DNA ladder
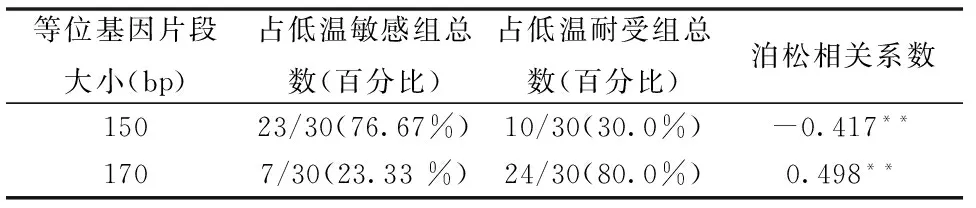
表 3 KPC43位点差异等位基因在各组中出现次数统计Table 3 The statistic of two differential alleles of microsatellite loci KPC43
**:在0.01置信度极显著相关

图2 KPC43位点2个差异等位基因片段序列的比对结果Fig 2 Sequence alignment of two alleles from locus KPC43
序列比对结果表明,微卫星位点KPC43两个差异等位基因片段序列的差别仅在于(TG)重复单位的重复次数不同,KPC43170bp比KPC43150bp在(TG)重复单位上多重复了10次。
3 讨论
水温对鱼类的生存和代谢有着至关重要的影响[24]。大黄鱼是一种温水性鱼类,对低温较为敏感,在寒流到来时常有大黄鱼冻死,造成经济损失。徐镇等[25]的研究显示浙江岱衢洋大黄鱼对低温的耐受能力要高于福建群体,但水温低于6℃时也大量死亡。对大黄鱼的低温胁迫实验和越冬期血清生化、脂肪酸组成等研究显示,大黄鱼有一定的低温适应能力,在一定的低温范围内鱼体会通过调整自身代谢进行应对,并可通过增加不饱和脂肪酸的含量来增加低温下质膜的流动性[17,20],并且经过多代选育后选育群体的耐低温能力会有所加强[21]。但目前对大黄鱼的低温适应机理仍缺少足够深入了解,也未见有关于大黄鱼影响耐低温性状关键基因的报道。在某些极地鱼类中,抗冻蛋白是其能耐受0℃以下低温的重要机制之一[26]。大黄鱼虽然也有编码抗冻蛋白的基因,但其抗冻蛋白并没有明显的抗冻活性[27]。另外,即使将极地鱼类的抗冻蛋白基因转入大西洋鲑、罗非鱼等鱼类中,也并未提高其耐低温能力[28]。因此,筛选与大黄鱼耐低温性状相连锁的分子标记用于分子标记辅助育种可能是培育耐低温大黄鱼的一条可行途径。
微卫星标记具有分布广泛、呈孟德尔共显性遗传、多态性丰富等特点[9],被广泛用于遗传分析和鉴定的研究中。本研究用10对微卫星引物对“东海1号”大黄鱼的低温敏感个体和低温耐受个体进行扩增分析,共得到39个条带,平均观测杂合度和期望杂合度分别为0.527、0.552,多态信息含量PIC范围平均为0.531,其中6个位点呈高度多态性(PIC>0.5)。虽然获得了较丰富的SSR标记遗传信息,但10对SSR引物中仅KPC43扩增条带的出现频率在低温敏感组和低温耐受组之间存在显著差异。高国强等[14]和王惠儒等[15]分别用5对和13对SSR引物对低温选育的大黄鱼和对照组进行扩增比较,也都是仅有1对引物的扩增条带在两组间存在差异。SSR标记筛选大黄鱼耐低温相关标记的筛选率较低,可能是使用的标记数量不够多、对基因组覆盖面较窄有关,可以尝试使用诸如DArT基因芯片[29]、转录组分析[30]等技术进行更加全面、细致地筛选。
笔者对微卫星引物KPC43扩增条带的分析显示,等位基因KPC43170bp和KPC43150bp分别与耐低温性状呈正相关和负相关,相关系数分别为0.498和-0.417,推测该微卫星位点可能与某种耐低温基因存在一定的连锁关系。测序后比对KPC43位点这两个等位基因在微卫星核心序列的重复次数上存在差别,KPC43170bp中(TG)重复有12个,而KPC43150bp中(TG)重复仅2个。Streelman的研究显示SSR位点核心单元的重复次数会影响与其紧密连锁的基因的转录活性[31]。笔者推测大黄鱼低温敏感个体中的某个抗寒基因的(TG)重复单元重复的丢失影响了其表达活性,从而影响其耐低温能力。高国强等[14]和王惠儒等[15]的研究结果均显示:筛选出来SSR标记其核心单元重复次数和耐低温性状呈一定相关关系,核心单元重复次数多的等位基因更多出现在低温耐受组,而核心重复次数少的等位基因更多出现在正常对照组。这些研究结果也符合微卫星逐步突变模型(SMM)[32-34]。
虽然微卫星标记KPC43与大黄鱼耐低温性状相关,但仍需进一步研究该标记与大黄鱼耐低温能力的直接关系。另外,该标记是否与耐低温相关的功能基因相连锁,以及能否应用于育种实践中,都是今后需要继续探索的。
[1]张自银, 龚道溢, 郭 栋, 等. 我国南方冬季异常低温和异常降水事件分析[J]. 地理学报, 2008, 63(9):899-912.
[2]区又君. 低温冰冻灾害对我国南方渔业生产的影响、存在问题和建议[J].中国渔业经济, 2008, 26(4):89-93.
[3]梁利群, 孙效文. 鲤耐寒性状分子标记在遗传连锁图上的定位[J].大连水产学院学报, 2003, 18(4): 278-281.
[4]梁利群, 常玉梅, 董崇智, 等. 微卫星DNA标记对乌苏里江哲罗鱼遗传多样性的分析[J].水产学报, 2004, 28(3): 241-244.
[5]梁利群, 孙效文, 闫学春, 等. 用RAPD技术鉴定荷包红鲤抗寒品系[J]. 水产学杂志, 2000,13(1):15-20.
[6]潘 贤, 梁利群, 雷清泉. 筛选与鲤鱼抗寒性状相关的微卫星分子标记[J]. 哈尔滨工业大学学报, 2008, 40(6):915-918.
[7]SEKINO M, HARA M. Application of microsatellite markers to population genetics studies of Japanese flounderParalichthysolivaceus[J]. Marine Biotechnology, 2001, 3(6): 572-589.
[8]CHEN S L, DENG S P, MA H Y, et al. Molecular marker-assisted sex control in half-smooth tongue sole (Cynoglossussemilaevis)[J]. Aquaculture, 2008, 283(1-4):7-12.
[9]孙效文, 张晓峰, 赵莹莹. 水产生物微卫星标记技术研究进展及其应用[J]. 中国水产科学, 2008, 15(4):689-703.
[10]AGRESTI J, SEKI S, CNAANI A, et al. Breeding new strains of tilapia: development of an artificial center of origin and linkage map based on AFLP and microsatellite loci [J]. Aquaculture, 2000, 185(1-2): 43-56.
[11]CNAANI A, HALLERMAN E M, RON M, et al. Detection of a chromosomal region with two quantitative trait loci, affecting coldtolerance and fish size, in an F2tilapia hybrid [J]. Aquaculture, 2003, 223(1-4):117-128.
[12]OZAKIA A, SAKAMOTO T, KHOO S, et al. Quantitative trait loci (QTL) associated with resistance /susceptibility to infectious pancreatic necrosis virus (IPNV) in rainbow trout (Oncorhynchusmykiss) [J]. Molecular Genetics and Genomics: MGG, 2001, 265(1): 23-31.
[13]卢钟磊, 迟信才, 王义权, 等. 褐牙鲆耐热性状相关的微卫星分子标记筛选[J]. 厦门大学学报(自然科学版), 2007, 46( 3): 396-402.
[14]高国强, 常玉梅, 韩启霞, 等. 大黄鱼耐低温性状相关微卫星标记的筛选[J]. 遗传, 2010, 32(3):248-253.
[15]王惠儒, 柳敏海, 油九菊, 等. 大黄鱼群体遗传多样性分析及耐低温性状相关微卫星标记的筛选[J]. 浙江海洋学院学报(自然科学版), 2014, 33(1):6-13.
[16]冀德伟, 李明云, 王天柱, 等. 不同低温胁迫时间对大黄鱼血清生化指标的影响[J]. 水产科学, 2009, 28(1): 1-4.
[17]张晓丽, 胡玉珍, 李明云, 等. 养殖大黄鱼在自然海区降温不同阶段抗氧化水平及血清酶活性的变化[J]. 海洋科学, 2013, 37(11):27-34.
[18]李明云, 冀德伟, 吴海庆, 等. 低温胁迫下大黄鱼肝脏蛋白质组双向电泳分析[J]. 农业生物技术学报, 2010, 18(2):323-328.
[19]张春丹, 胡玉珍, 苗 亮, 等. 网箱养殖大黄鱼越冬期间脂肪酸的相对含量变化[J]. 海洋学研究, 2014, 32(2):80-84.
[20]李明云, 吴玉珍, 冀德伟, 等. 低温选择大黄鱼(Pseudosciaenacrocea)的肝脏蛋白质组双向电泳分析[J]. 2010, 41(3):348-351.
[21]苗 亮, 李明云, 陈 炯, 等. 快长、耐低温大黄鱼新品种东海1号的选育[J]. 农业生物技术学报, 2014, 22(10):1314-1320.
[22]AN H S, CHO K C, PARK J Y. Eleven new highly polymorohic microsatellite loci in the yellow croaker,Pseudosciaenacrocea[J]. Molecular Ecology Notes, 2005, 5(4):866-868.
[23]张秀华, 王文锋. 微卫星DNA聚丙烯酰胺凝胶电泳和银染技术的探讨[J]. 山东农业科学, 2009(6):13-17.
[24]VARRIALE A, BERNARDI G. DNA methylation and body temperature in fishes[J]. Gene, 2006, 385(6): 111-121.
[25]徐 镇, 江锦坡, 陈寅儿. 不同品系大黄鱼致死低温的研究[J]. 宁波大学学报(理工版), 2006, 19(4):462-464.
[26]张 强, 谢 峰, 江建平, 等. 冷血脊椎动物冷适应研究[J].四川动物, 2006, 25(2):433-438.
[27]吴海珍, 卫 玮, 徐红艳, 等. 大黄鱼类Ⅳ型抗冻蛋白基因的克隆、表达及功能研究[J].食品与药品, 2009, 11(9):15-19.
[28]沈桂芳, 丁仁瑞. 现代生物技术与 21 世纪农业[M]. 杭州:浙江科学技术出版社, 2000: 295-299.
[29]RAMAN H, RAMAN R, NELSON M N, et al. Diversity array technology markers: genetic diversity analysis and linkage map construction in rapeseed (BrassicanapusL.)[J]. DNA Research, 2012, 19(1):51-65.
[30]刘红亮, 郑丽明, 刘青青, 等. 非模式生物转录组研究[J]. 遗传, 2013, 35(8):955-970.
[31]STREELMAN J T, KOCHER T D. Microsatellite variation associated with prolactin expression and growth of salt challenged Tilapia[J]. Physiological Genomics, 2002, 9(1) :1-4.
[32]WEBER J L, WONG C. Mutation of human short tandem repeats[J]. Hum Mol Genet, 1993, 2(8): 1123-1128.
[33]SCHLÖTTERER C, TAUTZ D. Slippage synthesis of simple sequence DNA[J]. Nucleic Acids Research, 1992, 20(2): 211-255.
[34]STEINBERG E K, LINDNER K R, GALEA J, et al. Rates and patterns of microsatellite mutations in pink salmon[J]. Mol Biol Evol, 2002,19(7):1198-1202.
Screening of microsatellite markers associated with cold tolerance of large yellow croaker (Pseudosciaenacrocea)
MU Fang-shen, MIAO Liang, LI Ming-yun, HU Mou, CHEN Jiong, ZHANG Hao
(Key Laboratory of Applied Marine Biotechnology, Ministry of Education, Ningbo University, Ningbo 315211, China)
In this study, the large yellow croakers Donghai No.1 was divided into cold-tolerant and cold-sensitive two groups by reducing water temperature from 15℃ to 6℃ gradually, and then the molecular marker which linked to the resistance to low temperature was screened by microsatellite markers (SSR) analysis. The results showed that 39 alleles were amplified using 10 SSR primers, and only the alleles frequence of locus KPC43 had significant difference between the cold-tolerant group and the cold-sensitive group. In the three alleles of KPC43, the occurrence frequency of KPC43170bpwas 80.0% in the cold-tolerant group, while its occurrence frequency was only 23.33% in the cold-sensitive group. Correlative analysis showed that there was a significant positive correlation between KPC43170bpand cold-tolerant trait (P<0.01), and the correlation coefficient was 0.498. In the cold-sensitive group, the frequency of the KPC43150bp(76.67%) was significantly higher than that in the cold-tolerant group (30.0 %). And there was a significant negative association with the KPC43150bpand cold-tolerant related character (P<0.01), and the correlation coefficient was-0.417. Sequence alignment showed that the microsatellite flanking regions of KPC43170bpand KPC43150bpwere the same, while the repeat sequence was (TG)12in KPC43170bpand (TG)2in KPC43150bp. It can be speculated that SSR marker KPC43 may be linked to some cold tolerant gene of large yellow croaker, and the repeat numbers of (TG) may affect these gene′s expressing activity, which is associated to the ability of cold tolerance.
Pseudosciaenacrocea; low temperature tolerant; microsatellite marker
2016-03-10;
2016-03-23
国家高技术研究发展计划(2012AA10A403-4);浙江省重大科技专项优先主题(2009C12077; 2012C12907-8);宁波市重大项目(2008C3005)
穆方申,硕士,研究方向为生物化学与分子生物学,E-mail:mufangshen@126.com
李明云,教授,研究方向为鱼类遗传育种与种质保护,E-mail: limingyun@nbu.edu.cn
Q958.8; S917.4
A
2095-1736(2017)01-034-05
doi∶10.3969/j.issn.2095-1736.2017.01.034
