变应性鼻炎对小鼠嗅觉神经元的作用
2017-02-18宋宫儒安丽娜2彭碧波
宋宫儒,安丽娜2,彭碧波
变应性鼻炎对小鼠嗅觉神经元的作用
宋宫儒1,安丽娜2,彭碧波1
目的 探讨变应性鼻炎(allergic rhinitis,AR)对嗅觉神经元(olfactory sensory neuron,OSN)的作用。方法 以卵清蛋白建立野生型BALB/c小鼠AR模型(AR组,n=15),并采用随机数字表法设置正常对照组(n=15)。通过埋藏食物小球实验(buried food pellet test,BFPT)对小鼠进行嗅觉检测,以蛋白质免疫印迹法(western blot)检测小鼠嗅区黏膜内OSN凋亡程度及其与嗜酸性粒细胞的相关性。结果 (1)AR组小鼠BFPT所用时间较对照组显著延长[(18.71±3.93)s vs(12.53±2.70)s, t=5.01,P<0.05];(2)与对照组相比,AR组小鼠鼻嗅黏膜内成熟OSN嗅标识蛋白(olfactory marker protein,OMP) 显著降低(t=15.55, P<0.05),凋亡通路Caspase-3(t=10.98, P<0.05)及嗜酸性粒细胞过氧化物酶[(eosinophil peroxidase,EPX),(t=33.52, P<0.05)]显著增多;(3)AR组小鼠鼻嗅黏膜内Caspase-3与EPX蛋白呈正相关(r=0.78,P<0.05)。结论 AR状态下嗜酸性粒细胞向嗅黏膜内浸润,可损伤OSN造成神经性嗅觉减退。
变应性鼻炎;嗅觉减退;嗅觉神经元;嗜酸性粒细胞
变应性鼻炎(allergic rhinitis,AR)是一种鼻科常见病,以鼻黏膜接触变应原后迅速引发由IgE介导的非感染性炎性反应为病理学特征[1]。嗅觉减退是AR主要症状之一,患者群中发病率为10%~88%[2]。与季节性AR相比,常年性AR患者嗅觉减退症状的严重程度及发作频率更为显著[3]。一般认为,AR导致嗅觉减退的主要病理机制是由于鼻呼吸黏膜(nasal respiratory mucosa,NRM)水肿及分泌物增多,导致鼻腔通气功能受限,鼻嗅黏膜内嗅觉神经元(olfactory sensory neuron,OSN)感知的气味分子数量减少。因与传导性听力损失相似,有学者将鼻腔通气机械性阻塞而引起嗅觉功能下降称之为传导性嗅觉减退[2]。然而临床研究发现,给予AR患者鼻喷肾上腺素缓解NRM水肿程度后,嗅觉无明显改善[4],提示NRM病变并不是AR导致嗅觉减退的唯一病因。
2010年,Sivam等[5]首先报道了季节性AR患者鼻嗅黏膜中存在嗜酸性粒细胞浸润;同年,Ozaki等[6]通过卵清蛋白腹腔致敏及鼻腔刺激的方法建立AR模型小鼠,发现AR小鼠鼻嗅黏膜内嗜酸性粒细胞分布于OSNs轴突束周围,提示AR状态下鼻嗅黏膜内嗜酸性粒细胞可能参与损伤OSNs。因此,笔者依据上述假设开展动物模型研究,以嗅标识蛋白(olfactory marker protein,OMP)标识成熟OSN,以经典凋亡标记物半胱氨酸天冬氨酸蛋白酶3(Caspase-3)标识凋亡OSN,以嗜酸性粒细胞过氧化物酶(eosinophil peroxidase,EPX)标识嗜酸性粒细胞。通过蛋白质免疫印迹法(western blot)检测AR小鼠鼻嗅黏膜内OSN凋亡情况,以研究AR对于小鼠嗅觉功能的影响及AR状态下小鼠鼻嗅黏膜内OSN凋亡及嗜酸性粒细胞浸润及二者相互关系。
1 材料与方法
1.1 实验动物 8周龄BALB/c 雌性小鼠30只,无特定病原体(specific pathogen free,SPF)级,由北京维通利华公司提供[实验动物证编号:33214]。饲养于实验动物室,给予标准化配方饲料及过滤纯水。饲养环境为12 h昼夜交替,温度为22~24℃,湿度55%~70%。
1.2 仪器及耗材 医用超声雾化器(江苏鱼跃医疗设备股份有限公司);有机玻璃雾化箱(山东泰安市仪器设备制造厂);10~100 μl移液枪(美国Eppendorf公司);高速离心机、Thermo病理切片机购自美国Thremofisher公司;超净工作台、-80℃冷藏柜购自Thermo公司;Ⅳ级卵清蛋白及明矾(上海Sigma-Aldrich公司);磷酸盐缓冲液(phosphate buffered saline,PBS)购自上海Gibco公司;10%水合氯醛(首都医科大学宣武医院);小鼠血清卵清蛋白特异性IgE酶联免疫吸附法(enzyme-linked immunoassay,ELISA)试剂盒(美国Chondrex公司);兔抗小鼠OMP多克隆抗体、兔抗小鼠Caspase-3多克隆抗体购自美国Abcam公司;山羊抗小鼠EPX多克隆抗体(美国Santa Cruz公司)。
1.3 建立AR模型小鼠 采用随机数字表法将30只BALB/c雌鼠分为AR组与对照组,每组15只。AR模型建立分前期致敏阶段与后期刺激阶段。于第0天和第7天,将10 μg卵清蛋白及2 mg明矾溶于0.5 ml PBS后注射入AR组及对照组小鼠腹腔。第14日始,AR组开始接受1%卵清蛋白(10 mg/ml PBS)雾化吸入,1次/d,30 min/次,连续14 d。同时间内,对照组接受PBS雾化吸入。第30天,两组小鼠行行为学嗅觉测试后处死,取材。以血清卵清蛋白特异性IgE升高与NRM嗜酸性粒细胞浸润作为小鼠AR模型建立成功的标准[7]。
1.4 行为学测试 采用埋藏食物小球实验(buried food pellt test,BFPT)对AR组及对照组小鼠进行嗅觉检测,BFPT参照经典方法[8]。选取形状一致的新鲜鼠料以减少外源性食物味道干扰。实验前小鼠空腹24 h,测试前将食物小球埋在鼠料表面以下5 cm处,记录小鼠从被随机放置于盒子中开始,到揭开食物小球并用前爪或牙齿抓住食物小球的时间,如果5 min(300 s)内小鼠未找到食物小球,即被移走。
1.5 血清卵清蛋白特异性IgE检测 将AR组与对照组小鼠以10%水合氯醛0.6 ml深度麻醉,固定于动物解剖台,颈部与腹部常规消毒、铺巾,以眼科剪暴露小鼠心脏,将1 ml注射器垂直刺入小鼠右心房,抽取静脉血0.2~0.3 ml,收集血液标本于4℃离心机14000 r/min,高速离心5 min以分离血清,每管分装。按照ELISA试剂盒说明书测量血清中卵清蛋白特异性IgE浓度。
1.6 小鼠鼻黏膜获取及嗜酸性粒细胞检测 暴露深度麻醉小鼠的心脏,自心尖部灌注生理盐水30 ml,至肝、肺等器官颜色退色。取下小鼠头部,去除头部软组织。一部分小鼠以两侧鼻骨为解剖标志物,行矢状位切割,显露小鼠鼻中隔两侧嗅区黏膜和呼吸区黏膜,分别在显微镜下剥离获取嗅区黏膜后,在-80℃冰箱中保存备用。另一部分小鼠头骨置于10%甲醛内固定处理,并过夜保存。以小鼠上腭表面切牙(截面Ⅰ),第2腭嵴(截面Ⅱ)及第2上磨牙(截面Ⅲ)为解剖标志物,行冠状位切割,从而将每只小鼠鼻腔分为3份组织块,标记后的组织块经乙醇梯度脱水,二甲苯透明后,浸润石蜡;将包埋好的蜡块固定于切片机,以4 μm为层厚,切成薄片。切下薄片放入45℃水中铺平,贴至载玻片表面,放60℃恒温箱过夜烘干。苏木素-伊红(hematoxylin-eosinstaining,HE)染色,组织病理学观察肥大细胞及嗜酸性粒细胞数量。
1.7 小鼠鼻嗅黏膜中OMP,Caspase-3及EPX蛋白western blot法检测 将各组小鼠鼻嗅黏膜组织立即投入液氮中,后转移至-80℃冰箱中保存,将组织置于2.0 ml平头离心管中,加入冰冷的含有蛋白酶抑制剂的RIPA缓冲液,用机械匀浆器冰浴中匀浆30 s,置于冰上静止15 min,4℃离心10 min(15000 g),上清即为组织总蛋白。蛋白定量变性后,吸取50 μg总蛋白的组织液加入电泳缓冲液,进行SDS-聚丙烯酸胺凝胶电泳,转入到PVDF膜后,再移至到含有5%脱脂奶粉平皿中室温封闭2 h,加入OMP,Caspase-3或EPX一抗,4℃孵育过夜,漂洗后加入二抗,最后使用增强型化学发光(enhanced chemiluminescence,ECL)法显示目的蛋白,内参蛋白选用β-肌动蛋白(β-actin),目的蛋白与内参蛋白的光密度(optical density,OD)值比较即该样本蛋白表达的计量资料。
1.8 统计学处理 应用SPSS 17.0统计软件分析,计量资料符合正态分布,以x ±s表示,两组间比较采用独立样本t检验。以双侧P<0.05为差异具有统计学意义。采用Pearson方法进行相关性分析,计算相关系数。
2 结 果
2.1 小鼠AR模型的建立 血清卵清蛋白特异性IgE方面,AR组小鼠平均血清卵清蛋白特异性IgE浓度为(114.28±15.28)ng/ml高于对照组的(24.50±4.49)ng/ml,两组比较差异具有统计学意义(t=20.07,P<0.05,图1A)。NRM及鼻嗅黏膜嗜酸性粒细胞浸润方面,由图1B所示:AR组小鼠NRM固有层中嗜酸性粒细胞显著分布于血管周围,鼻嗅黏膜固有层中少量嗜酸性粒细胞散在分布,而NRM及鼻嗅黏膜上皮层中均无嗜酸性粒细胞浸润。对照组NRM及鼻嗅黏膜固有层及上皮层中均未发现明显嗜酸性粒细胞浸润。
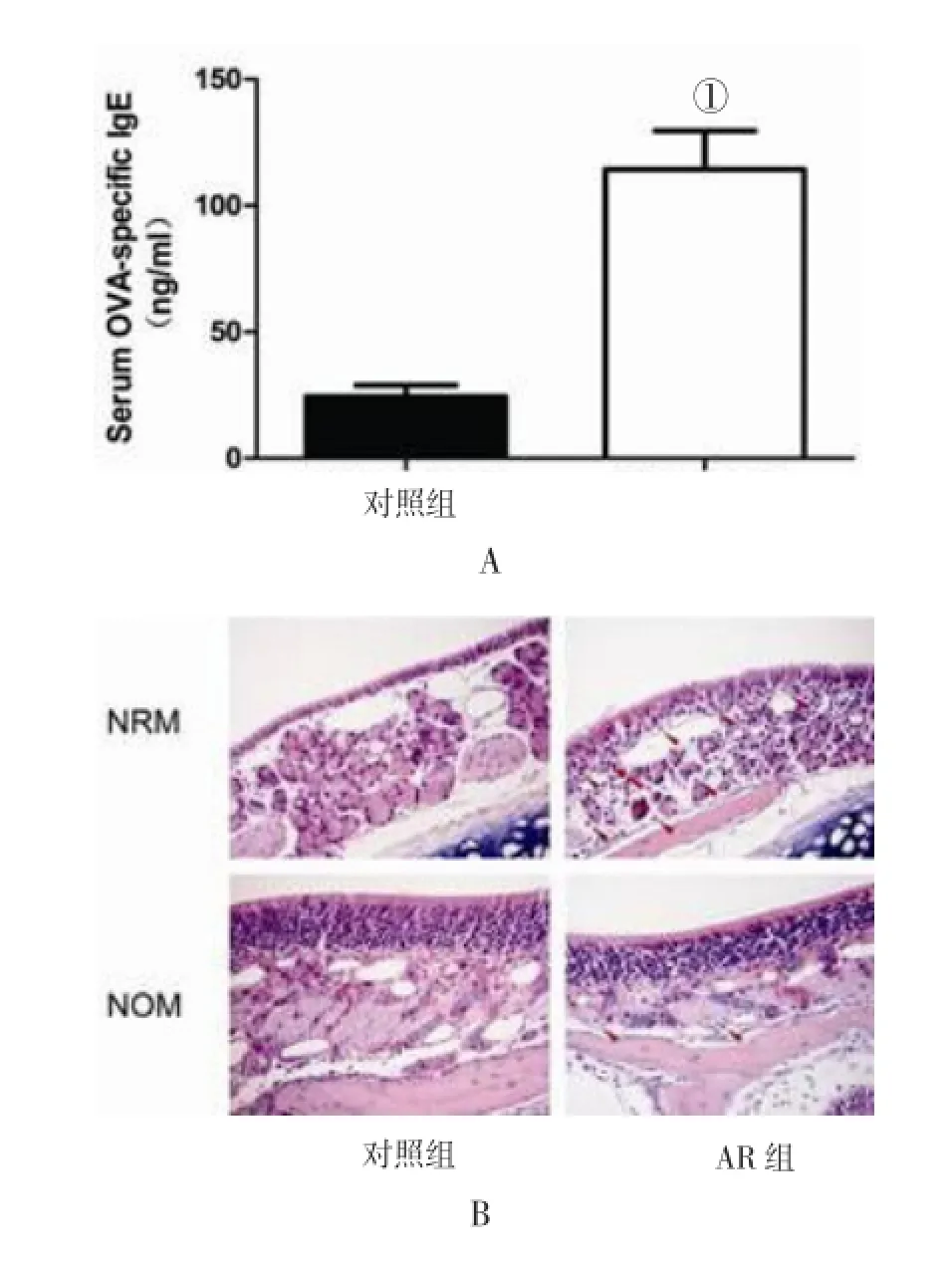
图1 两组小鼠血清卵清蛋白特异性IgE浓度及染色
2.2 行为学测试结果 BFPT中,AR组小鼠找到食物小球时间为(18.71±3.93)s,对照组为(12.53±2.70)s,AR组较对照组时间显著延长,差异具有统计学意义(t=5.01,P<0.05)。
2.3 小鼠鼻嗅黏膜中OMP,Caspase-3及EPX蛋白western blot法检测结果及相关性分析 AR组小鼠鼻嗅黏膜内成熟OSN标志物OMP较对照组降低(t=15.55,P<0.05),而鼻嗅黏膜内凋亡OSN 标志物Caspase-3(t=10.98,P<0.05)及嗜酸性粒细胞标记物EPX(t=33.52,P<0.05)较对照组明显升高,见图2、图3。AR组小鼠鼻嗅黏膜内嗜酸性粒细胞标志物EPX与凋亡OSN标记物Caspase-3 呈正相关(r=0.78,P<0.05,图4)。

图2 两组小鼠鼻嗅黏膜中OMP,Caspase-3及EPX蛋白western blot
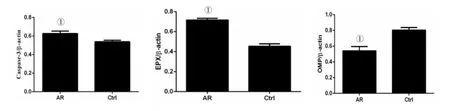
图3 两组小鼠鼻嗅黏膜中OMP,Caspase-3及EPX蛋白western blot法检测结果
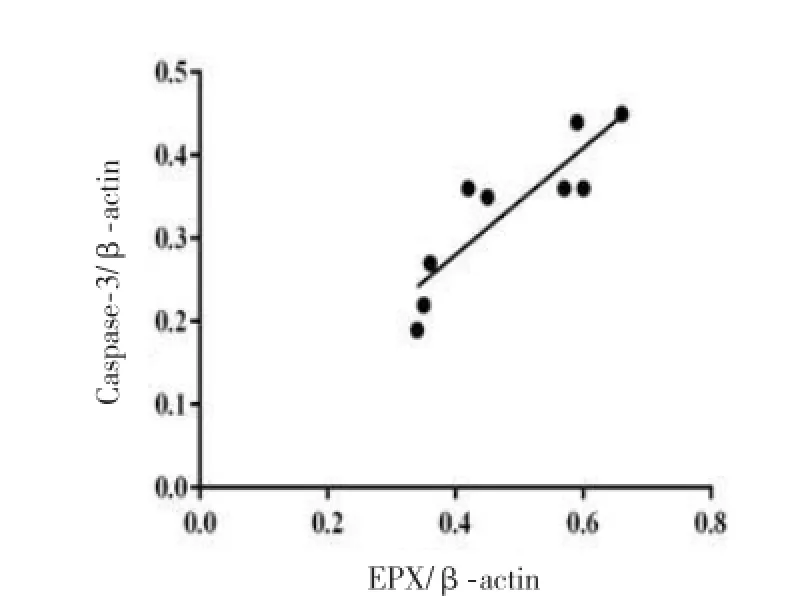
图4 AR组小鼠鼻嗅黏膜内嗜酸性粒细胞标志物EPX与凋亡OSN标记物Caspase-3相关性分析
3 讨 论
嗅觉减退是AR主要症状之一,却常易被AR患者所忽视。嗅觉减退可引起食欲减退、情绪低落及无法识别危险信号(食物霉变、煤气泄漏)等一系列问题,影响患者生活质量[9]。一直以来,AR导致嗅觉减退的病因被归结于NRM炎性水肿及鼻分泌物分泌过多,到达鼻嗅黏膜区域的气味分子减少。临床研究证实,AR患者嗅觉减退程度与NRM典型变应性炎性反应介质(如嗜酸性粒细胞阳离子蛋白、肥大细胞胰蛋白酶)浓度呈正相关性[10,11]。但是另有一部分研究也发现,降低鼻腔NRM炎性水肿,并不能从客观上改善AR患者嗅觉功能,因此,除了传导性因素,AR导致嗅觉减退还存在其他潜在机制。近期临床研究与动物实验发现AR状态下,鼻嗅黏膜内出现嗜酸性粒细胞浸润现象,提示其在鼻嗅黏膜具有潜在影响作用[5,6]。因此,笔者在此基础上通过建立AR模型小鼠,发现在AR状态下:(1)鼻嗅黏膜内OSN凋亡导致神经性嗅觉减退;(2)鼻嗅黏膜内嗜酸性粒细胞浸润,与OSN凋亡正性相关。
鼻嗅黏膜是由位于上皮表层OSN、支持细胞及上皮基底层的嗅神经干细胞——水平基细胞构成。OSN轴突穿透基底膜后鼻嗅黏膜固有层内汇集成束,穿越筛孔与嗅球形成突触,向神经中枢传递嗅觉信号[12]。区别于其他绝大多数外周神经,OSN暴露于外界环境,嗅觉功能可随时间发生下降[13]。生理状态下,OSN能够启动自身程序性凋亡,并由水平基细胞分化成为新的成熟OSN。二者之间保持动态平衡状态,维持嗅觉感知所必须OSN数量的过程称为神经自稳[12]。而在本研究中,笔者发现正常小鼠鼻嗅黏膜内即存在Caspase-3蛋白表达,反映了生理状态下OSN存在凋亡的现象。而AR模型小鼠鼻嗅黏膜内Caspase-3蛋白较对照组小鼠显著升高,而成熟OSN蛋白标记物OMP显著降低,表明AR可导致OSN发生凋亡,破坏了鼻嗅黏膜内OSN神经自稳状态。
AR可导致小鼠鼻嗅黏膜内OSN大量凋亡,但其机制仍不清楚。既往研究发现OSN可因直接接触吸入鼻腔的真菌、病毒或化学物刺激发生凋亡,其目的可能是避免上述刺激物通过OSN轴突进入神经中枢[14,15]。研究者发现AR模型小鼠鼻嗅黏膜存在嗜酸性粒细胞浸润现象。Li等[7]通过甲苯胺蓝染色发现AR模型小鼠鼻嗅黏膜固有层中肥大细胞具有特征性的脱颗粒表现。肥大细胞颗粒中存在多种嗜酸性细胞趋化因子参与嗜酸性粒细胞向特定组织内浸润。本研究发现,鼻嗅黏膜内嗜酸性粒细胞与OSN凋亡Caspase-3 蛋白水平呈正相关。Lane等[16]通过观察慢性鼻-鼻窦炎模型小鼠鼻嗅黏膜提出假说,当鼻嗅黏膜内炎性细胞浸润,特别是嗜酸性粒细胞紧密围绕在OSN轴突束周围,可对OSN轴突造成挤压,使OSN轴突无法从嗅球运输营养成分至OSN胞体,导致OSN凋亡。嗜酸性粒细胞可通过释放肿瘤坏死因子α(tumor necrosis factor α,TNF-α)结合OSN表面TNF受体,启动OSN细胞内凋亡前通路引发细胞内Caspase级联反应,诱导OSN凋亡[17]。
总之,AR状态下,NRM炎性水肿及鼻嗅黏膜内OSN凋亡分别构成了嗅觉减退的传导性及神经性因素。在较为充分的前期研究和合理的理论依据基础之上,如能在动物实验AR嗅觉的病理机制和作用规律进行深入研究和探索,加深研究者对AR状态下嗅觉减退机制的理解,未来可较为客观的对临床用药在嗅觉安全性方面进行评价,为向患有嗅觉减退的AR患者提出更具针对性和更安全的治疗方案提供科学依据。
[1]Broide D H. Allergic rhinitis: pathophysiology [J]. Allergy Asthma Proc, 2010, 31(5): 370-374. DOI: 10.2500/ aap.2010.31.3388.
[2]Stuck B A, Hummel T. Olfaction in allergic rhinitis: a systematic review [J]. J Allergy Clin Immunol, 2015, 136(6): 1460-1470. DOI: 10.1016/j.jaci.2015.08.003.
[3]Moll B, Klimek L, Eggers G, et al. Comparison of olfactory function in patients with seasonal and perennial allergic rhinitis [J]. Allergy, 1998, 53(3): 297-301. DOI: 10.1111/j.1398-9995.1998.tb03890.x.
[4]Apter A J, Mott A E, Cain W S, et al. Olfactory loss and allergic rhinitis [J]. J Allergy Clin Immunol, 1992, 90(4Pt1): 670-680. DOI: 10.1016/0091-6749(92)90141-N.
[5]Sivam A, Jeswani S, Reder L, et al. Olfactory cleft inflammation is present in seasonal allergic rhinitis and is reduced with intranasal steroids [J]. Am J Rhinol Allergy, 2010, 24(4): 286-290. DOI: 10.2500/ajra.2010.24.3478.
[6]Ozaki S, Toida K, Suzuki M, et al. Impaired olfactory function in mice with allergic rhinitis [J]. Auris Nasus Larynx, 2010,37(5): 575-583. DOI: 10.1016/ j.anl.2009.12.004.
[7]Li P, Cui Y, Song G, et al. Phenotypic characteristics of nasal mast cells in a mouse model of allergic rhinitis [J]. ORL J Otorhinolaryngol Relat Spec, 2014, 76( 6): 303-313. DOI: 10.1159/000369142.
[8]Nathan B P, Yost J, Litherland M T, et al. Olfactory function in apoE knockout mice [J]. Behav Brain Res, 2004, 150(1-2): 1-7. DOI: 10.1016/S0166-4328(03)00219-5.
[9]Passàli G C, Ralli M, Galli J, et al. How relevant is the impairment of smell for the quality of life in allergic rhinitis?[J]. Curr Opin Allergy Clin Immunol, 2008, 8( 3): 238-242. DOI: 10.1097/ACI.0b013e3282ffd6bb.
[10]Becker S, Pflugbeil C, Gröger M, et al. Olfactory dysfunction in seasonal and perennial allergic rhinitis [J]. Acta Otolaryngol, 2012,132(7): 763-768. DOI: 10.3109/ 00016489.2012.656764.
[11]Klimek L, Eggers G. Olfactory dysfunction in allergic rhinitis is related to nasal eosinophilic inflammation [J]. J Allergy Clin Immunol, 1997, 100(2): 158-164. DOI: 10.1016/S0091-6749(97)70218-5.
[12]Mackay-Sim A. Stem cells and their niche in the adult olfactory mucosa [J]. Arch Ital Biol, 2010, 148(2): 47-58.
[13]Kondo K, Suzukawa K, Sakamoto T, et al. Age-related changes in cell dynamics of the postnatal mouse olfactory neuroepithelium: cell proliferation, neuronal differentiation, and cell death [J]. J Comp Neurol, 2010, 518(11): 1962-1975.DOI: 10.1002/cne.22316.
[14]Epstein V A, Bryce P J, Conley D B, et al. Intranasal Aspergillus fumigatus exposure induces eosinophilic inflammation and olfactory sensory neuron cell death in mice [J]. Otolaryngol Head Neck Surg, 2008, 138(3): 334-339. DOI: 10.1016/j.otohns.2007.11.029.
[15]Kim H Y, Kim J H, Dhong H J, et al. Effects of statins on the recovery of olfactory function in a 3-methylindoleinduced anosmia mouse model [J]. Am J Rhinol Allergy, 2012, 26(2): e81-e84. DOI: 10.2500/ajra.2012.26.3719.
[16]Lane A P, Turner J, May L, et al. A genetic model of chronic rhinosinusitis-associated olfactory inflammation reveals reversible functional impairment and dramatic neuroepithelial reorganization [J]. J Neurosci, 2010, 30(6): 2324-2329. DOI: 10.1523/JNEUROSCI.4507-09.2010.
[17]Sultan B, May L A, Lane A P. The role of TNF-α in inflammatory olfactory loss [J]. Laryngoscope, 2011, 121(11): 2481-2486. DOI: 10.1002/lary.22190.
(2016-12-12 收稿 2016-12-29 修回)
(本文编辑 付 辉)
Effect of allergic rhinitis on olfactory sensory neuron in mice
SONG Gongru1, AN Li'na2, and PENG Bibo1. 1. Institute of Disaster Medicine, 2. Department of Anesthesia Surgery, General Hospital of Chinese People's Armed Police Force, Beijing 100039, China
PENG Bibo, E-mail: pengbibo0610@126.com
Objective This study aimed to explore the effects of allergic rhinitis (AR) on olfactory sensory neurons (OSN) in mice. Methods An AR model of BALB/c mice was established by ovalbumin exposure (AR group, n=15), and wild-type BALB/c mice were set as the control group (n=15). The olfaction ability of the mice was detected by buried food pellet test (BFPT). The degree of OSN apoptosis in olfactory mucosa as well as its correlation with eosinophils were evaluated with the western blot analytical technique. Results (1) The mean time of BFPT in AR group was significantly longer than that the control group [(18.71±3.93)s vs (12.53±2.70) s, t=5.01,P<0.05]; (2) When compared with the control group, the olfactory marker protein (OMP) of mature OSN in the nasal olfactory mucosa of AR group was significantly decreased (t=15.55, P<0.05), whereas Caspase-3 in apoptosis pathway and eosinophil peroxidase (EPX) protein were significantly increased (t=10.98, P<0.05; t=33.52, P<0.05); (3) There was a positive correlation between Caspase-3 and EPX proteins in the nasal olfactory mucosa of mice in AR group (r=0.78,P<0.05). Conclusions In the setting of AR, eosinophils infiltrated into olfactory mucosa induced sensorineural olfactory loss by exerting a detrimental effect on OSNs.
allergic rhinitis; olfactory loss; olfactory sensory neuron; eosinophil
R765
10.13919/j.issn.2095-6274.2017.02.007
100039 北京,武警总医院:1. 灾害救援医学研究所,2. 麻醉手术科
彭碧波,E-mail:pengbibo0610@126.com
