2013-2015年湖北省药品质量监督抽验结果分析
2017-02-18蔡丹宁湖北省食品药品监督检验研究院武汉430075
蔡丹宁,江 燕(湖北省食品药品监督检验研究院,武汉 430075)
2013-2015年湖北省药品质量监督抽验结果分析
蔡丹宁*,江 燕#(湖北省食品药品监督检验研究院,武汉 430075)
目的:评价湖北省药品抽验质量情况,为监管部门与药品生产企业提供参考。方法:收集汇总湖北省食品药品监督检验研究院2013-2015年省计划抽验药品检验结果,以现行标准对总体质量状况及不合格样品情况进行统计分析。结果与结论:2013-2015年共完成省计划抽验药品检验7 721批,发现不合格样品333批,占4.3%。不合格产品主要出自经营企业(不合格率为2.8%~9.0%)和医疗机构(不合格率为5.2%~11.7%);从品种看,中药材不合格率最高(12.1%~37.4%)、不合格项目(含量测定、补充检验项目、性状、二氧化硫残留量及灰分等项目)种类最多,药物制剂的质量则相对稳定,不合格项目分布与品种和剂型有关。宏观层面存在现有标准水平参差不齐、抽验资源分配欠合理、行业整体水平较低等问题。建议监管部门整顿药品标准,合理规划抽验工作,加强生产企业源头治理。
湖北省;药品;抽验;质量情况;改进建议
药品质量监督抽验是对上市后药品进行质量控制和科学监管的重要手段[1-2]。目前,湖北省药品质量监督抽验计划除包含监督检验、风险监测、专项抽验外,还增加了快检专项和评价抽验,拓展了抽验的深度与广度。湖北省食品药品监督检验研究院每年在省计划抽验中承担相当数量的任务,承检样品覆盖全省药品生产企业、经营企业与医疗机构的药品,几年来积累了大量的数据。笔者现选择抽验内容基本类似的2013-2015年的药品检验结果进行汇总分析,评价其总体质量状况,针对抽验中发现的问题提出建议,供监管部门与药品生产企业参考。
1 资料与方法
统计湖北省食品药品监督检验研究院检验管理系统中2013-2015年抽验药品的检验结果,提取药品的名称、剂型、检验依据、检品来源、不合格检项、生产企业和生产批号等数据。因快检专项不提供判定结果,故未计入统计;评价抽验则仅统计符合现行标准的检验结果,未计入探索性研究的检验结果。结果,共有检品7 721批,其中生产企业3 386批、经营企业3 173批、医疗机构1 162批。根据导出数据分别统计抽验总体情况、检验标准情况、不合格样品分布情况、不合格项目名称及数量,据此展开质量分析。
2 结果与讨论
2.1 湖北省药品质量监督抽验基本情况
2.1.1 抽检总量及品种覆盖情况 湖北省食品药品监督检验研究院2013-2015年共完成省计划抽验药品7 721批,其中不合格样品333批,占4.3%。检验总体情况见表1。
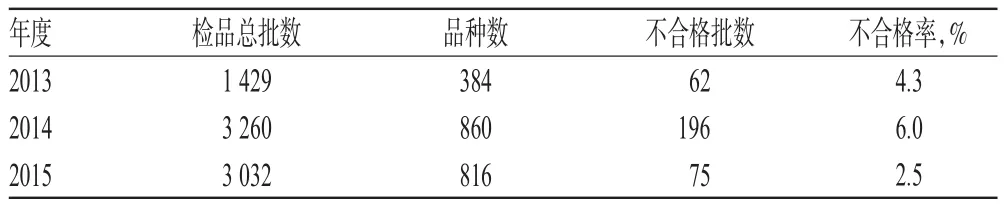
表1 检验总体情况Tab 1 The overall data obtained in drug sampling and testing
由表1可见,与2013年比较,2014、2015年检品总量和品种覆盖范围均明显增加。2013年以后,通过开展系列针对性抽验,并选择关键项目进行部分检验,检品总批数与品种数量几乎是2013年的2倍,提高了抽验工作效率。不合格率总体平稳,但2015年不合格率偏低,提示应加强对数据的回顾性分析,继续优化抽验工作规划。
2.1.2 执行标准情况 经统计,省计划抽验的标准主体为2010年版《中国药典》,此外还涉及部(局)颁布的药品标准、企业注册标准等。涉及检验标准情况见表2(表中,“其他”主要包含地方药材标准、饮片炮制规范和医疗机构制剂规范)。
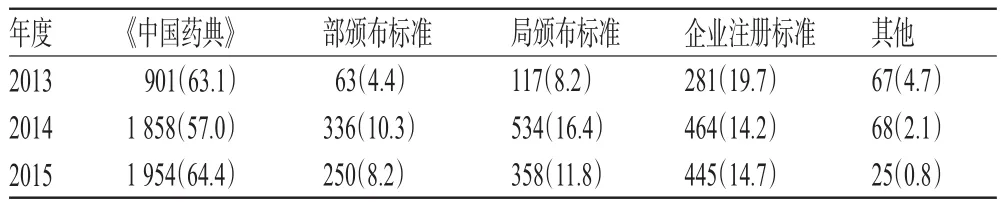
表2 涉及检验标准情况[批(%%)]Tab 2 Drug standard involved in drug sampling and testing[batch(%%)]
2.2 不合格样品分布情况
按抽验样品分类统计,2013-2015年中药材的不合格率最高(12.1%~37.4%),与总体不合格率变化趋势一致,说明中药材质量对药品总体质量有较大影响;其次为中成药(1.6%~3.3%),而化学药、抗生素(0.6%~1.1%)和生化药(0.4%~1.3%)不合格率较低。按抽样来源统计,医疗机构药品不合格率最高(5.2%~11.7%),其次为经营企业(2.8%~9.0%),而生产企业最低(1.2%~1.9%)。上述规律与全国其他地区的情况[3]类似。但在2015年应用近红外模型筛查后发现,部分生产企业存在擅自变更原辅料来源的现象,对此应加强监督。抽验样品分类统计结果见表3,抽验样品来源统计结果见表4。
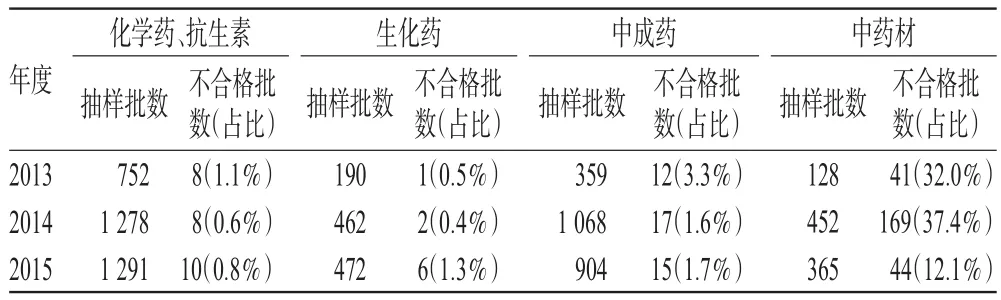
表3 抽验样品分类统计结果Tab 3 Statistical results of the classification of testing samples
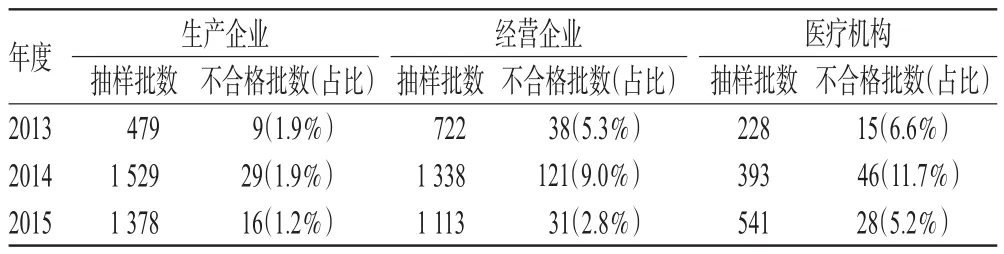
表4 抽验样品来源统计结果Tab 4 Statistical results of the sources of testing samples
2.3 各类样品抽验不合格项目分析
由以上分析可以发现,省计划抽验中不合格样品分布呈现一定的规律。为进一步发掘药品质量的潜在风险因素,有必要对上述样品的不合格项目分类分项目进行深入分析。
2.3.1 不合格项目与样品类别的相关性 (1)中药材。中药材不合格项目见表5。
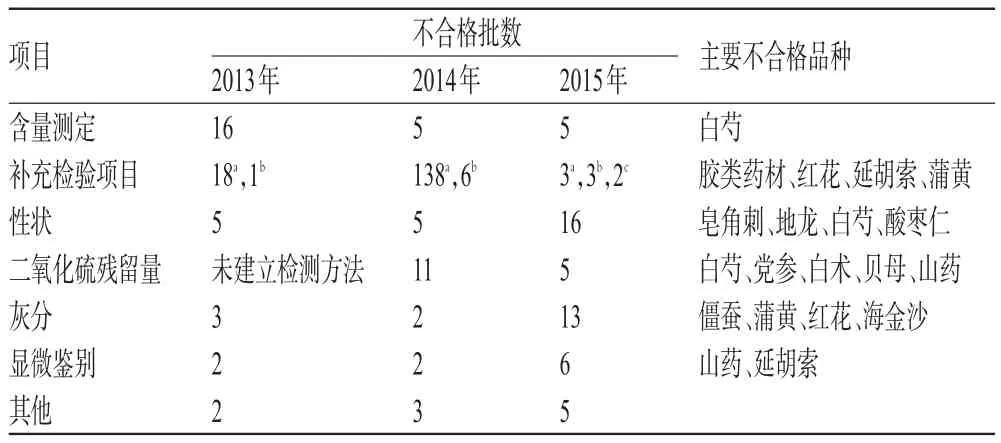
表5 中药材不合格项目及主要品种Tab 5 Unqualified items and main types of TCM
由表5可见,中药材不合格项目较多。与文献[3-4]报道的中药材不合格项目主要集中于性状、鉴别方面不同,本次质量分析结果表明,补充检验项目不合格数量最多,含量测定、灰分、二氧化硫残留量等项目不合格的样品也占据相当比例,说明中药材的质量问题日趋复杂化、隐蔽化。对主要不合格品种统计了连续出现不合格样品或不合格样品数量较多的品种,结果其不合格批数约占中药材不合格总批数的80%,可见不合格品种分布较集中。其中,胶类药材表现为掺杂,如阿胶检出牛皮源成分;红花、延胡索、蒲黄等易被染色;白芍不合格项目较多,原因可能与炮制过程复杂有关;而二氧化硫熏蒸不仅影响样品的二氧化硫残留量,还会使其指标成分含量降低、性状改变[5]。
(2)中成药。中成药不合格项目见表6。

表6 中成药不合格项目及主要剂型Tab 6 Unqualified items and main dosage forms of Chinese patent medicine
由表6可见,中成药不合格项目主要为薄层色谱、特征图谱、含量测定、补充检验项目、重(装)量差异。中成药补充检验项目主要针对非法添加和违规生产,可有针对性地发现并处理问题,如2014年检出2批中成药中含有解热镇痛类西药,2015年检出7批银杏叶片游离槲皮素、山柰素和槐角苷超过限度,说明所用银杏叶提取物未按正常工艺生产[6]。
(3)化学药、抗生素和生化药。化学药、抗生素和生化药的不合格项目见表7。
由表7可见,化学药、抗生素和生化药的不合格项目类似,主要有溶液澄清度/颜色、含量测定、溶出度/释放度、有关物质和不溶性微粒。其中,溶液澄清度/颜色不合格的品种多见于抗生素与生化药,有关物质不合格的品种有维生素K1注射液、氯霉素滴眼液、苯磺酸左旋氨氯地平片。值得注意的是,氯霉素滴眼液2012年曾检出45批降解产物氯霉素二醇物超过限度的样品,2015年再次检出不合格样品,提示相关企业应重新开展该药的稳定性研究,改进处方工艺。
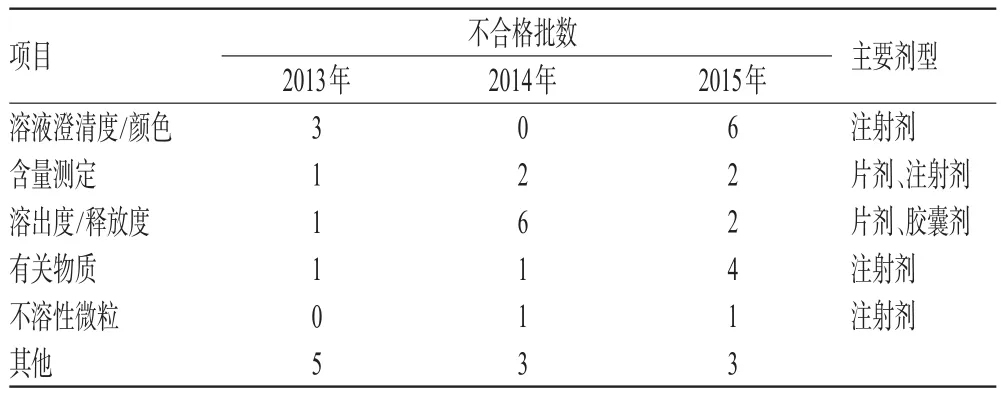
表7 化学药、抗生素和生化药的不合格项目及主要剂型Tab 7 Unqualified items and main dosage forms of chemical drugs,antibiotics and biochemical drugs
2.3.2 不合格项目与样品剂型的相关性 不合格项目的主要剂型见表6、表7。不合格样品剂型涉及片剂、注射剂、丸剂、胶囊剂、颗粒剂、口服溶液剂、糖浆剂、搽剂、滴眼剂和贴膏剂。总体而言,片剂和注射剂不合格项目最多。具体看来,片剂的不合格项目主要集中于溶出度/释放度和含量测定,前者多见于分散片、舌下片、缓控释片等。注射剂不合格项目主要集中在溶液澄清度/颜色、有关物质和不溶性微粒。溶液澄清度/颜色不合格的样品均为注射用无菌粉末。稳定性研究发现,上述样品胶塞接触药物一段时间后,样品颜色及澄清度均发生变化,提示胶塞中某些成分发生迁移而污染药物。胶囊剂的不合格项目主要是溶出度和水分。颗粒剂、丸剂、口服溶液剂的不合格项目分布类似,主要集中在含量测定及间接反映主成分含量的薄层色谱、特征图谱方面。对比不同类别药物同一剂型的不合格项目后发现,中成药还存在重(装)量差异等制剂学指标和补充检验项目不合格的样品,整体质量控制水平较差。
2.3.3 不合格项目批数变化 不合格项目批数变化见表5~表7。由表5可见,2015年中药材补充检验项目及二氧化硫残留量不合格批数较2013年有下降,但补充检验项目中添加物种类趋于多样化;性状、显微鉴别与灰分不合格批数较2013年有上升。由此可见,通过完善标准、及时采用补充检验方法,可及时发现、有效遏制中药材生产中的违规行为。性状不合格批数上升暴露出部分中药材的真品程度、有效成分纯度状况不佳,质量波动大。值得注意的是,含量测定不合格批数虽有所下降,但在检验中涉及品种不多,部分品种如红花、金银花等出现含量不合格样品后未进行跟踪抽验,因此不能单纯从数据变化判断其质量变化趋势。由表6可见,2015年中成药除补充检验项目不合格批数较2013年有上升外,其余不合格项目检出批数均有所下降。由表7可见,2015年化学药、抗生素和生化药的有关物质及溶液澄清度/颜色不合格批数较2013年有增加,提示今后抽验工作应关注注射剂的质量风险。
3 问题与建议
3.1 存在的问题
3.1.1 现有标准体系复杂,不利于客观评价药品质量检验过程中发现,不少品种仍采用部颁布标准或早期局颁布标准;一些现行版药典未收载的品种仍执行原药典标准,质量控制水平不高;此外,中药材的国家标准与地方标准共存,存在“同名异物”现象,各地饮片炮制规范间存在“一药数法”“各地各法”的现象。注册标准中某些品种未经统一,导致多个标准并行,检验时须逐一向厂家发函索要,增加了检验的难度,易使结果不客观。
3.1.2 抽验工作资源分配欠合理,药品抽验的针对性差 从抽样来源看,2013年后,药品抽验开始向生产单位倾斜,经营企业和医疗机构抽样数量占比下降,不仅与目前生产企业、经营企业、医疗机构数量分布情况[7]不符,也不符合不合格样品分布规律。从抽样类别看,中药材不合格率最高,但抽样量最少。不少品种的检验项目以性状为主,项目设置过于简单。此外,各年度抽验品种存在一定随机性,未针对问题品种及不合格项目进行跟踪抽验,抽验结果缺乏连续性及可比性。
3.1.3 部分企业缺乏自律,行业技术水平有待提升 分析不合格项目成因可以发现,各类品种、剂型普遍存在含量低于规定限度的问题。这表明生产企业仍存在为追求利润而进行低限投料、使用低劣原料的行为。中药材则存在种植加工不规范、提取后二次销售及伪劣品冒充真品等问题;此外,中药材还存在不同品种混用、贮藏不当、染色增重、掺杂掺假及过度熏蒸等问题,表现为性状、鉴别、补充检验项目、灰分及二氧化硫残留量不合格。中成药难以进行“全成分检测”,存在非法添加、不按处方投料等问题。化学药、抗生素和生化药药学研究基础薄弱,存在处方工艺不够合理、产品稳定性差或溶出不完全,随意选择或更换包材、药物与包材发生相互作用等问题。此外,制剂生产过程中的控制水平较低,表现为产品制剂学指标如重(装)量差异、含量均匀度等不合格,个别产品甚至受到污染。
3.2 建议
3.2.1 整顿现有药品标准,形成健全的标准体系 国家主管部门应针对不同类型的标准采用不同策略。对于早期制订的国家标准,应及时提高标准,通过增设检验项目、完善检验方法、提高限度要求,以遏制投机取巧及违法生产行为。对专属性不强、可操作性差的标准,应引入淘汰与废止机制。对于中药材(饮片)标准,应清理地方药材标准,尽早出台全国性中药饮片炮制规范。对于注册标准,应推进试行标准转正统一工作,对已上市同品种药品建立一致、有效的标准。此举也有利于全国药检系统共享标准信息[8]。
3.2.2 科学规划抽验工作,合理利用检验资源 既往数据的回顾性分析表明,省计划抽验不合格率与抽样环节、药品种类有关,不合格项目多集中于某一类药品或剂型。建议引入“质量源于设计”理念[9],围绕关键环节、品种和项目制订抽样计划。加大药品经营企业、医疗机构及生产企业外购原辅料的抽验力度,重点是中药材及既往不合格品种。中药材应进行专项抽验,辅以探索性研究;既往不合格品种应进行跟踪抽验。抽验计划规定检验项目时,应以问题导向与效能优先为原则,不宜过分强调全检率。以中药材检验项目为例,应先结合性状、显微鉴别、薄层鉴别、指纹图谱/特征图谱等手段,确认是否为真品,再对易掺杂品种进行有效成分纯度检查,对易掺伪染色的品种增加补充检验项目,最后关注含量测定。鉴于2015年版《中国药典》增设了大量中药材安全性检测指标,建议抽验中选择部分品种进一步考察重金属及有害元素、黄曲霉毒素、农药及二氧化硫残留量,以及时发现潜在问题。
3.2.3 注重源头治理和过程控制,推动行业整体水平提升 抽验是事后的被动控制。要从源头上杜绝不合格现象,企业必须强化质量主体意识,在制订内控标准时从严要求;在各生产环节中充分防控风险。中药材应从环境与种植方面入手,对药材的产地、种植、采收、炮制、包装、贮存全过程予以规范。中成药应严格按照核准的处方工艺组织生产,不得随意对生产工艺进行变更;探索合适的过程控制技术,减少原料变异对产品均一性的影响。对化学药、抗生素和生化药,建议生产企业借助一致性评价契机,从原料晶型、杂质特征、辅料、溶出曲线、生物利用度等方面开展与原研药的全面质量对比,深入研究改进处方工艺,有效提升产品的内在质量,缩小与原研药及国际公认产品的差距。
4 结语
对2013-2015年省计划抽验数据的回顾性分析,一是根据检验结果梳理了质量问题突出的品种及检验项目、分析了其变化趋势、发掘了当前药品质量的风险点,为监管提供了数据支持;二是针对抽验过程中发现的问题,从提升抽验工作质量与效率、提高药品质量的角度提出了合理建议,可供监管部门与药品生产企业参考。
[1] 张慕禹,管晓东,李江宁,等.评价药品监管部门工作质量的药品安全绩效评价指标体系的建立[J].中国药房,2016,27(1):1-4.
[2] 国家食品药品监督管理总局.药品质量抽查检验管理规定[EB/OL].(2006-07-21)[2016-03-08].http://www.sda. gov.cn/WS01/CL0844/10583.html.
[3] 冯华东,臧恒昌.2012年济宁市药品抽验不合格报告分析[J].中国药业,2014,23(10):16-17.
[4] 左毅,费路华.2011-2013年武汉药品医疗器械检验所抽验药品质量分析[J].中国药师,2016,19(1):146-149.
[5] 刘静静,刘晓,蔡皓,等.对市售白芍饮片芍药苷含量低于
《中国药典》标准的深入探讨[J].药物分析杂志,2010,30(10):1817-1821.
[6] 国家食品药品监督管理总局.食品药品监管总局发布银杏叶药品补充检验方法[EB/OL].(2015-06-08)[2016-03-08].http://www.cfda.gov.cn/WS01/CL0051/120950. html.
[7] 王长之,孙利华.我国药品抽验存在的问题及对策[J].中国药房,2015,26(1):124-127.
[8] 尚汝瑶,杨昭鹏.关于建立国家药品标准共享机制的探讨[J].中国药事,2013,27(4):356-359.
[9] 韩亮,Buhay N,郑强,等.美国FDA药品生产质量监管体系[J].中国新药杂志,2012,21(18):2128-2136.
(编辑:刘明伟)
·综述讲座·
Analysis of the Results of Drug Sampling and Testing in Hubei Province from 2013 to 2015
CAI Danning,JIANG Yan(Hubei Institute for Food and Drug Control,Wuhan 430075,China)
OBJECTIVE:To evaluate the quality of sampling drugs of Hubei province,and to provide reference for drug enterprises and supervision department.METHODS:The data obtained by Hubei Institute for Food and Drug Control about provincial drug sampling and testing from 2013 to 2015 were summarized,the overall quality and unqualified items were statistically analyzed according to current standard.RESULTS&CONCLUSIONS:The number of total sampling batches was 7 721 and that of the unqualified batches was 333(4.3%)during 2013-2015.Most of the unqualified samples came from distribution units(2.8%-9.0%)and medical institutions(5.2%-11.7%).Among all sample types,the herbal medicine has the highest unqualified rate(12.1%-37.4%),with the largest number of unqualified items(content determination,supplement inspection item,property,residual amount of sulfur dioxide,ash content).The quality of pharmaceutical preparations is relatively stable,and the unqualified items correlated with drug types and dosage forms.The current issues of provincial drug sampling and testing are the variety of standard levels,unreasonable sampling resource allocation and the low level of the industry.Supervision department is proposed to readjust drug standard,reasonably plan sampling and testing process and strengthen production source controlling.
Hubei province;Drug;Sampling and testing;Quality status;Suggestions for improvement
R92
A
1001-0408(2017)01-0126-05
2016-06-02
2016-10-15)
*主管药师,硕士。研究方向:药品质量控制。电话:027-87279953。E-mail:13986209858@163.com
#通信作者:主任药师,硕士。研究方向:药物分析。电话:027-87705209。E-mail:13871237288@163.com
DOI10.6039/j.issn.1001-0408.2017.01.33
