人单核细胞THP-1源性泡沫细胞内雷帕霉素含量测定的HPLC法的建立及应用Δ
2017-02-18胡华钟王仲萍陈亦清朱秋连林彩燕严鹏科广州医科大学附属第三医院药学部广州5050广州同鹏中旭医药科技有限公司广州5050
胡华钟,王仲萍,陈亦清,朱秋连,林彩燕,严鹏科#(.广州医科大学附属第三医院药学部,广州 5050;.广州同鹏中旭医药科技有限公司,广州 5050)
人单核细胞THP-1源性泡沫细胞内雷帕霉素含量测定的HPLC法的建立及应用Δ
胡华钟1*,王仲萍2,陈亦清2,朱秋连1,林彩燕1,严鹏科1#(1.广州医科大学附属第三医院药学部,广州 510510;2.广州同鹏中旭医药科技有限公司,广州 510510)
目的:建立人单核细胞THP-1源性泡沫细胞内雷帕霉素(RAPA)含量的测定方法,研究RAPA靶向制剂(RAPA-NP-Apt)对泡沫细胞的靶向作用。方法:以氧化型低密度脂蛋白诱导THP-1细胞建立泡沫细胞模型,取200 ng/mL的RAPA和200、400、800 ng/mL的RAPA-NP-Apt与泡沫细胞共同孵育60 min。采用高效液相色谱法(HPLC)测定细胞内RAPA含量,色谱柱为Diamonsil C18,流动相为乙腈-水(90∶10,V/V),流速为1.0 mL/min,柱温为40℃,检测波长为278 nm,进样量为20 μL。结果:RAPA检测质量浓度线性范围为50~6 400 ng/mL(r=0.999 96),平均回收率为98.72%(RSD=0.62%,n=3),日内、日间RSD均不大于6.15%(n=6),稳定性试验的RSD<2%(n=6),重复性试验的RSD=1.64%(n=6)。RAPA和低、中、高质量浓度的RAPA-NP-Apt与泡沫细胞共孵育后RAPA的含量分别为12、43、98、140 ng/106个细胞。结论:本方法操作简单,稳定性和重复性好,可用于泡沫细胞内RAPA的含量测定。RAPA-NP-Apt可提高RAPA对泡沫细胞的靶向作用。
高效液相色谱法;雷帕霉素;含量测定;靶向药物;泡沫细胞
雷帕霉素(RAPA)是一种疏水性大环内酯类免疫抑制剂,能特异性抑制冠脉支架置入后血管平滑肌细胞的过度增殖,降低冠脉支架置入后再狭窄的发生率[1]。但该药物全身给药对再狭窄疗效不佳,故一直采用药物涂层于支架的方法,局部用药治疗动脉粥样硬化(Athero-sclerosis,AS)病变。由于给药方式、剂量、给药时间受限等因素,易造成晚期支架内血栓形成和支架内再狭窄等临床安全性问题[2-4]。
泡沫细胞的形成是AS早期的标志,在AS的发生发展中具有重要的作用。本课题组已将前期研究获得的特异性靶向泡沫细胞的适配子与雷帕霉素纳米粒构建成靶向纳米给药体系,旨在替代现有的抗再狭窄药物涂层于支架的靶向模式,防治支架内再狭窄。本研究采用高效液相色谱法建立了细胞内RAPA含量的测定方法,分析RAPA靶向制剂对AS泡沫细胞的靶向作用,以期为研发具抗AS作用的RAPA靶向制剂提供参考。
1 材料
1.1 仪器
1200高效液相色谱仪,包括G1322A在线脱气机、G1313A自动进样器、G4212B二极管阵列紫外检测器(DAD)和色谱化学工作站(美国Agilent公司);5804低温离心机(德国Eppendorf公司,离心半径:95 mm);BP310P电子天平(德国Sartorius公司);M3800-C超声波清洗机(美国Bransonic公司)。
1.2 药品与试剂
RAPA靶向制剂(RAPA-NP-Apt,批号:2015090606,载药量:13%)、氧化型低密度脂蛋白(ox-LDL,批号:2015062301,规格:14 mg/L)均由广州医科大学附属第三医院药剂科实验室自制;RAPA对照品(广州慈铭生物公司,批号:140503,纯度:99.4%);油红O(美国Sigma公司);乙腈为色谱纯,丙酮、乙醇为分析纯。
1.3 细胞株
人单核细胞THP-1购自中国科学院上海细胞所。
2 方法与结果
2.1 泡沫细胞模型的建立及鉴定
THP-1细胞培养于6孔培养板中,置于5%CO2、37℃的培养箱中培养。试验前用100 nmol/L的丙二醇甲醚醋酸酯(PMA)诱导72 h,使其分化成巨噬细胞,再用80 mg/L的ox-LDL孵育72 h,诱导成泡沫细胞[5]。取泡沫细胞用油红O[油红O-去离子水(3∶2)]染色10 min,再用60%的异丙醇漂洗,显微镜下观察细胞形态和脂滴的变化。结果显示,细胞胞浆体积增大且细胞内含大量红色脂滴,与泡沫细胞的形态特点相符,表明泡沫细胞诱导成功。THP-1细胞及其泡沫细胞的鉴定结果见图1。
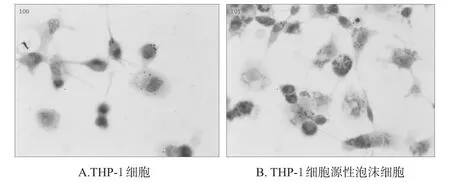
图1 THP-1细胞及其泡沫细胞的鉴定图(油红O染色,×400)Fig 1 Identification of THP-1 cells and foam cells(Oil red O staining,×400)
2.2 溶液的制备
2.2.1 RAPA对照品溶液 精密称取RAPA对照品0.1 g,置于100 mL量瓶中,用乙腈溶解并稀释至刻度,制成1 mg/mL的RAPA对照品溶液。
2.2.2 细胞内液 泡沫细胞用冷的磷酸盐缓冲液(PBS)清洗3次,去上清,加入200 μL的乙腈,超声振荡20 min
破壁,再收集,涡旋振荡20 min,13 000 r/min(离心半径:95 mm)离心10 min,收集上清液,即得。
2.2.3 RAPA标准细胞液 取细胞内液875 μL,加125 μL的RAPA对照品溶液,混匀即得。
2.2.4 细胞样品溶液 取泡沫细胞(106mL-1),分别加入含RAPA[溶于0.1%二甲基亚砜(DMSO)]或RAPANP-Apt的培养基,孵育60 min后,细胞用冷的PBS清洗3次,去上清。加入200 μL的乙腈,超声20 min破壁,再收集,涡旋振荡20 min,13 000 r/min(离心半径:95 mm)离心10 min,收集上清液,即得。
2.3 含量测定方法的建立
2.3.1 色谱条件 色谱柱:Diamonsil C18(250 mm×4.6 mm,5 μm);流动相:乙腈-水(90∶10,V/V),流速:1 mL/min;检测波长:278 nm;柱温:40℃;进样量:20 μL。
2.3.2 专属性试验 取细胞内液、RAPA标准细胞液、RAPA细胞样品溶液,分别按“2.3.1”项下色谱条件进样分析。结果显示,细胞内液中RAPA的出峰时间约为5.811 min,内源性物质不干扰其测定。色谱图见图2。
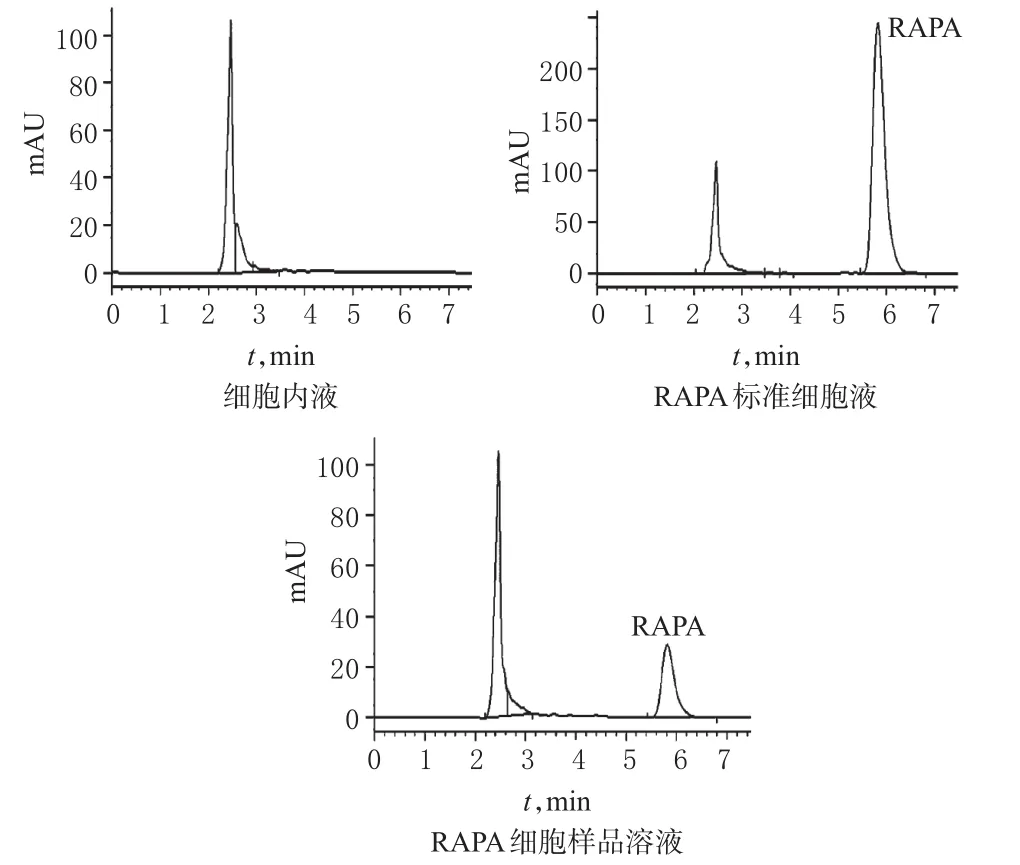
图2 高效液相色谱图Fig 2 HPLC chromatograms
2.3.3 线性关系考察 按“2.2.3”项下方法制备质量浓度分别为50、100、200、400、800、1 600、3 200、6 400 ng/mL的RAPA标准细胞液,照“2.3.1”项下色谱条件进样测定。以雷帕霉素质量浓度(x)为横坐标、峰面积(y)为纵坐标,进行回归分析,得回归方程为y=510.369 19x+ 2.381 436 5(r=0.999 96)。结果表明,RAPA检测质量浓度的线性范围为50~6 400 ng/mL,定量限为1 ng。
2.3.4 精密度试验 按“2.2.3”项下方法制备质量浓度分别为200、800、1 600 ng/mL的RAPA标准细胞液,按“2.3.1”项下色谱条件进样测定。同日内检测6次考察日内精密度,连续测定6 d考察日间精密度。结果,日内RSD分别为4.02%、4.38%、3.50%(n=6),日间RSD分别为4.45%、5.51%、6.15%(n=6),均不大于6.15%,表明精密度良好。
2.3.5 回收率试验 按“2.2.3”项下方法制备质量浓度分别为200、800、1 600 ng/mL的RAPA标准细胞液,分别加入RAPA对照品16.24 ng,按“2.3.1”项下色谱条件进样测定,计算回收率。结果显示,平均回收率为98.72%,RSD=0.62%(n=3),表明准确性良好,结果见表1。

表1 回收率试验结果(n=3)Tab 1 Results of recovery test(n=3)
2.3.6 稳定性试验 制备质量浓度为800 ng/mL的RAPA标准细胞液,分别在0、2、4、6、8、12、24、48 h时按“2.3.1”项下色谱条件进样测定,考察稳定性。结果显示,峰面积的RSD=2.84%(n=8),表明RAPA标准细胞液在48 h内稳定性良好。
2.3.7 重复性试验 制备质量浓度为800 ng/mL的RAPA标准细胞液,按“2.3.1”项下色谱条件进样测定,重复测定6次,考察重复性。结果显示,峰面积的RSD=1.64%(n=6),表明该方法重复性良好。
2.3.8 样品含量的测定 取含200 ng/mL RAPA的培养基和含200、400、800 ng/mL(低、中、高质量浓度)RAPA-NP-Apt的培养基,按“2.2.4”项下方法孵育细胞,按“2.3.1”项下色谱条件进样测定细胞内RAPA的含量。采用SPSS 16.0软件进行统计分析,多组样本均数间的比较采用单因素方差分析,两组样本均数间的比较采用t检验,P<0.05为差异具有统计学意义。结果显示,RAPA和低、中、高质量浓度的RAPA-NP-Apt与泡沫细胞共孵育后RAPA的含量分别为12、43、98、140 ng/106个细胞。与RAPA比较,3个质量浓度的RAPA-NP-Apt在泡沫细胞中的含量均增加,差异有统计学意义(P<0.05),结果见图3。

图3 样品含量的测定结果Fig 3 Results of content determination of samples
3 讨论
Guo J等[6]用荧光分析法来检测适配子介导的靶向制剂对脑瘤细胞的靶向性,证明了靶向制剂对脑瘤细胞的靶向性良好。但荧光分析只能定性分析,不能定量分析,误差比较大。本文采用高效液相色谱法检测细胞内RAPA含量,分辨率和灵敏度更高,分析速度快,重复性更好,定量更精确。
高效液相色谱法的样品提取一般采用液-液萃取法[7],但液-液萃取法只能萃取到样品中纯的药物,不能萃取到具有水溶性的纳米粒里面的药物。而本文的样品是由纳米粒包载的药物,所以采用液-液萃取法提取的药物的浓度检测不准确。经过笔者的改进,采用超声破碎后再用液-液萃取法,既可以破碎细胞,又可以破坏纳米粒的结构,让包载在纳米粒中的RAPA溶出,使其可以直接定量分析,提高了试验的准确度。
本文研究结果表明,RAPA-NP-Apt比RAPA有更好的生物相容性。低、中、高质量浓度的RAPA-NP-Apt在泡沫细胞中含量较RAPA高,且差异具有统计学意义(P<0.05),进一步说明了RAPA-NP-Apt可提高RAPA对泡沫细胞的靶向作用。
本文建立了测定泡沫细胞内RAPA含量的方法,可用于分析RAPA靶向制剂对泡沫细胞的靶向作用,为RAPA靶向制剂用于治疗AS的研究奠定了基础。
[1] 刘春霄,邢玉华.国产雷帕霉素药物涂层支架置入术对缺血性心肌病患者近中期预后影响的临床研究[J].现代诊断与治疗,2015,26(13):2893-2895.
[2] 李年秀.药物洗脱支架临床应用安全性的影响因素[J].
中国组织工程研究与临床康复,2010,14(25):4729-4732.
[3] 彭峰林.药物支架材料特征与置入后再内皮化及晚期血栓形成的评价[J].中国组织工程研究与临床康复,2010,14(29):5447-5450.
[4] 王浩,李泱,张文辉,等.紫杉醇与雷帕霉素复合药物涂层支架预防冠脉再狭窄动物实验研究[J].河北医药,2013,35(2):173-175.
[5] 杨青,罗俊生,关宁,等.罗格列酮对人单核巨噬细胞THP-1中胆固醇代谢的影响机制研究[J].中国药房,2012,23(17):1565-1567.
[6] Guo J,Gao X,Su L,et al.Aptamer-functionalized PEGPLGA nanoparticles for enhanced anti-glioma drug delivery[J].Biomaterials,2011,32(31):8010-8020.
[7] 白玉国,魏国义,魏娟娟,等.HPLC-MS联用同时测定血浆中舒血宁注射液中银杏内酯A、B的含量[J].中国药房,2011,22(16):1516-1518.
Establishment and Application of HPLC Method for Content Determination of Rapamycin in Human Monocyte THP-1 Derived Foam Cells
HU Huazhong1,WANG Zhongping2,CHEN Yiqing2,ZHU Qiulian1,LIN Caiyan1,YAN Pengke1(1.Dept.of Pharmacy,the Third Affiliated Hospital of Guangzhou Medical University,Guangzhou 510510,China;2.Guangzhou Tongpeng Zhongxu Pharmaceutical Technology Co.,Ltd.,Guangzhou 510510,China)
OBJECTIVE:To establish the method for the content determination of rapamycin(RAPA)in human monocyte THP-1 derived foam cells,and to study the effects of RAPA targeting preparation(RAPA-NP-Apt)targeting at foam cells.METHODS:Foam cells model were established through THP-1 cells were induced by oxidized low density lipoprotein.Foam cells were incubated with 200 ng/mL RAPA or 200,400,800 ng/mL RAPA-NP-Apt for 60 min.The content of RAPA was determined by HPLC.The determination was performed on Diamonsil C18column with mobile phase consisted of acetonitrile-water(90∶10,V/V)at flow rate of 1.0 mL/min.The column temperature was set at 40℃,and the detection wavelength was 278 nm.The sample size was 20 μL.RESULTS:The concentration of RAPA ranged 50-6 400 ng/mL(r=0.999 96)with average recovery of 98.72%(RSD=0.62%,n=3).RSDs of inter-day and intra-day were not more than 6.15%(n=6),RSD of stability was lower than 2%(n=6),and RSD of repeatability was 1.64%(n=6).After foam cells were incubated with RAPA or low-concentration,medium-concentration and high-concentration of RAPA-NP-Apt,the contents of RAPA were 12,43,98,140 ng/106cells.CONCLUSIONS:The method is simple,stable and reproducible.It can be used for content determination of RAPA in foam cells.RAPA-NP-Apt can improve the effects of RAPA targeting at foam cells.
HPLC;Rapamycin;Content determination;Targeting medicine;Foam cells
R927.2
A
1001-0408(2017)01-0043-03
2016-05-16
2016-07-17)
(编辑:邹丽娟)
广东省科技计划项目(No.2013B021800192);广州市科技计划项目(No.2013J4100040)
*硕士研究生。研究方向:动脉粥样硬化。电话:020-62784060。E-mail:2012386379@qq.com
#通信作者:主任药师,教授,硕士生导师。研究方向:动脉粥样硬化发病机制与药物干预。E-mail:yanpk988@126.com
DOI10.6039/j.issn.1001-0408.2017.01.11
