危重症应激性高血糖患者内毒素、NO与胰岛素组分关系的研究
2017-02-17马春霞李晓娟曹相原
马春霞,朱 瑞,李晓娟,曹相原
·论 著·
危重症应激性高血糖患者内毒素、NO与胰岛素组分关系的研究
马春霞1,朱 瑞1,李晓娟1,曹相原2
目的 研究危重症应激性高血糖(SHG)患者内毒素、一氧化氮(NO)与胰岛β细胞分泌组分的关系,探讨SHG的发病机理。方法 选择危重症SHG患者65例,测定内毒素的化学本质脂多糖(LPS)、NO及胰岛素组分[包括胰岛素原(PI)、真胰岛素(TI)、C-肽(C-P)]浓度。根据LPS的三分位数法分为3组,A组、B组及C组,比较3组间胰岛素组分;再根据NO的三分位数法分为3组,Ⅰ组、Ⅱ组及Ⅲ组,比较3组间胰岛素组分,并进行LPS、NO与胰岛素组分的相关性分析。结果 随着LPS水平的增高,PI浓度逐渐增高(P<0.05),TI浓度逐渐降低(P<0.05)。随着NO水平的增高,PI、C-P浓度逐渐增高(P均<0.05),TI浓度逐渐降低(P<0.05)。LPS与PI呈正相关性(r=0.316,P<0.05),与TI呈负相关性(r=-0.308,P<0.05);NO与PI、C-P呈正相关性[(r=0.150,P<0.05)、(r=0.219,P<0.05)],与TI呈负相关性(r=-0.150,P<0.05)。结论 内毒素及NO可影响胰岛素组分的转换,致使胰岛素的合成减少,从而导致血糖升高。
危重症;应激性高血糖;内毒素;一氧化氮;胰岛素组分
应激性高血糖(SHG)在危重症患者中普遍存在,其发生机制目前尚不清楚。目前已有大量研究显示,胰岛β细胞功能障碍是引起SHG的主要原因之一。研究显示,内毒素可引起胰岛β细胞受损[1]。内毒素通过整体作用诱导炎症细胞和胰岛细胞诱导型一氧化氮合酶(iNOS) 表达,产生一氧化氮(NO),NO可直接引起胰岛β细胞DNA断裂,细胞凋亡,引起胰岛素合成与分泌功能障碍[2]。内毒素及NO是否通过影响胰岛β细胞分泌组分的转换而引起胰岛素合成及分泌功能障碍目前尚未见相关报道。本研究采用前瞻性对照性研究方法,测定内毒素的化学本质脂多糖(LPS)、NO及胰岛素组分[包括胰岛素原(PI)、真胰岛素(TI)、C-肽(C-P)],分析LPS、NO与胰岛素组分的关系,探讨内毒素及NO影响胰岛素合成分泌中的具体环节。
1 资料与方法
1.1 一般资料:选取2012年11月-2013年10月宁夏人民医院重症监护病房(ICU)的危重症SHG患者65例,其中男48例,女17例;年龄23~78岁,平均(52.2±17.8)岁;BMI 17.5~24.6 kg/m2,平均(22.4±3.6)kg/m2;急性生理与慢性健康状况评分系统(APACHE)Ⅱ评分7~37分,平均(6.3±5.1)分。原发病:重症肺炎12例,脑外伤10例,外科大手术后10例,腹腔感染9例,急性创伤8例,急性脑血管疾病7例,慢性阻塞性肺部疾病4例,心血管疾病3例,自发性气胸2例。
1.2 诊断标准:①纳入标准,年龄18岁以上,糖化血红蛋白(HbA1c)4.5%~6.1%[3],BMI≤25kg/m2;随机测量2次以上血糖,空腹血糖(FPG)>6.1 mmol/L或随机血糖>10 mmol/L[4]。②排除标准有糖尿病、肾上腺疾病、甲状腺疾病及其他内分泌疾病者,入院后予以免疫抑制剂治疗者。
1.3 病例分组:将65例危重症SHG患者根据LPS的三分位数法分为A组、B组、C组[9],0.18 ng/L≤A组<27.12 ng/L、27.12 ng/L≤B组<47.84 ng/L、47.84 ng/L≤C组≤84.38 ng/L;根据NO的三分位数法分为Ⅰ组、Ⅱ组、Ⅲ组[5],0.59 μmol/L≤Ⅰ组<8.24 μmol/L、8.24 μmol/L≤B组<14.70 μmol/L、14.70 μmol/L≤C组≤52.35 μmol/L。
1.4 检测指标及方法:入选患者采血前2 h禁止使用任何直接引起血糖升高的药物和液体(如葡萄糖、胰岛素、氨基酸、脂肪乳、激素等),并在采血前8 h禁食。取外周血5~6 mL注入未加抗凝剂的预冷试管中,血液凝固后离心10 min取出血清,放入-80 ℃冰箱中保存,待测定。
LPS采用单克隆双抗体夹心酶联免疫吸附(ELISA)法测定,试剂盒由美国CUSABIO公司提供;NO采用化学发光法,试剂盒由南京建成生物工程研究所提供;TI、PI及C-P采用ELISA法测定,试剂盒由美国DRG公司提供;血糖测定采用己糖激酶法。

2 结果
2.1 不同LPS水平组NO及胰岛素组分的比较:随着LPS的增高,NO水平逐渐增高(P<0.05);随着LPS的增高,PI水平逐渐增高,TI水平逐渐降低(P均<0.05)。C-P水平,3组患者比较差异无统计学意义(P>0.05),见表1。
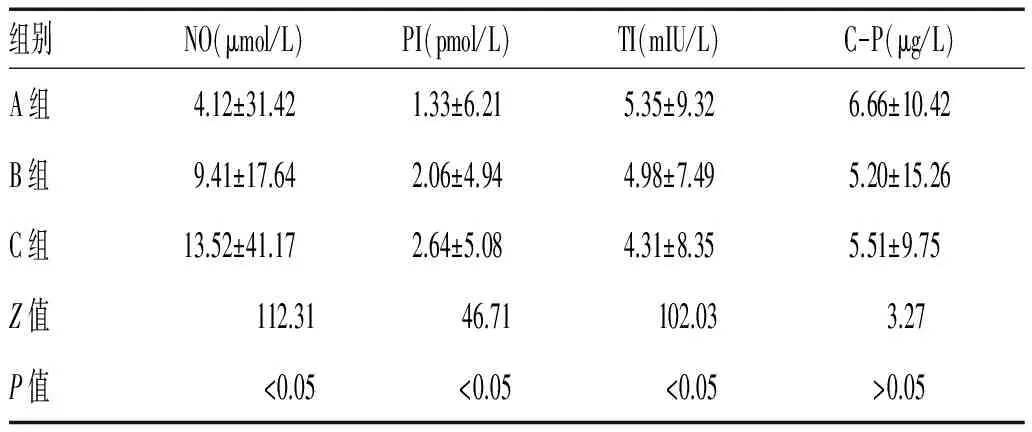
表1 不同LPS水平组NO及胰岛素组分的比较[M(QR)]
2.2 不同NO水平组胰岛素组分的比较:随着NO水平的增高,PI、C-P浓度逐渐增高,TI浓度逐渐降低,差异有统计学意义(P<0.05),见表2。

表2 不同NO水平组胰岛素组分的比较[M(QR)]
2.3 LPS与NO以及LPS、NO与胰岛素组分的相关性分析:LPS与NO、PI呈正相关性,与TI呈负相关性,差异均有统计学意义(P<0.05);NO与PI、C-P呈正相关性,与TI呈负相关性,差异均有统计学意义(P<0.05),见表3。
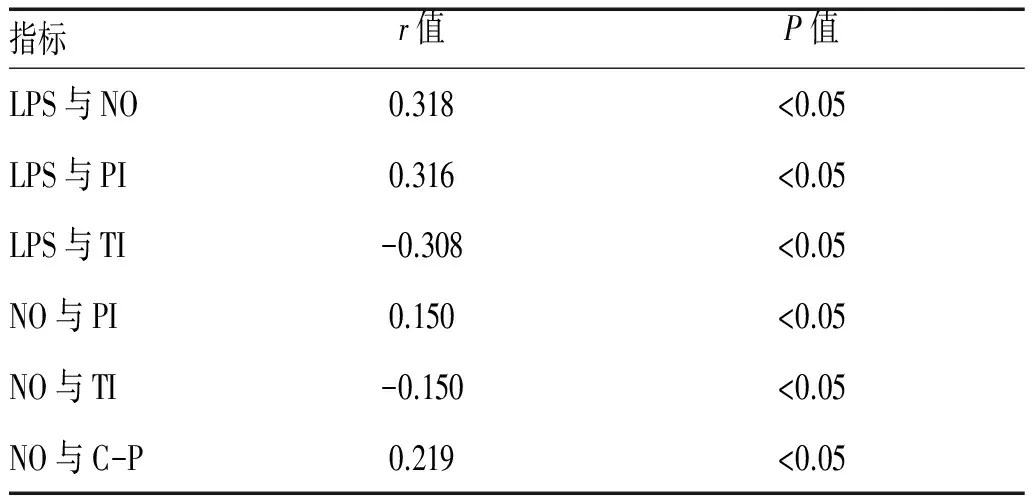
表3 LPS与NO及LPS、NO和胰岛素组分的相关性
3 讨论
内毒素血症可引起肿瘤坏死因子、白细胞介素等炎症介质的释放,进而激活一氧化氮合酶(NOS),导致NO的大量合成[2]。本研究显示,随着LPS的升高,NO水平逐渐增高,且LPS与NO呈正相关性,提示LPS可能诱发NO大量释放,与Hughes KJ等研究结果一致[2]。临床研究显示,内毒素在SHG发生中发挥着重要作用,内毒素及NO可引起SHG患者胰岛素浓度减少[6]。胰岛素浓度减少的因素有胰岛素合成和胰岛素分泌功能障碍。胰岛素合成过程是在胰岛β细胞核内,胰岛素基因DNA转录成前胰岛素原mRNA,在核糖体中翻译成前胰岛素原,随后在粗面内织网中脱去5′端的24肽直链形成PI,再转运到高尔基体,在高尔基体中形成PI、前胰岛素转变酶、Ca2+、ATP等包装在一起的分泌颗粒,之后脱去C-P形成胰岛素。胰岛素组分除了TI之外,还有PI、中间代谢产物及C-P,其中TI是胰岛素中真正有生物活性的部分。正常情况下,PI在胰岛素原转换酶及羧基肽酶的作用下等比例的转化为TI和C-P,外周血中PI 的浓度很低,仅占胰岛β细胞分泌组分的5%~15%,但当β细胞功能受损时,PI转化为TI和C-P出现障碍,PI比例增高,可达50%[7]。
本研究发现,随着LPS的增高,PI水平逐渐增高,TI水平逐渐降低,且LPS与PI呈正相关性,与TI呈负相关性;提示内毒素血症可引起胰岛β细胞功能受损,可能引起胰岛β细胞分泌颗粒内环境的不合适,如Ca2+浓度和pH不正常,影响胰岛素原转换酶活性[8],从而导致PI转换为TI出现障碍。内毒素血症显著增加NO的生成,NO选择性地损伤胰岛细胞,加重糖代谢紊乱[9]。本研究进一步发现,随着NO水平的增高,PI、C-P浓度逐渐增高,TI浓度逐渐降低,NO与PI、C-P呈正相关性,与TI呈负相关性;结果提示NO可引起胰岛β细胞功能障碍,且通过影响胰岛素组分的转换而影响胰岛素的合成,即PI在转化为TI及C-P的过程中出现障碍,表现为PI水平增高,TI及C-P并没有呈现出等克分子数的转换,而是C-P水平升高,TI水平降低,可能是NO影响胰岛素原转换酶活性或功能[8],致使PI转化异常。
[1] Hsieh PS,Chan JYH,Shyu JF,et al.Mild portal endotoxaemia induces subacute hepatic inflammation and pancreatic β-cell dysfunction in rats[J].European Journal of Clinical Investigation,2008,38(9):640-648.
[2] Hughes KJ,Chambers KT,Meares GP,et al.Nitric oxides mediates a shift from early necrosis to late apoptosis in cytokine treated β-cells that is associated with irreversible DNA damage[J].American Journal of Physiology Endocrinology and Metabolism,2009,297(5):1187-1196.
[3] 周小莉,贾丽敏,梁海艳,等.糖化血红蛋白检测在糖调节异常及糖尿病中的诊断价值[J].宁夏医学杂志,2015,37(3):258-260.
[4] Capes SE,Hunt D,Malmberg K,et al.Stress hyperglycaemia and increased risk of death after myocardial infarction in patients with and without diabetes:a systematic overview[J].Lancet,2000,355:773-778.
[5] Ekmekci A,Cicek G,Uluganyan M,et al.Admission hyperglycemia predicts inhospital mortality and major adverse cardiac events after primary percutaneous coronary intervention in patients without diabetes mellitusp[J].Angiology,2014,65(2):154-159.
[6] 马春霞,王利,王萍,等.内毒素、NO及NOS在危重病应激性高血糖中的作用研究[J].宁夏医学杂志,2016,38(1):21-23.
[7] Jie Wang,Kwame Osei.Proinsulin maturation disorder is a contributor to the defect of subsequent conversion to insulin in β-cells[J].Biochemical and Biophysical Research Communications,2011,411(1):150-155.
[8] Urukawa H,Carroll RJ,Swift HH,et al.Long-term elevation of free fatty acid leads to delayed processing of proinsulin and prohorone convertases 2 and 3 in the pancreatic beta-cell line MIN6[J].Diabetes,1999,48(7):1395-1401.
[9] 杨志红,钟历勇,王惠.内毒素血症对糖尿病大鼠氧化应激及一氧化氮的影响[J].首都医科大学学报,2007,28(6):310-312.
The relationship of endotoxin,NO and insulin in the stress hyperglycemia of critically ill.
MAChunxia1,ZHURui1,LIXiaojuan1,CAOXiangyuan2.
1.DepartmentofIntensiveCareUnit,NingxiaPeople'sHospital,Yinchuan750002,China;2.DepartmentofIntensiveCareUnit,GeneralHospitalofNingxiaMedicalUniversity,Yinchuan750004,China
Correspondingauthor:CAOXiangyuan,Email:c_xyuan@ sina.com.cn
Objective To study the relationship of endotoxin,NO and insulin in stress hyperglycemia (SHG),and to investigate the pathogenesis of SHG.Methods The concentration of serum lipopolysaccharide (LPS),nitric oxide (NO)and the secreted insulin builders including proinsulin (PI),true insulin (TI)and C-peptide (C-P)were respectively measured in 65 SHG patients with critical illness.According to LPS level,the patients were divided into group A,group B and group C.Then according to NO level,the patients were divided into group Ⅰ group Ⅱ and group Ⅲ.The secreted insulin builders were compared.And the relationship of LPS,NO and the secreted insulin builders were analyzed.Results The higher LPS was,the more PI was,and the lower TI was (P<0.05);The higher NO was,the higher PI and C-P were,and the lower TI was (P<0.05);The concentration of LPS was positively correlated with PI (r=0.316,P<0.05),and negativity correlated with TI (r=-0.308,P<0.05);The concentration of NO was positively correlated with PI (r=0.150,P<0.05)and C-P (r=0.219,P=0.039),and negativity correlated with TI(r=-0.150,P<0.05).Conclusion LPS and NO probably impact on the conversion of secretion constituents,decreasing insulin synthesis,leading to increased blood sugar.
Criticalillness;Stresshyperglycemia;Endotoxin;NO;Thesecretedinsulinbuilders
10.13621/j.1001-5949.2017.01.0022
宁夏自然科学基金资助项目(NZ1270)
1.宁夏人民医院总医院ICU,宁夏 银川 750002 2.宁夏医科大学总医院ICU,宁夏 银川 750004
马春霞(1975-),女,硕士学位,副主任医师,主要从事重症代谢研究方向。
曹相原,Email:c_xyuan@sina.com.cn
http://www.cnki.net/kcms/detail/64.1008.R.20170112.1708.034.html
R459.7
A
2016-02-06 [责任编辑]马兴忠
