甲状腺功能亢进症患者中桥本甲状腺炎的比例及其生化和病理特征
2017-02-17朱丽华陆西宛毛晓明
何 珂,胡 源*,朱丽华*,陆西宛,毛晓明
·临床诊疗提示·
甲状腺功能亢进症患者中桥本甲状腺炎的比例及其生化和病理特征
何 珂1,胡 源1*,朱丽华1*,陆西宛1,毛晓明2
目的 观察临床上诊断为毒性弥漫性甲状腺肿(GD)的甲状腺功能亢进症(甲亢)患者术后病理中桥本甲状腺炎(HT)的比例,评估甲亢患者中HT的比例及其生化、病理特征。方法 选取2012—2014年于南京市第一医院内分泌科及甲乳外科临床诊断为GD的甲亢患者36例,甲状腺切除术后甲状腺组织常规送病理检查,观察术后病理GD、HT、GD+HT的比例及其生化、病理特征。结果 36例甲亢患者术后病理中,26例(72.2%)为GD,7例(19.5%)为HT,3例(8.3%)为GD+HT。3组患者性别、年龄、病程、促甲状腺激素(TSH)、游离三碘甲腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺素受体抗体(TRAb)水平比较,差异均无统计学意义(P>0.05);3组患者甲状腺过氧化物酶抗体(TPOAb)、甲状腺球蛋白抗体(TGAb)水平比较,差异均有统计学意义(P<0.05),其中GD+HT组TPOAb水平高于GD组,HT组和GD+HT组TGAb水平高于GD组(P<0.05)。结论 HT在甲亢患者中占一定比例,HT和GD+HT可能是GD进展为HT的不同发展阶段。
格雷夫斯病;桥本病;甲状腺功能亢进症
何珂,胡源,朱丽华,等.甲状腺功能亢进症患者中桥本甲状腺炎的比例及其生化和病理特征[J].中国全科医学,2017,20(2):214-218.[www.chinagp.net]
HE K,HU Y,ZHU L H,et al.The proportion,biochemical and pathological characteristics of hashimoto′s thyroiditis in hyperthyroidism[J].Chinese General Practice,2017,20(2):214-218.
自身免疫性甲状腺疾病(autoimmunethyroiddiseases,AITD)是一类器官特异性自身免疫性疾病,其发生与遗传、免疫、环境等因素密切相关,可以表现为典型的桥本甲状腺炎(Hashimoto′sthyroiditis,HT)和毒性弥漫性甲状腺肿(Graves′disease,GD),而在两者的疾病发展过程中均可以表现为甲状腺功能亢进症(甲亢)与弥漫性甲状腺肿大[1-3]。在临床上,有相当一部分患者,表现出甲亢的临床症状、体征及生化特点,然而,甲状腺大部切除术后的病理却提示为HT,而随着术后逐步甲状腺功能减退(甲减)的发生,需要终生的甲状腺素替代治疗[4-5]。尽管HT和GD有不同的临床表型和发病机制,但其也有共同的致病因素。HT和GD患者常在同一家庭中被发现[6],甚至可以共存于同一甲状腺组织中[7-9]。HT和GD还可以相互交替出现于同一患者,患者可从GD起病,逐步进展为HT或从HT进展为GD。对AITD家庭的全基因组关联研究表明,多个基因与HT或GD的发生相关,并且存在共同基因[10-11]。此外,同卵双胞胎的相关研究报道中,其中一个发展为GD,而另一个则为HT[12-14]。GD患者最终结局为HT所致的甲减[15-16],而在少数报道中,HT最终可以发展为GD[17-19]。本研究拟通过对临床上诊断为GD的甲亢患者术后病理观察HT的比例,以评估在临床确诊的GD患者中HT的比例及其生化、病理特征,对HT的诊断与治疗提供理论依据。
1 对象与方法
1.1 研究对象 选取2012—2014年于南京市第一医院内分泌科及甲乳外科临床诊断为GD的甲亢患者36例,其中男6例,女30例;年龄18~68岁,平均年龄(37.4±13.6)岁。GD的诊断根据2011年美国甲状腺学会及美国内分泌医师学会共同制定的指南[20],具有典型的临床特征及实验室检查确诊。患者对抗甲状腺药物不敏感、药物过敏、甲亢复发,或颈部肿大而被建议行甲状腺切除术。术后甲状腺组织常规送病理检查。排除结节性甲状腺肿及高功能甲状腺腺瘤患者。
1.2 方法 甲状腺病理切片以苏木素-伊红(HE)染色观察淋巴细胞的浸润。GD病理特征:滤泡上皮增生呈高柱状,有的呈乳头样增生,并有小滤泡形成;滤泡腔内胶质稀薄,滤泡周边胶质出现许多大小不一的上皮细胞的吸收空泡;间质血管丰富、充血,淋巴组织增生。HT的病理特征:甲状腺实质组织广泛破坏、萎缩,滤泡上皮常有嗜酸性变,胞质内出现嗜酸性颗粒,间质内有大量淋巴细胞及不等量的嗜酸粒细胞(Hurthle细胞)浸润、淋巴小结形成、纤维组织增生。
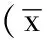
2 结果
2.1 生化特征 患者均具有甲状腺肿大及甲状腺毒症的症状,如心悸手抖、怕热多汗、易饥多食以及体质量下降;此外,血清游离三碘甲腺原氨酸(FT3)、游离甲状腺素(FT4)水平上升、促甲状腺激素(TSH)水平下降,促甲状腺素受体抗体(TRAb)阳性,99Tcm弥漫性摄取增加,支持GD的临床诊断。根据甲状腺切除术术后病理将患者分为GD组、HT组及GD+HT组,分别为26、7、3例。3组性别、年龄、病程、TSH、FT3、FT4、TRAb水平比较,差异均无统计学意义(P>0.05);3组甲状腺过氧化物酶抗体(TPOAb)、甲状腺球蛋白抗体(TGAb)水平比较,差异均有统计学意义(P<0.05),其中GD+HT组TPOAb水平高于GD组,HT组和GD+HT组TGAb水平高于GD组,差异均有统计学意义(P<0.05,见表1)。
2.2 病理学特征 36例入选的甲亢患者中,26例(72.2%)患者病理表现为甲状腺滤泡呈高柱状、乳头样增生,滤泡周边出现吸收空泡,提示GD,与术前的临床诊断一致。7例(19.5%)患者术后甲状腺病理可见大量淋巴细胞浸润、淋巴小结形成,提示HT。而另有3例(8.3%)患者病理提示同时存在GD和HT。

表1 3组患者一般情况及生化特征比较
注:与GD组比较,aP<0.05;b为χ2值;GD=毒性弥漫性甲状腺肿,HT=桥本甲状腺炎,TSH=促甲状腺激素,FT3=游离三碘甲腺原氨酸,FT4=游离甲状腺素,TRAb=促甲状腺素受体抗体,TPOAb=甲状腺过氧化物酶抗体,TGAb=甲状腺球蛋白抗体
甲状腺淋巴细胞浸润是AITD的病理学特征。尽管HT和GD的甲状腺组织均存在淋巴细胞组成的淋巴小结及生发中心,但其淋巴细胞浸润程度存在显著差异,HT中淋巴细胞的数量及浸润范围更广。GD患者中淋巴细胞聚集于腺体间质周围,其滤泡上皮增生呈高柱状,有的呈乳头样增生,并有小滤泡形成;滤泡腔内胶质稀薄,滤泡周边胶质出现许多大小不一的上皮细胞的吸收空泡(见图1,本文图1~3彩图详见本刊官网www.chinagp.net电子期刊相应文章附件)。但在HT,甲状腺实质组织广泛破坏、萎缩。滤泡上皮常有嗜酸性变,胞质内出现嗜酸性颗粒,细胞核有一定异型性,但无核分裂象。间质内有大量淋巴细胞及不等量的Hurthle细胞浸润、淋巴小结形成,有时可出现多核巨细胞(见图2)。此外,在同一甲状腺切片中看到GD和HT的并存,既有甲亢的甲状腺滤泡上皮增殖性改变,又有淋巴细胞浸润的病理改变(见图3)。

图1 甲状腺术后病理:甲状腺滤泡细胞增生与吸收空泡提示GD(HE染色)
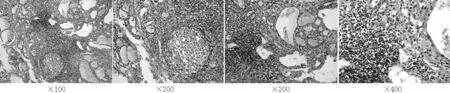
图2 甲状腺术后病理:Hurthle细胞,淋巴细胞浸润及淋巴小结提示HT(HE染色)

注:GD=毒性弥漫性甲状腺肿,HT=桥本甲状腺炎
图3 甲状腺术后病理:GD与HT共存(HE染色)
Figure 3 Thyroidectomy specimen showing simultaneous occurrence of GD and HT
3 讨论
GD和HT均是甲状腺特异性自身免疫性疾病,这两种截然不同的临床综合征具有共同的免疫病理机制。GD和HT的临床表现通常分别为甲状腺毒症和甲减,但两者具备的共同特点是甲状腺淋巴细胞浸润和产生甲状腺自身抗体。GD患者甲状腺中存在免疫效应细胞和甲状腺抗原特异性T细胞的减损,TSH受体表达于各组织,产生对甲状腺抗原相关的自身抗体。GD的产生是由于甲状腺上TSH受体被刺激,产生甲状腺刺激性抗体(thyroid stimulating antoantibodies,TSAb)所致。GD体内的TSAb活化促甲状腺激素受体(TSHR),从而刺激甲状腺滤泡上皮细胞的增生,促进甲状腺激素的产生与分泌,使甲状腺腺体增生与功能亢进[21-23]。相反,HT的发生与TSH刺激阻断抗体(TSH stimulating blocking antibody,TBAb)相关,其阻断TSHR,间接抑制甲状腺,使甲状腺腺体萎缩。AITD患者体内的甲状腺自身抗体在TSAb和TBAb间相互转化,相应其甲状腺功能也随之发生变化[24-26]。在GD患者中,10~15年的抗甲状腺药物或甲状腺次全切除术后,15%~20%患者会发生甲减,与逐步发展为HT密切相关[27]。抗甲状腺药物治疗可以降低TRAb水平,而患者体内同时存在TSAb和TBAb,下降的TSAb可以反馈性地使TBAb水平升高,最终导致HT的发生。TSAb、TBAb是甲亢和甲减相互转化的潜在机制。
GD与HT拥有共同的免疫学背景,是同类疾病的两个发展方向,部分GD最终会发生甲减,GD患者甲状腺内同样有中度的淋巴细胞浸润及炎性反应,而TPOAb及TGAb水平均明显升高(二者是HT的典型标志)。调节性T细胞在GD发病及与HT联系中起重要作用。研究发现,去除调节性T细胞可明显提高实验动物GD的发生率;在GD动物模型中,进一步去除调节性T细胞会使其向HT转化[28]。免疫调节细胞在GD的发病及GD向HT的转化过程中起重要作用。GD与HT的发病与转化有共同的免疫学机制。
HT是甲状腺弥漫性肿大和甲减最常见的原因,是以血清甲状腺相关抗体水平升高为特征的自身免疫性疾病。HT患者具有不同的临床特征,20%最终发展为甲减[29]。桥本甲亢常发生于HT的初期,占HT的不到5%。桥本甲亢的发生一方面与甲状腺抗原抗体炎性反应导致的甲状腺滤泡细胞破坏相关,另一方面,TSAb导致的自身免疫性炎性反应刺激甲状腺组织,共同促进甲状腺激素释放入血液中。然而,HT的发生通常是短暂的、自限性的。随着甲状腺组织的持续破坏和TBAb的不断作用,HT患者最终发展为甲减。
甲状腺腺体周围的炎性反应增加甲状腺切除术的难度,此外,甲状腺切除术会加重并加速HT患者甲减的发生[30-31]。因此,甲状腺切除术不推荐用于HT患者,即便是桥本甲亢期的患者。一般来说,HT患者手术适应证包括了恶性可疑、与疾病相关的持续症状,以及甲状腺体积不断肿大出现压迫症状。尽管相关研究提出了HT手术的指征,但由于报道的不同的HT结局和发病率,甲状腺切除术治疗HT目前仍存在争议[31]。
在病理学方面,HT和GD共同特点是淋巴细胞的浸润。甲状腺淋巴细胞的浸润是自身免疫性甲状腺疾病的病理标志。然而,淋巴细胞的浸润在数目和性质方面各不相同,反映了两种疾病不同的发病机制[3,32]。GD患者淋巴细胞浸润于腺体的基质中,而大量淋巴细胞浸润则是HT的病理特征。在HT中,浸润的淋巴细胞代替了甲状腺滤泡,甲状腺激素生成细胞的丢失从而导致甲减。损伤的甲状腺滤泡细胞以及甲状腺抗原抗体诱导的炎性反应的刺激,又激活了其他剩余的甲状腺滤泡细胞,使其功能代偿性的亢进,也因而导致了甲亢的发生[33]。而GD患者的淋巴小结是完整的。TSAb作用于甲状腺激素受体是甲亢的直接原因。在本研究中,HT和GD的病理改变出现在同一甲状腺组织中,弥漫性的甲状腺滤泡增生伴随嗜酸性改变,淋巴细胞浸润与间质伴随淋巴小结的形成。HT和GD具有共同的特征,其之间可以相互转化[34]。在病理学上,有很多病理切片无法具体区分是GD还是HT,或换句话说,其共存于同一甲状腺组织中。在很多病例中,GD和HT是并存的,临床所看到的仅是GD到HT的进展或HT到GD的相互转化的过程之中。
在本研究中,3组患者的一般情况及临床特征无差异。甲状腺功能及TRAb水平均是上升的,提示甲亢的存在。GD+HT组TPOAb水平、HT组及GD+HT组TGAb水平高于GD组,而HT组和GD+HT组之间TPOAb、TGAb水平无差异。GD+HT组的甲状腺功能与甲状腺抗体水平均与HT组无差异,提示HT和GD+HT组的相似性。可以推测,HT和GD+HT仅是GD进展为HT的不同发展阶段。此外,病理切片中,GD与HT的共存也支持了这一假设。
综上所述,HT和GD+HT可能是GD发展为HT的不同阶段。这一研究也对AITD的诊断与治疗提供了新思路。条件许可,甲状腺细针穿刺病理学检查对AITD诊断可以提供帮助,这也为后续的AITD相关基础研究提供新方向。
作者贡献:何珂、胡源进行试验设计与实施、资料收集整理、撰写论文、成文并对文章负责;陆西宛、毛晓明进行试验实施、评估、资料收集;朱丽华进行质量控制及审校。
本文无利益冲突。
[1]TOMER Y.Mechanisms of autoimmune thyroid disease:from genetics to epigenetics[J].Annu Rev Pathol,2014,9(1):147-156.
[2]HUBER A,MENCONI F,CORATHERS S,et al.Joint genetic susceptibility to type 1 diabetes and autoimmune thyroiditis:from epidemiology to mechanisms[J].Endocr Rev,2008,29(6):697-725.
[3]HUTFLESS S,MATOS P,TALOR M V,et al.Significance of prediagnostic thyroid antibodies in women with autoimmune thyroid disease[J].J Clin Endocrinol Metab,2011,96(9):E1466-1471.
[4]WORMER B A,MCHENRY C R.Hashimoto′s thyroiditis:outcome of surgical resection for patients with thyromegaly and compressive symptoms[J].Am J Surg,2011,201(3):416-419.
[5]UMAR H,MUALLIMA N,ADAM J M,et al.Hashimoto′s thyroiditis following Graves′ disease[J].Acta Med Indones, 2010,42(1):31-35.
[6]DESAI M P,KARANDIKAR S.Autoimmune thyroid disease in childhood: a study of children and their families[J].Indian Pediatr,1999,36(7):659-668.
[7]DONIACH D.Humoral and genetic aspects of thyroid autoimmunity[J].Clin Endocrinol Metab,1975,4(2):267-285.
[8]SUTRADHAR S R,SIDDIQUI N I,RAHMAN S,et al.Combined occurrence of hyperthyroid Graves′ and Hashimoto′s thyroiditis[J].Mymensingh Med J,2006,15(1):102-104.
[9]MAJUMDER A,SANYAL D.A case of simultaneous occurrence of Graves′ disease and Hashimoto′s thyroiditis[J].Indian J Endocrinol Metab,2012,16(Suppl 2):S338-339.
[10]TOMER Y,BAN Y,CONCEPCION E,et al.Common and unique susceptibility loci in Graves and Hashimoto disease:results of whole-genome screening in a data set of 102 multiplex families[J].Am J Hum Genet,2003,73(4):736-747.
[11]BAN Y,TOMER Y.The contribution of immune regulatory and thyroid specific genes to the etiology of Graves′ and Hashimoto′s diseases[J].Autoimmunity,2003,36(6/7):367-379.
[12]ILICKI A,MARCUS C,KARLSSON F A.Hyperthyroidism and hypothyroidism in monozygotic twins:detection of stimulating and blocking THS receptor antibodies using the FRTL5-cell line[J].J Endocrinol Invest,1990,13(4):327-331.
[13]TANI J,YOSHIDA K,FUKAZAWA H,et al.Hyperthyroid Graves′ disease and primary hypothyroidism caused by TSH receptor antibodies in monozygotic twins:case reports[J].Endocr J,1998,45(1):117-121.
[14]AUST G,KROHN K,MORGENTHALER N G,et al.Graves′ disease and Hashimoto′s thyroiditis in monozygotic twins:case study as well as transcriptomic and immunohistological analysis of thyroid tissues[J].Eur J Endocrinol,2006,154(1):13-20.
[15]WOOD L C,INGBAR S H.Hypothyroidism as a late sequela in patient with Graves′ disease treated with antithyroid agents[J].J Clin Invest,1979,64(5):1429-1436.
[16]TAKASU N,YAMADA T,SATO A,et al.Graves′ disease following hypothyroidism due to Hashimoto′s disease:studies of eight cases[J].Clin Endocrinol(Oxf),1990,33(6):687-698.
[17]LE BERRE J P,ROUSSEAU C,DUPUY O,et al.Unusual evolution of autoimmune hypothyroidism:occurrence of Graves′ disease[J].Rev Med Interne,2004,25(11):841-843.
[18]OHYE H,NISHIHARA E,SASAKI I,et al.Four cases of Graves′ disease which developed after painful Hashimoto′s thyroiditis[J].Intern Med,2006,45(6):385-389.
[19]KAMATH C,YOUNG S,KABELIS K,et al.Thyrotrophin receptor antibody characteristics in a woman with long-standing Hashimoto′s who developed Graves′ disease and pretibial myxoedema[J].Clin Endocrinol(Oxf),2012,77(3):465-470.
[20]BAHN R S,BURCH H B,COOPER D S,et al.Hyperthyroidism and other causes of thyrotoxicosis:management guidelines of the American thyroid association and American association of clinical endocrinologists[J].Endocr Pract,2011,17(3):456-520.
[21]PONTO K A,KAHALY G J.Autoimmune thyrotoxicosis:diagnostic challenges[J].Am J Med,2012,125(9):S1.
[22]HÉBRANT A,VAN STAVEREN W C,MAENHAUT C, et al.Genetic hyperthyroidism:hyperthyroidism due to activating TSHR mutations[J].Eur J Endocrinol,2011,164(1):1-9.
[23]MATTHEWS D C,SYED A A.The role of TSH receptor antibodies in the management of Graves′ disease[J].Eur J Intern Med,2011,22(3):213-216.
[24]MCLACHLAN S M,RAPOPORT B.Thyrotropin-blocking autoantibodies and thyroid-stimulating autoantibodies:potential mechanisms involved in the pendulum swinging from hypothyroidism to hyperthyroidism or vice versa[J].Thyroid,2013,23(1):14-24.
[25]EVANS M,SANDERS J,TAGAMI T,et al.Monoclonal autoantibodies to the TSH receptor,one with stimulating activity and one with blocking activity,obtained from the same blood sample[J].Clin Endocrinol(Oxf),2010,73(3):404-412.
[26]TAKASU N,MATSUSHITA M.Changes of TSH-stimulation blocking antibody(TSBAb)and thyroid stimulating antibody(TSAb) over 10 years in 34 TSBAb-positive patients with hypothyroidism and in 98 TSAb-positive Graves′ patients with hyperthyroidism:reevaluation of TSBAb and TSAb in TSH-receptor-antibody(TRAb)-positive patients[J].J Thyroid Res,2012,2012:182176.
[27]BHARGAV P R,SHEKHAR S.Surgical indications for Goiter with background Hashimoto′s thyroiditis:institutional experience[J].Indian J Surg,2011,73(6):414-418.

[29]ZALETEL K.Determinants of thyroid autoantibody production in Hashimoto′s thyroiditis[J].Expert Rev Clin Immunol,2007,3(2):217-223.
[30]MCMANUS C,LUO J,SIPPEL R,et al.Should patients with symptomatic Hashimoto′s thyroiditis pursue surgery?[J].J Surg Res,2011,170(1):52-55.
[31]SHIH M L,LEE J A,HSIEH C B,et al.Thyroidectory for Hashimoto′s thyroiditis:complications and associated cancers[J].Thyroid,2008,18(7):729-734.
[32]ARMENGOL M P,JUAN M,LUCAS-MARTN A,et al.Thyroid autoimmune disease:demonstration of thyroid antigen-specific B cells and recombination-activating gene expression in chemokine-containing active intrathyroidal germinal centers[J].Am J Pathol,2001,159(3):861-873.
[33]CUNHA L L,FERREIRA R C,MARCELLO M A,et al.Clinical and pathological implications of concurrent autoimmune thyroid disorders and papillary thyroid cancer[J].J Thyroid Res,2011,2011:387062.
[34]ZEPPA P,BENINCASA G,LUCARIELLO A,et al.Association of different pathologic processes of the thyroid gland in fine needle aspiration samples[J].Acta Cytol,2011,45(3):347-352.
(本文编辑:贾萌萌)
The Proportion,Biochemical and Pathological Characteristics of Hashimoto′s Thyroiditis in HyperthyroidismHEKe1,HUYuan1*,ZHULi-hua1*,LUXi-wan1,MAOXiao-ming2
1.DepartmentofEndocrinology,WuxiHospitalofChineseMedicine,WuxiHospitalAffiliatedtoNanjingUniversityofChineseMedicine,Wuxi214000,China
2.DepartmentofEndocrinology,NanjingFirstHospital,NanjingHospitalAffiliatedtoNanjingMedicalHospital,Nanjing210001,China
*Correspondingauthor:HUYuan,Attendingphysician;E-mail:779591765@qq.comZHULi-hua,Chiefherbphysician;E-mail:815724766@qq.com
ObjectiveToinvestigatetheproportionofhistopathologicallyconfirmedHashimoto′sthyroiditis(HT)inclinicallydiagnosedGraves′disease(GD)patientswithhyperthyroidism,andevaluatethebiochemicalandpathologicalcharacteristics.MethodsFrom2012to2014,thirty-sixpatientswithhyperthyroidismwhowereclinicallydiagnosedasGDintheDepartmentofEndocrinologyandThyroid-breastSurgeryatNanjingFirstHospitalacceptedthyroidectomy.Thethyroidtissuesacceptedroutinelypathologicalexaminationafterthesurgery.TheproportionsofGD,HT,andGD+HTwerecalculatedandthebiochemicalandpathologicalfeatureswereanalyzed.ResultsInall36patientswithhyperthyroidism,26(72.2%)ofthemwereGDconfirmedbyhistopathology,7(19.5%)wereHT,and3(8.3%)wereGD+HT.Therewerenostatisticallysignificantdifferencesingender,age,courseofdisease,TSH,FT3,FT4andTRAblevelamongthethreegroups(P>0.05).TherewerestatisticallysignificantdifferencesinTPOAbandTGAblevelamongthethreegroups(P<0.05).TheTPOAblevelinGD+HTgroupwashigherthanthatinGDgroup,andTGAblevelinHTgroupandGD+HTgroupwerehigherthanthatinGDgroup(P<0.05).ConclusionHTaccountedforacertainproportioninhyperthyroidism.HTandGD+HTmightbethedifferentstagesinthedevelopmentfromGDtoHT.
Gravesdisease;Hashimotodisease;Hyperthyroidism
R 581.1 R 392.6
B
10.3969/j.issn.1007-9572.2017.02.019
2016-03-10;
2016-09-15)
1.214000江苏省无锡市中医医院 南京中医药大学无锡附属医院内分泌科
2.210001江苏省南京市第一医院 南京医科大学附属南京医院内分泌科
*通信作者:胡源,主治医师;E-mail:779591765@qq.com 朱丽华,主任中医师;E-mail:815724766@qq.com
