RasGRP1基因多态与苏淮猪体尺性状关联分析
2017-02-170070生猪健康养殖协同创新中心湖北武汉0070南京农业大学养猪研究所江苏南京210095淮安市淮阴种猪场江苏淮安2222
*0070;2.生猪健康养殖协同创新中心,湖北 武汉 0070;.南京农业大学养猪研究所,江苏 南京 210095;.淮安市淮阴种猪场,江苏 淮安 2222)
RasGRP1基因多态与苏淮猪体尺性状关联分析
吴 慧1,2,黄瑞华3,李平华3,周 炼1,2,傅道斌4,李 强4,李新云1,2*,赵书红1,2
(1.华中农业大学农业动物遗传育种与繁殖教育部重点实验室,湖北 武汉
430070;2.生猪健康养殖协同创新中心,湖北 武汉 430070;3.南京农业大学养猪研究所,江苏 南京 210095;4.淮安市淮阴种猪场,江苏 淮安 223322)

栏目协办
苏淮猪是我国培育的一个优良品种,具有肉质好、抗逆性强等优良特性,但生长相对较慢,瘦肉率偏低,导致养殖效益偏低,改良其体型、生长等性能指标对苏淮猪的推广具有重要意义。该实验中首先测量了354头苏淮母猪的部分体尺,对其体尺性状进行了表型相关分析。性状相关分析结果表明苏淮母猪体长与体高、胸围、腹围、管围极显著相关(P<0.01);体高与体长、胸围、腹围、腿臀围极显著相关(P<0.01);胸围与体长、体高、腹围、腿臀围极显著相关(P<0.01);腹围与体长、体高、胸围、腿臀围极显著相关(P<0.01);管围与体长极显著相关(P<0.01);腿臀围与体高、胸围、腹围极显著相关(P<0.01)。利用网上已有的猪基因组测序数据,对RasGRP1基因进行了选择信号分析,结果表明RasGRP1基因在西方猪种中受到高强度选择。通过对RasGRP1基因启动子区域G/A多态位点进行PCR-RFLP分型,结果表明,在苏淮母猪群体中存在多态,其中A等位基因频率为0.672 3,为优势等位基因;关联分析结果显示RasGRP1基因G/A多态与苏淮母猪体高呈显著关联(P<0.05),与管围关联接近显著(P=0.054 8)。其中,AG型个体的体高及管围性状均值均高于GG型个体(P<0.05),但AA和GG个体间差异不显著(P>0.05),这表明该位点对体尺性状的效应主要是由非加性效应导致的。该实验结果为苏淮母猪种质特性研究提供了基础数据。
苏淮猪;RasGRP1基因;SNP;体尺性状;关联分析
苏淮猪的前身是新淮猪,是将新淮母猪与大白公猪杂交,在F2代中选择黑猪组建零世代基础群,然后经7个世代选育而成的[1]。苏淮猪具有耐粗饲、饲喂成本低、抗病能力强、适应性强、肉质鲜美等优点,被专家们称为“中国的杜洛克”[2],但苏淮猪也有瘦肉率相对较低,生长速度相对缓慢的缺点。改良苏淮猪的生长、胴体及体型性状将有利于提升苏淮猪的经济价值,强化其品种特性。
选择性清扫(selective sweep)是定位受选择重要经济性状相关基因的重要方法。在西方猪种培育过程中,其生长、体型、胴体等性状受到长期人工定向选择,通过选择信号分析能鉴定出这些性状主效基因。本实验中对西方商品猪进行了选择性清扫分析,结果发现RasGRP1基因受到高强度选择。RasGRP1为Ras的激活蛋白,属于小G蛋白Ras鸟嘌呤核苷酸交换因子(gua nine nucleotide exchange factors,GEFs)家族中的一员,该家族包括RasGRP1到RasGRP4四个成员。RasGRP1主要表达于T细胞和胸腺细胞。Ras蛋白家族是多种细胞信号通路的开关,参与调节细胞增殖、凋亡、分化等过程[3]。研究表明RasGRP1缺陷的小鼠表现出严重的胸腺发育停滞[4]。已有研究表明RasGRP1主要在机体免疫系统中发挥重要作用,但该基因在其他组织器官中的作用研究的还较少。此外,已有部分研究表明免疫和生长存在互作[5-6]。目前,RasGRP1基因在猪生长及体尺性状中的作用研究还未见报道。
本试验测量了354头苏淮母猪体尺数据,对体尺性状间进行了相关分析;同时在苏淮母猪群体中,对RasGRP1基因启动子区域一个受选择的多态位点进行了基因型检测及性状关联分析。本试验结果为苏淮猪种质特性研究提供了基础数据。
1 材料与方法
1.1 材料收集
本研究收集354头苏淮母猪体尺数据,采用基因组提取试剂盒(TIANGEN)提取DNA。该母猪群体拥有详细的系谱资料,饲喂的营养标准和环境条件一致。测定性状包括体长、体高、胸围、腹围、管围与腿臀围。所有测量值均校正到220日龄。
1.2 选择性清扫信号分析
利用29头西方商品猪种和21头中国地方猪的全基因组重测序数据进行选择性清扫分析[7-8],具体算法参照已发表文献中的方法[9]。
1.3 引物设计
根据Ensemble中ID为ENSSSCG00000004791猪RasGRP1基 因 序列,使用Primer Premier 5.0设计引物,设计引物如下,扩增RasGRP1基因启动子区域371 bp片段。Primer-F: 5’-AAGATCACAGAATCCTTAGTCAAAT-3’;Primer-R:5’-G T T G C T T T G C T T T T CCCTTC-3’。引物由北京奥科鼎盛生物科技有限公司合成备用。
1.4 PCR扩增及PCR-RFLP方法进行基因分型
PCR扩增体系(10 µL):DNA模板(50 ng/µL) 1 µL,PCR mix 5 µL,正反向引物各0.2 µL,加灭菌双蒸水补足至10 µL。PCR反应程序为:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火温度30 s,72 ℃延伸25 s,循环数35个,72 ℃终延伸5 min,15 ℃保存2 min后停止反应。
1.5 数据分析
性状间相关分析使用SPSS 2.0软件。使用T检验对相关系数进行显著性检验。性状关联分析使用SAS 9.2软件,数学模型如下:
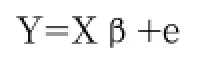
其中:Y为表型值;X为固定效应关联矩阵;β为固定效应参数向量,包括基因型效应、公畜效应、公畜内母畜效应;e为随机残差效应。
2 结果与分析
2.1 苏淮母猪体尺性状测定及性状间相关分析
对苏淮母猪体尺性状进行了测定,测定结果均校正到220日龄,结果表明苏淮母猪体长为(109.58±5.56)cm; 体 高 为(58.71±3.36)cm;胸 围 为(102.85±8.00)cm; 腹围 为(117.12±6.89)cm; 管 围为(16.10±0.94)cm;腿 臀 围 为(79.66±5.90)cm(表1)。相关分析结果表明苏淮母猪体长与体高、胸围、腹围、管围极显著相关(P<0.01);体高与体长、胸围、腹围、腿臀围极显著相关(P<0.01);胸围与体长、体高、腹围、腿臀围极显著相关(P<0.01);腹围与体长、体高、胸围、腿臀围极显著相关(P<0.01);管围与体长极显著相关(P<0.01);腿臀围与体高、胸围、腹围极显著相关(P<0.01)(表2)。

图1 RasGRP1基因选择信号分析(星号下为rs330828410SNP位点)
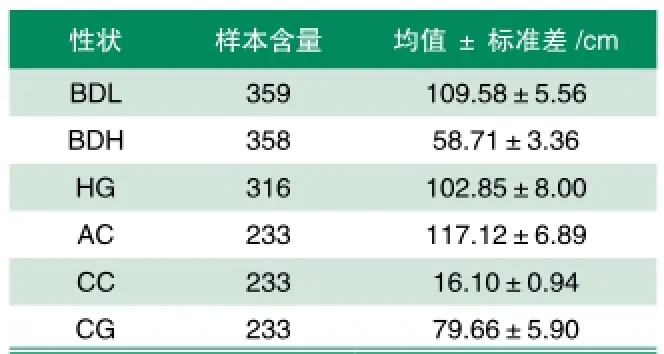
表1 苏淮母猪体尺性状均值
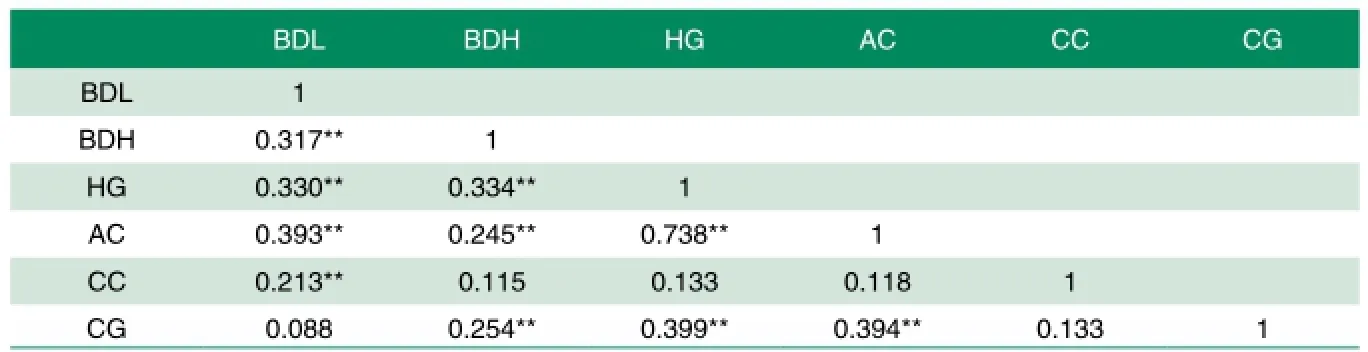
表2 苏淮母猪体尺性状相关分析
2.2 选择信号分析与PCR-RFLP结果
西方猪种选择信号分析结果发现,RasGRP1基因区域在中外猪种中的分化程度(0.55)高于全基因组显著水平(0.2)。其中1号染色体148 271 478处(Ensemble Variant ID rs330828410)存在一个A>G(星号标识)多态(图1a,b),这个多态位点位于RasGRP1基因启动子区域,造成一个PsiI酶切位点。RasGRP1基因酶切后存在3种基因型(图2)。
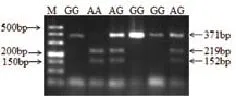
图2 RasGRP1基因SNP位点PsiI酶切判型结果
2.3 RasGRP1 A>G SNP位点与苏淮母猪体尺性状关联分析
对354头苏淮母猪进行了基因型分析,其中AA型168头,AG型140头,GG型46头。A基因频率为0.672 3,为优势等位基因。关联分析结果显示,该位点与苏淮猪体高呈显著关联(P<0.05),与管围关联接近显著(P=0.054 8),其中,AG型个体的体高及管围性状均值均显著高于GG型个体(P<0.05),但AA和GG个体间差异不显著(P>0.05)。该位点与其他体尺性状关联不显著(表3)。
3 讨论
本研究测定了苏淮母猪的体尺性状,并分析了各个体尺性状间的相关。根据本研究结果,大部分体尺性状存在表型相关,这也是合乎逻辑的,体尺性状主要取决于骨骼生长,而全身的骨骼是一个整体,因此会存在相关。根据本文的研究,我们认为如果需要改良苏淮猪的体型,可以主选1~2个体尺性状即可达到目的。
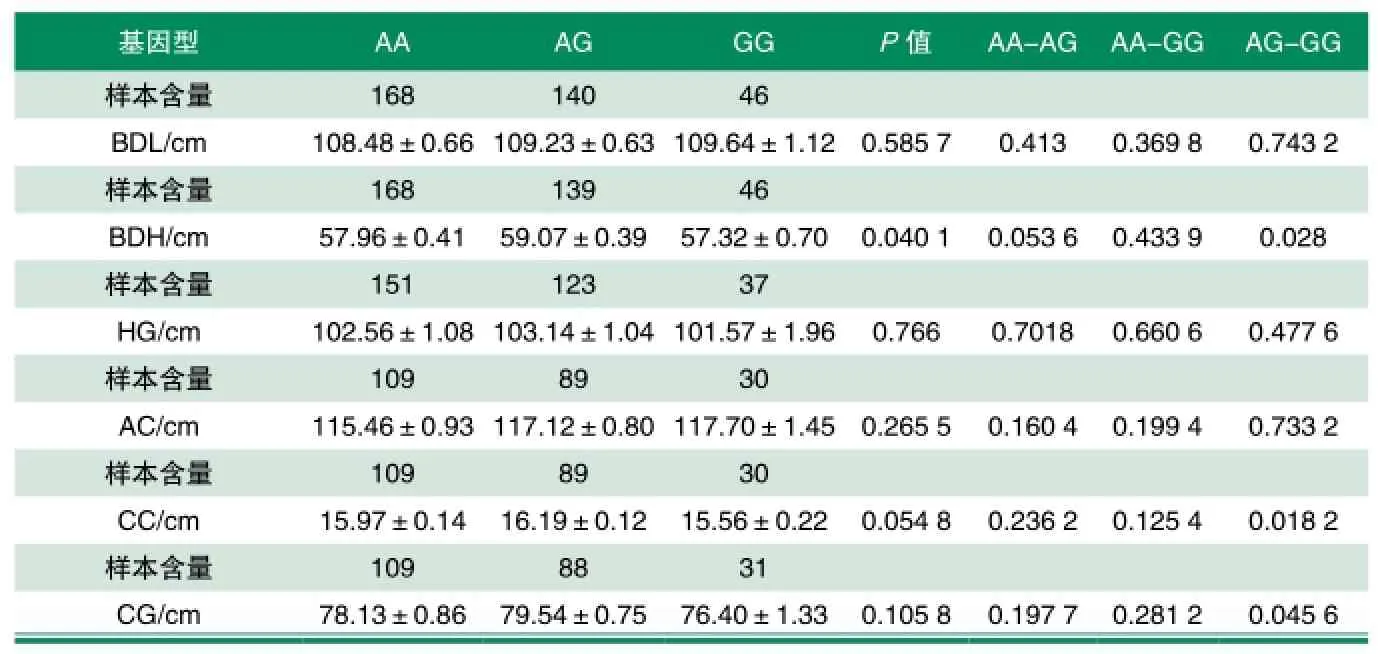
表3 RasGRP1基因G/A SNP位点与苏淮母猪体尺性状的关联分析结果
选择性清扫分析是鉴定养殖动物重要经济性状主效基因的主要方法,目前已有多篇文献报道运用此方法鉴定了动物经济性状主效基因[10-12]。众所周知,西方猪种在培育的过程中,其生长、体型及胴体等性状受到长期定向人工选择,导致西方猪种和中国地方品种在体型、生长方面存在很大差异,因此,通过选择信号分析有利于发现与上述性状的重要候选基因。本研究中,利用全基因组选择性清扫分析发现RasGRP1基因在西方猪种中受到高强度选择,最终选择了启动子区域的一个SNP位点进行后续研究,该SNP位于转录因子NR3C1的核心motif(TGTACAGATTGTAAA)中,该SNP可能影响NR3C1转录因子的结合,很可能是该选择信号区域的致因突变,故我们选择了这个SNP进行关联分析研究。
基因频率分析结果表明RasGRP1基因的A等位基因是优势等位基因。根据全基因组选择分析可以发现A等位基因主要是存在西方猪种中,而苏淮猪中含有75%的大白猪血液,推测这是导致A等位基因为优势等位基因的主要原因。性状关联分析结果表明,RasGRP1基因多态与苏淮母猪体高显著关联,与管围关联接近显著。这表明RasGRP1基因能够影响苏淮母猪的体尺性状。目前的研究表明RasGRP1基因主要在免疫系统中发挥作用[13],而许多研究表明生长与免疫存在互作。Williams等人发现减少猪只与病原接触,抑制免疫系统激活,能够促进机体生长、提高饲料利用效率[5]。因此,我们推测RasGRP1基因可能会通过机体免疫系统间接影响体尺性状。另外,我们发现RasGRP1基因两种纯合子间体高和管围性状差异均不显著,而杂合子均值大于两纯合子。这表明该基因的效应主要是由非加性效应导致的,非加性效应是形成杂种优势的一个重要原因,因此该基因的杂合子高于两纯合子可能是由于非加性效应导致的杂种优势。非加性效应形成的机理非常复杂,需要进一步研究。尽管非加性效应在目前的育种中很难利用,但是非加性效应是遗传方差的重要组成部分,也是导致群体遗传变异的重要因素,因此,也是需要深入研究的。另外,根据杂种优势,也可以安排合理的杂交生产,提高生产效益。
综上所述,本实验测量了354头苏淮母猪体尺数据,对体尺表型进行了性状间相关分析,并在苏淮母猪群体中进行了性状关联分析,发现RasGRP1基因能够影响苏淮母猪体尺性状,并鉴定了一个关键的多态位点。
[1] 于传军,王钧顺.苏淮猪的选育方法总结[J].畜牧与兽医,2011,43(11):108-109.
[2] 赵建军,吴建海,张新国,等.苏淮猪培育历程及市场化推广现状[J].中国畜禽种业,2015,11(5):71-73.
[3] ROOSE J P,MOLLENAUER M,GUPTA V A,et al.A diacylglycerol-Protein kinase C-RasGRP1 Pathway directs Ras activation upon antigen receptor stimulation of T cells[J]. Molecular & Cellular Biology,2005,25(11):4426-4441.
[4] DOWER N A,STANG S L,BOTTORFF D A,et al.RasGRP is essential for mouse thymocyte differentiation and TCR signaling[J]. Nature Immunology,2000,1(4):317-321.
[5] WILLIAMS N H,STAHLY T S,ZIMMERMAN D R.Effect of chronic immune system activation on the rate, efficiency, and composition of growth and lysine needs of pigs fed from 6 to 27 kg[J]. J o u r n a l o f A n i m a l S c ience,1997,75(9):2463-2471.
[6] GABLER N K, SPURLOCK M E.Integrating the immune system with the regulation of growth and efficiency[J]. J o u r n a l o f A n i m a l S c ience,2008,86(14 Suppl):64-74.
[7] LI M,TIAN S,JIN L,et al.Genomic analyses identify distinct patterns of selection in domesticated pigs and Tibetan wild boars[J]. Nature Genetics,2013,45(12):1431-1438.
[8] RUBIN C J,MEGENS H J,BARRIO A M,et al.Strong signatures of selection in the domestic pig genome[J]. P r o c e e d i n g s o f t h e N at i o n a l A c a d e m y o f S c i e n ces of the United States of America,2012,109(48):19529-19536.
[9] 李秀领,杨松柏,唐中林,等.大白猪和通城猪全基因组选择性清扫分析[J].遗传,2012,34(10):1271-1281.
[10] 杨怀谷,李宝红,张洁,等.利用选择性清除方法鉴别影响太湖猪(二花脸、梅山猪)及野猪产仔数差异的SNP位点[J].广东农业科学,2014,41(15):100-106.
[11] QANBARI S,GIANOLA D,HAYES B,et al. Application of site and haplotype-frequency based approaches for detecting selection signatures in cattle[J].BMC Genomics,2011,12(1):318.
[12] Q A N B A R I S,P I M E NTEL E C G,TETENS J,et al.A genome-wide scan for signatures of recent selection in Holstein cattle[J]. Animal Genetics,2010,41(4):377-389.
[13] ROOSE J,WEISS A.T cells:getting a GRP on Ras[J].Nature Immunology,2000,1(4):275-276.
2016-12-05)
国家自然科学基金(31372291)
吴慧,华中农业大学硕士研究生,主要从事动物分子育种方向的研究,E-mail:wuhuixqh@163.com
李新云,华中农业大学教授,博士生导师,研究方向为猪骨骼肌生长发育的分子机理,E-mail:hzaulxy@163.com
