禽多杀性巴氏杆菌外膜蛋白H受体的初步鉴定
2017-02-17吾鲁木汗那孜尔别克恩特马克布拉提白
吾鲁木汗·那孜尔别克,韦 东,恩特马克·布拉提白,肖 迪
禽多杀性巴氏杆菌外膜蛋白H受体的初步鉴定
吾鲁木汗·那孜尔别克1,2,韦 东2,恩特马克·布拉提白1,2,肖 迪3
目的 鉴定鸡胚成纤维(CEF)细胞膜禽多杀性巴氏杆菌外膜蛋白H(OmpH)受体。方法 用膜蛋白提取试剂盒制备CEF细胞的膜蛋白,通过SDS-PAGE和配体印迹检测CEF细胞膜蛋白中的OmpH受体,采用MALDI-TOF质谱技术鉴定蛋白种类,并用配体印迹、ELISA和免疫荧光技术检测OmpH受体在不同宿主食管黏膜细胞表面的分布情况。结果 在转印CEF细胞膜蛋白的NC膜上有一条明显的疑似受体条带,分子量约为49 kDa。MALDI-TOF质谱鉴定结果表明该受体蛋白是ATP合成酶β亚基。在转印鸡和兔食管黏膜细胞膜蛋白的NC膜上检测到能够与OmpH结合的蛋白条带,但在牛和猪食管黏膜细胞膜蛋白中未见任何印迹条带,而OmpH与鸡和兔食管黏膜细胞膜蛋白的结合力高于猪和牛食管黏膜细胞膜蛋白。结论 禽多杀性巴氏杆菌OmpH受体可能是CEF细胞膜表面的ATP合成酶β亚基。
禽多杀性巴氏杆菌;OmpH;受体;ATP合成酶β亚基
禽霍乱是由血清型A∶1、A∶3或A∶4的多杀性巴氏杆菌(Pasteurellamultocida,以下简称巴氏杆菌)引起的一种急性败血性传染病,给养禽业造成了巨大的经济损失[1]。目前,国内外用灭活疫苗和活疫苗来控制巴氏杆菌病,但这些疫苗存在保护周期短、交叉保护性较差和易出现毒力返强等缺点,所以至今本病仍未得到有效控制[2-3]。病原菌感染机体的第一步,为黏附素和宿主细胞表面相应特异性受体的结合,而介导细菌的定居、宿主细胞信号传递和适当途径的毒素传递,从而引发机体一系列病理过程,直至细胞、组织器官死亡[4-5]。
研究表明,A型禽巴氏杆菌的外膜蛋白H(outer membrane protein H,OmpH)具有黏附作用和交叉保护作用,即抗OmpH抗体阻止了细菌对鸡胚成纤维(chicken embryo fibroblast, CEF)细胞的黏附,且OmpH免疫组鸡或OmpH免疫组小鼠对血清型A∶1和A∶3菌株致死性攻毒的保护率分别为100%和80%[6-9]。国内外学者为了探讨OmpH的致病作用,采用基因敲除技术和RNA干扰技术分别构建血清型A∶1和A∶3禽巴氏杆菌ompH基因的突变株,结果显示突变株的荚膜合成能力基本丧失,而突变株对SPF猪或对小鼠的致病性明显降低[10-11]。后来韦东等[12]检测鸡血清补体或小鼠腹腔巨噬细胞对ompH基因缺失突变株的杀伤作用,结果显示与野生株相比突变株的血清抵抗性和抗吞噬作用显著降低。上述研究结果表明,OmpH在A型禽巴氏杆菌对宿主的感染与致病过程中可能发挥重要的作用,但在自然宿主细胞膜OmpH受体及其致病机制尚不清楚。因此,本文用配体印迹技术检测CEF细胞膜蛋白中的OmpH受体,通过MALDI-TOF质谱技术鉴定受体蛋白种类,并用免疫学方法检测OmpH受体在不同宿主细胞膜中的分布。
1 材料与方法
1.1 实验材料
1.1.1 菌株、试验动物和动物组织 血清型A∶1禽巴氏杆菌C48-3株购自国家兽医菌种保藏中心;禽巴氏杆菌C48-3株重组蛋白OmpH的原核表达和纯化及其抗体制备等工作在本实验室完成[12];8周龄SPF鸡和种蛋购自北京梅里亚维通实验动物技术有限公司;清洁级新西兰白兔购自湖南斯莱克景达实验动物有限公司;2岁健康湘西黄牛食管组织和1岁湘西黑猪食管组织由湖南省吉首市畜牧水产局提供。
1.1.2 主要试剂和培养基 Protein Molecular Weight Marker (Broad)购自TaKaRa公司;Mem-PER Eukaryotic Membrane Protein Extraction Reagent Kit购自上海前尘生物科技有限公司;X-Gal和IPTG购自北京鼎国公司;HRP标记的羊抗兔IgG、HRP标记的羊抗鼠IgG、FITG标记的羊抗兔IgG、邻苯二胺(DAB)购自上海生工生物工程公司;抗6聚组氨酸单克隆抗体购自南京Bioword Technology公司;6聚组氨酸由上海强辉生物科技有限公司合成;BSA购自北京欣经科生物技术有限公司。Dextrose Starch Agar(DSA)和Tryptose Broth(TB)培养基均为Difco公司产品;MEM培养基为Invitrogen公司产品。
1.2 方法
1.2.1 CEF细胞膜蛋白样本的制备 按Borrathybay等的方法[6],用10日龄SPF鸡胚制备CEF细胞,用含100 μg/mL链霉素、100 μg/mL卡那霉素、2.5 μg/mL两性霉素B和10%胎牛血清的MEM培养液制备浓度约为106个/mL的CEF细胞,将20 mL细胞液加入500 mL培养瓶内,5% CO2培养箱37 ℃培养24 h,通过0.25%胰蛋白酶消化收集CEF细胞,-80 ℃保存。采用Mem-PER Eukaryotic Membrane Protein Extraction Reagent Kit提取CEF细胞的膜蛋白样本。Bradford法测定蛋白质含量,以BSA为标准品绘制标准曲线。
1.2.2 CEF细胞膜蛋白的SDS-PAGE和配体印迹分析 按Mullen等介绍的方法[13]进行。取制备好的CEF细胞膜蛋白100 ℃处理5 min,用SDS-PAGE分离CEF细胞膜蛋白条带,用半干式电转仪将凝胶中的蛋白条带转移至硝酸纤维素(NC)膜上,用封闭液(含5%脱脂奶粉和0.1%Tween 20的PBS溶液)4 ℃封闭过夜,加入纯化的重组OmpH(20 μg/mL)或6聚组氨酸(10 μg/mL)室温作用1 h,加抗重组OmpH抗体(1∶500)或抗6聚组氨酸单克隆抗体(1∶1 000)室温反应2 h,然后与HRP标记的羊抗兔IgG(1∶1 000)或HRP标记的羊抗鼠IgG(1∶1 000)室温孵育1 h,充分冲洗后,用DAB显色液避光显色。
1.2.3 OmpH受体的MALDI-TOF质谱鉴定 通过配体印迹分析得知,CEF细胞膜蛋白中的分子量约为49 kDa蛋白可被OmpH配体所识别。将此位置的蛋白条带切胶回收,加入胰蛋白酶37 ℃充分消化后,采用5700型飞行时间质谱仪(MALDI-TOF/ TOF-MS,Applied Biosystems, Foster City, CA, USA)鉴定蛋白种类。Nd:YAG激光器频率200 Hz,波长为355 nm,正离子模式采用,默认校准(误差小于50 ppm)。酶解之后的样品中加入蛋白溶解液(0.5%TFA-50%ACN),采用干滴法使样品蛋白与基质(10 mg/mL)以1∶1的比例在192靶上混合,干燥后行质谱采样。采用4 000 Series ExplorerTMsoftware version 3.0软件采集样品。从800 Da到4 000 Da采集一级谱图,采用interpreation从高到底采集6个母离子。使用GPS工作站(GPS ExplorerTMv3.6,Mascot v2.1) 搜索NCBI的非冗余蛋白质数据库。设置可变修饰Carboxymethyl(C)、Oxidation(M),搜索母离子偏差设为0.1 Da,MS/MS片段偏差设为0.1 Da。蛋白与离子的置信区均高于95%,且至少有两个肽段得分大于50或一个肽段得分大于60,确认蛋白。
1.2.4 不同宿主食管黏膜细胞膜蛋白的配体印迹分析 将SPF鸡、清洁级新西兰白兔、健康湘西黄牛和湘西黑猪的食管组织放入-80 ℃冻存72 h。取冷冻保存的鸡、兔、猪和牛食管,PBS清洗后用无菌刀片切开食管,去除外层和肌肉层,取内层黏膜组织用于制备膜蛋白样本。用Mem-PER Eukaryotic Membrane Protein Extraction Reagent Kit分别制备鸡、兔、牛和猪食管黏膜细胞膜蛋白样本。用重组OmpH和其抗体经配体印迹法检测在不同宿主食管黏膜细胞膜蛋白中的OmpH受体。
1.2.5 不同宿主食管黏膜细胞膜OmpH受体的ELISA检测 按Moser等的方法[14]检测不同宿主食管黏膜细胞膜表面的OmpH受体。即用100 mmol/L碳酸盐缓冲液(pH9.6)制备蛋白含量为20 μg/mL的膜蛋白溶液,将50 μL膜蛋白溶液加入ELISA板孔内,37 ℃包被2 h,用含1% BSA的PBS溶液室温封闭30 min,将50 μg/mL的重组OmpH溶液50 μL加入ELISA板孔内,37 ℃孵育1 h,用含0.1%Tween 20的PBS(PBST)洗板3次,加50 μL的抗重组OmpH抗体(1∶500)4 ℃孵育过夜,PBST洗板3次,加50 μL的HRP标记的羊抗兔IgG(1∶1 000)37 ℃孵育1 h,PBST洗板3次。将OPD底物溶液150 μL加入酶标板孔内,室温避光显色15 min,最后用25% H2SO4溶液终止反应。用酶标仪测定OD492的吸光值。
1.2.6 不同宿主食管黏膜细胞膜OmpH受体的免疫荧光检测 将100 μg/mL的膜蛋白溶液300 μL加入置有无菌盖玻片的24孔组织培养板4 ℃孵育过夜,加入300 μL封闭液(含3% BSA和0.1% Tween20的PBS溶液)37 ℃封闭2 h,PBST洗涤1次,将100 μg/mL的重组OmpH溶液300 μL加入24孔组织培养板孔内,37 ℃作用2 h,加入抗重组OmpH抗体(1∶500)室温孵育1 h,PBS洗涤3次,加FITG标记的羊抗兔IgG,37 ℃避光孵育30 min,用去离子水清洗后,用荧光显微镜观察OmpH与膜蛋白的结合情况。
2 结 果
2.1 CEF细胞膜蛋白的SDS-PAGE检测结果 制备的CEF细胞膜蛋白样本经SDS-PAGE分离出多种蛋白组分(图1泳道1和2),与刘伟等[15]提取的CEF细胞膜蛋白SDS-PAGE结构基本相似。通过镍离子亲和层析法纯化得到了N端带有6个组氨酸标签的重组OmpH(图1泳道3)。

M:蛋白质分子量标准;1、2:CEF细胞膜蛋白;3:纯化的重组OmpHM:Protein marker;1,2:CEF cell membrane proteins;3:Purified recombinant protein OmpH图1 CEF细胞膜蛋白的SDS-PAGE检测结果Fig.1 SDS-PAGE analysis of CEF cell membrane proteins

M:蛋白质分子量标准;1、2、4、5:CEF细胞膜蛋白;3、6:纯化的重组OmpH M:Protein marker;1,2,4,5:CEF cell membrane proteins;3,6:Purified recombinant OmpH图2 禽巴氏杆菌OmpH受体的配体印迹检测Fig.2 Ligand blot assay to detect receptor for OmpH of avian P.multocida
2.2 OmpH受体的配体印迹检测 配体印迹结果显示,在转印CEF细胞膜蛋白的NC膜上出现一条49 kDa蛋白条带(图2泳道1和2),即能与重组OmpH结合的CEF细胞膜蛋白条带,而重组OmpH与其抗体特异性结合(图2泳道3)。另外,重组OmpH能够与抗6聚组氨酸单克隆抗体结合(图2泳道6),但在转运CEF细胞膜蛋白的NC膜上未见任何印迹条带(图2泳道4和5)。本研究结果表明,在CEF细胞膜蛋白中的49 kDa蛋白条带可能是OmpH受体。
2.3 OmpH受体的MALDI-TOF质谱鉴定 将CEF细胞膜蛋白中的49 kDa蛋白条带切取后,胶内酶解并用于MALDI-TOF质谱鉴定。质谱鉴定结果表明,CEF细胞膜蛋白中的OmpH结合蛋白是ATP合成酶β亚基,与NCBInr数据库已公布的原鸡(Gallusgallus)、爪蛙(Xenopuslaevis)、鲑鱼(Salmosalar)、斑马鱼(Daniorerio)ATP合成酶β亚基的C.I%值均高于97(表1),表明CEF细胞膜蛋白中的OmpH受体可能是ATP合成酶β亚基。
表1 禽巴氏杆菌OmpH受体的MALDI-TOF/TOF质谱鉴定
Tab.1 Identification of OmpH receptor for avianP.multocidaby MALDI-TOF/TOF Mass Spectrometry

ProteinnameAccessionNo.ProteinMW(kDa)ProteinscoreProteinscoreCI%TotalioneCI%ATPsynthasesubunitbeta,mito-chondrialprecursor[Gallusgallus]gi|7189723751.519110097.855MitochondrialATPsynthasebetasubunit[Xenopuslaevis]gi|14822335965.216410097.855ATPsynthaseH+transportingmi-tochondrialF1complexbeta[Salmosalar]gi|19828547754.515310097.855MitochondrialATPsynthasebetasubunit-like[Daniorerio]gi|6677308054.915110097.855ATPsynthasesubunitbeta,mito-chondrialprecursor[Homosapiens]gi|3218939448.114710031.08MitochondrialATPsynthase,H+transportingF1complexbetasub-unit[Lepuseuropaeus]gi|8957402345.114710031.08
2.4 不同宿主食管黏膜细胞膜OmpH受体的配体印迹检测 SDS-PAGE结果显示,CEF细胞膜蛋白结构与鸡食管黏膜细胞膜蛋白结构基本相似(图3泳道1和2),与兔、猪和牛食管黏膜细胞膜蛋白结构有差异(图3泳道3、4和5)。配体印迹结果显示,OmpH分别能与CEF细胞和鸡食管黏膜细胞的49 kDa膜蛋白结合(图3泳道6和7),OmpH也能与兔食管黏膜细胞的52 kDa膜蛋白结合(图3泳道8),但在转印猪或牛食管黏膜细胞膜蛋白的NC膜上未见任何印迹条带(图3泳道9和10),表明OmpH受体可能具有宿主特异性。
2.5 不同宿主食管黏膜细胞膜OmpH受体的ELISA检测 如图4所示,OmpH对CEF细胞、鸡食管黏膜细胞、兔食管黏膜细胞膜蛋白结合的OD值高于猪和牛食管黏膜细胞膜蛋白以及BSA对照组(P<0.01),表明鸡和兔食管黏膜细胞膜蛋白中可能存在OmpH受体。
2.6 不同宿主食管黏膜细胞膜OmpH受体的免疫荧光检测:如图5所示,OmpH对CEF细胞、鸡食管黏膜细胞和兔食管黏膜细胞膜蛋白的结合能力高于猪食管黏膜细胞和牛食管黏膜细胞膜蛋白,表明在鸡和兔食管黏膜膜蛋白中可能存在OmpH受体。
3 讨 论
配体印迹是一种鉴定细胞膜受体的常用方法[13-15]。它是通过SDS-PAGE分离细胞膜蛋白后,转印至硝酸纤维素膜或PVDF膜上,再与相应的配体作用,确定能与配体结合的蛋白条带。本研究采用配体印迹技术从CEF细胞膜蛋白中检测到能够与OmpH结合的49 kDa蛋白条带,通过MALDI-TOF质谱技术将其鉴定为ATP合成酶β亚基。用SDS-PAGE比较了鸡、兔、牛、猪食管粘膜细胞膜蛋白的结构,结果显示SPF鸡食管粘膜细胞膜蛋白的结构与CEF细胞膜蛋白的结构基本相似,与兔、牛和猪食管黏膜细胞膜蛋白的结构有一定的差异,表明不同宿主黏膜细胞膜蛋白组分有明显的差异。为了探讨OmpH受体的宿主特异性,用配体印迹检测OmpH受体在鸡、兔、牛和猪食管黏膜细胞膜蛋白
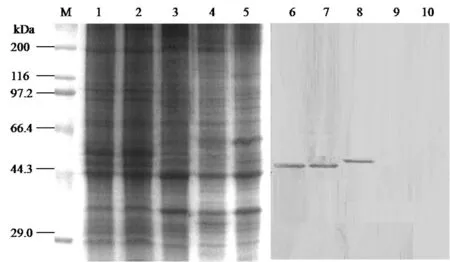
M:蛋白质marker;1、6:CEF细胞;2、7:鸡食管黏膜细胞;3、8:兔食管黏膜细胞;4、9:猪食管黏膜细胞;5、10:牛食管黏膜细胞M:Protein marker;1,6:CEF cells;2,7:Chicken esophageal mucosal cells;3,8:Rabbit esophageal mucosal cells;4,9:Swine esophageal mucosal cells;5,10:Bovine esophageal mucosal cells图3 不同动物食管黏膜细胞膜蛋白的SDS-PAGE和配体印迹检测Fig.3 SDS-PAGE and Ligand blot analysis of membrane proteins from the different animal esophageal mucosal cells

**:Significantly different at P<0.01 when compared to the membrane proteins of cattle esophageal mucosal cells and swine esophageal mucosal cells, as well as BSA (a negative control)图4 不同动物食管黏膜细胞膜OmpH受体的ELISA检测Fig.4 Determination of the binding ability of the OmpH to the membrane proteins of different animal esophageal mucosal cells by ELISA
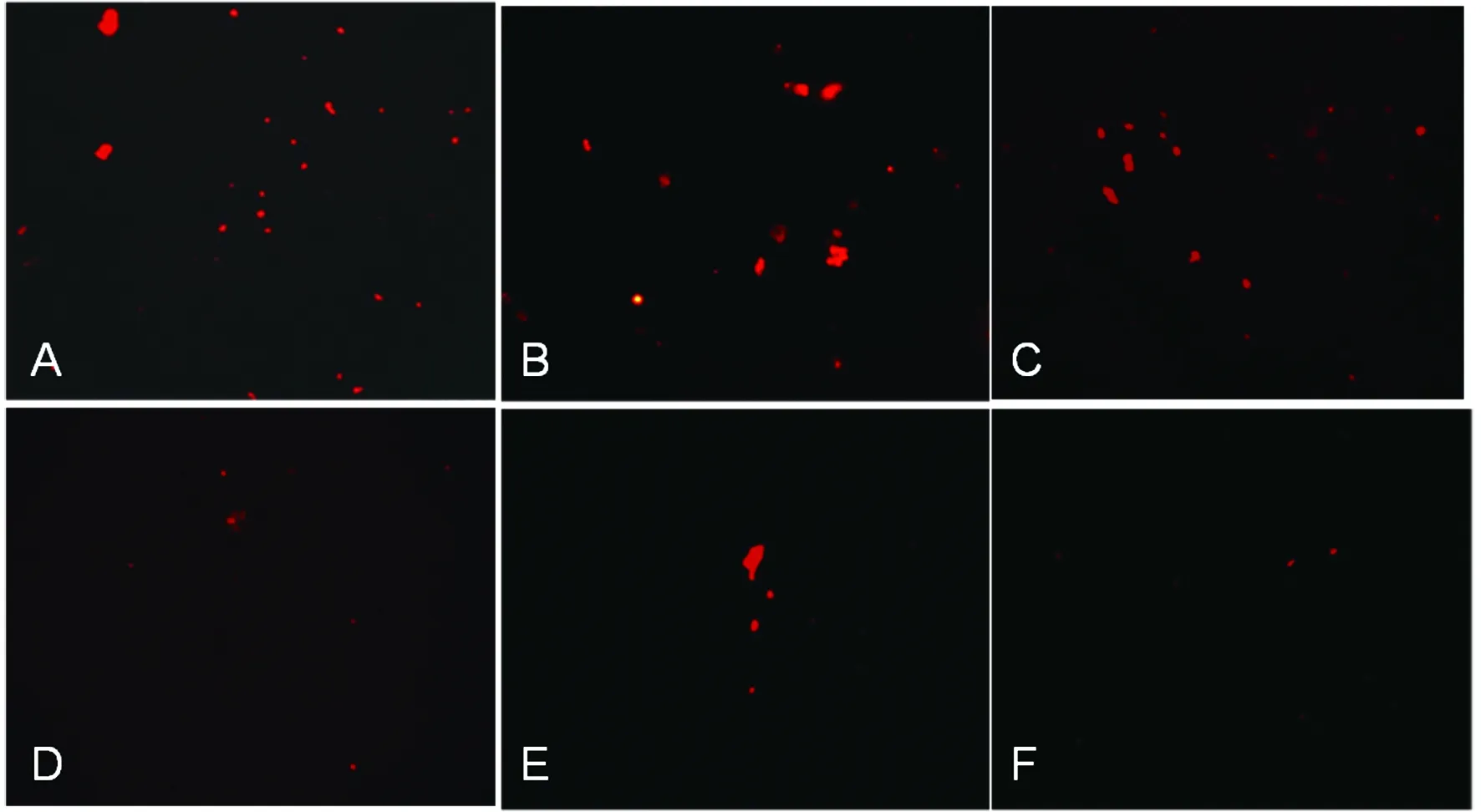
A:CEF细胞;B:鸡食管黏膜细胞;C:兔食管黏膜细胞;D:牛食管黏膜细胞;E:猪食管黏膜细胞;F:牛血清白蛋白A:CEF cells;B:Chicken esophageal mucosal cells;C:Rabbit esophageal mucosal cells;D:Cattle esophageal mucosal cells;E: Swine esophageal mucosal cells;F:Bovine serum albumin 图5 不同动物食管黏膜细胞膜OmpH受体的荧光显微镜观察Fig.5 Observation of by fluorescence microscope of the binding of OmpH to the membrane proteins of different animal esophageal mucosal cells
中的分布情况,结果显示CEF细胞和兔粘膜细胞膜蛋白中检测到能被OmpH所识别和结合的蛋白条带,分子量分别49 kDa和52 kDa,而牛和猪食管黏膜细胞膜蛋白未见任何印迹条带。而间接ELISA和免疫荧光染色结果显示,OmpH对牛和猪食管黏膜细胞膜蛋白的结合能力低于鸡和兔食管黏膜细胞膜蛋白。上述研究结果表明,CEF细胞和鸡黏膜细胞膜蛋白中的ATP合成酶β亚基可能是A型禽巴氏杆菌黏附蛋白OmpH的受体,且该受体具有宿主特异性。
F1F0-ATP合成酶(F1F0-ATP synthase)是定位于真核细胞线粒体上的多亚单位复合酶分子,主要由脂溶性的F0和水溶性的F1两个亚单位组成。F1的亚基构成及比例为α3β3γδε,其中α/β亚基成对存在,催化由ADP到ATP的合成。ATP合成酶的催化活性部位在F1的β亚基上,3个β亚基轮流执行催化。Das等[16]从人肿瘤细胞A549的细胞膜中首次发现ATP合成酶β亚基(hATP5B),纯化的hATP5B能够与NK细胞和具有白介素2活性的LAK细胞的细胞膜结合,且抑制了这些淋巴细胞对人肿瘤细胞K562和A549的细胞毒性作用。后来国内外学者从多种肿瘤细胞膜和肿瘤血管内皮细胞膜中发现ATP5B,它是血管抑素(Angiostatin)的受体,而血管抑素是通过与肿瘤细胞膜或血管内皮细胞膜上的ATP5B结合来抑制肿瘤细胞的增殖和迁移,从而发挥其抗肿瘤活性[17-19]。
从上述血管抑素对肿瘤血管内皮细胞和肿瘤细胞膜ATP合成酶酶活力的抑制作用,以及A型禽巴氏杆菌感染鸡后出现出血性败血症的临床症状,可以推测OmpH通过与鸡血管内皮细胞膜表面的ATP合成酶β亚基结合来抑制ATP合成酶的酶活性,从而导致机体的一系列病理过程,直至血管内皮细胞的死亡以及血管的破裂出血。所以,进一步研究禽巴氏杆菌黏附蛋白OmpH和CEF细胞膜ATP合成酶β亚基(受体)的相互作用及其致病机理,将可为禽巴氏杆菌病的预防和治疗提供重要的线索。
[1] Rhoades KR, Rimler RB. Capsular groups ofPasteurellamultocidaisolated from avian hosts[J]. Avian Dis, 1987, 31(4):895-898.
[2] Myint A, Carter GR, Jones TO. Prevention of experimental haemorrhagic septicaemia with a live vaccine[J]. Vet Rec, 1987, 120(21):500-501.
[3] Avakian AP, Dick JW, Derieux WT. Fowl cholera immunity induced by various vaccines in broiler minibreeder chickens determined by enzyme-linked immunosorbent assay[J]. Avian Dis, 1989, 33(1):97-102.
[4] Wizemann TM, Adamou JE, Langermann S. Adhesins as targets for vaccine development[J]. Emerg Infect Dis, 1999, 5(3):395-403.
[5] Hatfaludi T,Al-Hasani K,Boyce JD, et al. Outer membrane proteins ofPasteurellamultocida[J]. Vet Microbiol, 2010, 144(1/2):1-17. DOI: 10.1016/j.vetmic.2010.01.027
[6] Borrathybay E,Sawada T,Kataoka Y,et al. A 39 kDa protein mediates adhesion of avianPasteurellamultocidato chicken embryo fibroblast cells[J]. Vet Microbiol, 2003, 97(3/4):229-243.
[7] Borrathybay E, Sthitmatee N, Suzuki K, et al. Molecular characterization of an adhesive protein ofPasteurellamultocidastrain P-1059 and its variant strain P-1059B[J]. Bull Nippon Vet Life Sci Univ, 2008, 57:90-99.
[8] Sthitmatee N,Numee S,Kawamoto E,et al. Protection of chickens from fowl cholera by vaccination with recombinant adhesive protein ofPasteurellamultocida[J]. Vaccine, 2008, 26(19):2398-2407. DOI: 10.1016/ j.vaccine.2008.02.051
[9] Borrathybay E, Peng QZ, Yan F, et al. Cross protective effect of the Cp39 adhesive proteins against avianPasteurellamulticidain mice[J]. Acta Microbiologica Sinica, 2010, 50(3):360-366. (in Chinese)
恩特马克·布拉提白, 彭清忠, 严芳, 等. 禽多杀性巴氏杆菌粘附蛋白Cp39的交叉保护作用[J]. 微生物学报, 2010, 50(3):360-366.
[10] Nazierbieke W,Zhang Y,Gong F, et al. Construction and characterization of OmpH gene knockout mutant of avianPasteurellamultocidaC48-3[J]. Acta Microbiologica Sinica, 2013, 53(1):66-73. (in Chinese)
吾鲁木汗·那孜尔别克, 张宇凤, 龚凤娟, 等. 禽多杀性巴氏杆菌C48-3株ompH基因敲除突变株的构建及其生物学功能[J]. 微生物学报, 2013, 53(1):66-73.
[11] Sthitmatee N, Kataoka Y,Sawada T. Inhibition of capsular protein synthesis ofPasteurellamultocidastrain P-1059[J]. J Vet Med Sci, 2011, 73(11):1445-1451.
[12] Wei D, Nazierbieke W, Duan SX, et al. Role of outer membrane protein H in the pathogenesis of avianPasteurellamulticidastrain C48-3[J]. China Biotechnol, 2014, 34(6):31-39. (in Chinese)
韦东, 吾鲁木汗·那孜尔别克, 段世雄, 等. 禽多杀性巴氏杆菌C48-3株外膜蛋白H的致病作用[J]. 中国生物工程杂志, 2014, 34(6):31-39.
[13] Mullen LM,Nair SP,Ward JM,et al. Novel adhesin fromPasteurellamultocidathat binds to the integrin-binding fibronectin FnIII9-10 repeats[J]. Infect Immun, 2008, 76(3):1093-1104.
[14] Moser TL,Enghild JJ,Pizzo SV,et al. The extracellular matrix proteins laminin and fibronectin contain binding domains for human plasminogen and tissue plasminogen activator[J]. J Biol Chem, 1993, 268(25): 18917-18923.
[15] Liu W, Ding Z, Xuan H, et al. Identification of Newcastle disease virus receptor on natural host cell membrane[J]. Chin J Biologicals, 2008, 21(8):651-653. (in Chinese)
刘伟, 丁状, 宣华, 等. 新城疫病毒自然宿主细胞膜受体的鉴定[J]. 中国生物制品学杂志, 2008, 21(8):651-653.
[16] Das B,Mondragon MO,Sadeghian M,et al. A novel ligand in lymphocyte-mediated cytotoxicity: expression of the beta subunit of H+ transporting ATP synthase on the surface of tumor cell lines[J]. J Exp Med, 1994, 180(1): 273-281.
[17] Arakaki N,Nagao T,Niki R,et al. Possible role of cell surface H+-ATP synthase in the extracellular ATP synthesis and proliferat ion of human umbilical vein endothelial cells[J]. Mol Cancer Res, 2003, 1(13):931-939.
[18] Chi SL,Wahl ML,Mowery YM,et al. Angiostatin-like activity of a monoclonal antibody to the catalytic subunit of F1F0 ATP synthase[J]. Cancer Res, 2007, 67(10):4716-4724.
[19] Zhang X, Peng Y, Yu LL, et al. Preparation and anti-tumor activity of mouse monoclonal antibody against human F1-F0 ATP synthase beta subunit[J]. Chin J Immunol, 2008, 24(11):984-988. (in Chinese)
张霞, 彭艳, 俞丽丽, 等. 抗人F1-F0 ATP合成酶beta亚基单抗的制备及其抗肿瘤活性研究[J]. 中国免疫学杂志, 2008, 24(11):984-988.
Preliminary identification of the outer membrane protein H receptors of avianPasteurellamultocida
NAZIERBIEKE Wulumuhan1,2, WEI Dong2, BORRATHYBAY Entomack1,2, XIAO Di3
(1.CollegeofBiologicalandGeographySciences,YiliNormalUniversity,Yining835000,China;2.CollegeofBiologyandEnvironmentalSciences,JishouUniversity,Jishou416000,China;3.NationalInstituteforCommunicableDiseaseControlandPrevention,ChineseCenterforDiseaseControland
Prevention,Beijing102206,China)
To identify the receptors for the outer membrane protein H (OmpH) of avianP.multocida, the membrane proteins of chicken embryo fibroblast (CEF) cells were separated by SDS-PAGE and analyzed by Ligand blot. The OmpH-binding protein was identified by MALDI-TOF mass spectrometry, and its distribution in the membrane proteins of different host esophageal mucosal cells was detected by Ligand blot, ELISA and immunofluorescence microscopy, respectively. Ligand blot analysis showed that a 49-kDa membrane protein of CEF cells bound to recombinant OmpH, and MALDI-TOF spectral results demonstrated that the OmpH-binding protein was ATP synthase β subunit. In addition, the OmpH receptor was present in the chicken and rabbit mucosal cell membranes, but was not detected in the bovine and swine mucosal cell membranes. The above results indicate that the OmpH receptor may be CEF cell-derived ATP synthase beta subunit.
avianPasteurellamultocida; OmpH; receptor; ATP synthase beta subunit
Borrathybay Entomack, Email: 1632984092@qq.com
10.3969/j.issn.1002-2694.2017.01.002
国家自然科学基金项目(No. 31360613)资助
恩特马克·布拉提白,Email: 1632984092@qq.com
1.伊犁师范学院生物与地理科学学院,伊宁 835000; 2.吉首大学生物资源与环境科学学院,吉首 416000; 3.中国疾病预防控制中心传染病预防控制所,北京 102206
R378
A
1002-2694(2017)01-0009-06
2016-05-30 编辑:李友松
Supported by the National Natural Science Foundation of China (No.31360613)
