外源过氧化物酶在毕赤酵母中的优化表达
2017-02-15杨静吴慧潘一展
杨静+吴慧+潘一展

摘要:为提高外源过氧化物酶基因在毕赤酵母中的表达量,对甲醇毕赤酵母诱导表达培养基进行优化,在培养基中添加0.5 g/L高铁血红素,每12 h补加100%甲醇至终浓度为0.5%,待酵母生长量达到最大值时加入0.5 mL/L微量元素混合物。结果表明,优化后培养基表达量是普通培养基的10.6倍,研究为后期外源蛋白进入发酵罐生产提供了理论依据。
关键词:过氧化物酶基因;毕赤酵母;优化培养基;血红素;微量元素
中图分类号:Q814文献标志码:
文章编号:1002-1302(2016)08-0051-02
近年来,酶工程在生物技术领域得到很大发展,过氧化物酶被应用于疾病诊断及治疗、农作物品种选育及病虫害防治、染料中脱色剂生产[1]、有机物和聚合物合成[2]、农业废弃物处理[3]等领域。但是,天然酶在开发和应用中受到一定限制。本研究采用基因重组技术生产酶,研究外源萝卜过氧化物酶在甲醇毕赤酵母中的表达,旨在探讨高表达量的优化培养条件。
1材料与方法
1.1材料
菌株:野生型毕赤酵母GS115(GS115)及商丘学院风景园林学院实验室构建的转萝卜过氧化物酶基因(RsPrxl)型毕赤酵母GS115(GSRP25)均由该实验室保存。
培养基 YPD、BMGY/BMMY组成和配制参见 Invitrogen 公司毕赤酵母操作手册。
1.2方法
1.2.1菌种活化挑取菌株 GSRP25在 YPD上进行平板划线培养,分离后,挑取单菌落进行优化诱导培养。
1.2.2转基因酵母的诱导表达培养挑取2个GSRP25单菌落分别接种于200 mL BMGY培养基中,pH值7.4、26 ℃、0.5%甲醇、225 r/min条件下培养[4]。待D600 nm达到2~3时,静置,收集菌体分别重悬于20 mL BMMY中和含有0.5 g/L血红素[5]的20 mL BMMY中培养,每12 h补加甲醇至终浓度为 0.5%,80~90 h间酵母生长量达到最大值,此刻向培养基中加入0.5 mL/L微量元素混合物(0.5 g/L MgCl2,30 g/L FeCl2·6H2O,1 g/L ZnCl2·4H2O,0.2 g/L CoCl2·6H2O,1 g/L Na2 MoO4·2H2O,0.5 g/L CaCl2·2H2O,1 g/L CuCl2和0.2 g/L H2BO3)[6]继续培养。
1.2.3各项指标的测定每12 h取1 mL菌液,4 ℃、10 000 r/min 离心20 min,取上清,测D600 nm;采用愈创木酚法[7]测过氧化物酶(POD)活性;采用Bradford的微量法[8]测定可溶性蛋白含量,以小牛血清白蛋白作标准曲线。
1.2.4表达产物聚丙烯酰胺凝胶电泳(SDS-PAGE)检测POD同工酶活性电泳采用垂直板聚丙烯酰胺不连续凝胶电泳方法,凝胶采用Lopes等的方法[9]制备,电泳后POD用联苯胺染色[10]。用天能GIS-1000凝胶成像和分析系统拍照分析。
2结果与分析
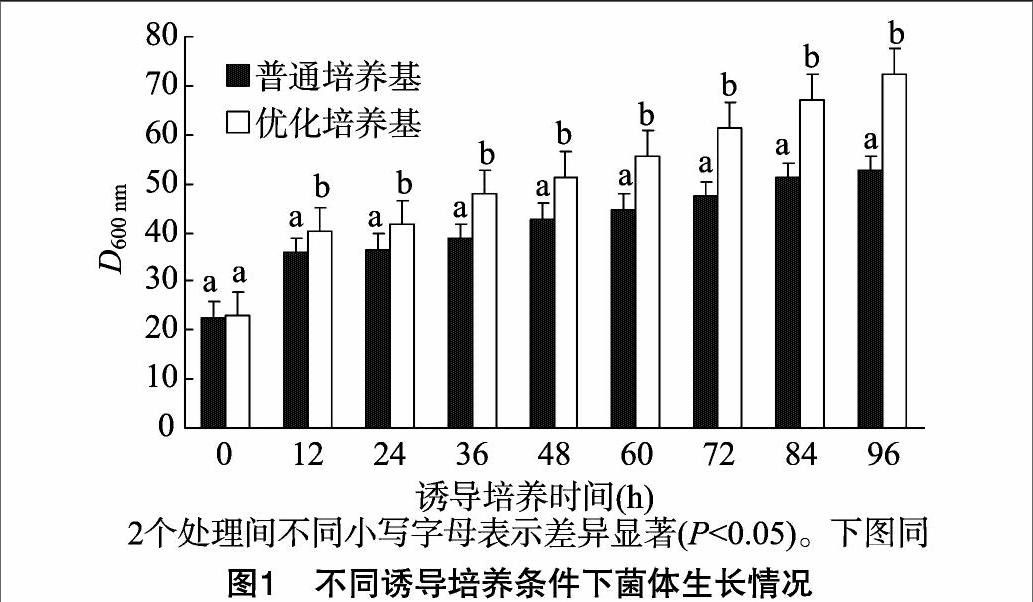
2.1不同诱导培养条件下菌体生长状态
D600 nm代表菌株生长速度,由图1可知,在2种培养条件下,D600 nm随时间的延长都有所增加,说明酵母生长比较稳定;但从60 h开始,普通培养基培养的酵母生长速度缓慢,而优化培养基培养的酵母生长速度开始加快;96 h取样检测发现,D600 nm达到72.3,比普通培养基培养的酵母增加了近37%。
2.2POD活性的变化
由圖2可见,优化培养基中POD的活性显著高于普通培养基。转基因酵母GSRP25在普通诱导培养基条件下,随着培养时间延长,外源POD的表达量增加不明显,在培养72 h后趋于稳定。在优化后的诱导表达培养基培养下,随着培养时间延长,外源POD活性显著增加,在培养72 h后也慢慢趋于稳定,培养96 h酶活性达到最大值,为 30.9 U/mL,是普通BMMY培养基酶活性的5.9倍;且在培养12 h时,酶活性为4.7 U/mL,几乎达到普通培养基培养的最大酶活量,说明优化后的诱导表达培养基对酶活性的表达有显著提高作用。
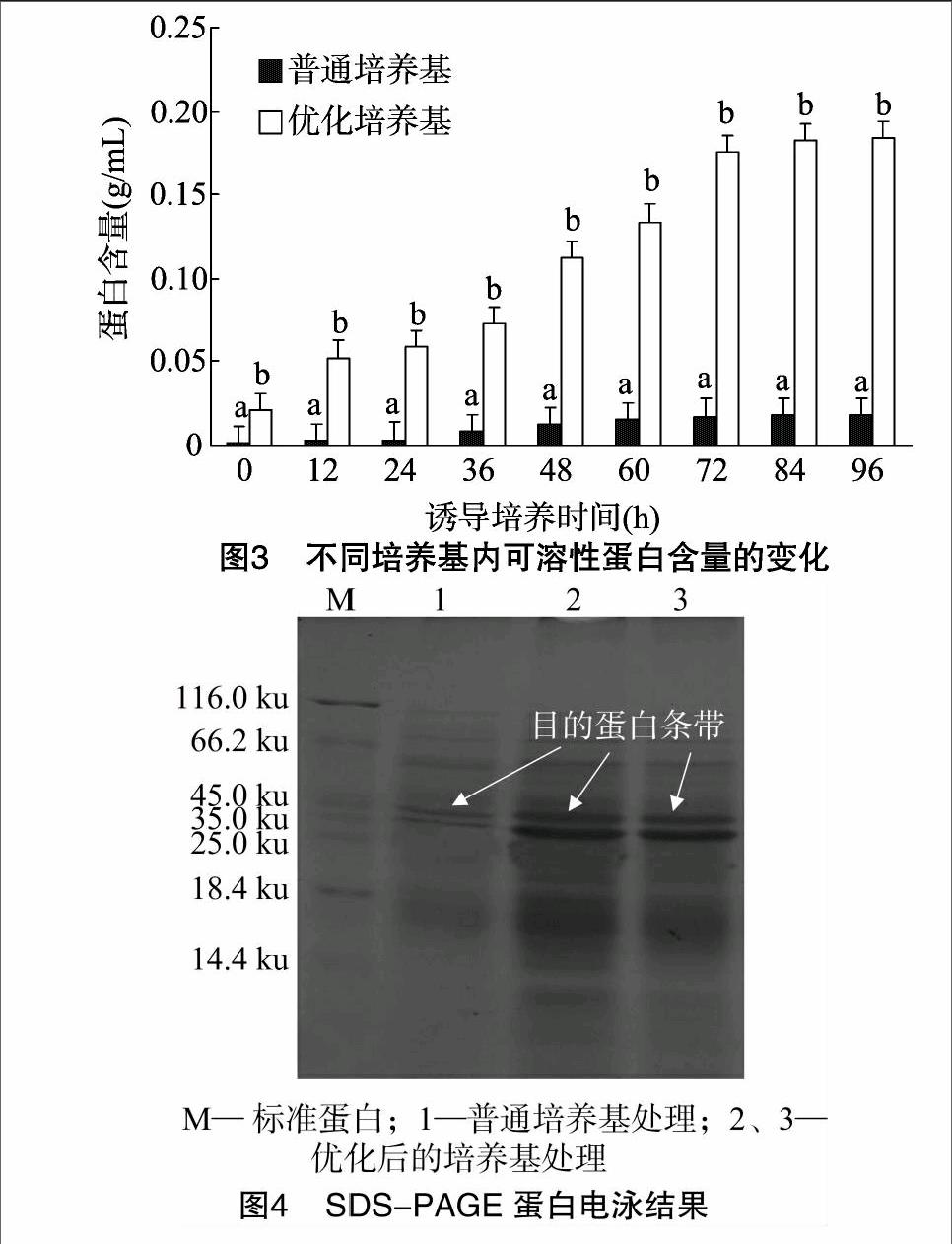
2.3可溶性蛋白含量变化
巴斯德毕赤酵母作为外源基因表达的酵母宿主,自身分泌的蛋白非常少,外源POD的表达量可以用培养基上清中蛋白含量来衡量。由图3可知,在普通BMMY培养基条件下,外源蛋白的表达量很低,培养96 h后蛋白含量只有 0.018 g/mL;而优化BMMY培养基培养的外源蛋白表达量很高,培养36 h后蛋白含量迅速增加,培养72 h后蛋白表达量趋于稳定,培养96 h时蛋白表达量达到最大值,为 0.18 g/mL,约是普通 BMMY 培养基表达量的10倍。说明优化BMMY培养基显著提高了外源POD蛋白的表达量。
2.4SDS-PAGE检测目的蛋白
已知目的蛋白的分子量约37 ku,由图4可见,优化后培养基培养目的蛋白的条带比普通培养基培养的目的蛋白条带粗、颜色深,说明优化后的培养基诱导表达的蛋白量明显增多。
3结论与讨论
纵观近年来的文献报道,提高外源蛋白在巴斯德毕赤酵母中表达量主要有2种途径,一是优化诱导表达的时间、温度、pH值、摇床转速、通氧量、添加微量元素等,如RsPHGPx在1%甲醇、pH值6、28 ℃条件下诱导60 h后得到最大表达量,产率约为102 mg/L[11]。本研究结果与文献报道一致,在0.5%甲醇、pH值7.4、26 ℃、通气面积1.5 cm2、225 r/min 条件下,有利于萝卜过氧化物酶RsPrx1表达。二是结合外源目的蛋白自身的结构特点,利用适合外源蛋白合成的某些诱导剂可以提高重组蛋白的表达量[12]。POD蛋白分子的活性中心含Fe(Ⅲ)-原卟啉Ⅸ(血红素)辅基,只有在辅基存在的条件下,酶才被称为全酶,具有活性。所以血红素是组成POD分子的必需基团,在一定程度上增加血红素含量,有助于辅基卟啉含量的增加,从而促进POD合成。Gu等报道,利用甲醇毕赤酵母GS115表达外源锰过氧化物酶时,在培养基中添加0.5 g/L血红素,锰过氧化物酶的表达量增加[5]。有报道表明,在添加0.5 g/L高铁血红素的培养基中,锰过氧化物酶在曲霉菌中的表达量增加[13]。Conesa等研究证实,用曲霉菌表达锰过氧化物酶,在培养基中加入0.5 g/L血红素,过氧化物酶的产量达到100 mg/L[14]。以上研究为本研究中添加0.5 g/L高铁血红素提供一定的理论依据。另外,无机盐或矿物质元素在微生物生长过程中提供了各种重要元素,在配制酵母诱导表达培养基时添加必要的微量元素,有助于酵母生长。其中Fe是目的蛋白POD的分子成分,Na+维持渗透压,Mg2+、Cu2+、Zn2+、Mn2+可以作为酶的激活剂[15]。表达系统中含有适量的Mg2+、K+、NH+4、Ca2+有利于降低蛋白质合成中的错读[16]。因此在本研究中,在优化诱导培养基中添加了各种微量元素。结合以上理论依据,本研究从培养条件、培养基成分入手进行改良,结果表明,在BMMY培养基中添加0.5%甲醇、0.5 g/L高铁血红素、0.5 mL/L微量元素,获得的酶活性达30.9 U/mL,是普通培养基的5.9倍,说明优化后的诱导表达培养基有效提高了外源蛋白的表达量。
参考文献:
[1][JP3]An S Y,Min S K,Cha I H. Decolorization of triphenylmethane and azodyes by Citrobacter sp.[J]. Biotech Lett,2002,24(12):1037-1040.
[2]Lim Y H,An A S,Song B K. Polymerization of cardanol using soybean peroxidase and its potential application as anti-biofilm coating material[J]. Biotech Lett,2003,25(18):1521-1524.
[3]赵红霞,杨建军,詹勇. 白腐真菌在秸秆作物资源开发中的研究[J]. 饲料工业,2002,23(11):40-42.
[4]王一帆,李芳军,杨静,等. 转萝卜过氧化物酶基因毕赤酵母株系培养条件的优化[J]. 生物技术通报,2010(4):203-206.
[5]Gu L,Lajoie C,Kelly C. Expression of a Phanerochaete chrysosporium manganese peroxidase gene in the yeast Pichia pastoris[J]. Biotechnology Progress,2003,19(5):1403-1409.
[6]Kristensen B K,Bloch H,Rasmussen S K. Barley coleoptile peroxidases. Purification,molecular cloning,and induction by pathogens[J]. Plant Physiology,1999,120(2):501-512.
[7]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:246-247.[ZK)][HJ]
[HT8.]
[8]Gazaryan I G,Lagrimini L M,Ashby G A,et al. Mechanism of indole-3-acetic acid oxidation by plant peroxidases:anaerobic stopped-flow spectrophotometric studies on horseradish [JP3]and tobacco peroxidases[J]. The Biochemical Journal,1996,313(3):841-847.
[9][JP3]Lopes T S,Hakkaart G J,Koerts B L,et al. Mechanism of high-copy-number integration of pMIRY-type vectors into the ribosomal DNA of Saccharomyces cerevisiae[J]. Gene,1991,105(1):83-90.[ZK)]
[10]胡能书,万贤国. 同工酶技术及其应用[M]. 长沙:湖南科学技术出版社,1985:58-61.
[11]李洋,李晖,祝建波,等. 重组萝卜磷脂氢谷胱甘肽过氧化物酶在毕赤酵母优化表达初步纯化与鉴定[J]. 中国生物工程杂志,2010,30(4):54-59.
[12]张毅,屈贤铭,杨胜利. 乳糖作为诱导剂对重组目的蛋白表达的影响[J]. 生物工程学报,2000,16(4):464-468.
[13]Stewart P,Whitwam R E,Kersten P J,et al. Efficient expression of a Phanerochaete chrysosporium manganese peroxidase gene in Aspergillus oryzae[J]. Applied and Environmental Microbiology,1996,62(3):860-864.
[14]Conesa A,van den Hondel C A,Punt P J. Studies on the production of fungal peroxidases in Aspergillus niger[J]. Applied and Environmental Microbiology,2000,66(7):3016-3023.
[15][JP3]周德慶. 微生物学教程[M]. 北京:高等教育出版社,1993:82-86.
[16]许崇利,杨梅,许崇波. 大肠杆菌表达系统的影响因素[J]. 中国动物检疫,2010,27(8):66-68.
[FQ)]
