拮抗菌JS-8对‘台农’芒果贮藏品质及保护酶活性的影响
2017-02-15井敏敏田亚琴邵远志
井敏敏,田亚琴,邵远志
(海南大学 食品学院,海南 海口,570228)
拮抗菌JS-8对‘台农’芒果贮藏品质及保护酶活性的影响
井敏敏,田亚琴,邵远志*
(海南大学 食品学院,海南 海口,570228)
以‘台农’芒果为实验材料,研究了不同浓度Burkholderiasp.的拮抗菌JS-8对芒果采后品质的影响,并对果实进行伤口接种,测定多酚氧化酶(polyphenol oxidase, PPO)、过氧化物酶(peroxidase, POD)、苯丙氨酸解氨酶(phenylalnine ammonialyase, PAL)、几丁质酶(chitinase , CHI)、β-1,3葡聚糖酶(β-1,3-glucanase , GLU)五种保护酶活性。结果表明:107CFU/mL JS-8处理可以较好地维持芒果果实色泽,延缓果实硬度的下降以及可溶性固形物的升高,并且抑制果实可滴定酸以及抗坏血酸含量的下降,有利于维持果实品质,延长贮藏时间;且JS-8对果实的PPO、POD、PAL、CHI、GLU均具有一定的诱导作用,病原菌Cladosporiumcladosporioides与JS-8在对PPO、POD、CHI、GLU的诱导作用中具有协同作用。
台农芒果;拮抗菌;品质;酶活性
芒果“露水斑病”(Cladosporiumcladosporioides)是近几年来在海南芒果产区爆发的新的病害,该病害主要在芒果果实表皮形成水渍状病斑,严重降低了芒果果实品质,对芒果整个产业的发展造成严重影响。现阶段对于该病害防治的报道很少,杨永利等[1]从30种杀菌剂中筛选出了抑菌效果较好的7种杀菌剂:多抗霉素B、吡唑醚菌酯、多菌灵、咪酰胺、苯醚甲环唑、苯甲丙环唑、溴菌腈。王赛格等[2]对9种单剂进行了复配增效配比筛选,发现吡唑醚菌酯与丙环唑以1 ∶4 的配比、咪酰胺与多抗霉素B 以2∶3 的配比时对Cladosporiumcladosporioides抑制效果最明显。目前生物防治技术以对环境以及人类无毒无害、对病原菌不产生抗药性、拮抗效果好而成为研究热点,其中拮抗菌是生物防治研究的重点,但在芒果“露水斑病”的防治上没有报道。拮抗菌的生物防治机理主要包括营养和空间竞争、寄生作用、产生杀菌物质、诱导抗病性[3]。研究发现,拮抗菌可以诱导果蔬抗病能力的提高,是拮抗菌生物防治的重要作用之一[4]。如多酚氧化酶(PPO)氧化酚类物质可产生高毒性醌类物质对入侵的病原菌具有毒杀作用[5];过氧化物酶(POD)是果蔬组织中一种重要的氧化还原酶,与果蔬的生长发育、成熟与衰老、抗病性、抗氧化、抗逆境胁迫有密切关系[6],并且可以促进木质素与植物保卫素(PA)的合成[7];苯丙氨酸解氨酶(PAL)是丙烷类代谢途径的关键酶与限速酶,参与植物木质素、酚类以及PA等抗冰物质的合成,与果蔬抗病性密切相关[8];几丁质酶(CHI)与β-1,3葡聚糖酶(GLU)能够将解病原菌细胞壁中的几丁质以及β-1,3葡聚糖,导致病原菌细胞破裂从而杀死病原[9]。JS-8是本实验室从芒果果园土壤中分离出的一株对Cladosporiumcladosporioides有较强的拮抗作用的菌株Burkholderiasp.。本实验研究了不同浓度的拮抗菌JS-8对台农芒果果实品质的影响,并通过测定PPO、 POD、 PAL、 CHI、 GLU酶活性的变化情况,探讨拮抗菌JS-8对芒果果实保护酶活性的影响,为芒果“露水斑病”的生物防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 芒果果实
摘自海南省东方市芒果园,品种为台农,七成熟,采摘当天运回实验室进行处理。
1.1.2 拮抗菌
实验室从海南昌江芒果园芒果根系土壤中分离筛选出的拮抗菌JS-8。
1.1.3 致病菌
枝状芽枝霉(Cladosporiumcladosporioides):实验室从芒果“露水斑病”发病果实中分离,并通过形态特征以及ITS分析鉴定。
1.1.4 培养基
LB培养基:酵母膏10.0 g,蛋白胨10.0 g,NaCl 5.0 g,蒸馏水1 000 mL,pH 7.2。马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1 000 mL,pH自然。
1.1.5 仪器与设备
Shimadzu spectrophotometer UV-1800,岛津企业管理(中国)有限公司;TG16KR台式高速冷冻离心机,长沙东旺实验仪器有限公司;FYL-YS-280L型恒温箱,北京福意电器有限公司;NRY-211恒温培养摇床,上海南荣实验室设备有限公司;AL-204电子天平,梅特勒-托利多仪器(上海)有限公司;ZEALWAYGR60DA高压灭菌器,厦门致微仪器有限公司;Nikon ECLIPSE Ci-s/Ci-L显微镜,南京衡桥仪器有限公司。
1.2 方法
1.2.1 拮抗菌发酵原液的制备
挑取经活化后的拮抗菌JS-8于500 mL装有200 mL LB培养基的锥形瓶内,在28 ℃条件下200 r/min摇床培养24 h,并用无菌水配制成107、108、109CFU/mL的菌悬液。
1.2.2 病原菌孢子悬浮液制备
将枝状芽枝霉(Cladosporiumcladosporioides)接于PDA培养基上28 ℃培养5 d后,用无菌水冲洗孢子,经10 000 r/min下离心20 min,弃上清液,用无菌蒸馏水重悬,采用血球计数板法调节孢子浓度为106CFU/mL。
1.2.3 果实品质测定样品处理
选取大小一致、外观无机械损伤、成熟度一致的新鲜芒果,分为4组,分别浸泡于浓度为107、108、109CFU/mL的拮抗菌悬液中10 min,以无菌水为对照。晾干后装于厚度为0.01 mm的保鲜袋中,于25 ℃下保湿贮藏。实验重复3次。
1.2.4 果实品质指标的测定
果实色泽测定:用CM-700d分光测色计测定果实表皮的a*值[10]。
果实硬度测定:采用FHM-1硬度计进行测定[11]。
可溶性固形物TSS测定:采用N-1α型手持折光仪进行测定[12]。
可滴定酸测定:参照郝建军[13]等人的酸碱滴定法。
VC含量测定:采用2,6-二氯酚靛酚滴定法[14]。
1.2.5 果实病程相关酶活性测定
将芒果分为4组,用灭菌打孔器在果实赤道处打取直径4 mm深度3 mm的伤口,分别进行以下处理:CK组:果实刺伤接种20 μL无菌水;A组:只接种20 μL 108CFU/mL的拮抗菌悬液;B组:接种20 μL 108CFU/mL的拮抗菌悬液,2 h后接种20 μL浓度为104CFU/mL的病原菌悬液;C组:只接种20 μL浓度为104CFU/mL的病原菌悬液。各处理装于厚度为0.01 mm的保鲜袋中,于25 ℃下保湿贮藏。实验重复3次。
多酚氧化酶(PPO)活性采用邻苯二酚法进行测定[15],以每分钟反应体系在波长398 nm处OD值上升0.01为1个酶活力单位(U);过氧化物酶(POD)活性采用愈创木酚法进行测定[16],以每分钟反应体系在波长470 nm处OD值上升0.01为1个酶活力单位(U);苯丙氨酸解氨酶(PAL)活性参照ASSIS等[17]的方法,以每分钟反应体系在290 nm处OD值上升0.001为1个酶活性单位(U);几丁质酶(CHI)活性采用曹建康等[18]的方法,以每秒每克果实组织中的酶分解胶状几丁质所产生的 1×10-9molN-乙酰葡萄糖胺作为1个酶活力的单位(U);β-1,3葡聚糖酶(GLU)活性采用MAUCH等[19]的方法,以每秒每克果实组织中的酶分解昆布多糖产生的1×10-9mol葡萄糖作为1个酶活力的单位(U)。
1.3 数据处理与分析
实验数据采用SPSS Statistics 17.0软件进行统计,并采用ANOVA 进行Duncan多重差异分析。
2 结果与分析
2.1 拮抗菌对芒果果实品质的影响
2.1.1 拮抗菌处理对芒果色泽的影响
色泽是判断果实成熟度以及果实品质的重要指标之一,a*值表示红绿值,由负值到正值表示果皮颜色由绿色到红色或黄色转变。由图1可以看出,随着处理天数的增加,处理组与对照组a*值均由负值到正值呈上升趋势,第8天经浓度为107、108、109CFU/mL拮抗菌处理的芒果a*值明显低于对照组(P<0.05),且经107CFU/mL拮抗菌处理组a*值最低。至处理12 d之后各处理间差异逐渐减小,第16、20天经108、109CFU/mL拮抗菌处理的芒果a*值无显著性差异,但经107CFU/mL拮抗菌处理的A组芒果a*值明显低于对照组(P<0.05)。说明不同浓度的拮抗菌处理有利于芒果后期的贮运,并且以107CFU/mL浓度为最佳。

CK-无菌水;A-107 CFU/mL;B-108 CFU/mL; C-109 CFU/mL图1 拮抗菌对芒果果实a*值的影响Fig.1 Effect of antagonist bacterial treatment on the value of a*
2.1.2 拮抗菌处理对芒果硬度的影响
由图2可以看出芒果果实的硬度随处理时间的延长呈下降趋势,对照组果实硬度一直低于拮抗菌处理组,第8天后对照组硬度迅速下降,经107CFU/mL拮抗菌处理的A组果实硬度下降最缓慢,各处理间存在显著性差异(P<0.05)。处理第12天,A组果实硬度为0.68 kg/cm2,是对照组的1.43倍,且不同浓度拮抗菌处理各组果实的硬度值均高于对照组。说明拮抗菌的处理可显著抑制芒果果实软化,其中以浓度为107CFU/mL效果最显著。
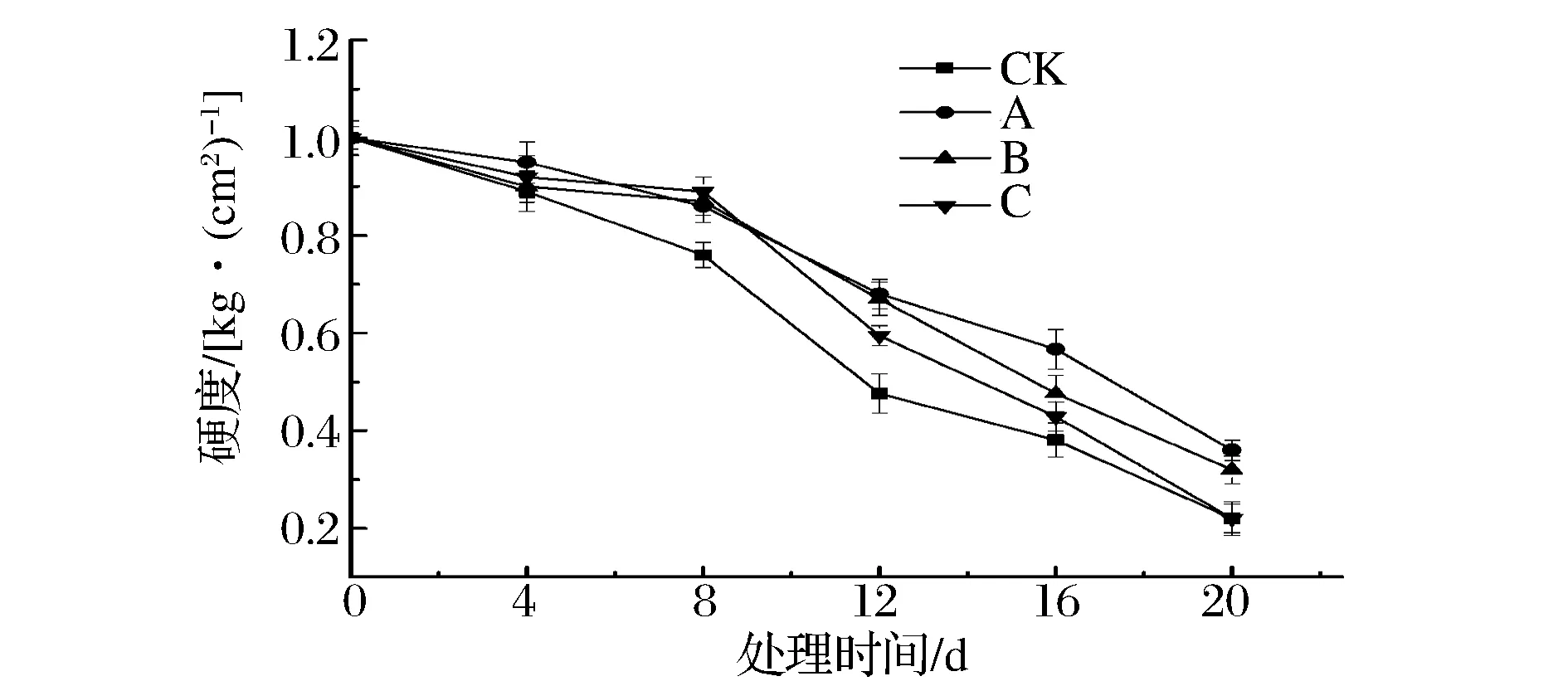
CK-无菌水;A-107 CFU/mL;B-108 CFU/mL; C-109 CFU/mL图2 拮抗菌对芒果果实硬度的影响Fig.2 Effect of antagonist bacterial treatment on the firmness of mango fruit
2.1.3 拮抗菌处理对芒果可溶性固形物的影响
可溶性固形物是衡量果实成熟度以及品质的重要指标之一。由图3可以看出,在整个贮藏期各处理组可溶性固形物含量呈先上升后下降趋势,各组均在第16天达到最大值,对照组果实TSS达到18.44%,而107CFU/mL拮抗菌处理的芒果果实TSS最低为16.80%。处理16 d之后对照组果实TSS含量呈下降趋势,而107CFU/mL拮抗菌处理的果实TSS含量略有上升。说明经107CFU/mL拮抗菌处理可抑制果实TSS含量的升高。

CK-无菌水;A-107 CFU/mL;B-108 CFU/mL; C-109 CFU/mL图3 拮抗菌对芒果果实可溶性固形物的影响Fig.3 Effect of antagonist bacterial treatment on the total soluble solid of mango fruit
2.1.4 拮抗菌处理对芒果可滴定酸的影响
可滴定酸是反映果实风味品质的重要指标,其含量随着果实的成熟而下降。由图4可以看出各处理组芒果果实的可滴定酸含量随着处理时间的延长而呈下降趋势,处理前8天各组果实可滴定酸含量无显著差异,第12天经107CFU/mL拮抗菌处理的果实可滴定酸含量显著高于对照组组,但高浓度拮抗菌处理的果实可滴定酸含量显著低于对照组(P<0.05),到第20天,经107CFU/mL拮抗菌处理的果实可滴定酸含量可达13.47%,是对照组的1.89倍。说明,经107CFU/mL拮抗菌处理可显著抑制可滴定酸的下降(P<0.05),有利于芒果果实的贮藏。
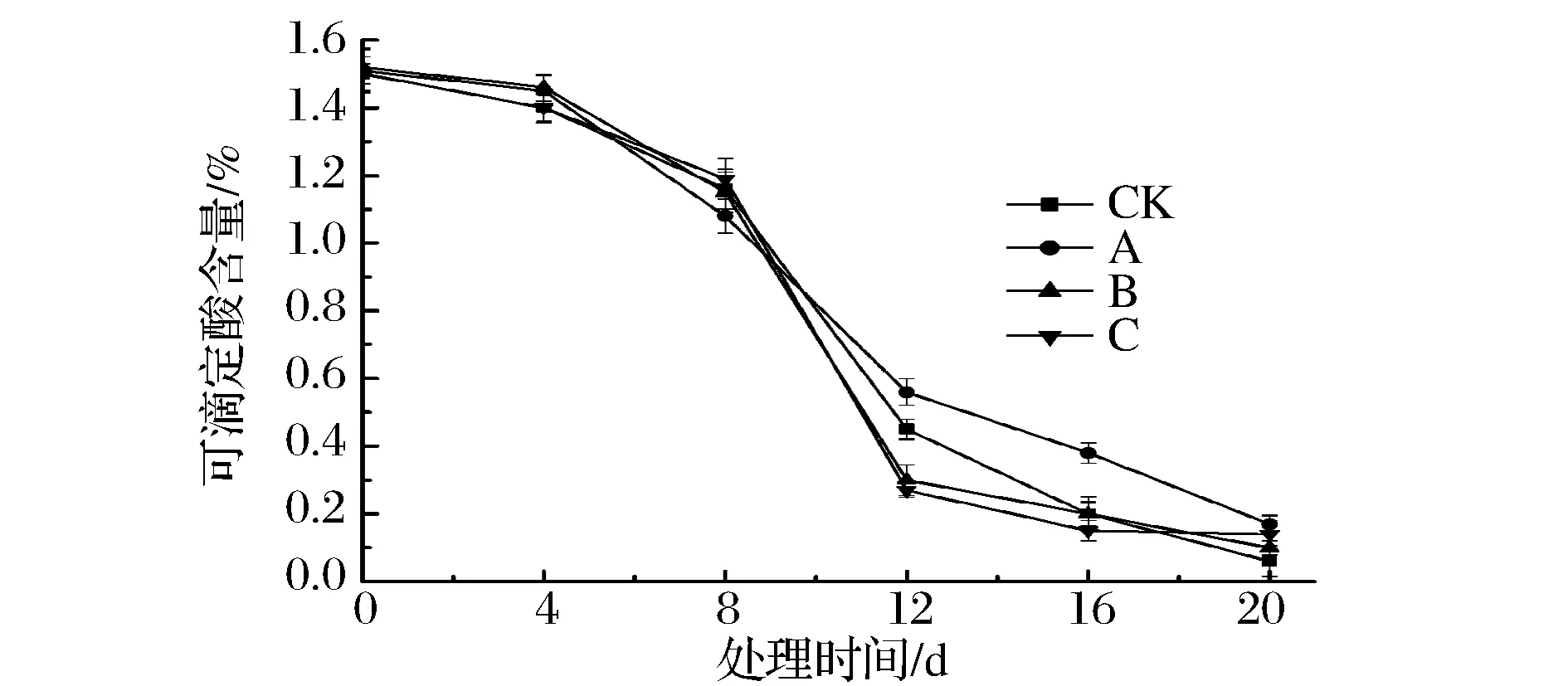
CK-无菌水;A-107 CFU/mL;B-108 CFU/mL; C-109 CFU/mL图4 拮抗菌对芒果果实可滴定酸含量的影响Fig.4 Effect of antagonist bacterial treatment on the titratable acid of mango fruit
2.1.5 拮抗菌处理对芒果VC含量的影响
Vc是芒果重要的营养成分,且具有抗氧化活性,是衡量果实品质的重要指标。由图5可以看出,芒果果实中VC含量呈下降趋势。经107CFU/mL拮抗菌处理的芒果果实VC含量显著高于其他3组(P<0.05),经108、109CFU/mL拮抗菌处理的芒果果实VC含量与对照组无显著差异(P<0.05),并且在处理第12、16、20天,经107CFU/mL拮抗菌处理的芒果果实VC含量分别比对照组高46.33%、 35.65% 、44.46%。由此可见,107CFU/mL拮抗菌可以显著抑制芒果果实中VC含量的下降。
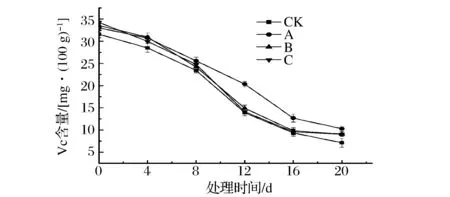
CK-无菌水;A-107 CFU/mL;B-108 CFU/mL; C-109 CFU/mL图5 拮抗菌对芒果果实VC含量的影响Fig.5 Effect of antagonist bacterial treatment on the VC of mango fruit
2.2 拮抗菌对抗病性相关酶活性的影响
2.2.1 拮抗菌处理对芒果果实PPO活性的影响
由图6可知,在整个处理期间,对照组PPO活性变化不大,单独接种拮抗菌JS-8、与病原菌C.cladosporioides组PPO活性较对照组略有上升,均在第6天达到最大值,JS-8与C.cladosporioides共同处理组PPO活性显著高于对照组(P<0.05),第6天酶活性为对照组的1.83倍,并且在处理后期仍保持较高的活性。说明,病原菌C.cladosporioides与拮抗菌JS-8在促进芒果果实PPO活性上具有协同作用。

图6 拮抗菌处理对芒果PPO活性的影响Fig.6 Effect of antagonist bacterial treatment on the activities of PPO in mango fruits
2.2.2 拮抗菌处理对芒果果实POD活性的影响
由图7可知,在整个处理期间,POD活性呈先上升后下降趋势,前8 d JS-8+C.cladosporioides处理组POD活性明显高于其他3组,并且在第8天达到最大值130.40 U,随后呈下降趋势。接种JS-8组果实POD活性在整个贮藏期间均高于对照组,并且在第10天达到最大值,为对照组的1.70倍,之后POD活性降低,但第12天仍具有较高活性。接种病原菌对果实POD活性影响不大,只有在第8天显著高于对照,其他时间均不明显(P<0.05)。由此可见,拮抗菌JS-8可明显诱导芒果果实POD活性增加,并且病原菌可促进拮抗菌的这一诱导作用。

图7 拮抗菌处理对芒果POD活性的影响Fig.7 Effect of antagonist bacterial treatment on the activities of POD in mango fruits
2.2.3 拮抗菌处理对芒果果实PAL活性的影响
由图8可知,未接菌的对照组PAL活性在整个贮藏期间均较低,未出现较大浮动,其他3组均出现2次峰值,其中单独接拮抗菌JS-8组、单独接C.cladosporioides组分别在第4天与第10天出现峰值,且第一个峰值为整个处理期间最高酶活性,分别是对照组的3.03倍、2.33倍,JS-8+C.cladosporioides组分别在第6天与第10天出现峰值,但两峰值均比单独接拮抗菌、病原菌组低(P<0.05)。由此可见,拮抗菌JS-8可显著提高芒果果实PAL活性。

图8 拮抗菌处理对芒果PAL活性的影响Fig.8 Effect of antagonist bacterial treatment on the activities of PAL in mango fruits
2.2.4 拮抗菌处理对芒果果实CHI活性的影响
由图9可知,接无菌水对照组的CHI活性在整个处理期间一直较低,接种实验组芒果果实CHI活性迅速上升显著高于对照组(P<0.05),并且在第8天达到酶活性最大值,其中JS-8+C.cladosporioides组酶活性最大为51.20 U,单独接拮抗菌JS-8组为43.30 U,单独接种C.cladosporioides组为35.10 U,并且第12天3组果实CHI仍保持较高活性,在38.40 U以上,显著高于对照组16.36 U(P<0.05)。由此说明拮抗菌JS-8可显著提高芒果果实的CHI活性,并且病原菌C.cladosporioides可促进拮抗菌的这一诱导作用。
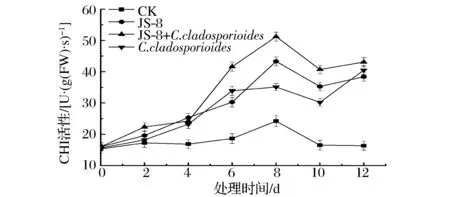
图9 拮抗菌处理对芒果CHI活性的影响Fig.9 Effect of antagonist bacterial treatment on the activities of CHI in mango fruits
2.2.5 拮抗菌处理对芒果果实GLU活性的影响
由图10可知,整个处理组芒果果实GLU活性在第0天到第2天略有下降,随后呈现上升趋势,并且在第8天达到最大值,随后酶活性下降。其中接JS-8组果实GLU活性从第2天便迅速上升,并且显著高于对照组(P<0.05),从第6天病原菌开始促进拮抗菌对芒果果实GLU活性的诱导作用,并且至第12天JS-8+C.cladosporioides组果实GLU活性均高于其他3组。由此可说明,拮抗菌JS-8可显著提高芒果果实的GLU活性,并且病原菌C.cladosporioides可促进拮抗菌的这一诱导作用。

图10 拮抗菌处理对芒果GLU活性的影响Fig.10 Effect of antagonist bacterial treatment on the activities of GLU in mango fruits
3 讨论
本研究探究了不同浓度的拮抗菌JS-8对芒果果实品质的影响,以及对芒果PPO、 POD、 PAL、 CHI、 GLU 5种保护酶活性的影响。研究发现拮抗菌JS-8可延缓芒果果实色泽的转变、抑制果实软化、抑制TSS含量的上升、延缓可滴定酸以及VC含量的下降,并且以107CFU/mL拮抗菌处理效果最佳,可显著维持芒果果实的品质。诱导植株的抗性是生物防治的一重要机理,当果蔬受到损伤或者病原菌入侵时,果蔬体内产生一些保护酶来抑制病原菌的入侵,一些拮抗菌可通过诱导果蔬相关保护酶活性来达到抑菌的效果[20]。许多研究表明,拮抗菌可诱导植物抗性酶活的增加,如范三红等[21]发现Burkholderiacontaminans可提高玫瑰香葡萄果实PAL、PPO、POD酶活性,以及诱导病程相关蛋白CHI、GLU活性的上升。闫岩等[22]研究发现Debaryomyceshansenii对柑橘指状青霉Penicilliumdititatum有较好的拮抗作用,并且可提高PPO、CHI、GLU等保护酶活性。IPPOLITO等[23]研究发现出芽短梗霉(Aureobasidiumpullulans)可以显著提高苹果果实的几丁质酶以及β-1,3葡聚糖酶的活性,降解真菌细胞壁从而抑制真菌的生长。此外,LUO等[24]发现拮抗酵母菌P.membranefaciens可诱导柑橘果实POD活性上升,并可促进酚类以及黄酮类抗氧化物的生成,从而提高柑橘的抗病性。ZHAO等[25]在研究P.guilliermondii对番茄根腐病(Rhizopusnigricans)的生防效果中,发现P.guilliermondii可诱导番茄果实SOD、CAT、POD活性的升高。本研究也证明了拮抗菌可诱导芒果果实相关抗性酶活的增加,经拮抗菌处理的芒果果实PPO、POD、PAL、CHI、GLU活性显著高于对照,其活性的增强可提高果实对病原菌侵染的抵抗能力。并且JS-8与病原菌C.cladosporioides共同接种后,PPO、POD、CHI、GLU活性上升幅度显著高于单独接拮抗菌与单独接病原菌,说明病原菌与拮抗菌JS-8在保护酶的诱导作用中具有协同作用,但这种协同作用不是简单相加,而是一种促进关系。综上所述,拮抗菌JS-8不仅可以使芒果在贮藏期维持较好的品质,而且还可以通过诱导芒果果实保护酶活性的提高来增强果实的抗病性,具有进一步研究和探索的价值。
[1] 杨永利,张贺,刘晓妹,等.杧果新病害露水斑病病原菌对杀菌剂敏感性测定[J].果树学报,2015,32(1):123-127.
[2] 王赛格,普金基,杨永利,等.芒果新病害露水斑病病原菌9种单剂间复配增效配比筛选[J].江苏农业科学,2015,43(10):191-193.
[3] 裘纪莹,王未名,陈建爱.拮抗菌在果蔬保鲜中的应用研究进展[J].食品工业科技,2009,30(5):334-336.
[4] 李淼,产祝龙,田世平,等.果实采后病害诱导抗性研究进展[J].保鲜与加工,2010,10(5):1-7.
[5] 王军节.采前Harpin处理对厚皮甜瓜果实抗病性的诱导及其机理[D].兰州:甘肃农业大学,2006
[6] 令利军,冯蕾,雷蕾,等.地衣芽孢杆菌TG116诱导黄瓜抗病性相关防御酶系的研究[J].西北师范大学学报,2016,52(1):100-104.
[7] FARKAS G L, STAHMANN A. On the nature of change in peroxidase isoenzymes in bean leaves infected by southern bean mosaic virus [J]. Phytopathology, 1996, 56(6): 669-677.
[8] WISNIEWSKI M E, WILSON C L. Biogical control of postharvest of fruits and vegetables: recent advances[J]. HortScience, 1992, 27(2): 94-98.
[9] SCHLUMBAUM A, MAUCH F, VOGELI U, et al. Plant chitinase are potent inhibitors of fungal growth[J]. Nature, 1986, 324(6095): 365-367.
[10] 毛淑波. 罗伦隐球酵母结合热空气处理对草莓采后病害的防治及其机理研究[D]. 南京: 南京农业大学, 2013.
[11] 曾凯芳. 套袋、SA和INA对芒果果实采后抗病性和品质的影响[D]. 北京: 中国农业大学, 2005.
[12] LARRIGAUDIERE C, PONS J, TORRES R, et al.Storage performance of clementines treated with hot water, sodium carbonate and sodium bicarbonate dips [J]. Hortic Sci.Biotech, 2002, 77(3): 314-319.
[13] 郝建军, 康宗利, 于洋. 植物生理学实验技术[M]. 北京: 化学工业出版社, 2006: 183-185.
[14] 冯双庆, 陈雨新, 吴海宗, 等. 延缓芒果后熟和控制采后病害的方法[J]. 北京农业大学学报, 1991, 17 (4): 61-65.
[15] 谭兴杰, 李月标. 荔枝果皮多酚氧化酶的部分纯化及性质[J]. 植物生理学报, 1984, 10 (4): 339-345.
[16] 枯草芽孢杆菌CS16诱导香蕉抗病性相关防御酶系的研究[J].福建农业学报,2013,28(6):570.
[17] ASSIS J S, MALDONADO R, MUNOZ T, et al. Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit [J]. Postharvest Biology and Technology, 2001, 23(1): 33-39.
[18] 曹建康, 姜微波, 赵玉梅. 果蔬釆后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007.
[19] MAUCH F, HADWIGER L A, BOILER T. Ethylene: symptom, not signal for the induction of chitinase and β-1,3-glucanase in pea pods by pathogens and elicitors[J]. Plant Physiology, 1984,76(3):607-611.
[20] 华娟,李淋玲,程华,等.拮抗菌生物防治果蔬病害的研究进展[J].江西农业学报,2013,25(10):71-74.
[21] 范三红,李静,施俊凤.拮抗菌Burkholderiacontaminans对玫瑰香葡萄采后灰霉病的抗性诱导[J].食品科学,2016,37(2):266-270.
[22] 闫岩,王明力,李岑.汉逊德巴利酵母对采后柑橘保护酶活性的影响[J].食品科技.2014,39(1):26-30.
[23] IPPOLITO A,EI-GHAOUTHA.Control of postharvest decay of apple fruit byAureobasidiumpullulansand induction of defense responses[J].Postharvest Biological and Technology,2000,19(3): 265-272.
[24] LUO Yang, ZENG Kai-fang, MING Jian. Control of blue and green mold decay of citrus fruit byPichiamembranefaciensand induction of defense responses[J].Scientia Horticulturae,2012,135:120-127.
[25] ZHAO Yan, TU Kang, SHAO Xing-feng, et al. Effects of the yeast Pichia guilliermondii against Rhizopus nigricans on tomato fruit [J]. Postharvest Biology and Technology,2008,49(1):113-120.
The effects of antagonistic bacterium JS-8 on storage quality and activity of protective enzymes of ‘Tai Nong’ mango
JING Min-min, TIAN Ya-qin, SHAO Yuan-zhi*
(College of Food Science and Technology, Hainan University, Haikou 570228, China)
In this study, the effects of different concentrations of antagonistic bacterium JS-8 (Burkholderiasp.) on the quality of postharvest mango fruit were investigated. The mango fruits were inoculated with JS-8,C.cladosporioidesor JS-8 plusC.cladosporioidesto detect the activity of polyphenol oxidase(PPO), peroxidase(POD), phenylalnine ammonialyase(PAL), chitinase(CHI), and β-1,3-glucanase(GLU). The results showed that the antagonistic bacterium JS-8 with 107CFU/mL could delay chromaa*values increasing and fruit firmness decreasing. Besides, the antagonistic bacterium JS-8 treatment could inhibit the changes of total soluble solids, titratable acid and ascorbic acid, maintain the storage quality and delay ripening of fruits. Moreover, the antagonistic bacterium JS-8 could enhance the activities of PPO, POD, PAL, CHI and GLU. At the same time,Cladosporiumcladosporioideshad positive effects on the induction of JS-8 on the activities of PPO, POD, CHI, and GLU.
Tai Nong mango fruits; antagonistic bacterium; quality; enzymes activities
10.13995/j.cnki.11-1802/ts.201701028
硕士研究生(邵远志教授为通讯作者,E-mail:s.yz123789@163.com)。
农业部南亚热作项目(14RZNJ-59);海南省重点研发计划项目(ZDYF2016043)
2016-07-11,改回日期:2016-08-29
